蛋白质二硫键异构酶与α-突触核蛋白的相互作用及对其聚集的影响
2022-12-28裴云山刘晓黎张则婷李从刚
裴云山,张 偲,刘晓黎,成 凯,张则婷*,李从刚
1.中国科学院生物磁共振分析重点实验室,波谱与原子分子物理国家重点实验室(中国科学院 精密测量科学与技术创新研究院),湖北 武汉 430071;2.中国科学院大学,北京 100049
引 言
α-突触核蛋白(α-synuclein,αsyn)是一种突触前神经元蛋白,在正常生理条件下以天然无结构可溶性的单体形式存在[1,2].病理学研究表明,帕金森症(Parkinson’s disease,PD)患者大脑中叶存在大量黑质神经元路易小体(Lewy bodies,LB),其主要成分是异常聚集形成纤维的αsyn,这也将αsyn 与PD 等神经退行性疾病密切关联[3-9].αsyn 含有140 个氨基酸残基,按照氨基酸序列及其性质可以分为三个区域:(1)1~60 号残基组成的N 端区域,此区域主要是膜、分子伴侣和其他蛋白质的结合位点[10-12];(2)61~95 号残基组成的非淀粉样成分(non-amyloid component,NAC)区域,被认为是αsyn 聚集的必需区域[13];(3)96~140 号残基组成的C 端区域,该区域富含酸性氨基酸,是蛋白质、金属离子和聚胺等的结合位点[14-16].
前期研究表明分子伴侣,如热休克蛋白70(heat shock protein 70,HSP70)、热激同源蛋白70(heat shock cognate 70,HSC70)、蛋白质二硫键异构酶(protein disulfide isomerase,PDI)等,能够与αsyn 的N 端结合,防止αsyn 的错误折叠和异常聚集,尤其是PDI 甚至能反向解聚初步形成的αsyn 纤维[17],这显示了伴侣蛋白在阻止αsyn 聚集并调节αsyn 生理功能中起到重要作用[11,18-22].PDI是一种多功能性应激蛋白,几乎存在于所有组织细胞中,如神经组织中的丘脑中脑细胞、视网膜细胞、上皮组织的腺上皮细胞等[23].晶体结构显示,PDI 的abb'xa'c 等结构域以U 型排列[24].其中,同源结构域a 和a'都包含一个活性位点CGHC 基序,该位点主要负责催化氧化还原反应中二硫键的重排[25];b 和b'同源结构域则形成一个大的疏水表面,主要负责识别与结合错误折叠蛋白或未折叠蛋白[26].在功能方面,PDI 是一种主要定位于内质网的关键酶和伴侣蛋白[27],负责催化内质网中新生蛋白的二硫键氧化还原反应,并协助蛋白质的正确折叠[28,29].PDI 还可以预防内质网应激和蛋白质错误折叠相关的神经毒性.有研究发现,PD 患者的大脑中存在功能失调的S-亚硝基化PDI(SNO-PDI),亚硝基化修饰抑制了PDI 正常参与蛋白折叠反应,从而导致细胞内发生内质网应激反应、蛋白质错误折叠等,进而引起神经元细胞的死亡[23,30].
有研究[31]表明,PDI 的a'结构域在体外能有效抑制αsyn 聚集,PDI 通过与αsyn 的N 端(尤其是His50 残基)相互作用抑制αsyn 形成纤维[22],但是PDI 识别αsyn 的机制仍不明确.虽然Yagi-Utsumi等[32]通过液体核磁共振(nuclear magnetic resonance,NMR)及X 射线晶体衍射等手段阐述了Humicola insolensPDI(HiPDI)与人源αsyn 多肽的结合方式,但HiPDI 与人源PDI 在序列和结构上都存在着明显的差异.因此研究人源伴侣蛋白PDI 识别αsyn 并影响其纤维化的机理仍至关重要.
NMR 技术是研究生物大分子间相互作用的有效方法[33,34],比如液体NMR 技术能够准确提供生物大分子间残基水平的作用位点信息.本文利用NMR 方法和硫黄素T(thioflavin T,ThT)纤维化荧光实验研究了人源PDI ab、PDI b'xa'和PDI 与αsyn 的相互作用及其对αsyn 聚集过程的影响,并采用NMR 滴定实验检测了αsyn 识别PDI b'xa'结构域的结合位点.基于以上结果通过HDOCK 在线平台对接服务构建了PDI 结合αsyn 的分子模型,探讨并提出了PDI 抑制αsyn 聚集的作用机理.本研究有助于我们进一步了解PD,从而为后续的疾病预防及治疗提供一定的理论基础.
1 实验部分
1.1 实验试剂
三羟甲基氨基甲烷(TRIS)、4-羟乙基哌嗪乙磺酸(HEPES)、K2HPO4、NaH2PO4、NaCl、苯甲基磺酰氟(PMSF)、乙二胺四乙酸(EDTA)购自国药集团化学试剂有限公司;咪唑、2-吗啉乙磺酸(MES)、三(2-羧乙基)膦(TCEP)、1,6-己二醇购自上海阿拉丁生化科技股份有限公司;标记所需的同位素15NH4Cl 和锁场溶剂D2O 均购于Cambridge Isotope Laboratories;αsyn 1-19 多肽MDVFMKGLSKAKEGVAAA 和αsyn 30-42 多肽AGKTKEGVLYVGS 均购于上海生工生物技术有限公司,基因测序由上海生工生物技术有限公司完成.
1.2 蛋白质样品的制备
将人源αsyn 全长蛋白(简称αsyn)的编码序列克隆到pT7-7 载体上,将N 端含His6-tag 和烟草蚀斑病毒蛋白酶(tobacco etch virus protease,TEV)酶切位点的人源PDI 全长蛋白(简称PDI)以及PDI b'xa'结构域蛋白(简称PDI b'xa')的编码序列克隆到pET-28a 载体上.通过单点突变的方法,成功获得编码含有完整N 端区域的αsyn 1-60 截短体蛋白(简称αsyn 1-60)以及PDI ab 结构域蛋白(简称PDI ab)的质粒.
将上述5种质粒通过热激法转化进BL21(DE3)大肠杆菌中,并分别于LB 培养基和含15NH4Cl同位素的M9培养基中表达非标记和15N标记的各种目的蛋白.在220 rpm、37 ℃条件下培养至OD600达0.6~0.8 后,加入终浓度为1 mmol/L 的异丙基-β-D-硫代半乳糖吡喃糖苷(isopropyl 1-thio-β-Dgalactopyranoside,IPTG)诱导6 h,以过量表达目的蛋白.
所有收集的菌液于高压裂菌仪裂解,并在裂解前加入 PMSF 及蛋白酶抑制剂 cocktail(P2714-1BTL)防止目的蛋白降解.αsyn 及PDI b'xa'的纯化方法参照文献[35-38];αsyn 1-60 经SP阳离子交换柱(GE Healthcare)初步纯化,并于Superdex 75 26/600 分子筛柱(GE Healthcare)进行细分离;PDI 先使用HiLoad Ni 亲和柱(GE Healthcare)除去一部分杂蛋白,再上样至Source Q(GE Healthcare)阴离子交换柱去除剩余大部分杂蛋白,最后上样至Superdex 75 分子筛柱,纯度达到NMR 实验要求;PDI ab 通过Ni(GE Healthcare)柱和Superdex 75 分子筛柱两步纯化,纯度达到95%以上.所有目的蛋白都脱盐至超纯水中,冻干备用.
根据280 nm 处的摩尔消光系数(Ext.Coefficient: 5 960、1 490、45 380、21 430、23 950 mol−1∙cm−1对应于αsyn、αsyn 1-60、PDI、PDI ab 和PDI b'xa'),使用Nanodrop 2000 采集的紫外吸收强度标定各蛋白的浓度(https://web.expasy.org/protparam/),并经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)进行纯度分析.
1.3 NMR 谱图采集及数据处理
1H-15N HSQC 实验样品的制备:15N 标记的冻干αsyn 样品溶于含20 mmol/L Hepes、100 mmol/L NaCl、5 mmol/L TCEP,pH=7.0 的缓冲液中,并加入10% (v/v)的D2O,终浓度为0.1 mmol/L.采集1H-15N HSQC 谱图后,再按等摩尔浓度比例加入非标记的PDI 或者PDI ab 或者PDI b'xa'等冻干蛋白并调整溶液pH,然后再次采集1H-15N HSQC 谱图.
NMR 滴定实验样品的制备:15N 标记的冻干PDI b'xa'样品溶于含20 mmol/L 磷酸盐缓冲液(Phosphate Buffer Solution,PBS)、200 mmol/L NaCl、5 mmol/L TCEP,pH=7.0 的缓冲液中,并加入10% (v/v)的D2O,终浓度为0.2 mmol/L.采集1H-15N TROSY 谱图后,再以1:0、1:0.25、1:0.5、1:1、1:1.5、1:2、1:3、1:4 或1:5 的摩尔浓度梯度比例分别加入非标记αsyn 1-19 多肽或者αsyn30-42多肽或者αsyn 1-60 等冻干样品,调整溶液pH 后再依次采集1H-15N TROSY 谱图.
NMR 谱图在配有5 mm TCI H-C/N-D CryoProbeTM超低温探头的Bruker Avance 850 MHz NMR谱仪上采集.1H-15N HSQC 实验F2维和F1维谱宽分别为12 ppm 和28 ppm,谱中心分别为δH4.70和δN119.0;采样点阵t2×t1=2 048×256,扫描次数ns=10;采样温度为288 K.1H-15N TROSY 实验F2维和F1维谱宽分别为12 ppm和35 ppm,谱中心分别为δH4.70和δN119.0;采样点阵t2×t1=2 048×256,ns=24;采样温度为303 K.谱峰指认依据BioMagResBank(entry number 16543 和59363).二维NMR 数据通过NMRPipe[39]处理,使用Sparky[40]软件分析.
化学位移扰动(chemical shift perturbations,CSPs)通过(1)式[41]计算:

ΔδH和ΔδN分别代表PDI b'xa' 加入αsyn 1-19 多肽或αsyn 30-42 多肽或αsyn 1-60 后的1H 和15N 化学位移偏移量.
结合常数KD由(2)式[42]拟合得到:

Δδ代表检测CSPs 值;Δδmax代表拟合的最大化学位移变化值;[P]t代表PDI b'xa'的初始浓度,固定为0.2 mmol/L;[L]t代表滴加αsyn 1-19 多肽或αsyn 30-42 多肽或αsyn 1-60 的浓度,最高达1.0 mmol/L.
1.4 αsyn 聚集监测的ThT 荧光实验
将冻干的αsyn、PDI、PDI ab 和PDI b'xa'蛋白分别溶于纤维化缓冲液(含20 mmol/L Tris、100 mmol/L NaCl、2 mmol/L TCEP、0.01% (w/v) NaN3,pH=7.5)中至终浓度为0.6 mmol/L,配置浓度为1.5 mmol/L 的ThT 储液,并利用0.22 μm 滤膜除去可能残留的不溶物及寡聚体大分子.按照αsyn:PDI /PDI ab/PDI b'xa' = 1:1 的摩尔比例配置αsyn+PDI、αsyn+PDI ab、αsyn+PDI b'xa'混合溶液,单独αsyn 对照组加入等体积缓冲液.每个混合溶液体系体积为200 μL,再加入2 μL ThT 储液使ThT终浓度约为15 μmol/L.将混匀后的溶液分别加入到底透黑边的96 孔板中,每个样品孔中再放置1 个直径为2.5 mm 的干净透明玻璃球助匀[43],使用锡箔纸将96 孔板上层密封以防止长时间高温挥发,盖上盖子后利用SpectroMax i3x 酶标仪(Molecular Devices)在37 ℃温度下高速环形(orbital)震荡500 s,之后每10 min 检测一次ThT 荧光,激发波长为444 nm、发射波长为482 nm.纤维化聚集所需的半数时间t1/2等参数由(3)式[44]拟合得到:

其中,F(t)是根据实验最高ThT 荧光强度归一化后的荧光值,F0是归一化后的样品初始荧光值,A是拟合的到达平台期时的最大归一化荧光值,t是纤维生长时间,k代表对数期时纤维化生长速率常数.t1/2经Graphpad Prism 9 软件的单因素方差统计方法分析.产生纤维的滞后期时长t1ag=t1/2−2/k.
2 结果与讨论
2.1 αsyn N 端识别PDI 的b'xa'结构域的检测
αsyn 作为天然无结构蛋白,其二维1H-15N HSQC 谱峰在1H 维的化学位移仅分布在7.7~8.5 ppm范围内,而15N 维信号仍正常分布在105~131 ppm 范围内.前期研究[22]显示,人源分子伴侣PDI 与αsyn N 端结合.为研究PDI 与αsyn 相互作用时PDI 的识别位点,本文根据文献[31,32]报道及序列分析将PDI 划分并制备了PDI ab 和b'xa'两个结构域蛋白[图1(a)、(b)],并分别作用于αsyn.1H-15N HSQC谱图显示,与加入PDI 的结果类似[图1(d)],15N 标记的αsyn 样品中加入等量的PDI b'xa'后,位于N 端的交叉峰信号均产生明显的化学位移扰动及谱峰强度减弱[图1(e)、(f)],表明PDI b'xa'同样结合于αsyn 的N 端前20 个残基和Tyr39 位点附近约10 个残基区域,与文献[11,22]报道的PDI 等伴侣蛋白结合于αsyn 的N 端结果一致.值得注意的是,αsyn 滴加PDI 后会导致溶液pH 发生变化,如果不调节pH,His50 残基信号会产生明显化学位移扰动(调节前约δH8.36/δN125.0,调节后约为Hδ8.41/δN125.3).而如果控制pH 变化在0.1 以内,His50 的交叉峰既没有明显化学位移的变化,也没有信号强度的降低,这表明在溶液pH 稳定时,PDI 及PDI b'xa'不结合αsyn 的His50 残基,His50残基可作为反应过程中的pH 探针[45].我们推测,文献[22]中αsyn 出现的His50 残基化学位移扰动可能是由于加入PDI 后,溶液(20 mmol/L PBS,pH 6.0)pH 值变化导致.另外,与PDI 相互作用的αsyn 的区域与通过优化最适疏水性(Optimized Matching Hydrophobicity,OMH)法[46]序列疏水性预测得到的疏水区域较为吻合[图1(g)].
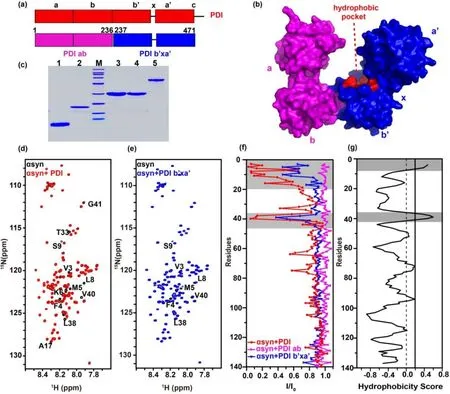
图1 PDI 的b'xa'结构域与αsyn 的N 端区域相互作用.PDI(红色)的(a)一级序列模型及(b)晶体结构(PDB ID: 4EKZ)表面图,粉色和蓝色分别代表PDI ab 与PDI b'xa'结构域;(c) SDS-PAGE 分析各蛋白纯度,1~5 泳道分别代表αsyn1-60、αsyn、PDI ab、PDI b'xa'、PDI,M 代表Marker;(d)、(e) αsyn 不加(黑色)与加入等量PDI(红色)或PDI b'xa'(蓝色)的谱图叠加,图中标注了明显发生信号减弱或移动的残基;(f)加入等量PDI(红色)、PDI ab(粉色)、PDI b'xa'(蓝色)后,αsyn 谱峰强度变化(I/I0);(g)基于OMH 法预测αsyn 序列疏水性分析图,互作区域或疏水性较强的区域用灰色标出Fig.1 The b'xa' domain of PDI interacts with N-terminal domain of αsyn.(a) Model for PDI (red) primary sequence, PDI ab domain(pink) and PDI b'xa' domain (blue) are shown underneath.(b) Surface crystal structure of human PDI (PDB ID: 4EKZ).(c) Protein purities analyzed by SDS-PAGE.M, Marker; lane 1, αsyn1-60; lane 2, αsyn; lane 3, PDI ab; lane 4, PDI b'xa'; lane 5, PDI.(d) and (e) Spectral overlay of αsyn in the absence (black) and presence of equivalent amount of PDI (red) and PDI b'xa' (blue).Residues showing significant signal attenuation or shifts were marked.(f) Residue-resolved attenuation (I/I0) of αsyn in the presence of PDI (red), PDI ab (pink) and PDI b'xa' (blue).(g) Hydrophobic residues of αsyn predicted by OMH method, the binding and hydrophobic areas are colored gray
但对比谱峰强度减弱程度可以发现,αsyn 结合PDI b'xa'的强度弱于PDI.同时我们发现,在加入PDI ab 后,谱峰不发生明显变化,说明PDI 的ab 区域不会与αsyn 结合[图1(f)].
2.2 PDI b'xa'抑制αsyn 聚集的ThT 荧光实验
ThT 荧光实验是目前体内外研究淀粉样蛋白纤维化过程最流行的手段之一[47].它利用游离的ThT 染料结合纤维化过程中淀粉样蛋白所形成的β片层后荧光强度大幅增强的特性来实时监测纤维的生长过程[48].我们采用ThT 荧光实验研究了PDI 各结构域与αsyn 相互作用对其聚集形成纤维这一过程的影响.
如图2所示,对照组αsyn 在约6 h 后逐渐形成纤维;约10 h 后达到半数平台期水平;约21 h后到达平台期.而加入PDI 后,其产生纤维的滞后期时长tlag及达到半数平台期水平时长t1/2均延长至超过3 倍,分别为约24 h 及35 h.纤维动力学曲线图及t1/2统计分析显示PDI 能有效抑制αsyn 纤维的形成,与文献[17,22,31,49]报道的PDI 抑制αsyn 纤维化的结论一致.而加入PDI ab 的纤维生长曲线与对照组几乎一致,t1/2统计分析也表明二者没有明显差异.但是加入PDI b'xa'后,αsyn 纤维化生长曲线显著被延后,具体表现为tlag由约6 h 延长至约13 h,t1/2增长至约23 h.说明PDI b'xa'对αsyn 的聚集也有明显的抑制作用,抑制效果约为2 倍,具体参数如表1所示.但是,此抑制效果与PDI 相比,也显现出不可忽略的差异(图2).
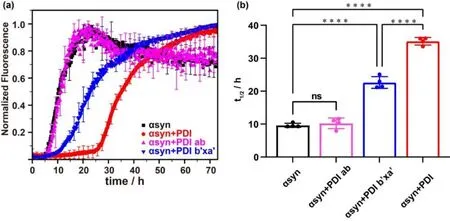
图2 ThT 荧光实验检测PDI、PDI ab 及PDI b'xa'对αsyn 聚集的影响.(a) αsyn 不加(黑色)和加入等量PDI ab(粉色)、PDI b'xa'(蓝色)、PDI(红色)后的纤维生长动力学曲线;(b)由动力曲线拟合得到的纤维生长达半数平台期所需时间t1/2 及其统计分析,ns 表示无明显差异,****表示p<0.0001;圆点表示四组平行实验所求得的数值Fig.2 The effect on αsyn aggregation of PDI, PDI ab and PDI b'xa' detected by ThT experiment.(a) Aggregations kinetics of αsyn in the absence (black) and presence of equimolar PDI ab (pink), PDI b'xa' (blue) and PDI (red).(b) The fitted half-time (t1/2) values of aggregation and their statistical analysis.ns: not significant, ****: p < 0.0001; the dots represent the values obtained from four parallel experiments

表1 纤维化生长参数Table 1 Aggregation kinetics data
以上结果也表明,PDI 的ab 结构域不与αsyn 相互作用,也不影响αsyn 的聚集.PDI 的b'xa'结构域结合αsyn 的N 端两个区域,同时也表现出对αsyn 聚集的抑制.这与PDI 类似,但PDI b'xa'与αsyn 相互作用的强度以及对αsyn 聚集的抑制程度均不及PDI.相互作用与纤维化抑制作用同步的现象表明PDI 通过b'xa'结构域与αsyn 相互作用来影响αsyn 的纤维化过程.
2.3 PDI b'xa'蛋白通过疏水空腔识别αsyn N 端区域
为了进一步研究αsyn 与PDI b'xa'作用的位点,我们将不同浓度的αsyn 1-19 和αsyn 30-42 多肽加入至15N 标记的PDI b'xa'溶液中,进行了NMR 滴定实验.实验结果显示,逐渐加入αsyn 1-19 和αsyn 30-42 多肽过程中,PDI b'xa'的TROSY 谱图中部分交叉峰逐渐出现化学位移变化,这些氨基酸残基的表观化学位移为总体化学位移的加权平均,说明PDI b'xa'与αsyn 1-19 和αsyn 30-42 多肽的相互作用在液体NMR 的时间尺度上属于快交换[图3(a)、(d)].进一步分析PDI b'xa'谱产生的CSPs 分布发现,与αsyn 1-19 和αsyn 30-42 多肽结合的区域为PDI 的b'结构域.将上述CSPs 值大于阈值(平均值+标准差)的氨基酸残基标注在PDI b'xa'三维结构上,发现αsyn 1-19 和αsyn 30-42 多肽主要结合于PDI b'结构域的I289、I291、I301、L302、I318、L320 等残基形成的疏水空腔上,另有少数残基分散在x linker 及a'结构域表面[图3(b)、(e)].

图3 PDI b'xa'与αsyn N 端相互作用的NMR 检测.PDI b'xa'(红色)加入(蓝色)αsyn 1-19 多肽(a)、αsyn 30-42 多肽(d)、αsyn 1-60蛋白(g)的1H-15N TROSY 谱图,选取E239 残基展示PDI b'xa'加入各底物后全局残基化学位移变化;PDI b'xa'加入αsyn 1-19 多肽(b)、αsyn 30-42 多肽(e)、αsyn 1-60 (h)后的CSPs 柱状图,以及根据CSPs 随底物αsyn 1-19 多肽(c)、αsyn 30-42 多肽(f)、αsyn 1-60 (i)浓度变化拟合计算解离常数.柱状图中用CSPs 的(平均值+标准差)作为阈值,高于阈值的残基标注在二维谱中,并在b'xa'的晶体结构表面用红色标记;上述高于阈值的残基通过全局拟合得到相应解离常数,离散的扰动残基通过以(平均值+2×标准差)为阈值验证并去除Fig.3 NMR results showing the interaction between PDI b'xa' with the N-terminal domain of αsyn.Overlaid 1H-15N TROSY spectra of PDI b'xa' (red) with (blue) αsyn 1-19 (a), αsyn 30-42 (d) or αsyn 1-60 (g).E239 were selected as representative residues for global chemical shift perturbations (CSPs) during NMR titration.Residue-resolved CSPs of PDI b'xa' during titrations with αsyn 1-19(b), 30-42(e) and 1-60 (h).KD values were fitted from curves of residues with significant CSPs, as a function of αsyn 1-19(c), αsyn 30-42(f), and αsyn 1-60 (i) concentration.Residues showing significant CSPs were marked in spectra and mapped red on the crystal structure surface of PDI b'xa'.Threshold level was indicated as ‘mean+standard deviation’.Disperse residues were verified and removed by the threshold of ‘mean +2×standard deviation’
将上述残基的化学位移随滴定浓度作曲线并通过全局拟合得到αsyn 1-19 以及αsyn 30-42 多肽结合PDI b'xa'的亲和力.结果显示αsyn 1-19 多肽结合PDI b'xa'的解离常数KD约为67.7±9.1 μmol/L,αsyn 30-42 多肽结合PDI b'xa'的KD约为136.3±16.0 μmol/L [图3(c)、(f)],这表明αsyn 的1-19 区域结合PDI b'xa'的亲和力稍强于30-42 区域.此外,我们构建了含有完整N 端区域的αsyn 1-60,并研究了其与PDI b'xa'的相互作用.实验结果显示,PDI b'xa'与αsyn 1-60 仍表现为快交换的相互作用[图3(g)],并且两者的结合位点仍集中在PDI 的b'结构域的疏水空腔[图3(h)],其解离常数KD为185.3±14.2 μmol/L [图3(i)].
对比αsyn 1-19 多肽,αsyn 30-42 多肽滴定时,PDI b'xa'的Thr453 残基附近产生明显扰动,表明PDI 在行使伴侣功能的过程中,可能需要a'结构域(如Thr453 附近的残基)辅助b'结构域的疏水口袋结合αsyn 底物.PDI b'xa'结合αsyn 1-60 的结果显示,Thr453 附近仍存在扰动,但程度略轻于αsyn 30-42 多肽.这可能是1-19 号残基区域与30-42 号残基区域均竞争性结合PDI b'疏水口袋,但由于1-19 号残基区域结合PDI b'xa'的亲和力强于30-42 号残基区域,因此在αsyn 1-60 结合PDI b'xa'时,主要表现为1-19 号残基区域与PDI b'xa'的相互作用,而30-42 号残基区域的Thr453 附近的氨基酸残基结合PDI b'xa'的概率相应减少,最终表现出Thr453 附近的化学位移扰动减少的现象.这些推论仍需在后续研究中进行确认.
2.4 讨论
我们的研究结果显示,PDI 和PDI b'xa'结合αsyn 较为疏水的前20 个残基和Tyr39 附近区域[图1(f)~(g)].ThT 荧光实验显示PDI 和PDI b'xa'均能有效抑制αsyn 聚集,而PDI ab 在溶液中与αsyn没有相互作用(图2).Cheng 等[31]的研究表明,PDI 的c 端截短变体PDI-c 对αsyn 纤维的抑制作用与PDI 一致.结合PDI b'xa'对αsyn 的亲和力以及对聚集的抑制作用都不及PDI 等结果,表明在PDI 结合αsyn 过程中,虽然ab 结构域及c 端不参与αsyn 的直接相互作用,但是它们可能增强b'xa'结构域与αsyn 的结合并促进其对αsyn 聚集的抑制作用.这种促进作用可能源于ab 结构域对b'xa'结构域疏水口袋的保护和稳定作用[50],从而使得PDI 比PDI b'xa'更稳定且高效结合底物蛋白αsyn,并使其表现出更强的聚集抑制作用.
结合NMR 滴定实验结果和还原型人源PDI 晶体结构(PDB ID: 4EKZ),我们使用HDOCK 服务[51]对接得到PDI 与αsyn1-40 的结合模型如图4(a)所示.最佳对接模型中,PDI 主要通过b'上的疏水空腔结合αsyn N 端区域.对接模型的局部放大图显示,αsyn1-40 蛋白以1~8 号和37~40 号的疏水氨基酸残基将PDI b'上的疏水口袋完全占据,与我们提出的PDI 结合αsyn 的方式为疏水相互作用相吻合.Yagi-Utsumi 等[32]的研究结果显示,结合人源αsyn31-41 多肽时,HiPDI b'xa'以氧化态形式参与反应,还原态则不能结合底物.而本研究显示,人源PDI 及PDI b'xa'在还原条件下均能有效结合αsyn 并抑制其聚集.然而,由于人源氧化态PDI 及PDI b'xa'较还原条件下更易发生多聚[24],导致无法获得高质量的NMR 谱图,因此本研究未对氧化态PDI 与αsyn 的相互作用展开研究.由于HiPDI 比人源PDI b'结构域的疏水空腔面积小,且序列比对结果显示HiPDI 与人源PDI 的序列相似度不高,疏水口袋b'区域(237~347 号氨基酸残基)序列相似度仅为31.5%.因此结合αsyn 多肽时,氧化态HiPDI 参与相互作用的关键残基分布与人源PDI 也有所差别[图4(b)].但是HiPDI 仍通过b'结构域疏水残基参与αsyn 多肽的相互作用[32],与本研究中人源PDI 通过b'结构域的疏水空腔结合αsyn 的结果相似(图4),表明两种不同来源的PDI 都以疏水相互作用结合αsyn 底物.

图4 PDI 与αsyn N 端的疏水结合模式.(a) PDI 结合αsyn 1-40 多肽的对接模型(左)及其结合区域的局部放大图(右),HDOCK对接实验在网站服务器(http://hdock.phys.hust.edu.cn/)上运行,上传人源PDI 晶体结构,αsyn1-40 序列及NMR 滴定鉴定的结合位点,最佳对接结果使用PyMol 软件作图,PDI 表面结构呈灰色,疏水口袋以红色标出,αsyn1-40 卡通结构呈品红色,右图中参与结合的αsyn 残基以棒状模式显示并标出.(b)人源PDI b'xa'与HiPDI b'xa'的氨基酸序列比对.序列一致性和相似性由Clustalw[52]和ESPript 3.0[53]分析所得,相似氨基酸(黑色字母填充黄色方框)以及相同氨基酸(白色字母填充红色方框)分别被标出,顶部标注人源PDI b'xa'二级结构区域,蓝色和绿色星号分别表示αsyn 结合人源PDI 和HiPDI 的关键疏水氨基酸残基Fig.4 Hydrophobic binding mode of PDI with the N-terminal domain of αsyn.(a) Docking model of PDI binding αsyn1-40 (left panel)and a local zoom view of binding area (right panel).The relevant residues of αsyn1-40 involving in binding PDI were depicted as magenta sticks.HDOCK experiments were performed on the web server (http://hdock.phys.hust.edu.cn/) by uploading human PDI crystal structure,amino acid sequences of αsyn1-40 and their binding sites identified by NMR titration.Optimal docking results were plotted with PyMol software, PDI molecular surface was colored gray and its hydrophobic pocket was marked in red, the magenta cartoon represented αsyn1-40 structure.(b) Alignment of amino acid sequence of human PDI b'xa' from HiPDI b'xa'. Sequence identity and similarity were calculated by Clustalw[52] and ESPript 3.0[53].Similar amino acids were showed as black letters in yellow boxes and identical amino acids were showed as white letters in red boxes.The secondary structural domains were indicated on the top of the sequences.Blue and green asterisks represented the key hydrophobic residues of αsyn interacting with human PDI and HiPDI, respectively
文献[54]显示,Tyr39 位点附近的区域被认为是αsyn 聚集过程中的主控单元,缺少或突变Tyr39位点附近区域中的位点影响αsyn 的聚集,结合本研究,我们认为PDI 抑制αsyn 纤维化聚集的主要机制在于PDI b'xa'通过b'结构域上I289、I291、I301、L302、I318、L320 等疏水氨基酸残基形成的疏水空腔结合αsyn 的N 端的两个区域,这种相互作用可能减少了αsyn 单体间的接触几率,也减弱主控单元Tyr39 附近区域对αsyn 聚集的控制作用,进而抑制了αsyn 的纤维化.
3 结论
本文通过液体NMR 技术研究了伴侣蛋白PDI 与αsyn 的相互作用,发现与αsyn 相互作用的区域是PDI 的b'xa'结构域.ThT 荧光实验显示PDI b'xa'能够抑制αsyn 的聚集.NMR 滴定实验结果显示PDI 识别αsyn 并与其相互作用的位点主要位于PDI b'结构域上I289、I291、I301、L302、I318、L320 等残基形成的疏水口袋.另外,我们通过HDOCK 对接构建了人源PDI 结合αsyn N 端区域的模型.本文还提出了人源伴侣蛋白PDI 通过b'xa'结构域疏水结合αsyn N 端区域从而抑制其纤维化聚集的机制.这一研究为理解伴侣蛋白与αsyn 的相互作用以及伴侣蛋白抑制αsyn 蛋白聚集提供了实验依据.
致谢
感谢国家自然科学基金(21673284,21773300)的支持.
利益冲突
无
