一例大肠杆菌的分离与鉴定
2022-12-28吴光燕陆海燕王梓乔鞠耿越
吴光燕,陆海燕,杨 娟,王梓乔,王 鹏,鞠耿越
(南京市江北新区农村工作管理服务中心,江苏南京 211899)
0 引言
大肠杆菌(Escherichia coli,E.coli)是一种常见的人畜共患病原菌[1],致病性大肠杆菌依据感染致病类型大致可分为5种,包括肠致病性大肠杆菌(EPEC)、肠出血性大肠杆菌(EHEC)、产肠毒性大肠杆菌(ETEC)、肠侵袭性大肠杆菌(EIEC)和肠聚集性大肠杆菌(EAggEC)。其中,某些血清型的大肠杆菌具有致病性,可导致仔猪黄痢、白痢和猪水肿等病[2],较容易与沙门氏菌等交叉感染,严重时可导致仔猪死亡。通常通过PCR检测大肠杆菌各致病型特有的毒力因子,以确定致病性大肠杆菌分离株为何种致病类型,主要PCR检测基因包括大肠杆菌肠毒素、黏菌素菌毛和LEE毒力岛携带的毒力基因[3]。
2021年12月16日,南京某规模化猪场发生了仔猪腹泻感染,笔者对该猪场仔猪腹泻发病情况进行诊治,诊断发现患病仔猪呈现的典型症状为腹泻、拉稀、食欲不振、精神状态萎靡等。针对上述情况,该猪场采集相关病料,对送检的病料进行细菌通过鉴别培养基进行分离鉴定,对分离的细菌通过PCR扩增其16SrDNA序列,进行测序鉴定,并对其耐药谱进行鉴定,相关研究旨在为该养猪场防治细菌性仔猪腹泻提供一定的依据。
1 材料与方法
1.1 材料
1.1.1 病料采集。无菌采集来自南京市某规模化养猪场死亡仔猪的组织病料,包括小肠段、大肠内容物、肝脏等。
1.1.2 主要试验材料。氯化钠、酵母粉、麦康凯平板、伊红美蓝琼脂平板和LB琼脂。PCR Mix和核酸电泳Marker购自南京诺唯赞生物科技股份有限公司,药敏纸片购自杭州滨和微生物试剂有限公司,MHB等琼脂平板购自南京鼎思生物技术有限公司。
1.2 方法
1.2.1 细菌分离。取病死仔猪的小肠、大肠内容物,以及肠段和肝脏组织,用接种环挑取内容物或组织接种于麦康凯琼脂平板。将接种后的琼脂平板放置于37℃恒温箱培养过夜,第二天,观察麦康凯琼脂平板上细菌菌落,再用接种环无菌挑取形态特征明显的细菌单菌落,接种至伊红美蓝培养基。将细菌划线传代培养后,然后通过革兰氏染色对挑取的单菌落进行鉴定,将染色后的细菌于显微镜下进行观察。
1.2.2 细菌形态学鉴定。对菌株进行分离培养,并对培养基中菌株生长情况进行观察,同时进行涂片以及染色镜检。
1.2.3 药敏试验。采用K-B纸片扩散法鉴定致病相关细菌分离株的药敏谱,将培养过夜的分离株菌液(100μl)均匀涂布于MHB琼脂平板,逐一贴上药敏片,培养16 h后分别检测细菌对阿莫西林、环丙沙星、卡那霉素、阿莫西林克拉维酸钾、氯霉素、庆大霉素、四环素、复方新诺明、青霉素、头孢拉定、头孢噻呋、链霉素、阿米卡星和多黏菌素B等14种抗生素的耐药性。
1.2.4 细菌16 S r D N A 鉴定。参考文献报道的细菌16 S r D N A 基因扩增引物序列[5],合成细菌16 S 扩增基因,P C R 通用引物序列如下:16 S-F(A G A G T T T G A T C C T G G C T C A G)和16 S-R(TACGGCTACCTTGTTACGACTT)。参照文献设定16S扩增的PCR程序:设置35个循环,首先95℃预变性5 min,接着95℃变性45 s,然后55℃退火45 s,72℃进行DNA延伸90 s,最后72℃延伸10 min[5]。完成RCP扩增后,运用1.5%琼脂电泳进行核酸电泳,对核酸电泳后16S的DNA片段进行回收,最后将该PCR扩增产物送至公司进行测序,将16S测序结果在NCBI数据库中与已知细菌16S rDNA序列进行比对分析。
2 结果
2.1 细菌分离及形态学观察
将病死仔猪的器官组织或肠内容物划线接种到麦康凯培养基上进行分离,对单菌落进一步进行平板划线培养,接种伊红美蓝培养基,从而纯化细菌分离纯化的细菌在麦康凯培养基上呈现出边缘整齐的红色菌落,在伊红美蓝培养基上呈现金属光泽的黑色菌落,依据菌落形态初步判断分离的细菌为大肠杆菌。
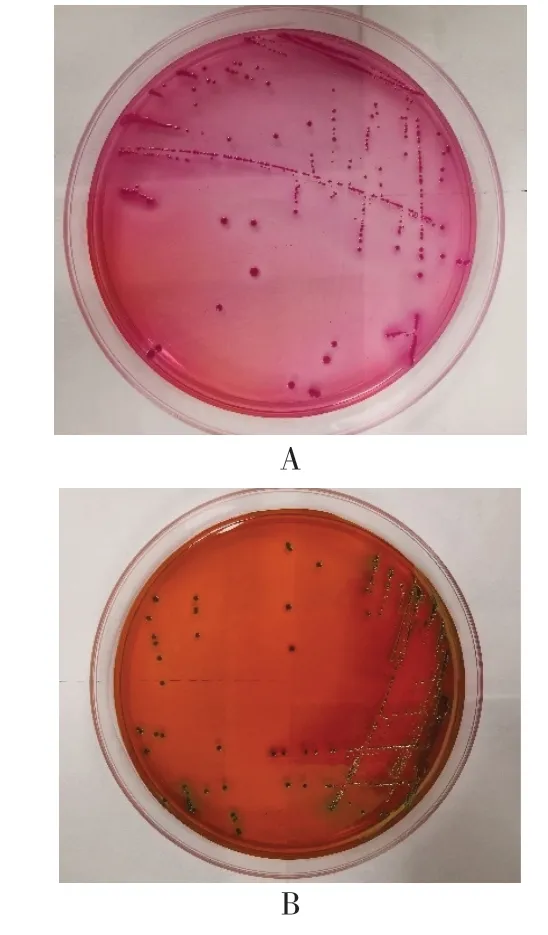
图1 分离菌株在麦康凯培养基上菌落形态(A)和伊红美蓝培养基上菌落形态(B)
2.2 菌液PCR鉴定结果
挑取伊红美蓝琼脂培养基上的疑似大肠杆菌的单菌落进行摇菌培养,将菌液进行16S rDNA的PCR扩增,将PCR扩增产物进行凝胶电泳(图2),对凝胶显色发现在1500 bp附近有一条明显DNA带,其大小符合PCR扩增预期。对PCR扩增产物进行回收,测序结果与已知细菌16S序列进行比对,发现该菌株的16S序列与大肠杆菌16S高度相似,确定该分离菌株为大肠杆菌。

图2 大肠杆菌16S rDNA基因PCR产物电泳结果
2.3 大肠杆菌的药敏谱
K-B纸片扩散法鉴定大肠杆菌分离株的药敏情况,药敏结果显示该菌对10种抗生素(阿莫西林、环丙沙星、卡那霉素、氯霉素、庆大霉素、四环素、复方新诺明、青霉素、头孢拉定、链霉素)具有明显耐药性,说明该大肠杆菌分离株具有多重耐药性。
3 结论
综上所述,本研究通过采集本地区猪场病死仔猪的器官,对病原的分离、药敏试验、和耐药性进行鉴定,并用PCR扩增16S rDNA,来确定该病原及其特性,为该猪场免疫防控提供基础依据。大肠杆菌是一种常见病原菌,对家畜、家禽等动物高度易感。本文对病死仔猪的器官进行病原菌分离操作,在麦康凯培养基上获得典型的圆形、边缘光滑、中央隆起、红色菌落,革兰氏染色结果显示该菌为革兰氏阴性菌。结合病死猪腹泻等症状,初步判断其病原为大肠杆菌。进一步采用细菌16S rDNA通用引物对致病菌分离菌株进行PCR扩增,测序结果与已知细菌16S基因序列进行同源性比较分析,与大肠杆菌同源性高于99%。
大肠杆菌发生的原因很多,也很复杂,广泛分布于自然界的各种土壤与水体中。该菌能引起多种动物食欲不振、排水样粪便、腹痛,尤其在冬春交替、梅雨季节时多发。目前,致泻性大肠杆菌对仔猪的感染发病具有散发和地方性流行的特点,对患有腹泻的仔猪进行诊断时通常采用实验室分子诊断方法,如16S rDNA的PCR测序比对,能够准确鉴定引起仔猪腹泻的病原菌类型,分子诊断方法有助于病原菌致病类型的理解和认识。
本文通过分离鉴定引起仔猪腹泻的大肠杆菌,为仔猪致泻疾病的防控及大肠杆菌的有效检验诊断提供了一定的参考,对大肠杆菌分离株的耐药谱鉴定和猪场仔猪腹泻的药物治疗防控有一定的指导意义,并为后续临床发病仔猪治疗提供参考依据。
