一种体外评价佐剂诱导人急性白血病单核细胞THP-1炎症因子方法的建立
2022-12-28魏多前单璞张转郝少杰王志标李树香徐静
魏多前,单璞,张转,郝少杰,王志标,李树香,徐静
国药中生生物技术研究院有限公司第三研究室,北京 101111
佐剂能够增强抗原的免疫原性,在疫苗尤其是亚单位疫苗的研发中至关重要。目前佐剂的研发处于快速发展阶段,其类型多样,按作用方式可分为免疫刺激分子、递送系统及复合佐剂等[1]。但佐剂在增强免疫原性的同时可能存在潜在的反应原性问题。安全性是佐剂开发中首要考虑的问题,因此关注其反应原性十分必要。
反应原性被定义为疫苗接种后的急性炎症反应,通常发生在疫苗接种后的几天内,可引起局部反应原性(如红斑、肿胀或疼痛),但当促炎因子(如IL-1β)、趋化因子以及前列腺素E2(prostaglandin E-2,PGE2)以足够的水平进入循环系统或中枢神经系统时,可能引发全身反应原性(如发烧、肌痛、头痛和流感样症状)[2-3]。不同佐剂的作用方式以及免疫刺激能力不同,诱导的反应原性可能不同,因此,在体内或体外监测炎症因子水平可用于评估佐剂可能引起的潜在安全性问题。
IL-8(CXCL-8)主要参与中性粒细胞的募集活化,在急性肝衰竭和严重急性肝损伤患者中显著升高[4]。干扰素诱导蛋白-10(interferon-induced protein-10,IP-10)主要参与免疫细胞至炎症部位的募集,在HIV 感染时血清IP-10 水平异常升高[5]。IL-1β 被称为体内致热源,是一种促炎性细胞因子,参与多种自身免疫性炎症反应[6]。单核细胞趋化蛋白(monocyte chemotactic protein,MCP-1)是参与调控单核细胞趋化和T淋巴细胞分化的趋化因子,在炎症性疾病、动脉粥样硬化和癌症的发病机制中发挥关键作用[7]。
THP-1 细胞来源于人急性白血病患者单核细胞,是人外周血单核细胞系,为悬浮细胞,在体外易培养,可被佛波酯(phorbol myristate acetate,PMA)诱导分化为巨噬细胞,分泌炎症因子,如IL-1β、IL-8等,目前广泛应用于免疫和炎症的相关研究[8-10]。本研究以THP-1 细胞为模型,建立一种体外检测方法,用于评价不同佐剂诱导产生IL-8、IP-10、IL-1β 及MCP-1 的水平。以期建立一种能够快速评价佐剂诱导炎症因子水平的体外方法,结合体内免疫增强作用考察其相关性,探究免疫增强作用与反应原性二者之间的关系,为疫苗佐剂开发早期阶段候选物的筛选及配方优化提供数据支持。
1 材料与方法
1.1 细胞 THP-1细胞购自武汉普诺赛生命科技公司。
1.2 主要试剂及仪器 RPMI1640 培养基购自北京达科为生物技术有限公司;胎牛血清及双抗(青霉素/链霉素)购自美国Hyclone公司;PMA购自碧云天生物技术有限公司;Toll 样受体(toll-like receptors,TLR)2激动剂类佐剂Pam2CSK4和TLR4激动剂类佐剂LPSB5购自美国InvivoGen 公司;细菌内毒素标准品购自中国食品药品检定研究院;乳剂类佐剂MF59和AS03为本研究室自制(配方同Novartis MF59和GSK AS03);Human IL-8、Human IP-10、Human IL-1β 和Human MCP-1 ELISA 试剂盒均购自欣博盛生物科技有限公司;酶标仪和细胞培养箱均购自美国Thermo公司。
1.3 方法的建立 用含10%胎牛血清(FBS)和1%双抗(青霉素/链霉素)的RPMI1640 培养基,于37℃,5%CO2条件下培养THP-1细胞。当细胞密度达80%左右时,重悬细胞,190 ×g离心5 min,弃上清,用RPMI1640培养基稀释至工作细胞密度,加入24孔板中,1 mL/孔,再加入PMA共刺激。以细菌内毒素标准品+PMA为阳性对照组,只加PMA为阴性对照组。刺激完成后,860 ×g离心30 min,取上清,用ELISA试剂盒检测各种炎症因子。
1.4 条件优化
1.4.1 PMA 刺激浓度及培养时间的优化 PMA 浓度分别设为25、5、1、0.1 ng/mL,设细菌内毒素标准品+ PMA 以及单PMA 刺激组,37 ℃,5% CO2培养。分别于4、16、24 h 取上清,检测IL-8、IP-10、IL-1β 及MCP-1的含量。
1.4.2 细胞密度的优化 细胞密度分别选择1×105、5×105、1×106个/mL,设细菌内毒素标准品+PMA以及单PMA刺激组,于37 ℃,5%CO2培养。取上清,检测IL-8、IP-10、IL-1β及MCP-1的含量。
1.5 不同浓度细菌内毒素标准品刺激THP-1细胞诱导炎症因子水平的检测 细胞密度长至80%左右时,重悬细胞,190×g离心5 min,弃上清,用RPMI1640培养基稀释至工作细胞密度,加入96孔板中,180 μL/孔,再加入PMA及不同浓度细菌内毒素标准品(0、0.125、0.5、1、5、10、20、50 EU/mL)共刺激,20 μL/孔,每组设2 个复孔。刺激完成后,860×g离心30 min,取上清,检测IL-8、IP-10、IL-1β及MCP-1的含量。
1.6 不同佐剂刺激THP-1细胞诱导炎症因子水平的检测 细胞密度长至80%左右时,重悬细胞,190×g离心5 min,弃上清,用RPMI1640 培养基稀释至工作细胞密度,加入96 孔板中,180 μL/孔,再加入PMA及不同佐剂(TLR 类佐剂设0、0.001、0.005、0.01、0.05、0.1、1、10、100 μg/mL 9 个浓度,乳剂类佐剂设0、0.25、0.5倍稀释及原倍4个浓度)共刺激,佐剂20 μL/孔,每组设2 个复孔。以细菌内毒素标准品(设10 和50 EU/mL 2 个浓度)+ PMA 为阳性对照组。刺激完成后,860×g离心30 min,取上清,检测IL-8、IP-10、IL-1β及MCP-1的含量。
1.7 结果处理 采用GraphPad Prism 5软件进行数据分析及作图。
2 结果
2.1 最佳检测条件
2.1.1 PMA 浓度及培养时间的确定 不同炎症因子的PMA 最佳刺激浓度和培养时间不同。PMA 浓度为25 ng/mL 时培养4、16、24 h 以及PMA 浓度为5、1 ng/mL时培养16、24 h,均诱导产生高水平的IL-8,但阴性对照A450较高(>0.5);PMA浓度为0.1 ng/mL培养16 h时阴性对照A450较低,且阳性对照有高水平应答。见图1A。因此确定诱导产生IL-8 的最佳PMA浓度为0.1 ng/mL,培养时间为16 h。
培养时间为4 h时,4个PMA浓度诱导产生的IP-10水平均较低;培养时间为24 h,PMA浓度为25、5 ng/mL时,阴性对照本底A450较高(>0.5),PMA浓度为1 ng/mL培养16 或24 h 时,阴性对照本底较低,且阳性对照应答相对较高。见图1B。因此确定诱导产生IP-10的最佳PMA浓度为1 ng/mL,培养时间为16 h。
PMA 浓度为25、5 ng/mL 时培养24 h,均诱导产生高水平的IL-1β,但阴性对照A450较高(>0.2);PMA 浓度为5 ng/mL 时培养4 h,阴性对照本底较低,且阳性对照应答相对较高。见图1C。因此确定诱导产生IL-1β 的最佳PMA 浓度为5 ng/mL,培养时间为4 h。
培养时间为4、16 h时,诱导产生较低水平的MCP-1;培养时间为24 h,PMA浓度为25、5 ng/mL时,阴性对照本底A450较高(>0.2);PMA 浓度为1 ng/mL 时培养16或24 h,阴性对照本底较低,阳性对照应答相对较高。见图1D。因此确定诱导产生MCP-1 的最佳PMA浓度为1 ng/mL,培养时间为24 h。
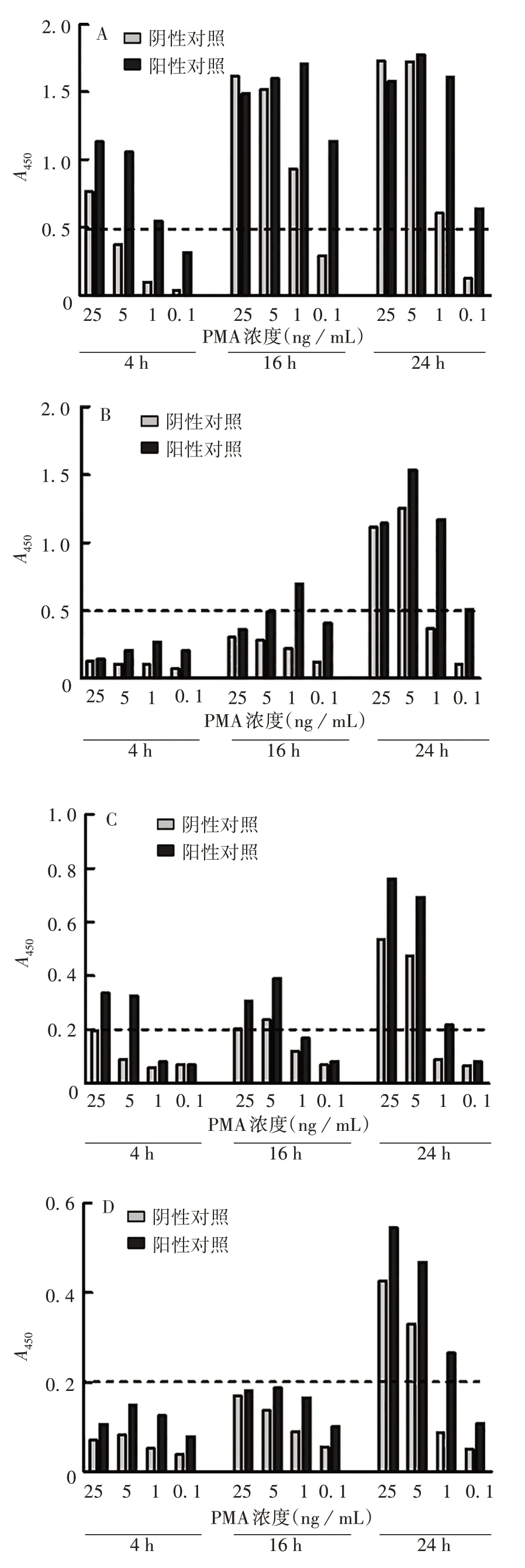
图1 不同PMA 浓度及时间诱导IL-8(A)、IP-10(B)、IL-1β(C)、MCP-1(D)的A450值Fig.1 A450 values of IL-8(A),IP-10(B),IL-1β(C)and MCP-1(D)induced with various concentrations of PMA for various incubation times
2.1.2 细胞密度的确定 不同炎症因子的分泌水平与细胞密度成正相关,随着细胞密度的增加而升高。细胞密度为1×106个/mL 时,能诱导产生高水平的IL-8、IP-10、IL-1β 及MCP-1,且阴性对照本底较低。见图2。因此确定1×106个/mL为最佳细胞密度。
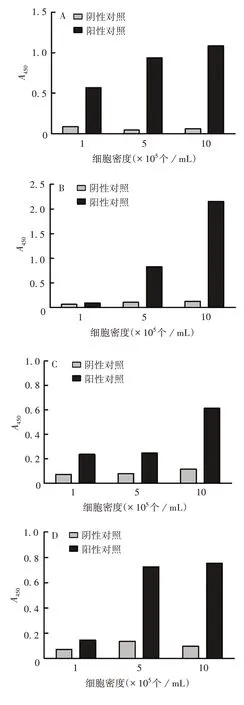
图2 不同细胞密度诱导IL-8(A)、IP-10(B)、IL-1β(C)、MCP-1(D)的A450值Fig.2 A450 values of IL-8(A),IP-10(B),IL-1β(C)and MCP-1(D)induced with various cell densities
2.2 不同浓度细菌内毒素标准品刺激THP-1细胞诱导炎症因子水平 细菌内毒素标准品浓度大于1 EU/mL时,IL-8 和IP-10 的分泌水平开始上升,且随浓度升高而增强,其中IP-10 的分泌水平最强,10 EU/mL时分泌量约300 pg/mL;细菌内毒素标准品浓度大于5 EU/mL 时,MCP-1 和IL-1β 的分泌水平开始上升,随浓度升高而增强,且MCP-1 和IL-1β 的分泌水平低于IL-8。见图3。
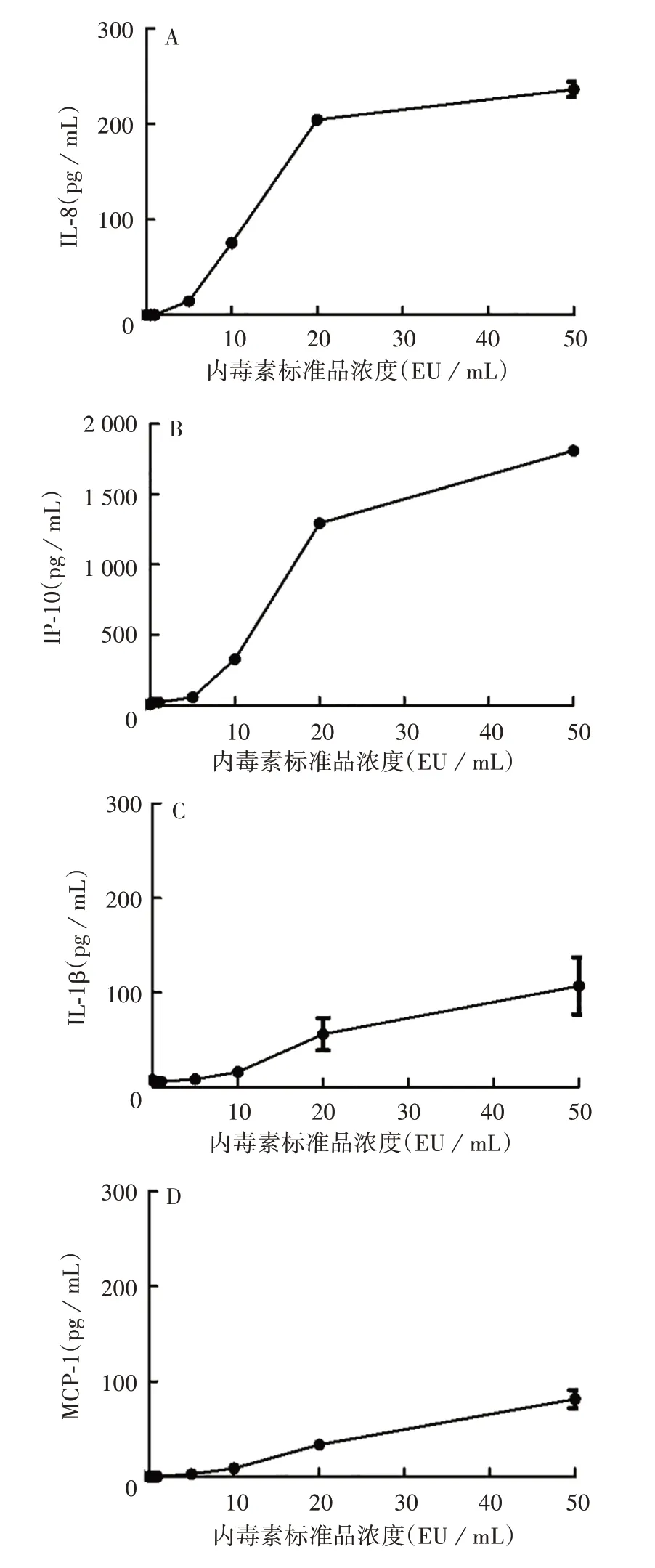
图3 不同浓度细菌内毒素标准品诱导IL-8(A)、IP-10(B)、IL-1β(C)、MCP-1(D)水平Fig.3 Levels of IL-8(A),IP-10(B),IL-1β(C)and MCP-1(D)induced by various concentrations of bacterial endotoxin standard
2.3 不同佐剂刺激THP-1细胞诱导炎症因子水平
2.3.1 TLR 激动剂类佐剂 Pam2CSK4 和LPS-B5 在较低浓度(0.001 μg/mL)即可诱导产生各类因子。Pam2CSK4 大于0.001 μg/mL 即可诱导产生高水平的IL-8、IP-10、IL-1β 及MCP-1,其中0.001 μg/mL Pam2CSK4诱导的IL-8和IP-10水平略高(或相当)于50 EU/mL内毒素标准品诱导水平,0.1 μg/mL诱导的IL-1β水平略高于50 EU/mL内毒素标准品诱导水平,0.005 μg/mL诱导的MCP-1水平高于50 EU/mL内毒素标准品诱导水平。LPS-B5 在0.001 μg/mL时诱导的IL-8和MCP-1水平与10 EU/mL内毒素标准品诱导水平相当,诱导的IP-10 和IL-1β 水平低于10EU/mL内毒素标准品诱导水平,在0.001~100μg/mL时诱导的各因子水平基本在10 ~50 EU/mL内毒素标准品诱导水平之间。总体上,在0.001 ~100 μg/mL范围内LPS-B5 诱导产生的炎症因子水平低于Pam2-CSK4。见图4。
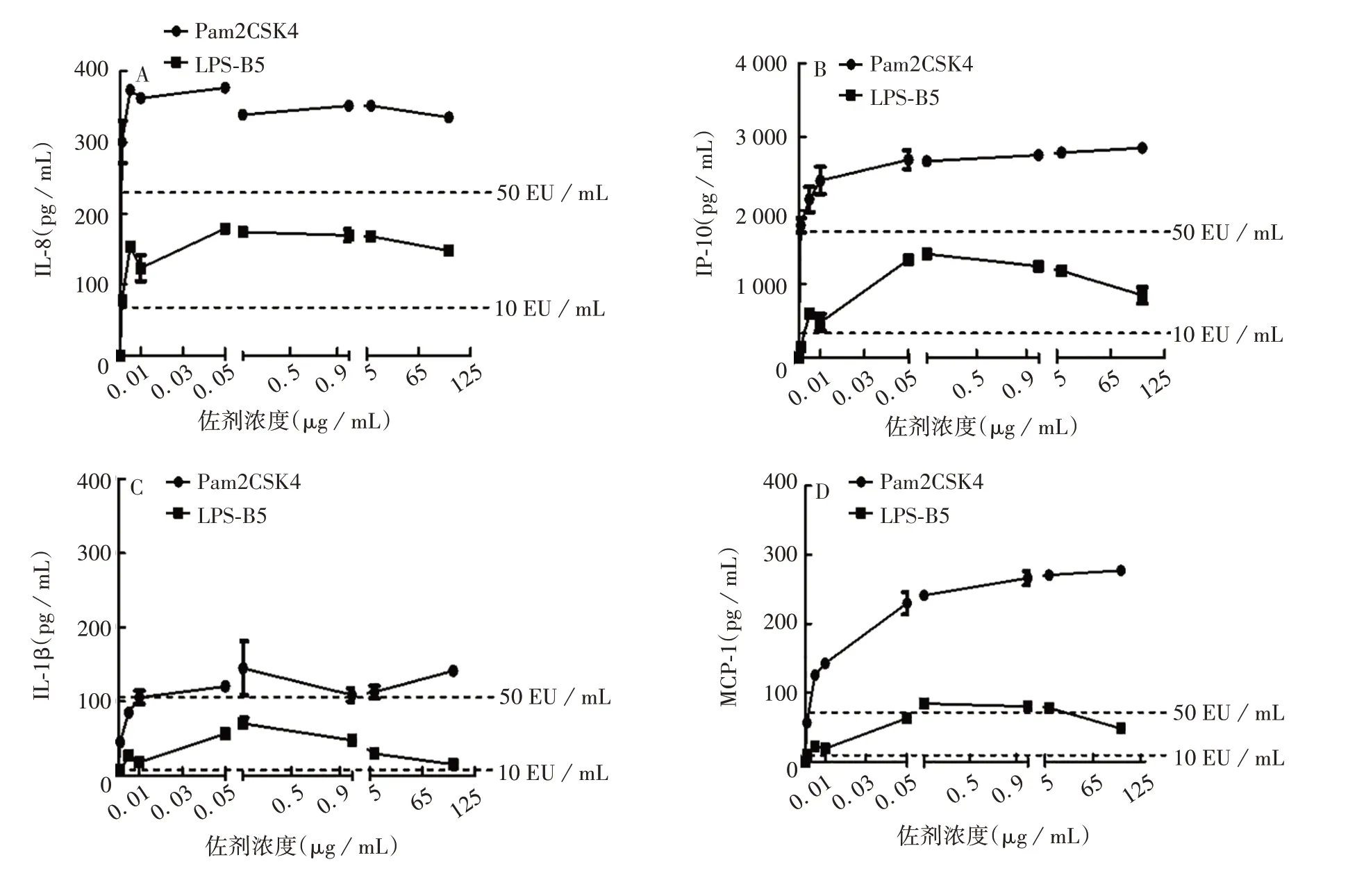
图4 TLR激动剂类佐剂诱导IL-8(A)、IP-10(B)、IL-1β(C)、MCP-1(D)的水平Fig.4 Levels of IL-8(A),IP-10(B),IL-1β(C)and MCP-1(D)induced by TLR agonist type adjuvants
2.3.2 乳剂类佐剂 MF59 和AS03 诱导产生的IL-8、IP-10、IL-1β、MCP-1 基本在40 pg/mL 以内,其中诱导的IL-8 和IP-10 水平均低于10 EU/mL 内毒素标准品诱导水平,而MF59(原倍)诱导的IL-1β和MCP-1水平与10 EU/mL内毒素标准品诱导水平相当。总体上,MF59和AS03诱导产生较低水平的IL-8、IP-10、IL-1β、MCP-1。见图5。
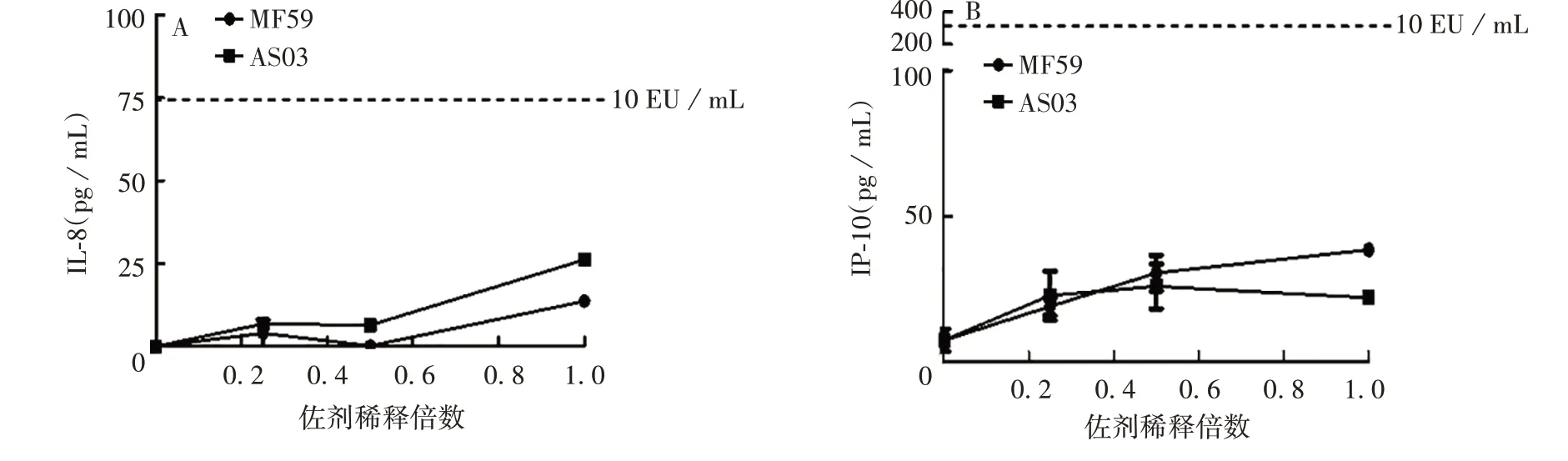
图5 乳剂类佐剂诱导IL-8(A)、IP-10(B)、IL-1β(C)、MCP-1(D)水平Fig.5 Levels of IL-8(A),IP-10(B),IL-1β(C)and MCP-1(D)induced by emulsion type adjuvants
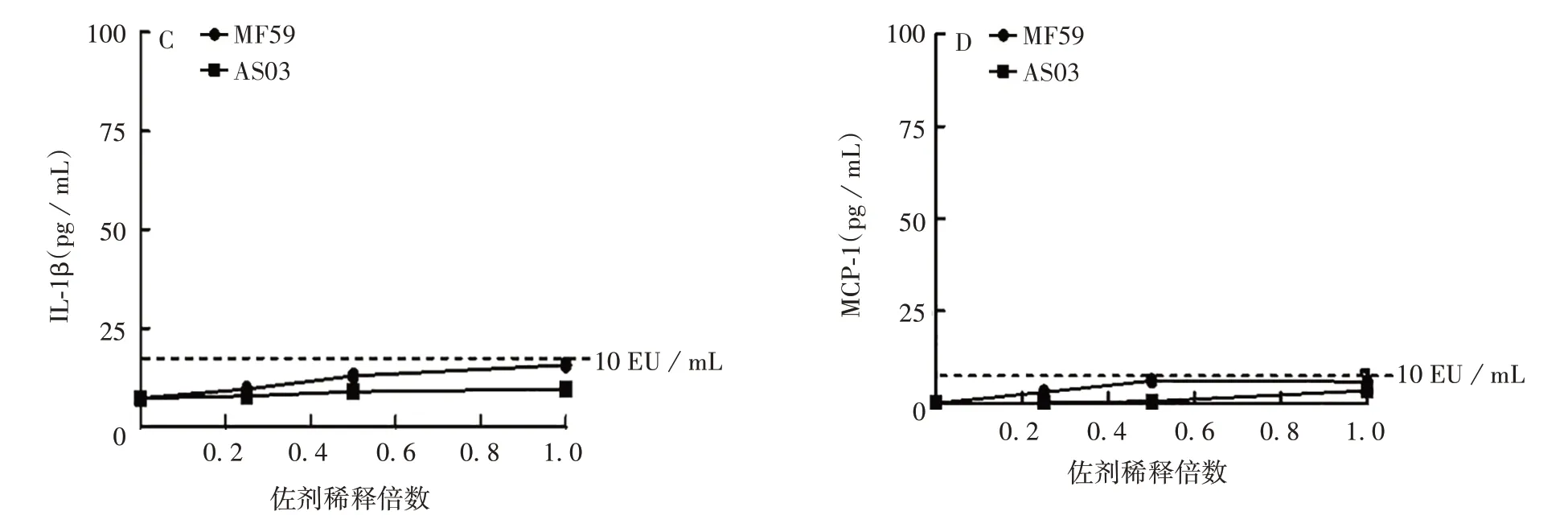
续图5 乳剂类佐剂诱导IL-8(A)、IP-10(B)、IL-1β(C)、MCP-1(D)水平Fig.5 (Continued)Levels of IL-8(A),IP-10(B),IL-1β(C)and MCP-1(D)induced by emulsion type adjuvants
3 讨论
炎症是人体自然免疫防御的一部分,适当的炎症反应对于激发免疫系统至关重要。疫苗接种后首先在注射部位发生局部炎症反应,进而激活并募集免疫细胞。佐剂可诱导细胞因子和趋化因子的分泌,导致更多免疫细胞如单核细胞、DC 以及中性粒细胞的募集和浸润,进而增强体液和细胞免疫应答[11]。研究表明,肌肉注射含佐剂系统的疫苗,注射后3 h 即可在注射部位检测到细胞因子和趋化因子,大部分细胞因子和趋化因子在24 h 内减少,并在72 h后恢复至基线水平[12]。
佐剂组合可表现出协同或拮抗作用,因此复合佐剂可能是增强免疫原性的有效方法。其中TLR 激动剂作为潜在复合佐剂组分是近年来关注的热点。研究表明,人TLR 在多种组织中差异表达,巨噬细胞中未检测到TLR9表达,原代单核细胞和MonoMac6 均不表达TLR7 和TLR9[13]。提示THP-1 细胞可能不适用于评价靶向这些受体的佐剂。
研究表明,已批准的在临床中显示安全性良好的佐剂在人MonoMac6 细胞中不诱导或仅诱导极低水平的炎症因子,而TLR 激动剂在一定的剂量范围内可诱导产生炎症因子[13]。这与本研究结果一致:MF59 和AS03 诱导产生的IL-8、IP-10、IL-1β、MCP-1基本低于10 EU/mL内毒素标准品诱导水平,而Pam-2CSK4(TLR2)和LPS-B5(TLR4)在0.001 μg/mL 即可诱导产生较高水平的炎症因子。
LEROUX等[14]比较了不同佐剂与模式抗原HBsAg结合后的免疫原性和反应原性,结果发现,反应原性水平与佐剂系统刺激先天反应并促进更高的HBs 特异性反应有关,提示一定水平的炎症反应可触发有效的适应性免疫反应。但目前仍不清楚哪种炎症水平是必需的,另外,如何量化炎症水平以及利用体外生物标记物来预测体内反应原性或免疫原性仍是一个需要探究的问题。
本研究利用THP-1 细胞易培养,可被诱导分化为巨噬细胞,分泌炎症因子的特点,建立了一种体外检测方法,能够快速评价不同佐剂体外诱导产生IL-8、IP-10、IL-1β、MCP-1 的水平。通过炎症因子的水平反映佐剂本身引起的反应原性,用于各种疫苗佐剂的早期筛选,可结合动物体内免疫结果综合评价其免疫增强作用及反应原性。
