尿液肌动蛋白作为脓毒症相关急性肾损伤的生物标志物研究
2022-12-27黄盼盼曾小康
黄盼盼,顾 乔,曾小康
(浙江大学医学院附属杭州市第一人民医院重症医学科,浙江 杭州 310003)
脓毒症的有效治疗仍然是重症监护室(intensive care unit,ICU)的主要挑战之一,其死亡率约为30%[1]。流行病学研究表明,近年来脓毒症的发病率不断上升,死亡率却在下降。根据2016年欧洲危重病学会指定的19位国际专家合作修订的脓毒症的定义和诊断标准,即“脓毒症-3”[2]标准定义,脓毒症是由宿主对感染反应失调引起的威胁生命的器官功能紊乱。脓毒症的发生与多种因素有关,包括血流动力学改变、肾血流量减少、微血栓形成、内毒素和炎症因子的影响及细胞凋亡等[3]。
急性肾损伤(acute kidney injury,AKI)是与脓毒症或脓毒症休克相关的最常见的器官功能障碍之一,其死亡率高达60%[4-5]。AKI指的是肾脏功能突然下降(大部分是可逆的),导致许多废物的滞留和细胞外容量的失调。根据血清肌酐水平的升高水平和尿量的减少情况,改善全球肾脏病预后组织(Kidney Disease: Improving Global Outcomes,KDIGO)的分类标准被广泛用于诊断AKI。然而,这些参数的变化并不能反映肾脏损伤的程度,因此需要更多敏感和特异的实验室生物标志物来早期诊断和预测AKI。肌动蛋白是一种球状蛋白(Mr约为2 000),以单体/球状和聚合/丝状的形式存在,可能是一种针对脓毒症相关AKI(sepsis-associated acute kidney injury,saAKI)有潜力的生物标志物[6]。在急性组织损伤中,释放的细胞外肌动蛋白被发现在血液循环中具有高毒性,因为它具有自发的聚合倾向,对凝血系统产生不利的影响[7]。凝胶素和Gc-球蛋白是所谓的肌动蛋白清道夫系统中最重要的蛋白,它们负责结合和解聚循环中的细胞外肌动蛋白,使这些蛋白复合物在尿液中出现的可能性减小[8]。然而,有研究表明,在持续AKI的肾移植患者的尿液中可以检测到肌动蛋白[9]。本研究对saAKI患者尿液中的肌动蛋白进行定量检测,以验证其作为saAKI中血清肌酐补充诊断生物标志物的可行性。
1 对象与方法
1.1 对象
选取2020年1月至2021年12月在我院急性确诊的脓毒症患者或saAKI患者入组。纳入标准:①病理诊断符合“脓毒症-3”[2]以及KDIGO的AKI临床指南标准[10];②出现器官功能障碍迹象,表现为序贯性器官功能衰竭评分(Sequential Organ Failure Assessment,SOFA)增加(>2分)、血清降钙素原(procalcitonin,PCT)水平升高(>2 μg/L)和微生物学感染;③血清肌酐水平升高(过去7 d从基线增加≥1.5倍或48 h内增加≥26.5 μmol/L)或尿量减少[<0.5 mL/(kg·h),持续6 h]的患者被认定患有AKI。排除标准:①纳入前3个月内服用糖皮质激素者,长期使用免疫抑制剂、免疫功能严重低下者;②既往有慢性肾病、肾移植史或终末期肾脏病患者;③合并间质性肾炎、肾小球肾炎患者;④妊娠期、哺乳期及经期患者;⑤合并血液系统传染性疾病及恶性肿瘤患者。另选取同时期在我院门诊中心体检,并愿意加入实验的健康人群作为对照组,其排除标准为患有急性炎症[超敏C-反应蛋白(hypersensitive C-reactive protein,hs-CRP)>5 mg/L]、传染病或肾脏疾病者。最终纳入脓毒症患者共65例,其中saAKI组45(男13,女32)例,非AKI脓毒症组20(男8,女12)例。对照组25(男11,女14)例。三组对象的平均年龄、收缩压、舒张压、心率和BMI差异无统计学意义(表1)。本研究经浙江大学医学院附属杭州市第一人民医院伦理委员会审查和批准(ZJUL20190845LC),所有患者或其家属均签署书面知情同意书。
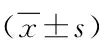
表1 三组入组人群基本情况统计结果
1.2 方法
1.2.1 采样和样本处理 本研究按前瞻性、开放、单中心临床研究方法设计。患者入组后,在3个时间点(T1,T2和T3)采集血液和尿液样本。T1:入院后24 h内;T2:入院后第2日上午;T3:入院后第3日上午。每位脓毒症患者使用促凝管采集静脉血5 mL,使用无菌离心管采集尿液6 mL;尿液和凝固的血液样本经1 500g离心10 min后,取上清液检测。
1.2.2 检测指标和数据分析 血常规检测包括血浆总蛋白、血浆白蛋白、肌酸激酶、血浆肌酐、血小板计数;炎症指标检测包括白细胞计数、hs-CRP、PCT;尿常规检测包括尿液总蛋白、尿液白蛋白、尿肌酐。以上检测均在杭州市第一人民医院检验科完成。采用自动化免疫比浊法(使用德国Roche诊断医疗生产的Cobas 8000/c502模块进行)测定尿液中指标黏蛋白和胱抑素C。尿液肌动蛋白则采用ELISA进行测定,检测试剂盒(ab240678)购自英国Abcam上海分公司。收集患者的临床病理信息,与血清和尿液肌动蛋白水平进行比较,并通过受试者工作特征曲线(receiver operating characteristic curve,ROC)评估血清和尿液肌动蛋白作为saAKI诊断指标的有效性。
1.2.3 统计学分析 本研究采用SPSS 25.0统计软件进行数据分析。由于检测数据未能通过正态分布检验,计量资料均采用M(Q1,Q3)表示,组间比较采用非参数Mann-WhitneyU检验。计数资料以n(%)表示,组间比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 三组入组人群基础特征比较
对三组入组人群主要并发症发生率进行比较,结果表明,非AKI脓毒症组和saAKI组患者并发心血管病、慢性肾病、肺部疾病和恶性肿瘤的比例显著高于对照组患者(P<0.05),非AKI脓毒症组和saAKI组之间则无显著差异(表2)。临床血液和尿液指标方面,非AKI脓毒症组和saAKI组在血浆总蛋白、血浆白蛋白、血浆肌酐、血浆肌酸激酶、白细胞、血小板计数、C-反应蛋白、降钙素原、尿液总蛋白、尿液白蛋白、尿液黏蛋白,尿液胱抑素、尿液肌动蛋白和尿液肌动蛋白/肌酐等指标与对照组相比均存在显著差异(P<0.05)。非AKI脓毒症组和saAKI组组间则在血浆肌酐、白细胞、血小板计数、尿液总蛋白、尿液白蛋白、尿液黏蛋白、尿液胱抑素、尿液肌动蛋白、尿液肌动蛋白/肌酐和尿液肌动蛋白/总蛋白等指标上差异显著,saAKI组上述指标数值均显著较高(P<0.05,表3~4)。

表2 三组入组人群主要合并症比较 [n(%)]

表3 三组入组人群临床血液指标比较 [M(Q1,Q3)]
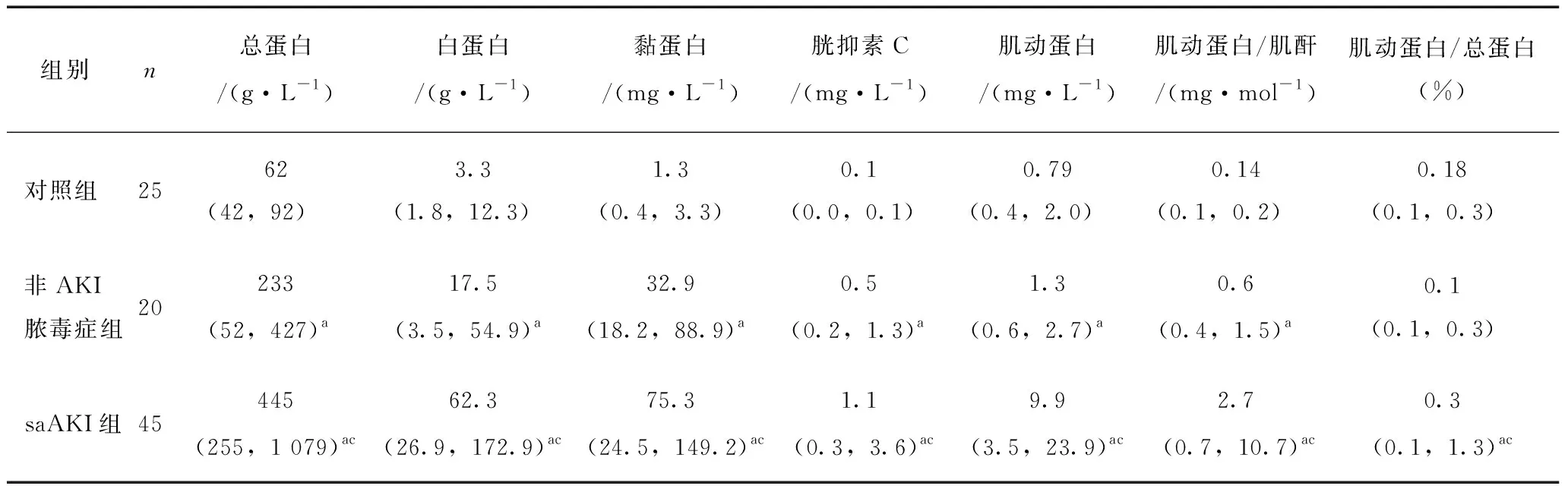
表4 三组入组人群临床尿液指标比较 [M(Q1,Q3)]
2.2 非AKI脓毒症组和saAKI组入院原因和临床数据比较
非AKI脓毒症组和saAKI组患者在内科并发症发生人数、手术干预人数、ICU住院时间、APACHE Ⅱ评分、SAPS Ⅱ评分和SOFA评分方面均存在显著差异(P<0.05,表5)。saAKI组患者多器官功能障碍综合征发病率较高,但两组差异不显著。临床病原体分型方面,两组也无显著差异(表6)。
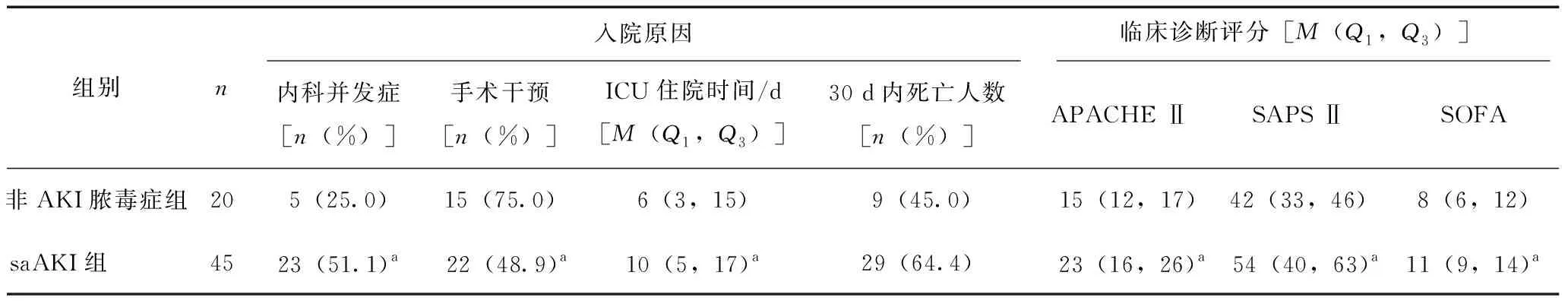
表5 入院原因和临床诊断评分对比
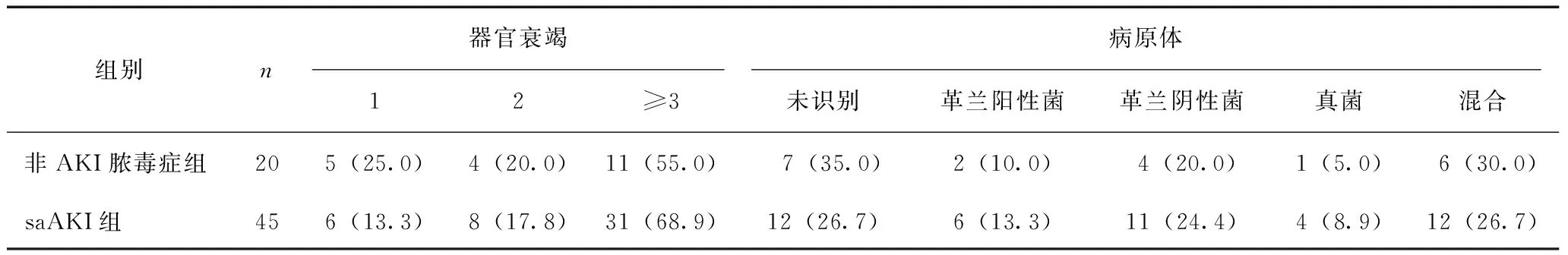
表6 器官衰竭程度和病原体比较 [n(%)]
2.3 三组入组人群血清和尿液肌动蛋白水平比较
在T1、T2和T3三个时间点所有脓毒症患者中(n=65)的血清肌动蛋白水平与对照组(n=25)比较未发现显著差异,但是尿液肌动蛋白水平在3个时间点均存在显著差异(P<0.01,图1A);将非AKI脓毒症组(n=20)和saAKI组(n=45)的检测数据进行比对,发现两组间血清肌动蛋白水平无显著差异,但是尿液肌动蛋白水平在3个时间点均存在显著差异(P<0.01,图1B);根据KDIGO指南分级说明对45例saAKI患者进行了分级,分为AKI-1组(10例),AKI-2组(15例)和AKI-3组(20例),并对其肌动蛋白检测数据进行比对。统计结果表明,各组间尿液肌动蛋白水平存在显著差异(P<0.01,图2A);同时,各组间尿液肌动蛋白/肌酐比值也存在显著差异(P<0.01,图2B)。
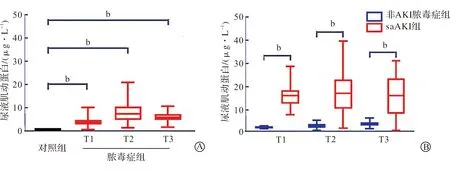
A:3个时间点对照组患者(n=25)和脓毒症患者(n=65)尿液肌动蛋白水平比较;B:非AKI脓毒症组(n=20)和saAKI组(n=45)患者尿液肌动蛋白水平比较。 bP<0.01。图1 脓毒症患者尿液肌动蛋白水平

A:3个时间点不同AKI分级患者的尿液肌动蛋白水平比较;B:3个时间点不同AKI分级患者的尿液肌动蛋白/肌酐比值比较。AKI-1组n=10;AKI-2组n=15;AKI-3组n=20。 bP<0.01。图2 不同AKI分级的saAKI患者的尿液肌动蛋白水平比较
2.4 尿液肌动蛋白水平对saAKI的诊断性能分析
通过使用ROC曲线分析评估了T1时间点各检测指标对saAKI的诊断性能(图3)。对于区分saAKI和非AKI的脓毒症患者,曲线下面积(area under the curve,AUC)值如下:尿液肌动蛋白0.887(P<0.01);血浆肌酐0.865(P<0.01);检验截止值如下,尿液肌动蛋白2.67 μg/L(敏感度:85.0%,特异度:81.3%);血浆肌酐121 μmol/L(敏感度:87.5%,特异度:75.2%)。

图3 区分AKI的ROC曲线
3 讨论
非AKI脓毒症和saAKI的早期诊断和有效治疗是保证患者成功康复的关键[11]。然而,目前使用的生物标志物(脓毒症相关:PCT、hs-CRP;AKI相关:肌酐、尿量)在脓毒症和AKI的诊断和预后方面显示出显著局限性[12]。本研究检验了患者血浆肌动蛋白和尿液肌动蛋白水平作为临床生物标志物的潜力。
越来越多的证据表明在各种临床状况下(如创伤、急性肝衰竭、心肌梗死、脓毒症),肌动蛋白清除蛋白酶浓度下降以及血浆肌动蛋白水平升高体现出的诊断价值[13]。由于尿液的采集是无创性的,利用尿液成分进行疾病生物标志物研究是目前的热门。针对尿液肌动蛋白的研究报道不多,尤其是针对AKI的研究非常少,我们的研究可以认为非常有创新性。
通过ELISA方法,我们精确地对患者血浆和尿液中的肌动蛋白进行了定量检测。试验结果表明,在为期3 d的随访采样时间内,与健康对照组相比,脓毒症患者的血浆肌动蛋白水平略有升高,但缺乏统计学显著性,但尿液肌动蛋白水平在3个时间点均存在显著差异(P<0.01)。同时,在脓毒症患者和saAKI患者之间,我们也发现了显著的尿液肌动蛋白水平差异(P<0.01)。同时,尿液肌动蛋白与AKI患者的分级水平也存在显著相关性,高分级的AKI患者显著具有更高的尿液肌动蛋白水平和尿液肌动蛋白/肌酐比值(P<0.01)。ROC曲线分析也表明,尿液肌动蛋白作为saAKI的诊断指标,性能优秀(AUC=0.887)。
我们的研究存在部分局限性,由于研究时间有限,我们连续招募患者的数量非常有限,整体样本量较小。此外,3个时间点采样的时间精确性受到了临床条件的限制,无法完全统一到精确时间点,在实际的第1日样本采集中,时间间隔稍有变化(大多在12 h内),因为大多数患者是在晚上或下午晚些时候入院,然后在第2日早上采集第一个样本。此外,在我们的研究中,为了控制尿流率的变化,新型尿液AKI生物标志物必须归一到尿肌酐的浓度。然而,越来越多的证据对尿肌酐正常化在AKI中的重要性提出了质疑,因为在AKI急性发作的情况下,尿肌酐和其他新型尿液AKI生物标志物的排泄率可能受到不同的影响[14-15]。由于肌动蛋白在血液循环中可与凝胶素或Gc-球蛋白结合,所以正常情况下不会出现在尿液中。然而,由于严重的肾小球或肾小管损伤,患者尿液中便可以检测出肌动蛋白,所以尿液肌动蛋白水平的升高可以提示患者存在严重的肾脏损伤[16]。有研究表明,KIM-1或NGAL是AKI中已知的损伤生物标志物,我们的研究表明,尿液肌动蛋白可以也可能被归入这一范畴。目前我们的试验证明,与血清肌酐相比,尿液肌动蛋白可能提供有关肾脏损伤程度的更准确信息。此外,包括尿液肌动蛋白和各种损伤生物标志物的多标志物联合检测的方法或许能提供与saAKI有关更准确的诊断信息。
下一步,我们的研究会将采样时间延长到5~7 d,同时增加入组患者的数量,特别是需要肾脏替代治疗的患者。并将脓毒症进行进一步的分类,以得出更准确的结论,并且开展其他不同种类的肾脏疾病(如慢性肾脏病、肾小球肾炎)的患者群体的尿液肌动蛋白相关性研究。我们的试验目前已经证明了ELISA的方法用于尿液肌动蛋白的检测是准确、有效和及时的,在进一步的研究中,我们还将对其他的检测方法,例如定量荧光法进行尝试,力图找到最适合该生物标志物的检测手段。
综上所述,在saAKI中,尿液肌动蛋白可作为酸性肌酐的补充诊断生物标志物,而较高的尿液肌动蛋白水平也可以准确地反映AKI的严重程度。尿液肌动蛋白水平作为针对脓毒血症相关AKI的诊断指标,效果显著,值得进一步深入研究。
