PSD-95/nNOS/CAPON复合体在重复轻型颅脑损伤致神经退行性变中的作用
2022-12-27杨二万田志成张卓媛黄毓韬包明冬石欣雨蒋晓帆
杨二万,田志成,张卓媛,2,黄毓韬,包明冬,廖 丹,石欣雨,罗 鹏,蒋晓帆
(1空军军医大学西京医院神经外科,陕西 西安 710032; 2西北大学生命科学学院,陕西 西安 710069)
颅脑损伤(traumatic brain injury,TBI)是全球范围内造成青壮年致死、致残的主要原因,每年有近4 000亿美元用于TBI患者的治疗和康复[1-2]。根据格拉斯哥昏迷评分,可将TBI划分为轻型、中型和重型,其中轻型TBI(mild TBI,mTBI)是临床上最常见的TBI类型,约占整体TBI的80%[3-4]。随着对mTBI认识的不断进展,研究人员发现许多反复发生mTBI(repetitive mTBI,rmTBI)的患者的病理演变过程并未在急性期结束后停止,而是逐渐转化为一种慢性疾病过程,表现出以认知功能障碍为主要临床症状的神经退行性变[5-7]。目前,对于这种神经退行性变发生的具体机制仍不清楚,导致缺少有效的生物学标志物和药物干预靶点。
突触后致密蛋白-95(postsynaptic density-95,PSD-95)是一种突触后支架蛋白,在兴奋性突触结合N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)和神经元一氧化氮合酶(neuronal nitric oxide synthase,nNOS)后,形成突触后大分子信号复合物,传递NMDAR激活后的相关信号[8]。以往的研究表明,阻断PSD-95与nNOS的结合可以减轻谷氨酸诱导的神经元兴奋性毒性损伤,并且促进缺血性脑损伤后新生神经元的突起生长和成熟神经元的树突棘形成,最终改善脑卒中预后[9]。同时,当NMDAR被激活后,nNOS会与其羧基端PDZ结构域结合配体(carboxy-terminal PDZ ligand of nNOS,CAPON)形成复合物。近期的研究显示,抑制nNOS与CAPON的相互作用,可以发挥神经元保护效应[10-11]。由此可见,PSD-95/nNOS/CAPON形成的突触后复合体是介导神经元损伤的关键位点,但其在rmTBI中的作用尚不明确。因此,本研究在构建小鼠rmTBI模型的基础上,探讨PSD-95/nNOS/CAPON复合体在rmTBI后神经退行性变中的作用机制。
1 材料与方法
1.1 材料
8周龄左右的雄性C57小鼠50只,由空军军医大学实验动物中心提供,所有动物实验均经空军军医大学实验动物福利与伦理委员会批准(许可证号:20210419)。小鼠饲养在20~25 °C的环境中,明暗交替时间为12 h∶12 h,通风良好,自由进食与饮水。将50只C57小鼠适应性喂养1周后,随机分为对照组(sham组)、重复轻型颅脑损伤组(rmTBI组)、重复轻型颅脑损伤+生理盐水组(rmTBI+saline组)、重复轻型颅脑损伤+抑制剂ZL006组(rmTBI+ZL006组)、重复轻型颅脑损伤+抑制剂ZLc002组(rmTBI+ZLc002组),每组10只。
1.2 方法
1.2.1 rmTBI模型的建立 采用精确皮层撞击器在未开颅情况下对小鼠进行重复打击,模拟rmTBI。在开始造模前1 d剃除小鼠耳朵前缘连线中点附近的毛发,使用异氟烷(瑞沃德)在小动物麻醉机(R500通用型小动物麻醉机,瑞沃德)上将小鼠麻醉后置于4 cm厚的海绵垫,调整撞针至小鼠耳朵前缘连线中点,以3 m/s的撞击速度、3 mm的撞击深度、200 ms的撞击持续时间分别在第1、3、5、7、9日对小鼠进行重复打击。打击完成后常规饲养1个月。
1.2.2 药物干预 通过腹腔注射将PSD95/nNOS阻断剂ZL006(Millipore)以10 μg/g的浓度、10 μL/g的剂量给药,给药时间为每次打击前15 min。nNOS/CAPON阻断剂ZLc002(Selleck)以相同方式和剂量给药。
1.2.3 认知功能检测 ①新物体识别实验:实验开始前1周每日抚摸小鼠以消除小鼠的陌生感,开始前1 d将小鼠置于实验装置旁饲养,尽量避免操作时对小鼠造成刺激。实验开始后,首先让小鼠在底面为40 cm×40 cm的立方体实验装置中自由运动10 min,随后在装置中放入2个相同的物体(A和B,确保物体没有气味且固定无法移动),物体距两侧壁约10 cm,将小鼠背朝物体从距物体等距离处放入装置中,用摄像设备记录小鼠在每个物体上的探索时间(以嘴或鼻子接触到物体和凑近物体2~3 cm范围都算探索物体),在5 min内测定小鼠探索每个物体的时间。在初次测试完成6 h后将两物体中的一个物体替换成一个不同的物体固定在装置中,同样将小鼠背朝物体从距物体等距离处放入装置中,用摄像设备记录小鼠在5 min内对每个物体上的探索时间。②水迷宫实验:将水迷宫分为4个象限,平台置于其中一个象限中,该象限称为目标象限(Q4),其余3个象限为非目标象限(Q1~Q3)。将小鼠头朝池壁放入水中,放入位置为平台所在象限以外的任一象限边缘中点,记录小鼠找到水下平台的时间,若小鼠未在60 s内找到水下平台,则引导小鼠至平台上且停留10 s。随后将小鼠取出擦干,放回笼内。每只小鼠每日训练4次,两次训练的时间间隔为15~20 min,连续训练4 d。在第5日撤去水下平台,在平台所在象限的对侧象限将小鼠头朝池壁放入水中,记录小鼠进入目标象限的次数和在目标象限的探索时间。
1.2.4 Fluoro-Jade C(FJC)染色 将小鼠脑组织采用常规方法固定、包埋,制备成2 μm的石蜡切片,脱蜡后水合。载玻片在50~60 ℃下干燥30 min,在1份A液(氢氧化钠溶液,TR-100-FJ,Biosensis)和9份800 mL/L乙醇混合后的液体中孵育5 min,接着用700 mL/L乙醇溶液浸润2 min,再转入蒸馏水中浸润2 min。将蒸馏水与B液(高锰酸钾溶液,TR-100-FJ,Biosensis)以9∶1混合,孵育载玻片100 s,随后在避光环境下将蒸馏水与C液(FJC溶液,TR-100-FJ,Biosensis)以9∶1混合,黑暗环境下孵育载玻片10 min。孵育完成后用蒸馏水漂洗3次,在黑暗环境下以50~60 ℃干燥5 min、二甲苯透明2 min,使用中性树脂封片后在荧光显微镜下观察各切片绿色荧光,切片避光保存。
1.2.5 Western blotting检测 提取蛋白样品时在脑组织样品中加入RIPA裂解液并匀浆,离心后取上清,制备好的蛋白样品于-80 ℃保存。使用BCA法测定蛋白样品浓度,在100 g/L聚丙烯酰胺凝胶中电泳,然后转膜至PVDF膜,50 g/L脱脂牛奶封闭2 h。一抗PSD-95(1∶1 000,Abcam)、nNOS(1∶1 000,Santa Cruz Biotechnology)、CAPON(1∶1 000,Novus Biologicals)、GAPDH(1∶1 000,Proteintech)于4 ℃孵育过夜,在常温下二抗孵育2 h,用发光仪(ChemiDoc Touch,Bio-Rad)对条带发光。
1.2.6 免疫共沉淀检测 将抗体与磁珠(10006D,ThermoFisher)共孵育2 h。提取蛋白样品后,将蛋白样品与磁珠于4 ℃孵育过夜,使用PBST对结合在磁力架上的磁珠清洗3次,加入loading buffer后95 ℃高温变性10 min,去除磁珠即为制备好的免疫共沉淀样品,-80 ℃保存。后续使用Western blotting检测蛋白表达情况。

2 结果
2.1 rmTBI可导致小鼠产生神经退行性变及认知功能障碍
小鼠rmTBI模型建立1个月后进行行为学及FJC染色,明确rmTBI损伤情况。新物体识别实验结果显示,rmTBI组小鼠的新物体识别指数[新物体识别指数=新物体识别时间/(新物体+旧物体识别时间)×100%]相比于sham组明显下降(P<0.05),表明rmTBI小鼠在损伤后出现学习记忆功能减退(图1A)。同时,水迷宫实验结果显示,rmTBI组小鼠相比于sham组在第4日寻找水下平台的潜伏期较长(P<0.05,图1B),第5 日sham组小鼠在Q4探索时间长于在Q1~Q3探索时间(P<0.05),而rmTBI组小鼠在Q4的探索时间较sham组小鼠短(P<0.05,图1C),表明rmTBI小鼠存在学习能力和空间记忆能力减退。此外,脑组织切片FJC染色提示,rmTBI组在撞击下皮层区发生退行性变的神经元与sham组相比明显增多(图2)。以上结果表明,rmTBI可导致小鼠出现神经退行性变及认知功能障碍。

A:新物体识别实验;B~C:水迷宫实验。sham组:对照组;rmTBI组:重复轻型颅脑损伤组。 aP<0.05。 图1 rmTBI可导致小鼠产生认知功能障碍

sham组:对照组;rmTBI组:重复轻型颅脑损伤组。图2 rmTBI可导致小鼠产生神经退行性变
2.2 PSD-95/nNOS/CAPON复合体在rmTBI后的表达变化
rmTBI损伤后1个月对损伤区进行Western blotting检测,结果显示rmTBI组中的PSD-95、nNOS、CAPON与sham组相比表达无显著性差异(图3A)。进一步的免疫共沉淀结果显示,rmTBI组中PSD-95与nNOS之间的相互作用以及nNOS与CAPON之间的相互作用较sham组显著增多(P<0.05,图3B~C)。以上结果提示,rmTBI并不影响PSD-95/nNOS/CAPON复合体中相关分子的表达变化,而是会增加PSD-95、nNOS、CAPON之间的相互作用,进而促进PSD-95/nNOS/CAPON复合体的形成。

A:Western blotting 检测rmTBI后小鼠脑组织中nNOS、PSD-95、CAPON蛋白表达水平;B~C: PSD-95与nNOS和nNOS与CAPON免疫共沉淀的结果(aP<0.05)。sham组:对照组;rmTBI组:重复轻型颅脑损伤组;nNOS:神经元一氧化氮合酶;PSD-95:突触后致密蛋白-95;CAPON:N-甲基-D-天冬氨酸受体羧基端PDZ结构域结合配体。图3 PSD-95/nNOS/CAPON复合体在rmTBI后的表达变化
2.3 ZL006通过阻断PSD-95/nNOS相互作用可减轻rmTBI后神经功能损害
Western blotting结果显示,与rmTBI+saline组相比,rmTBI+ZL006组PSD-95与nNOS的相互作用显著减少(P<0.05),表明ZL006有效阻断了PSD-95与nNOS之间的结合(图4)。新物体识别实验结果显示,rmTBI+ZL006组新物体识别指数较rmTBI+saline组明显升高(P<0.05,图5A)。水迷宫实验结果显示,rmTBI+ZL006组小鼠相较于rmTBI+saline组,在第4日寻找水下平台的潜伏期更短(P<0.05),而第5日在目标象限的探索时间更长(P<0.05,图5B~C)。这些神经功能学实验结果表明,ZL006可减轻rmTBI导致小鼠认知功能障碍,提示阻断PSD-95/nNOS相互作用可减轻rmTBI后神经功能损害。
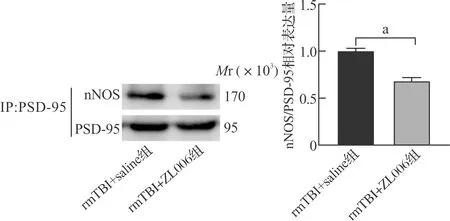
rmTBI+saline组:重复轻型颅脑损伤+生理盐水组;rmTBI+ZL006组:重复轻型颅脑损伤+抑制剂ZL006组。 aP<0.05。图4 ZL006阻断PSD-95/nNOS相互作用

A:新物体识别结果;B~C:水迷宫结果。rmTBI+saline组:重复轻型颅脑损伤+生理盐水组;rmTBI+ZL006组:重复轻型颅脑损伤+抑制剂ZL006组。 aP<0.05。图5 ZL006减轻rmTBI后神经功能损害
2.4 ZLc002阻断nNOS/CAPON相互作用可减轻rmTBI后神经功能损害
Western blotting结果显示,与rmTBI+saline组相比,rmTBI+ZLc002组nNOS与CAPON的相互作用显著减少(P<0.05),这表明ZLc002有效阻断了nNOS与CAPON之间的结合(图6)。新物体识别实验结果显示,rmTBI+ZLc002组的新物体识别指数较rmTBI+saline组明显升高(P<0.05,图7A)。水迷宫实验结果显示,rmTBI+ZLc002组小鼠相较于rmTBI+saline组,在第4日寻找水下平台的潜伏期更短(P<0.05),而第5日在目标象限探索时间更长(P<0.05,图7B~C)。这些神经功能学实验结果表明,ZLc002可减轻rmTBI导致小鼠认知功能障碍,提示阻断nNOS/CAPON相互作用可减轻rmTBI后的神经功能损害。

rmTBI+saline组:重复轻型颅脑损伤+生理盐水组;rmTBI+ZLc002组:重复轻型颅脑损伤+抑制剂ZLc002组。 aP<0.05。图6 ZLc002阻断nNOS/CAPON相互作用
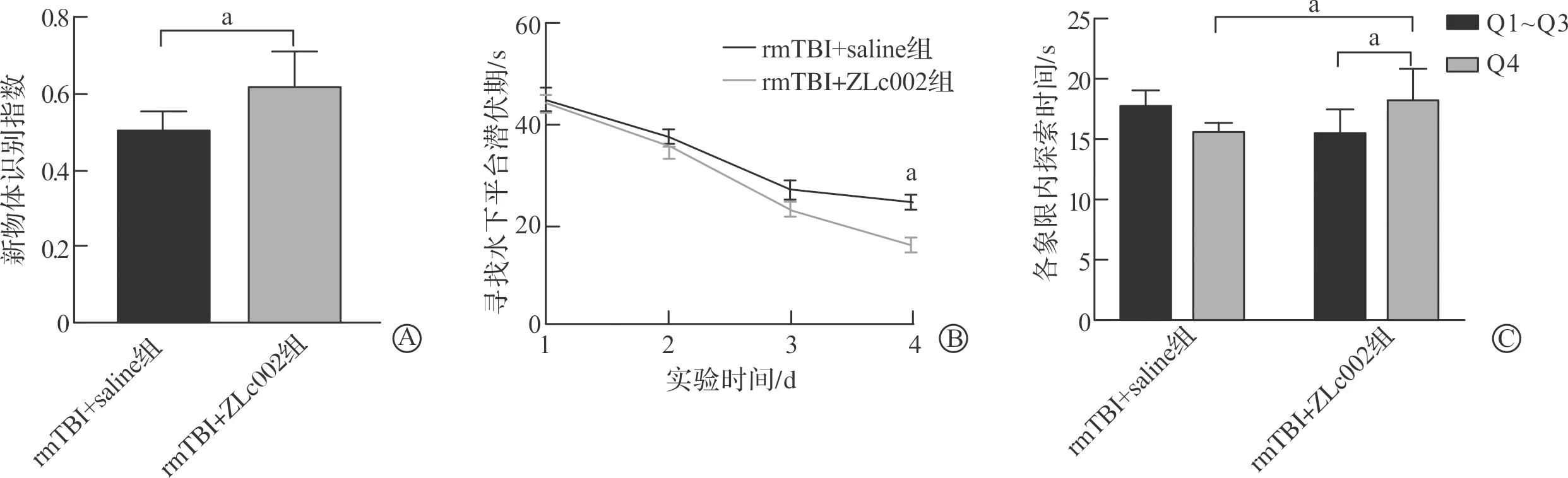
A:新物体识别结果;B~C:水迷宫结果。rmTBI+saline组:重复轻型颅脑损伤+生理盐水组;rmTBI+ZLc002组:重复轻型颅脑损伤+抑制剂ZLc002组。 aP<0.05。图7 ZLc002减轻rmTBI后神经功能损害
3 讨论
既往研究发现,rmTBI可导致以认知障碍、情绪障碍和创伤后应激障碍为主要表现的神经退行性变[12-14],但是其具体作用机制尚不明确。兴奋性毒性损伤是TBI后的重要损伤机制,而rmTBI后发生的慢性兴奋性毒性损伤可能跟神经退行性变相关[15]。NMDAR与PSD-95的相互作用是慢性兴奋性毒性损伤的重要机制,两者的相互作用可以将损伤信号从突触后向神经元内下游通路传导,最终引起神经元损伤和神经退行性变发生[16]。我们前期研究提示,调控NMDAR与PSD-95之间的相互作用能够阻断TBI引起的急性神经元损伤[17],这进一步提示PSD-95的下游信号可能会在rmTBI的致病过程中发挥关键作用。
PSD-95/nNOS/CAPON复合体是NMDAR异常激活后重要的下游效应分子,在神经元损伤调控中发挥关键作用[9-11]。本研究发现rmTBI并不直接影响PSD-95、nNOS和CAPON的蛋白表达水平,而是增加其分子之间的相互作用,提示rmTBI可促进PSD-95/nNOS/CAPON复合体形成。既往研究证明,阻断该蛋白复合体之间的相互作用可以对缺血性脑损伤产生脑保护作用,改善脑卒中预后[9-11]。本研究进一步表明,分别使用药理学抑制剂ZL006和ZLc002阻断PSD-95与nNOS之间以及nNOS与CAPON之间的相互作用,可在不影响相关蛋白表达的情况下改善rmTBI后的认知功能,提示rmTBI所导致的PSD-95/nNOS/CAPON复合体形成,是rmTBI后神经退行性变发生的重要分子机制。
以往研究发现,干预PSD-95/nNOS/CAPON复合体可以通过改变树突棘密度、树突分支长度、突触后微小兴奋性电流频率介导突触可塑性[11]。我们前期研究发现,NMDAR/PSD-95/nNOS信号途径主要针对神经元的线粒体功能发挥作用,通过抑制PSD-95与nNOS的相互作用,减轻TBI后线粒体发生的氧化应激损伤,从而发挥脑保护作用[18]。本研究进一步证实,CAPON作为nNOS的关键伴侣分子,是NMDAR/PSD-95/nNOS信号途径调控rmTBI病理过程的重要下游效应分子。在有关阿尔兹海默症的研究中,抑制nNOS与CAPON的相互作用能够改善神经退行性变和认知功能障碍[11]。而本研究同样表明,阻断CAPON与nNOS之间的联系可以改善rmTBI后认知功能,提示其可作为多种神经退行性变的共同干预靶点。
本研究使用ZL006和ZLc002对PSD-95/nNOS/CAPON复合体进行药理学干预,并不影响其蛋白表达量发生改变。相较于单纯地下调这些关键分子表达量,特异性地阻断其相互作用是一种更为安全有效的干预手段,这为进一步开发脑保护新药提供了新的思路。未来对于PSD-95/nNOS/CAPON复合体的研究应该关注其如何向下游传递兴奋性毒性损伤信号,寻找其下游发挥重要作用的信号分子,从而发现潜在的临床干预靶点,为rmTBI的治疗提供新的突破点。
