生白术多糖对洛哌丁胺诱导大鼠便秘的改善作用研究
2022-12-27贾梦鑫秦玲玲贾红梅邹忠梅
贾梦鑫,于 猛,秦玲玲,贾红梅,邹忠梅*
生白术多糖对洛哌丁胺诱导大鼠便秘的改善作用研究
贾梦鑫1,于 猛2,秦玲玲2,贾红梅2,邹忠梅2*
1. 天津中医药大学,天津 301617 2. 中国医学科学院 北京协和医学院药用植物研究所,北京 100193
探究生白术多糖对洛哌丁胺诱导大鼠便秘的改善作用及机制。采用ig洛哌丁胺(3 mg/kg)复制便秘大鼠模型,给予生白术水、醇提物及生白术多糖,通过测定粪便含水率、12 h粪便粒数及小肠推进率等指标评价其治疗便秘的作用;采用ELISA法检测大鼠血浆中胃动素(motilin,MTL)及血管活性肠肽(vasoactive intestinal peptide,VIP)水平;采用苏木素-伊红(HE)染色法检测大鼠结肠组织病理变化;采用免疫组化法检测结肠组织中黏蛋白2(mucoprotein 2,MUC2)和闭锁小带蛋白-1(zonula occludens-1,ZO-1)蛋白表达。生白术水提物显著改善便秘导致的大鼠粪便含水率、12 h粪便粒数及小肠推进率降低等症状(<0.01、0.001),而生白术醇提物则无明显改善作用。生白术多糖显著改善便秘大鼠症状(<0.001),显著升高便秘大鼠血浆中MTL水平并降低VIP水平(<0.001),改善便秘大鼠结肠黏膜损伤及杯状细胞的减少,显著增加便秘大鼠结肠组织MUC2和ZO-1的蛋白表达(<0.05、0.001)。生白术水提物治疗便秘药效显著,多糖是其治疗便秘的活性组分,可能通过调节血浆MTL、VIP水平,增加结肠组织MUC2、ZO-1蛋白表达水平,从而促进胃肠蠕动并增强结肠黏膜屏障功能,改善便秘症状。
白术;便秘;多糖;黏蛋白2;闭锁小带蛋白-1
便秘是一种常见的胃肠功能紊乱性疾病,主要表现为排便困难、排便次数减少或大便干结等,长期反复的便秘严重影响患者的工作和生活。目前西医治疗便秘多采用泻剂和促动力药,长期服用易引起腹痛、泻剂结肠、结肠黑变病及严重的药物依赖,损害患者的肠神经系统,从而加重便秘。中医药治疗便秘历史悠久,中医认为气虚不运者,水谷不消,脾气虚则肠腑传导无力,糟粕内停而生便秘[1]。白术是菊科植物白术Koidz.的根茎,性苦、甘,性温,归脾、胃经[2]。生白术单用或大剂量使用治疗便秘功效显著[3],但生白术通便作用及其药效物质尚不明确。
洛哌丁胺是临床上用于治疗急慢性腹泻的常用药物,可显著降低胃肠传输和排便频率,大鼠ig洛哌丁胺后,可减少粪便含水率及粪便粒数,降低小肠推进率,与临床患者便秘症状较为相似[4],是建立便秘动物模型的常用药物[5-7]。因此本研究采用洛哌丁胺诱导大鼠便秘模型,ig生白术不同极性提取物及组分,通过大鼠排便情况、肠动力、结肠组织病理等指标筛选生白术治疗便秘的活性组分,为白术的临床应用提供科学依据。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量180~220 g,购自北京维通利华实验动物有限公司,动物许可证号SYXK(京)2017-0020。大鼠饲养于中国医学科学院药用植物研究所动物实验中心,室温20~25 ℃,相对湿度(50±10)%,光照时间8: 00~18: 00,自由进食饮水,适应性饲养7 d后开始实验。动物实验经中国医学科学院药用植物研究所实验动物伦理委员会批准(批准号SLXD-20210824019)。
1.2 药材
生白术饮片(批号SBZ202005)购自安徽亳州永刚饮片厂有限公司,产地浙江省磐安县,经安徽省中医药科学院亳州中医药研究所院长刘耀武教授鉴定为菊科植物白术Koidz.的根茎;生白术饮片保存于国家中药化合物库。
1.3 药品与试剂
洛哌丁胺(批号L4762)购自美国Sigma-Aldrich公司;莫沙比利(批号26059)购自江苏豪森药业集团有限公司;阿拉伯胶(批号729J022)、牛血清白蛋白(bovine serum albumin,BSA,批号1106F052)购自北京索莱宝科技有限公司;活性炭(批号C12535790)购自上海麦克林生化科技有限公司;4%多聚甲醛通用型组织固定液(批号20201201)购自北京兰杰柯科技有限公司;大鼠胃动素(motilin,MTL)、血管活性肠肽(vasoactive intestinal peptide,VIP)ELISA试剂盒(批号202112)均购自北京长惠恒远生物科技有限公司;黏蛋白2(mucoprotein 2,MUC2)抗体(批号GR3374627-13)、闭锁小带蛋白-1(zonula occludens-1,ZO-1)抗体(批号GR3427980-4)、HRP标记的山羊抗兔抗兔(批号GR3265468-5)购自英国Abcam公司;二甲苯(批号20220320)购自国药集团化学试剂有限公司;水合氯醛(批号H1821050)、葡萄糖标准品(批号L2009312)购自上海阿拉丁生化科技股份有限公司;苯酚(批号20210422)购自福晨(天津)化学试剂有限公司;浓硫酸(批号20210425)购自黄骅市世纪科博科技发展有限公司;无水乙醇和95%乙醇(批号20210520)购自天津北联精细化学品开发有限公司;丙酮(批号20200904)购自北京市通广精细化工公司。
1.4 仪器
Infinite F50型酶标仪(瑞士Tecan公司);U-2910型双光束紫外分光光度计(日本日立公司);Micro17R型高速低温离心机(美国Thermo Fisher Scientific公司);DHG-9070A型电热鼓风干燥箱(上海恒科学仪器有限公司);YF-111B粉碎机型(瑞安市永历制药机械有限公司);DZTW型调温电热套(北京市永光明医疗仪器有限公司);SHK-III循环水式多用真空泵(郑州科泰实验设备有限公司);R-200型低温旋蒸蒸发仪(瑞士BUCHI公司);LGJ-185型冷冻干燥机(北京松源华兴科技发展有限公司);RM2235型病理切片机(德国Leica公司);JB-P7型包埋机(武汉俊杰电子有限公司);DB-B2型烤片机(常州国华电器有限公司);组化笔(Biosharp公司);MIchrome 5 Pro成像系统CCD相机(福州鑫图光电有限公司)。
2 方法
2.1 药材提取及多糖的制备
2.1.1 生白术水提物的制备 取生白术饮片适量,粉碎,称取600 g,加10倍量蒸馏水,浸泡12 h,加热回流提取2 h,趁热滤过(12层纱布),重复提取2次,合并滤液,真空抽滤,减压浓缩后置于冷冻干燥机,得冻干粉411.7 g,得率为68.6%。
2.1.2 生白术醇提物的制备 取生白术饮片适量,粉碎,称取300 g,加10倍量95%乙醇,浸泡12 h,加热回流提取2 h,趁热滤过,重复提取2次,合并滤液,真空抽滤,减压浓缩,冷冻干燥,得到冻干粉28.8 g,得率为9.6%。
2.1.3 生白术多糖的制备 称取生白术饮片600 g,粉碎,加10倍量蒸馏水,浸泡12 h,加热回流提取2 h,趁热滤过(12层纱布),重复提取2次,合并滤液,减压浓缩至0.2 g生药/mL,用95%乙醇进行醇沉,醇沉终体积分数为70%,4 ℃静置24 h后真空抽滤,反复醇沉2次,合并沉淀;依次用丙酮、无水乙醇冲洗醇沉获得的沉淀3次,冷冻干燥,得到生白术多糖,得率为46.8%。
2.2 多糖含量的测定
2.2.1 标准曲线的制作 准确称取干燥恒定质量的葡萄糖5.05 mg,蒸馏水定容至50 mL,摇匀后分别准确吸取0.0、1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL于10 mL量瓶中,加蒸馏水定容至刻度摇匀,取1.0 mL于具塞试管中,加1.0 mL 5%苯酚、5.0 mL浓硫酸,震摇,室温放置常温,于490 nm处测定吸光度()。以质量浓度为横坐标(),为纵坐标()做线性回归。
2.2.2 多糖含量的测定 称取生白术水提物及生白术多糖样品适量,分别于50 mL量瓶中,蒸馏水定容至刻度,取1.0 mL于具塞试管中,加1.0 mL苯酚、5.0 mL浓硫酸,震摇,室温放置常温,于490 nm处测定,并根据标准曲线计算多糖的含量。
2.3 便秘大鼠模型的复制
每日分别于9: 00、15: 00时,大鼠ig 3 mg/kg洛哌丁胺溶液(3 mL/kg),连续14 d后,通过粪便性状、粪便含水率、粪便粒数评价模型成功与否,对照组大鼠ig等体积生理盐水。
2.4 动物分组及给药
实验动物分2批进行,第1批分为对照组、模型组、莫沙比利(2.7 mg/kg)组、生白术水提物(8.64 g/kg,以生药量计)组、生白术醇提物(8.64 g/kg,以生药量计)组,每组8只大鼠;第2批分为对照组、模型组、莫沙比利(2.7 mg/kg)组和多糖(8.64 g/kg,以生药量计)组,每组8只大鼠。造模14 d后,各给药组ig相应药物,对照组ig等体积的生理盐水,1次/d,连续14 d。
2.5 动物取材及样本预处理
所有大鼠分别于末次给药后禁食不禁水12 h,ip 4%水合氯醛进行麻醉,腹主动脉取血,置于含肝素钠抗凝剂的采血管中,4 ℃、3000 r/min离心20 min,取上清分装,于−80 ℃低温保存。取回盲瓣2 cm后的结肠组织2 cm,用生理盐水冲净内容物,滤纸吸干,置于4%多聚甲醛通用型组织固定液中固定,用于苏木素-伊红(HE)染色及免疫组化检测。
2.6 粪便含水率及12 h粪便粒数的测定
收集第0、7、14、21、28天各组大鼠新鲜粪便,于90 ℃烘箱中干燥3 h,烘干前后分别称定质量,即得粪便湿质量及干质量,计算粪便含水率。
粪便含水率=(粪便湿质量-粪便干质量)/粪便湿质量
收集第0、7、14、21、28天各组大鼠12 h粪便,统计粪便粒数。
2.7 肠道推进实验
末次给药后各组大鼠禁食不禁水12 h,ig 2 mL 10%活性炭溶液(10%阿拉伯胶粉煮沸充分溶解至透明状后,加入10%活性炭粉末搅匀),20 min后麻醉,取幽门到盲肠段小肠,测定小肠推进率。
小肠推进率=活性炭推进距离/小肠总长度
2.8 血浆MTL和VIP水平的测定
按试剂盒说明书测定各组大鼠血浆中MTL、VIP水平。
2.9 结肠组织病理变化观察
实验结束后,解剖取结肠,于4%多聚甲醛溶液中固定,进行HE染色,于显微镜下观察大鼠结肠病理改变。
2.10 结肠组织MUC2和ZO-1蛋白表达的检测
取各组大鼠结肠组织1 cm,用生理盐水冲洗干净,以4%多聚甲醛溶液固定后,梯度乙醇脱水,透明,浸蜡,石蜡包埋、切片、烤片后,常规二甲苯脱蜡、梯度乙醇水化,3% BSA室温孵育30 min,分别滴加MUC2抗体(1∶300)、ZO-1抗体(1∶50),4 ℃孵育过夜;PBS洗片3次,每次5 min,滴加二抗(1∶400),37 ℃孵育30 min;PBS洗片3次,每次5 min,滴加DAB避光孵育3 min,水洗5 min,苏木素染液染色5 min。常规脱水、透明、中性树胶封片。采用Image-Pro Plus 6.0图像分析系统分析免疫组织化学图像上MUC2和ZO-1表达。
2.11 统计学分析
3 结果
3.1 多糖含量的测定
采用苯酚硫酸法检测生白术多糖的多糖含量,标准曲线为=10.542+0.006 5,2=0.999 4,计算得到生白术水提物中多糖质量分数为74.00%,白术多糖的多糖质量分数为86.20%。
3.2 生白术水、醇提物治疗便秘作用的比较
粪便粒数、粪便含水量是评价便秘动物胃肠功能的重要指标,其中粪便粒数表征胃肠动力强弱,粪便含水率表征肠道水分吸收与肠液分泌情况。本研究参照文献方法[8],采用ig洛哌丁胺复制便秘大鼠模型,如图1-A、B所示,造模第7天,模型组大鼠的粪便含水率和12 h粪便粒数已有下降趋势,但与对照组相比无显著性差异;造模第14天,模型组大鼠粪便含水率及12 h粪便粒数均显著下降(<0.001),表明便秘模型复制成功。便秘大鼠分别给予生白术水提物和醇提物治疗2周(第28天)后,如图1-C~E所示,与模型组比较,生白术水提物组大鼠粪便含水率、12 h粪便粒数及小肠推进率均显著升高(<0.01、0.001),药效和阳性药莫沙比利相当,而醇提物对便秘大鼠的排便情况及小肠推进率均无明显改善作用。
3.3 生白术多糖治疗便秘作用评价
便秘大鼠给予生白术多糖治疗后,如图2所示,治疗1周(第21天)后,便秘大鼠的粪便含水率及粪便粒数已呈上升趋势,向对照组靠近;当给药治疗2周(第28天)后,生白术多糖组大鼠的粪便含水率、12 h粪便粒数和小肠推进率均显著升高(<0.001),接近正常大鼠水平,且与阳性药莫沙比利组作用相当。提示生白术多糖对便秘大鼠的症状改善显著,可能是生白术治疗便秘的药效组分。
3.4 生白术多糖对便秘大鼠血浆MTL和VIP水平的影响
MTL是调节胃肠功能的兴奋性神经递质,可引起胃强烈收缩和小肠明显的蠕动。VIP是胃肠抑制性神经递质之一,具有松弛胃肠道平滑肌、抑制胃肠道蠕动的作用。如图3所示,与对照组比较,模型组大鼠血浆MTL水平显著降低(<0.05),VIP水平显著升高(<0.01);生白术多糖可以显著升高便秘大鼠血浆MTL水平(<0.001),降低VIP水平(<0.001),且多糖组治疗效果明显优于阳性药莫沙比利组(<0.05)。
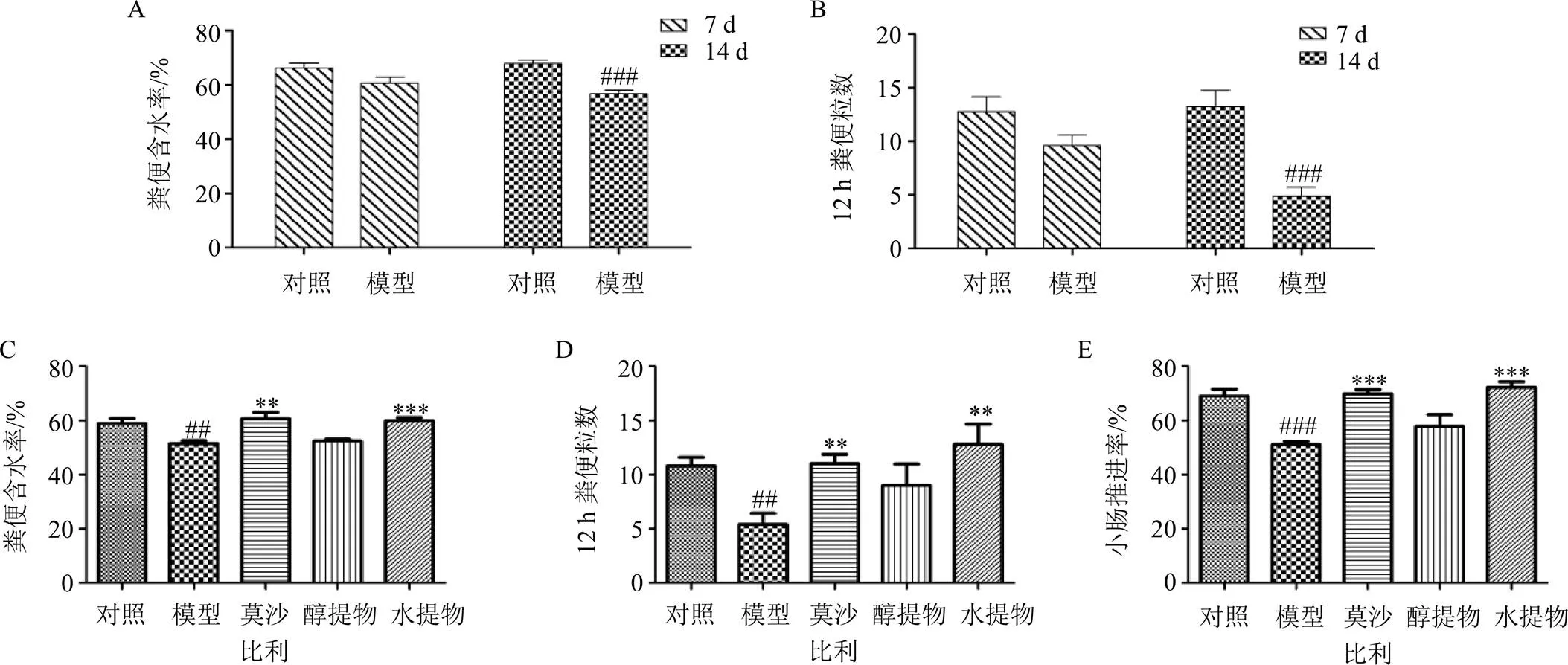
A-造模第7、14天大鼠粪便含水率 B-造模第7、14天大鼠粪便粒数 C-给药后各组粪便含水率 D-给药后各组粪便粒数 E-给药后各组小肠推进率 与对照组比较:#P<0.05 ##P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001,下图同

A-对照组 B-模型组 C-莫沙比利组 D-生白术多糖组,下图同
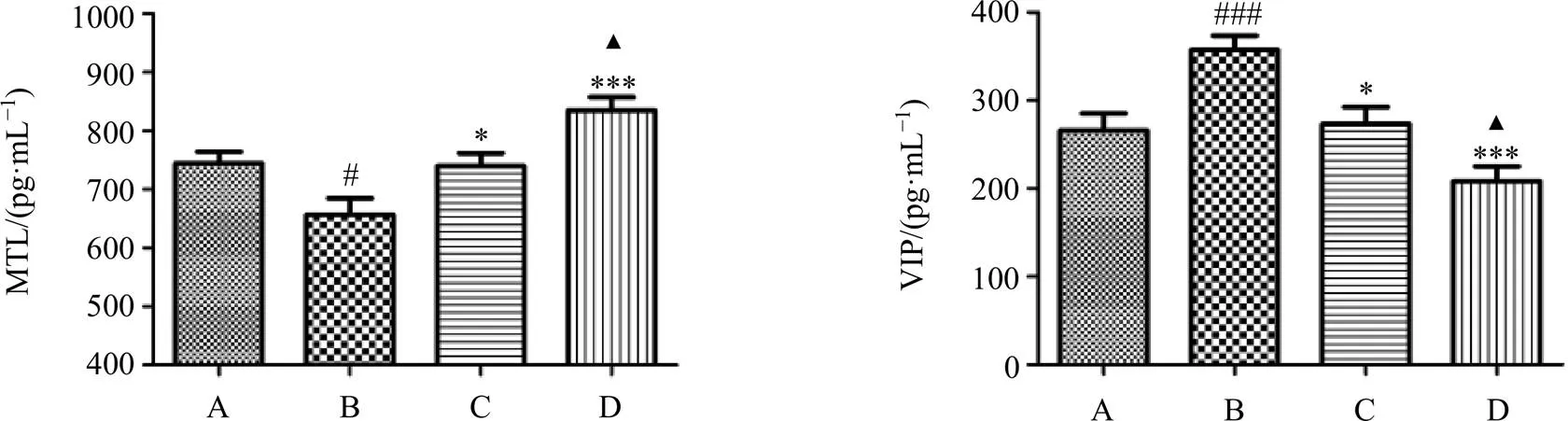
与莫沙比利组比较:▲P<0.05
3.5 生白术多糖对便秘大鼠结肠病理变化的影响
如图4所示,对照组大鼠结肠黏膜完整,腺体排列完整,结构清楚,未见异常病理形态改变。模型组结肠黏膜上皮破坏严重,隐窝排列混乱,肠腺杯状细胞数量明显减少,且伴有炎性细胞浸润。生白术多糖组和阳性药组治疗后,大鼠结肠黏膜层上皮细胞结构完整,腺体排列趋于正常,杯状细胞显著增多,较模型组有明显改善。
3.6 生白术多糖对便秘大鼠结肠组织MUC2蛋白表达的影响
MUC2是构成肠黏膜化学屏障(黏液层)最重要的糖蛋白之一,在肠道表面形成黏液层发挥润滑肠道的作用,研究发现,便秘小鼠结肠组织中MUC2 表达显著降低[9]。如图5所示,各组大鼠结肠组织中MUC2均有阳性表达,细胞胞质染色颗粒呈浅棕色、棕黄色或棕褐色。与对照组比较,模型组大鼠结肠组织MUC2的表达显著降低(<0.001);经生白术多糖及阳性药莫沙必利治疗后,大鼠结肠组织MUC2的表达均显著高于模型组(<0.001),接近正常大鼠水平,且二者药效相当。
3.7 生白术多糖对便秘大鼠结肠组织ZO-1蛋白表达的影响
ZO-1是构成肠道上皮细胞紧密连接的重要结构蛋白,对物质跨上皮转运、细胞增殖分化等过程具有重要调节作用,其在肠道组织内的低表达会导致肠黏膜细胞紧密连接蛋白功能降低,影响肠黏膜上皮屏障的完整性,造成肠道低渗环境,肠内水分流失,引起便秘的发生[10]。如图6所示,各组大鼠结肠组织中均有ZO-1的阳性表达,且呈浅棕色或棕黄色。与对照组比较,模型组结肠组织ZO-1的表达显著降低(<0.001);经生白术多糖及阳性药莫沙必利治疗后,ZO-1的表达均显著升高(<0.05、0.01),但多糖的改善作用弱于阳性药组。
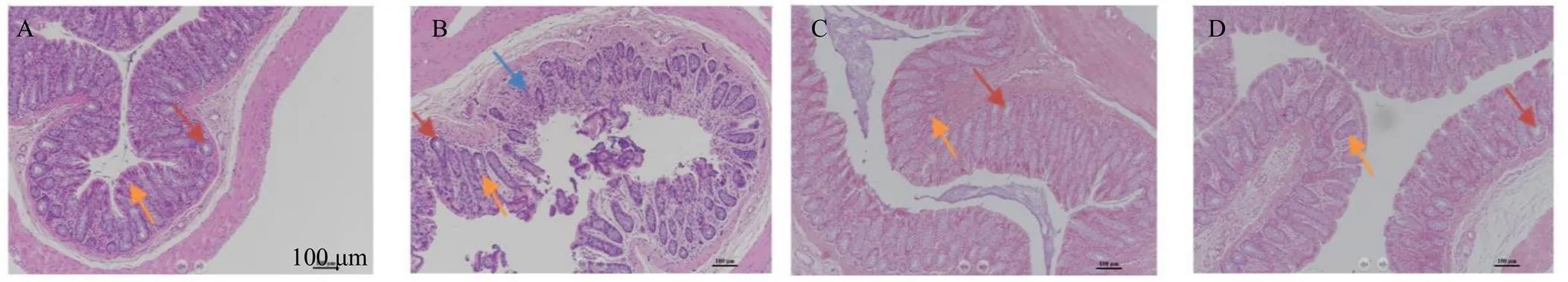
红色箭头表示腺体,黄色箭头表示杯状细胞,蓝色箭头表示炎性细胞浸润

图5 生白术多糖对洛哌丁胺诱导便秘大鼠结肠MUC2蛋白表达的影响(免疫组化, ×200)
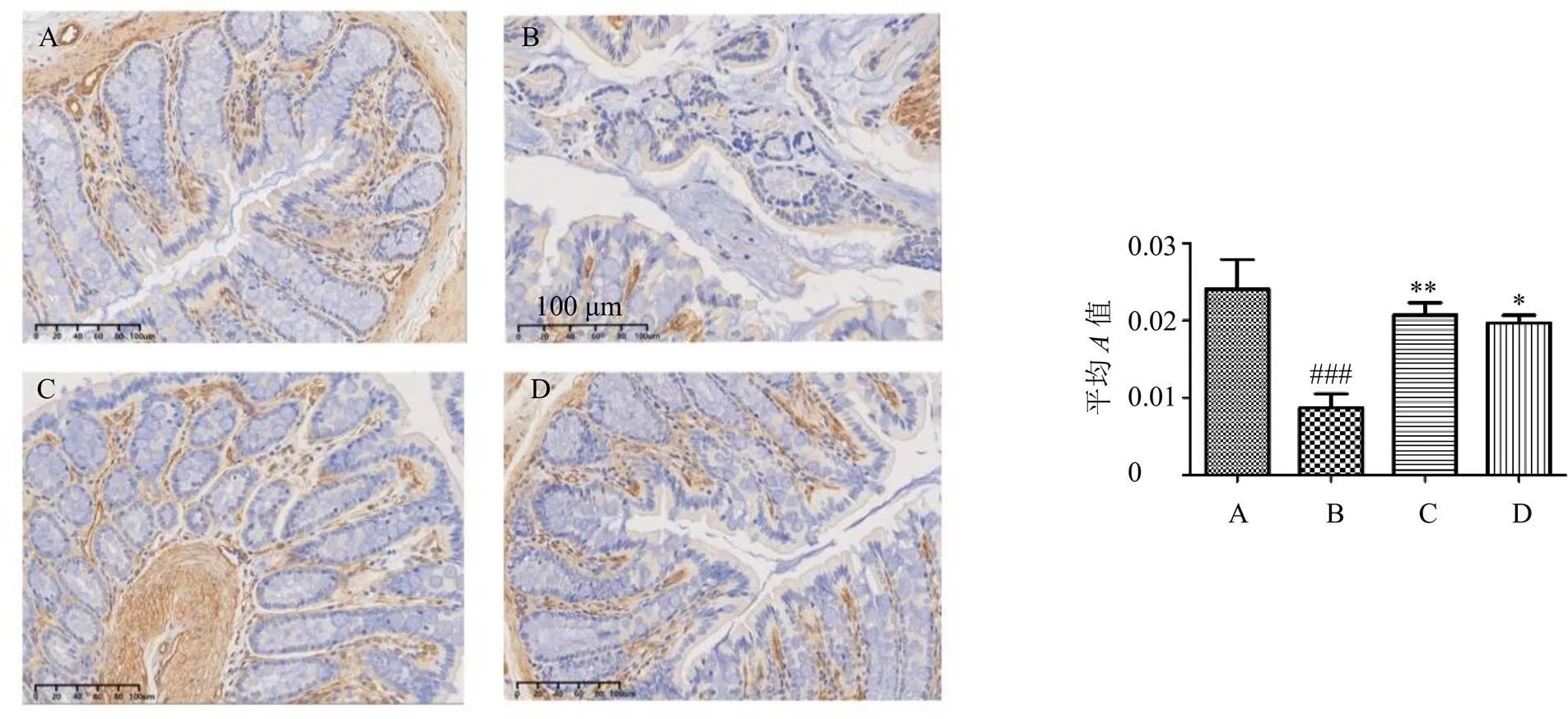
图6 生白术多糖对洛哌丁胺诱导的便秘大鼠结肠组织ZO-1蛋白表达的影响(免疫组化, ×200)
4 讨论
白术专入脾、胃二经,作为“脾脏补气第一药”,既可实脾,又可缓脾,自古被历代医者用于调理脾胃功能方面的疾病[11]。生白术重剂单用或方中配伍均可助运化而升清,协理气而降浊,气机调畅,津液输布,血运得旺,胃肠蠕润,则便秘自除。然而白术治疗便秘的药效物质至今尚不清楚。
胃肠动力不足及肠道水分和润滑性黏液分泌紊乱导致的肠道蠕动减弱,是便秘发生的主要原因[12-13]。本研究造模选用的盐酸洛哌丁胺通过抑制肠道平滑肌收缩,减少肠蠕动[14],延长肠道内容物的滞留时间[15],并减少消化液分泌引起大鼠排便困难[16]。排便粒数、粪便含水率和小肠推进率是评价胃肠道功能的重要指标。范亚楠等[17]发现便秘大鼠粪便干硬,粪便粒数及小肠推进率显著降低。本研究通过观察粪便含水率、12 h粪便粒数及小肠推进率等指标,比较了生白术水提物和醇提物对便秘大鼠的影响,结果显示,生白术水提物能显著改善便秘大鼠的症状,而醇提物无明显作用。多糖具有胃肠黏膜保护,平衡肠道菌群、改善肠内环境等功效,能够起到很好的润肠通便作用[18-19]。生白术水提物主要含多糖(质量分数为74.00%),因此,采用传统方法从生白术水提物制备获得生白术多糖(多糖质量分数为86.20%),并在洛哌丁胺诱导大鼠便秘模型上,对其治疗便秘作用进行了评价,发现多糖确能显著改善便秘大鼠的症状,并能修复便秘引起的结肠组织病理损伤。为了进一步验证其作用,从血浆中MTL、VIP水平及结肠组织MUC2、ZO-1蛋白表达考察了多糖对便秘大鼠的治疗作用。
脑肠肽是一类由中枢神经系统、胃神经系统和胃肠道内分泌细胞所分泌的小分子多肽物质。脑肠肽是脑-肠轴的作用物质基础和重要靶点,对胃肠功能调节具有关键作用[20]。在生理条件下,脑肠肽通过中枢神经系统和胃肠道平滑肌细胞调节胃肠运动。根据作用机制,脑肠肽可分为兴奋性神经递质和抑制性神经递质,其中MTL是调节胃肠功能的兴奋性神经递质,可引起胃强烈收缩和小肠明显的蠕动[21],而VIP是胃肠抑制性神经递质之一,主要分布于肠道全层,具有松弛胃肠道平滑肌、抑制胃肠道蠕动的作用[22]。研究证实,便秘大鼠血清中VIP水平显著升高,白术破壁饮片可通过降低便秘小鼠的VIP水平调节胃肠运动[23];还有研究发现,洛哌丁胺诱导的便秘大鼠血清MTL水平显著降低,VIP水平显著升高[24]。本研究结果与上述文献报道一致,同时还发现白术多糖可显著调节便秘大鼠血浆MTL和VIP水平,以促进胃肠道蠕动,从而起到治疗便秘的作用。
MUC2是一类由上皮细胞分泌的高相对分子质量糖蛋白[25],也是参与构成肠黏膜屏障最重要的糖蛋白,该蛋白在肠道表面形成黏液层发挥润滑和拮抗致病菌的肠道黏附和侵袭的作用[26]。ZO-1广泛分布于肠道、血管内皮等组织器官中,是构成上皮细胞紧密连接的重要结构蛋白,对物质跨上皮转运、细胞增殖分化等过程具有重要调节作用。其中ZO-1是细胞间紧密连接的枢纽,一旦ZO-1受到破环,紧密连接的结构与功能随之变化,因此,ZO-1常被用来观察肠紧密连接屏障功能和通透性功能的指标,且ZO-1很可能是益气健脾中药的作用靶点之一[27]。梅璐等[28]发现洛哌丁胺诱导的便秘小鼠结肠及mRNA表达显著降低,本研究结果与上述文献结果一致,同时还发现多糖可显著增加洛哌丁胺诱导的便秘大鼠结肠MUC2、ZO-1蛋白表达水平,增强结肠黏膜屏障功能,从而起到缓解便秘的作用。
本研究发现生白术水提物具有明确治疗便秘的作用,而多糖可修复便秘引起的结肠组织病理损伤,调控便秘大鼠血浆MTL、VIP水平,改善便秘大鼠结肠组织MUC2、ZO-1蛋白的低表达。表明多糖可能是生白术治疗便秘的主要有效组分。但生白术水提物中是否存在除多糖外治疗便秘的小分子药效成分仍不明确,后续将进一步比较白术水提物、多糖组分及除多糖组分的药效作用差异,为明确白术治疗便秘的药效物质提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 肖倩, 刘春强.慢传输型便秘的中西医治疗研究进展 [J]. 河南中医, 2012, 32(7): 933-935.
[2] 中国药典 [S]. 一部. 2020: 107.
[3] 李宝金, 宗文汇, 李桃花, 等. 重用生白术组方防治便秘的临床研究进展 [J]. 北京中医药, 2009, 28(11): 899-903.
[4] 黄亚娟, 蒋士生, 向燕芳. 洛哌丁胺对大鼠慢传输型便秘模型的稳定性研究 [J]. 湖南中医杂志, 2020, 36(7): 153-156.
[5] Li C, Nie S P, Zhu K X,. Effect ofNCU116 on loperamide-induced constipation in mice [J]., 2015, 66(5): 533-538.
[6] Lee H Y, Kim J H, Jeung H W,. Effects ofpaste on loperamide-induced constipation in rats [J]., 2012, 50(3/4): 895-902.
[7] Wintola O A, Sunmonu T O, Afolayan A J. The effect ofMill. in the treatment of loperamide-induced constipation in Wistar rats [J]., 2010, 10: 95.
[8] Li Y Y, Long S Q, Liu Q C,. Gut microbiota is involved in the alleviation of loperamide-induced constipation by honey supplementation in mice [J]., 2020, 8(8): 4388-4398.
[9] 王煜, 王自立, 王志旺, 等. 润肠通便合剂对便秘模型小鼠结肠MUC2、AQP3的影响 [J]. 中国应用生理学杂志, 2022, 38(2): 159-162.
[10] Wen Y, Zhan Y, Tang S Y,. Zhizhu Decoction alleviates intestinal barrier damage via regulating SIRT1/FoxO1 signaling pathway in slow transit constipation model mice [J]., 2022: 2022Aug31.
[11] 左军, 张金龙, 胡晓阳. 白术化学成分及现代药理作用研究进展 [J]. 辽宁中医药大学学报, 2021, 23(10): 6-9.
[12] Amir A A. Etiological factors of constipation in the elderly, with emphasis on functional causes [J]., 2011, 17(8): 708-711.
[13] 姚景春, 冯芹, 孙宝存. 己酮可可碱对慢传输型便秘模型大鼠的结肠黏液分泌和结肠肌电活动的影响 [J]. 中国药理学通报, 2011, 27(12): 1749-1752.
[14] Sohji Y, Kawashima K, Shimizu M. Pharmacological studies of loperamide, an anti-diarrheal agent. II. Effects on peristalsis of the small intestine and colon in guinea pigs (author’s transl) [J]., 1978, 74(1): 155-163.
[15] Yamada K, Onoda Y. Comparison of the effects of T-1815, yohimbine and naloxone on mouse colonic propulsion [J]., 1993, 29(2): 47-53.
[16] Shimotoyodome A, Meguro S, Hase T,. Decreased colonic mucus in rats with loperamide-induced constipation [J]., 2000, 126(2): 203-212.
[17] 范亚楠, 黄玉秋, 贾天柱, 等. 肉苁蓉炮制前后对便秘大鼠的通便作用 [J]. 中成药, 2016, 38(12): 2684-2687.
[18] 杨颖, 魏梦昕, 伍耀业, 等. 白术多糖提取分离、化学组成和药理作用的研究进展 [J]. 中草药, 2021, 52(2): 578-584.
[19] Feng W W, Liu J, Tan Y Z,. Polysaccharides fromKoidz. ameliorate ulcerative colitis via extensive modification of gut microbiota and host metabolism [J]., 2020, 138(Pt B): 109777.
[20] 郭椿, 贺平. 脑肠轴及其研究进展 [J]. 世界最新医学信息文摘, 2017, 17(95): 89-91.
[21] 肖政华, 谭芊任, 崔峻松, 等. 慢性应激对小鼠胃肠运动及血清GAS、MTL的影响 [J]. 贵阳中医学院学报, 2018, 40(1): 23-26.
[22] 姜迎娅, 陈忠. 动物肠道主要神经递质及其受体分布与功能的研究进展 [J]. 家畜生态学报, 2013, 34(9): 1-7.
[23] 陈容, 周必英, 周泠. 白术破壁饮片对慢传输型便秘小鼠肠神经递质及ICC的影响 [J]. 重庆医科大学学报, 2022, 47(1): 1-8.
[24] Huang J Q, Lin B, Zhang Y,. Bamboo shavings derived-acetylated xylan alleviates loperamide-induced constipation in mice [J]., 2022, 276: 118761.
[25] 朱伟, 朱迅. 肿瘤相关粘蛋白分子在肿瘤诊断及治疗中的意义 [J]. 中国肿瘤生物治疗杂志, 1996, 3(1): 72-75.
[26] 余晶仪, 郝小燕, 龙敏, 等.基因表达对益生菌调节肠屏障作用的影响 [J]. 南方医科大学学报, 2013, 33(2): 197-201.
[27] 李秋霞, 罗茂林, 李茹柳, 等. 紧密连接蛋白ZO-1研究概述 [J]. 广州中医药大学学报, 2007, 24(6): 523-526.
[28] 梅璐, 王昊阳, 张跃潇, 等. 复合发酵乳改善便秘小鼠的作用及其机制研究 [J]. 中华微生物学和免疫学杂志, 2022, 42(2): 110-120.
Ameliorative effect of polysaccharides from rawon constipation induced by loperamide in rats
JIA Meng-xin1, YU Meng2, QIN Ling-ling2, JIA Hong-mei2, ZOU Zhong-mei2
1. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China 2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences &Peking Union Medical College, Beijing 100193, China
To explore the effect and mechanism of polysaccharides from raw Baizhu () on constipation induced by loperamide in rats.The rat model of constipation was made by ig loperamide (3 mg/kg), and the water, ethanol extract and polysaccharides from rawwere given. The effects of rat model on constipation were evaluated by measuring fecal water content, number of fecal particles in 12 h and rate of intestinal propulsion; The levels of motilin (MTL) and vasoactive intestinal peptide (VIP) in plasma of rats were detected by ELISA; HE staining was used to detect the pathological changes of colon tissue in rats; The expressions of mucoprotein 2 (MUC2) and zonula occludens-1 (ZO-1) in colon tissue were detected by immunohistochemistry.The water extract from rawcould significantly improve the symptoms such as decreasing of fecal water content, fecal grains in 12 h and intestinal propulsion rate in rats caused by constipation (< 0.01, 0.001), ethanol extract had no obvious improvement effect. Polysaccharides from rawsignificantly improved the symptoms of constipation rats (< 0.001), increased MTL and decreased VIP levels in plasma (< 0.001), improved the damage of colon mucosa and reduction of goblet cells in rats with constipation, significantly increased the protein expressions of MUC2 and ZO-1 in colon tissues of rats with constipation (< 0.05, 0.001).The water extract from rawhas a significant effect on constipation. Polysaccharides are the active components in treatment of constipation. It may increase the expressions of MUC2 and ZO-1 proteins in colon tissue by regulating MTL and VIP levels in plasma, thereby promoting gastrointestinal peristalsis, enhancing the barrier function of colon mucosa, and improving constipation symptoms.
Koidz.; constipation; polysaccharide; mucoprotein 2; Zonula occludens-1
R285.5
A
0253 - 2670(2022)24 - 7808 - 08
10.7501/j.issn.0253-2670.2022.24.018
2022-09-22
国家自然科学基金资助项目(82073992);中国医学科学院医学与健康科技创新工程项目(2022-I2M-2-001)
贾梦鑫(1996—),女,硕士研究生,研究方向为中药药效物质基础及作用机制。E-mail: jia721001@163.com
邹忠梅,博士生导师,研究员,研究方向为中药药效物质基础。E-mail: zmzou@implad.ac.cn
[责任编辑 李亚楠]
