微生物法测定乳粉中维生素B12的实验室验证及结果分析
2022-12-27苏妙仪严家俊
◎ 苏妙仪,严家俊,綦 艳
(广东产品质量监督检验研究院,广东 顺德 528300)
维生素B12又名钴胺素(Cobalamin),是一类含钴的咕啉类化合物,也是唯一含金属元素的水溶性维生素,是人体所必需的维生素之一,对人体生理代谢与健康起着至关重要的作用[1-2]。缺乏维生素B12不仅会导致巨幼红细胞贫血,还会引起心脏病、神经紊乱、老年痴呆和帕金森综合征等神经系统疾病[3]。人体内不能合成维生素B12,需要从动物性食品中获取。
婴幼儿配方乳粉属于特殊膳食用品,通过在基础食物中添加多种营养素而得,它主要针对婴幼儿群体,对婴幼儿的生长发育起着重要作用[4-5],也可增加婴幼儿维生素营养需求的均衡性[6]。为了更好地补充生长发育所需各类营养素,通常6 个月以上的婴幼儿需要开始添加配方乳粉辅食,因此在婴幼儿健康发育过程中合理添加配方乳粉至关重要[7-8]。研究表明,中国母乳喂养比例逐年下降,婴幼儿奶粉已成为更多人的选择,由此可见,婴幼儿配方乳粉具有广阔市场发展前景,其各项指标检测数据要求也更加精确[9-10]。
维生素B12大多是借助于微生物发酵获得[11],其基质复杂,仪器法难以满足准确测定的要求。目前,传统微生物法是我国现行有效的检测标准,同时也是美国官方分析化学家协会和美国药典推荐的方法。但是,我国现行检测方法《食品安全标准 婴幼儿食品和乳品中维生素 B12的测定》(GB 5413.14—2010)[12]即将被《食品安全国家标准 食品中维生素B12的测定》(GB 5009.285—2022)[13]代替,其第三法微生物法适用于婴幼儿食品、乳及乳制品中维生素B12的测定。本研究在GB 5009.285—2022 新国家标准方法的基础上,优化测试菌液的制备和保存方法[14-15],从标准曲线线性、准确性、回收率和精密度等结果分析该方法在本实验室现有条件下的可行性与可靠性,为实验室开展此项检测工作提供有力支持。
1 材料与方法
1.1 试剂和材料
莱氏曼士乳酸杆菌(ATCC 7830):中国工业微生物菌种保藏管理中心;乳酸杆菌琼脂培养基、乳酸杆菌肉汤培养基、维生素B12测定用培养基:北京陆桥技术股份有限公司;维生素B12标准品:纯度≥99%,中国计量科学研究院。
婴幼儿配方乳粉:货号QC-IP-703,特性值4.111 μg/100 g,特性值区间3.471~4.752 μg/100 g:中国检验检疫科学研究院;5 组不同品牌的乳粉:随机购买。
1.2 仪器与设备
5804R 高速冷冻离心机(广东省中科进出口有限公司);PHS-3G pH 计(上海仪电科学仪器股份有限公司);XGI.D 型真空灭菌器(深圳市宇德立生物科技有限公司);ZQZY-CS8V 振荡培养箱(上海知楚仪器有限公司);酶标仪(德国拜发公司);UV-1900紫外可见分光光度计[岛津(中国)有限公司]。
1.3 试验方法
1.3.1 菌悬液的优化制备
参考GB 5009.285—2022 并稍作修改[14]。将莱士曼氏乳酸杆菌的冻干菌株活化后,接种到乳酸菌肉汤培养基上,于(36±1)℃培养24 h。再转种2~3 代增强活力。将活化后的菌液以8 000 r·min-1离心5 min,弃去上清液,加入10 mL 生理盐水,混匀。重复洗脱3 次,确保无残留培养基干扰。加入50 mL 含有25%甘油的维生素B12测定培养基,混匀制成菌株储备液,分装到菌株保存管中,每管1 mL,-70 ℃冻存备用。
试验前从-70 ℃冰箱中取出适量的菌株储备液,充分混匀。使用9 g·L-1生理盐水将其稀释成一定浓度的测试菌液,以9 g·L-1生理盐水做空白,用紫外可见分光光度计于550 nm 波长下检测测试菌液的透光率,使测试菌液透光率在60%~80%,待用。经验证,每10 mL 生理盐水(9 g·L-1)中加入该批次菌株储备液600 μL 所得测试菌液透光率在60%~80%,培养生长良好[14-15]。
1.3.2 线性检验
(1)工作曲线的配制。按照GB 5009.285—2022中的方法进行标准溶液的配制。①试管法检测按表1分别加入蒸馏水、维生素B12标准使用工作液和维生素B12测定用培养基于试管中,一式3 份。②微孔法按试管法标准曲线管的制备方式,将体积按比例缩减至1.0 mL 后,在无菌条件下过滤除菌至无菌离心管中,一式3 份。
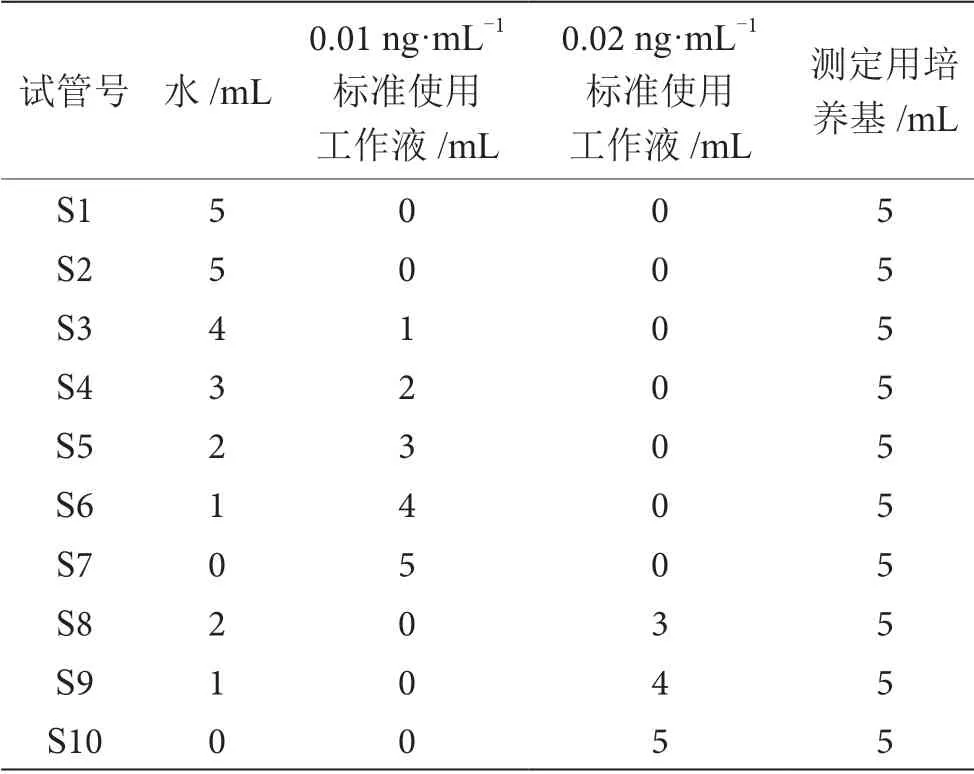
表1 标准曲线试管法配制表
(2)灭菌。在所有需培养的试管内分别加入一粒玻璃珠,盖上试管帽,按商品培养基标签说明进行灭菌(121 ℃灭菌5 min)。而微孔法无需高压灭菌,但是所需维生素B12测定用培养基需高压灭菌,然后备用。
(3)接种和培养。①试管法。将灭菌后的试管迅速冷却至30 ℃以下,除标准曲线管中空白S1 管外,分别向S2~S10 试管中加入预先准备好的1.3.1 测试菌液1 滴(约50 μL),将试管于(36±1)℃培养19~20 h。培养结束后,对每支试管进行目测检查,未接种试管S1 内培养液应是澄清的,如果S1 管出现浑浊,则测定无效,需重做实验。②微孔法。维生素B12测定用培养基高压灭菌冷却后,每10 mL 培养基中加入菌种测试菌液100 μL,混匀,吸取150 μL 加入微孔板中[16]。另吸取150 μL 1.3.2(1)项下标准系列管加入微孔板中,每个浓度做2 个平行。覆膜,混匀,置于(36±1)℃恒温培养箱中培养44~48 h[17]。
(4)测定。①试管法。将培养好的标准系列管用漩涡振荡器混匀,以未接种空白试管S1 作为空白,用1 cm 比色杯于550 nm 处将透光率调节为100%(或吸光度值为0),读出接种空白试管(S2)的读数。再以接种空白试管(S2)为空白,调节透光率为100%(或吸光度值为0),依次读出其他试管的透光率(或吸光度)。②微孔法。再次压紧粘合箔,将微孔板翻置在桌面上,振荡使微生物溶解在培养基中。将微孔板翻回如前置于桌面上,从右上角开始以对角线方向180°角轻扯下粘合箔,与此同时务必用另一只手按住放置在桌面上的微孔板,以防止因粘合箔与微孔板粘合过紧而在撕扯时带起微孔板。破坏微孔中液体表面的所有泡沫(可以用移液管尖或针状物)。用酶标仪在630 nm[17]条件下读取吸光度。如果未接种空白试管S1 出现浑浊,说明可能有杂菌污染,需重做实验。
1.3.3 准确性试验
采用中国检验检疫科学研究院测试评价中心货质控样(货号QC-IP-703,证书编号003IP02033)作为样品,按照GB 5009.285—2022 中的方法进行维生素B12的提取,试验重复6 次。①试管法按表2分别加入蒸馏水、试样提取液和维生素B12测定用培养基于试管中,一式3 份。同步配制工作曲线,见表1。②微孔法。在无菌条件下将试样提取液用无菌水相滤膜(0.22 μm)过滤除菌,取4支1.5 mL无菌离心管,分别加入100 μL、200 μL、300 μL 和400 μL 试样提取液,补无菌水至500 μL。一式3 份。同步配制工作曲线同1.3.2(1)中微孔法。灭菌、接种、培养和测定等具体操作步骤参考1.3.2。将测定的平均含量与其特性值进行相对误差比较。

表2 待测液的配制表
1.3.4 回收率试验
称取约1.0 g 质控样(货号QC-IP-703,证书编号003IP02033)12 份于锥形瓶中,精确到0.000 1 g,分为空白、低、中和高4 组,每组3 份。分别准确加入1 ng·mL-1维生素B12标准工作液0 mL、10 mL、50 mL和100 mL 各3 份,按照GB 5009.285—2022 中的方法进行维生素B12的提取、参考1.3.3 准确性试验进行检测,根据检测结果计算回收率。
1.3.5 精密度试验
随机选取5 组不同品牌的配方乳粉作为试验样品,每组样品做6 次重复性试验。用平行结果的相对标准偏差衡量精密度。
2 结果与分析
2.1 线性检验
以标准系列管维生素B12含量为横坐标,每个标准点吸光度值均值为纵坐标,绘制标准曲线得回归方程,结果见图1、图2。试管法和微孔法线性方程的相关系数R²分别为0.993 和0.990,均≥0.99,表明在0~0.1 ng 时,两种方法的吸光度值与维生素B12含量之间的线性关系良好,满足检测要求。
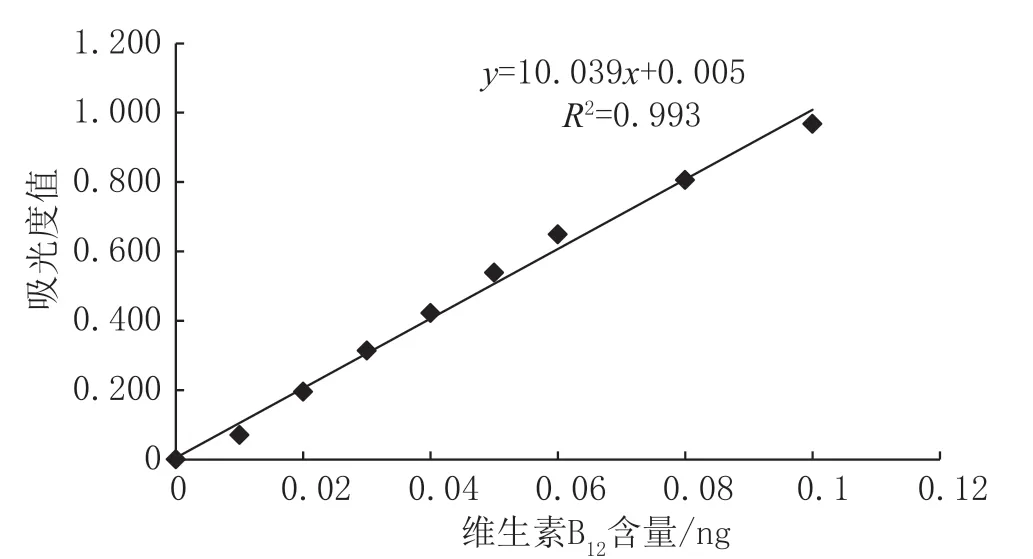
图1 试管法标准曲线图
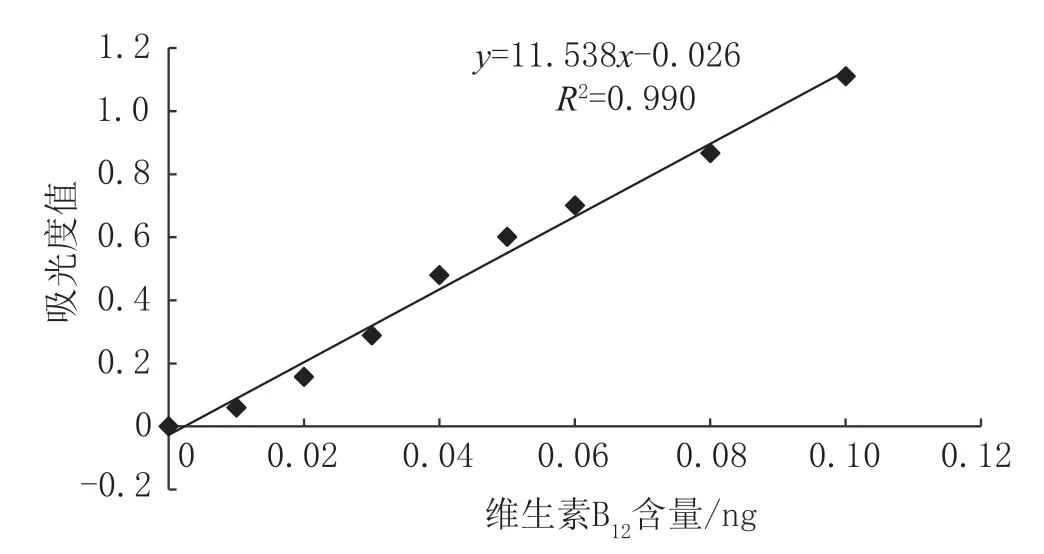
图2 微孔法标准曲线图
2.2 准确性试验
2.2.1 质控样测定
以中国检验检疫科学研究院测试评价中心的质控样(货号QC-IP-703 证书编号003IP02033)作为样品,检测结果见表3。试管法与微孔法测定质控样中维生素B12含量分别为(4.06±0.13)μg/100 g 和(4.13±0.12)μg/100 g,2 种方法所测结果都与其特性值相符,相对误差为-4.4%~3.4%,2 种方法准确度均符合《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)的要求。而且试管法与微孔法的RSD 分别为3.2%和3.0%,表明重复性良好。
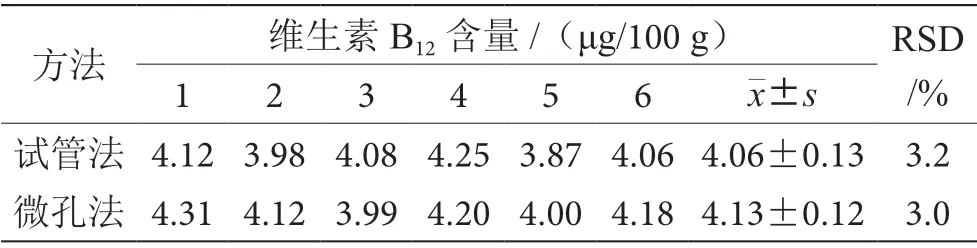
表3 试管法与微孔法测定质控样中维生素B12 结果表
2.2.2 加标回收检验
在0 ng、10 ng、50 ng 和100 ng 4 个不同的加标量下做3 个平行,计算回收率,结果见表4。试管法平均回收率为99.2%~100.0%,微孔法的平均回收率为100.8%~101.0%,RSD 均<2%,符合GB/T 27404—2008中关于回收率的要求,方法准确。
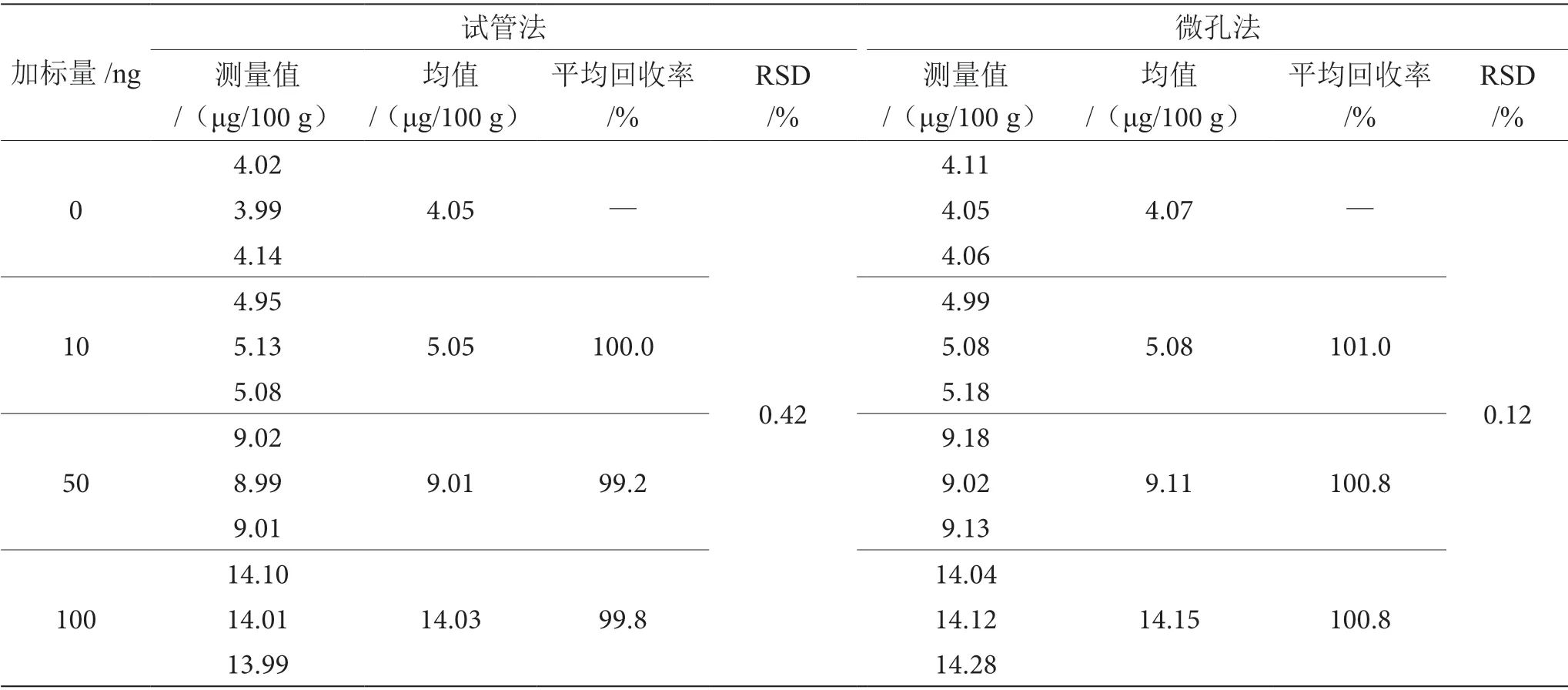
表4 试管法与微孔法加标回收检验结果表
2.3 精密度试验
5 种不同品牌的乳粉,每种进行6 次重复性实验,结果见表5、表6。试管法的RSD 值为2.0%~3.1%,微孔法的RSD 值为1.7%~3.2%,表明两种方法的重复性均良好。在显著性水平α=0.05 时,F<Fcrit,两种方法无显著性差异,5 组乳粉两种方法测定结果一致,符合要求。

表5 试管法重复性检验表

表6 微孔法重复性检验表
3 结论与讨论
微生物法利用相应的营养缺陷型菌种对特定维生素有很强的特异性,在一定条件下,其生长和繁殖速度与溶液中维生素的含量成一定对应关系,可测定具有生物活性的维生素,测定结果准确、范围广、灵敏度高,能满足含量低和基质复杂的特殊食品检测。维生素B12是莱士曼氏乳酸杆菌生长所必需的营养素。GB 5009.285—2022 中采用微生物法测定维生素B12的原理主要是利用莱士曼氏乳酸杆菌对维生素B12有极高的特异性和灵敏性,在一定条件下,莱士曼氏乳酸杆菌的生长与维生素B12的含量成对应关系,根据维生素B12的含量与透光率(或吸光度值)的标准工作曲线,能定量计算出待测样品中维生素B12的含量。
GB 5009.285—2022 新国家标准并未对微孔法进行具体操作说明,本研究建立的微孔法是参考即将实施的《食品安全国家标准 食品中叶酸的测定》(GB 5009.211—2022)的标准方法[16],并结合VitaFast®维生素B12检测试剂盒[17]中维生素B12培养时间对乳粉中维生素B12含量进行测定。从标准曲线线性、准确性、精密度可知,微孔法与试管法检测结果无明显差异,效果相当,能满足实验要求。且微孔法具有检测步骤简单、省时、操作便捷等优点,在制备样液过程中无需高压灭菌,操作简单,在培养过程中能大大降低培养箱空间,培养结束后直接运用酶标仪即可测量相关数据,极大地节省了检测时间。而试管法需用到大量试管、器皿等,清洗要求较高且烦琐,在灭菌和培养时占用空间大,使用分光光度计测量吸光度值时需要较长时间。在工作中,可根据实际情况选择合适的方法。
本研究在GB 5009.285—2022 新国家标准方法的基础上,优化了测试菌液的制备和保存方法,通过分析标准曲线线性,对QC-IP-703 质控样和5 组不同品牌的乳粉进行检测以及加标回收试验。验证结果表明,试管法和微孔法标准曲线线性关系R2≥0.99,准确性以及精密度等满足标准方法要求,可操作性强。因此,本实验室具有开展GB 5009.285—2022 微生物法测定乳粉中维生素B12的检测能力,可以开展此项检测工作。
