米泔水炮制桔梗过程中微生物变化规律研究△
2022-12-26于鑫鑫丁纯洁陈丽艳孙银玲郑宏宇王伟明
于鑫鑫,丁纯洁,陈丽艳,孙银玲,郑宏宇,王伟明
黑龙江省中医药科学院,黑龙江 哈尔滨 150036
桔梗为桔梗科植物桔梗Platycodon grandiflorum(Jacq.)A.DC.的干燥根,主入肺经,具有宣肺利咽、祛痰排脓的功效[1],是原中华人民共和国卫生部公布的药食同源品种[2],在我国有着悠久的药用及食用历史。米泔水,也称“米泔”“淅二泔”“米渖”,是淘洗大米或糯米时第2 次滤出的白色混浊液体,含少量淀粉及维生素等,是中药炮制常见液体辅料之一[3]。米泔水炮制中药是传统炮制方法之一,在古代应用广泛,现代多用于炮制苍术、射干、藜芦等[4-6]。米泔水制桔梗(MZJ)最早出现于宋代,《小儿卫生总微论方》中记载“去芦,米泔水浸一宿,焙干用”[7],明清两代较为盛行。《本草纲目》中也有记载“今但刮去浮皮,米泔水浸一夜,切片,微炒用。”[8]但历版《中华人民共和国药典》中收载的桔梗饮片均为生品,MZJ饮片未收载于任何标准中,且其炮制原理也未得到科学诠释。本研究以现代中药炮制理论为指导,参照古籍记载的方法用米泔水炮制桔梗,借助16S rRNA 测序技术,考察MZJ 浸泡液中微生物群落结构及丰度变化,为从微生物发酵及桔梗成分的生物转化角度阐明MZJ 炮制原理提供依据。
1 材料
1.1 试药
桔梗生品饮片购于北京同仁堂哈尔滨药店(批号:210501,产地:安徽亳州),由黑龙江省中医药科学院王伟明研究员鉴定为桔梗科植物桔梗Platycodon grandiflorum(Jacq.)A.DC.的干燥根;糯米购于超市;十六烷基三甲基溴化铵(CTAB,北京诺博莱德科技有限公司);Phusion®High-Fidelity PCR Master Mix(New England Biolabs 公司);引物由Wekemo Tech Group Co.公司合成。
1.2 仪器
LM17R 型冷冻高速离心机(美国赛默飞世尔公司);LDZM-60KC 型高压蒸汽灭菌锅(上海申安医疗器械厂);DHP9272 型恒温培养箱(上海一恒科学仪器有限公司);DYCP-32C 型琼脂糖水平电泳仪(北京市六一仪器厂);Qubit 型荧光定量仪(美国Life Technologies 公司);2100 型生物分析仪(美国Agilent Technologies 公司);Novaseq 6000 型测序仪(美国Illumina 公司);T100 型梯度聚合酶链式反应(PCR)仪(美国Bio-Rad公司)。
2 方法
2.1 样本的制备
米泔水的制备:取糯米适量,粉碎,过五号筛,每1 g 糯米粉加水50 mL,搅拌均匀,得米泔水混悬液[9]。
MZJ 浸泡液的制备:取桔梗生品饮片30 g,加8 倍量米泔水,于28 ℃浸泡72 h,分别取相同体积浸泡12、24、48、72 h 的溶液,12 000 r·min-1离心10 min(离心半径为8.6 cm),收集菌体,分别命名为MZJ1、MZJ2、MZJ3、MZJ4。
分别将米泔水、桔梗生品饮片加8 倍量水作为对照,于28 ℃浸泡24 h,12 000 r·min-1离心10 min(离心半径为8.6 cm),收集菌体,分别命名为MG和JG。
所有样品均为无菌条件下采集及处理,分别制备3个平行样品,处理后的样品于-80 ℃冰箱保存待测。
2.2 DNA提取、PCR扩增及高通量测序
DNA 提取:采用CTAB 法提取各样本基因组DNA,利用1%琼脂糖凝胶电泳检测DNA 的纯度和浓度,用无菌水稀释样品至1 ng·µL-1。
PCR 扩增:采用引物341F(5'-CCTAYGGGRBGCASCAG-3')和806R(5'-GGACTACNNGGGTATCTAAT-3')对样本的V3+V4可变区进行扩增。PCR反应体系30 µL,其中Phusion®High-Fidelity PCR Master Mix(2×)15 µL、正向引物(0.2 mol·L-1)1 µL、反向引物(0.2 mol·L-1)1 µL、gDNA(1 ng·µL-1)10 µL,双蒸水(ddH2O)补足至30 µL。扩增程序为98 ℃预变性1 min;98 ℃,10 s;50 ℃,30 s;72 ℃,30 s;共进行30 个循环;72 ℃延伸5 min。PCR 产物使用2%浓度的琼脂糖凝胶进行电泳检测。委托深圳微科盟科技集团有限公司采用Illumina Novaseq平台对样本进行双端测序。
2.3 高通量测序结果分析
测序所得数据经接头序列(barcode)拆分后获得有效序列信息,采用QIIME 2.0 软件包对有效序列进行操作分类单元(OTU)聚类/去噪和物种分类分析,形成OTU 和其他物种分类等级(门、纲、目、科、属、种)的物种丰度谱。利用qiime 2 diversity 插件及R 语言对α多样性及β多样性进行分析。对OTU 丰度矩阵中每个样本的序列总数在不同深度下随机抽样,以每个深度下抽取到的序列数及其对应的OTU 数量绘制稀释曲线;选取Observed OTU,Shannon、Chao1 指数对炮制过程中菌群丰度及多样性进行分析;绘制韦恩图,直观展现各样本组间特有或共有OTU占比;根据样本的OTU丰度信息计算Bray Curtis、Weighted Unifrac 和Unweighted Unifrac 距离来评估不同样品间的微生物群落结构差异;基于Weighted Unifrac 距离进行非度量多维尺度(NMDS)分析、主坐标分析(PCoA)和主成分分析(PCA),通过二维排序图描述群落样本的结构分布。利用Python LEfSe 软件包进行线性判别分析及影响因子(LEfSe)分析。
3 结果与分析
3.1 稀释曲线及韦恩分析
对JG、MG、MZJ1、MZJ2、MZJ3、MZJ4 组共18 个样品进行测序分析,所得测序数据经过barcode拆分,获得有效序列信息,得到1 898 034条序列,样本中所含最大序列数为115 484,最小序列数为95 999,平均测得105 446 条序列。对OTU丰度矩阵中每个样品序列总数在不同深度下随机抽样,以每个深度下抽到的序列数及其对应的OTU数量构建α多样性稀释曲线(rarefaction curve),随着测序深度的增加,稀释曲线达到饱和状态,即使增大样本容量,曲线变化也非常微小,说明测序数据量合理且足够大,能满足后续分析要求[10],见图1。

图1 基于Observed OTU的不同样本稀释曲线
使用韦恩图对样本共有OTU 进行分析,从图2可以看出,MZJ 不同浸泡时间溶液中共有OTU 数为116,随着浸泡时间的增加,特有OTU 数量先增加后减少。6 组样品共有OTU 数为80 个,MG 和JG 特有OTU数分别为50、54个。

图2 MZJ各组样品OTU韦恩图
3.2 α多样性分析
α多样性主要用于考察样本内微生物群落的丰度和多样性。Observed OTU 和Chao1 指数是样本菌群丰度的表征,数值越高说明菌群丰富度越高。Shannon、Simpson 指数与样本中菌群多样性相关,数值越大群落多样性越高[11]。结果显示,随着MZJ炮制时间的增加,浸泡液菌群丰度呈先增加后降低的趋势,其中MZJ1 和MZJ2 菌群丰度较接近,且高于其他4 组样本,菌群多样性也较高,MZJ4 菌群丰度和多样性均降至最低(表1)。
表1 MZJ样品α多样性指数(,n=3)
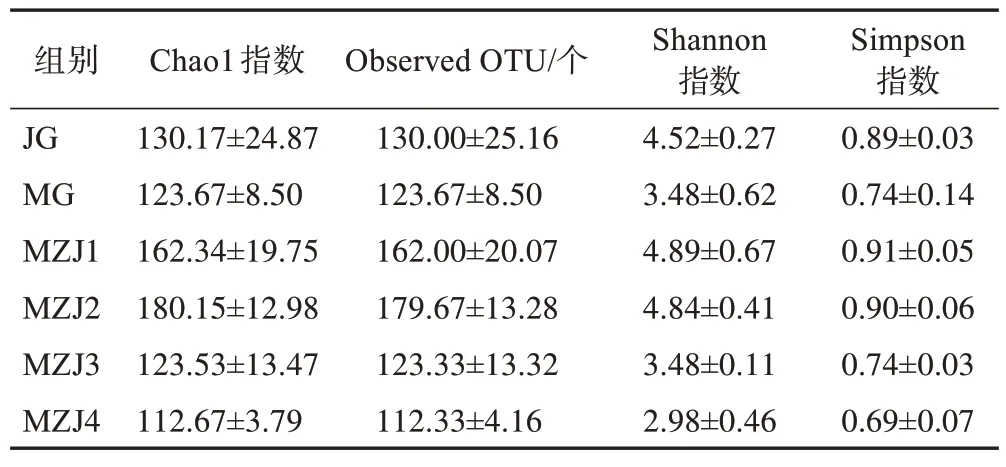
表1 MZJ样品α多样性指数(,n=3)
3.3 β多样性分析
β多样性分析主要用于考察不同样本间群落结构的相似性。采用基于Weighted Unifrac 距离进行的NMDS 分析。相较于Bray Curtis 距离和Unweighted Unifrac 距离,Weighted Unifrac 距离在考虑物种丰度信息的同时也考虑了物种的有无。由图3A可知,该聚类胁强系数为0.032 5(<0.05),说明NMDS分析结果能够清晰反映群落间相似程度,具有很好的代表性[12]。MZJ1 距离MG 较近,说明菌落组成具有较高相似性,随着MZJ 炮制时间的增加距离逐渐变远,说明菌落组成差异逐渐变大,MZJ3 和MZJ4 的菌落组成具有较高相似性,同时与JG 组的距离也逐渐加大。PCoA 表明,PC1 和PC2 的累积方差贡献率为89.70%,可反映出大部分信息,PCoA 结果与NMDS分析结果相近(图3B)。PCA结果表明,PC1和PC2的累积方差贡献率仅为26.56%,因此未参考PCA结果。
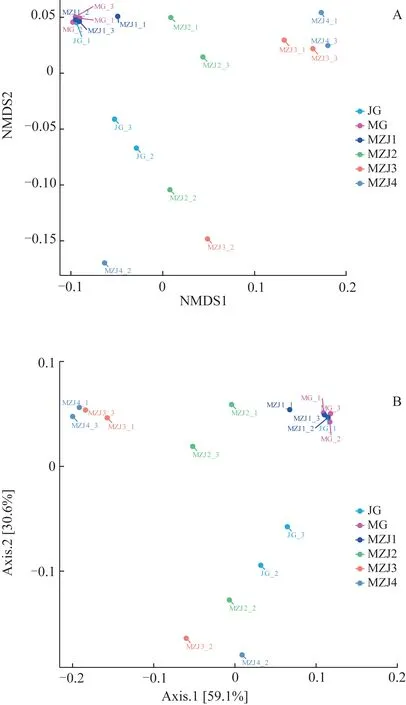
图3 MZJ样品菌群β多样性分析
3.4 菌群组成及相对丰度分析
3.4.1 门水平菌群组成及相对丰度分析 如图4 所示,各组样本主要菌群组成均为变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)。其中JG组变形菌门相对丰度为73.86%,厚壁菌门相对丰度为26.10%;MG 组变形菌门相对丰度为93.15%,厚壁菌门相对丰度为6.65%;MZJ1~MZJ4 变形菌门相对丰度分别为89.75%、56.35%、31.39%和37.70%,而厚壁菌门相对丰度分别为10.20%、43.57%、68.61%和62.30%。结果表明,MZJ 炮制前期变形菌门占优势,随着炮制时间的延长,厚壁菌门相对丰度增加,成为优势菌门,炮制48 h 时趋于稳定。

图4 MZJ样品门水平各菌群的相对丰度
3.4.2 属水平菌群组成及相对丰度分析 选取相对丰度前20 的菌属进行分析。如图5 所示,JG 组相对丰度较高的菌属包括肠杆菌科未明确分类属(Unspecified_Enterobacteriaceae,31.40%)、魏斯氏菌属(Weissella,21.48%)、肠杆菌属(Enterobacter,18.21%)、欧文氏菌属(Erwinia,9.50%)等。MG组丰度较高的菌属包括肠杆菌属(45.34%)和肠杆菌科未明确分类属(34.21%)等。MZJ 各组样本主要优势菌有肠杆菌科未明确分类属、乳球菌属(Lactococcus)、魏斯氏菌属、欧文氏菌属等,随着炮制时间的增加,肠杆菌科未明确分类属相对丰度先上升后下降,在MZJ1、MZJ2、MZJ3、MZJ4 中分别为17.98%、24.06%、16.17%和11.84%;乳球菌属相对丰度显著上升,在MZJ1 中仅为2.24%,在MZJ4 中达到40.15%;魏斯氏菌属相对丰度前24 h 迅速上升然后下降,在MZJ1、MZJ2、MZJ3、MZJ4中分别为1.89%、20.34%、24.71%和14.32%;欧文氏菌属相对丰度显著下降,在MZJ1 中为50.44%,在MZJ4 中仅为2.72%。除上述菌属外,葡糖杆菌属(Gluconobacter)、泛菌属(Pantoea)、明串珠菌属(Leuconostoc)变化也较大。葡糖杆菌属在浸泡48 h 前所占丰度均小于1.00%,而在72 h 丰度增至17.24%;泛菌属丰度则随炮制时间的增加呈下降趋势,由11.82%迅速下降至低于1.00%;明串珠菌属丰度则随着炮制时间的增加而增加,由1.47%增至7.58%。

图5 MZJ样品属水平各菌群的相对丰度
3.5 组间OTU差异显著性分析
LEfSe 分析基于相对丰度表,可筛选具有统计学差异的菌群,是非参数检验和线性判别分析的结合,适合菌群丰度差异检验[13],用线性判别分析(LDA)值表示。每个分组的特征微生物(LDA值>4)见图6。JG、MZJ4组未发现差异有统计学意义的菌群,MG组的特征菌包括假单胞菌目(Pseudomonadales)、鞘氨醇杆菌属(Sphingobacterium)、土壤杆菌属(Agrobacterium)、鞘氨醇杆菌科(Sphingobacteriaceae)、鞘脂杆菌纲(Sphingobacteriia)、鞘氨醇杆菌目(Sphingobacteriales);MZJ1 组的特征微生物包括γ-变形菌纲(Gammaproteobacteria)、肠杆菌科(Enterobacteriaceae)、肠杆菌目(Enterobacteriales)、变形菌门、欧文氏菌属;MZJ2组的特征微生物包括塔堤查仁杆菌属(Tanticharoenia)、伯克霍尔德氏菌属(Burkholderia)、伯克氏菌科(Burkholderiaceae)、罗尔斯 通菌属(Ralstonia)、草酸杆菌科(Oxalobacteraceae);MZJ3组的特征微生物包括厚壁菌门、乳杆菌目(Lactobacillales)、芽孢杆菌纲(Bacilli)。
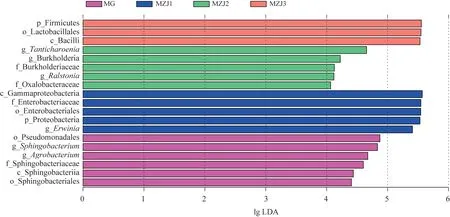
图6 MZJ样品差异菌群的LDA值分析
4 讨论
米泔水炮制中药多以浸制为主,时间为1~7 d,目前对于其炮制原理研究,多数研究者认为米泔水可去除药材中的油脂,降低药物的辛燥之性和滑肠作用,如米泔水炮制苍术能够降低挥发油、苍术素和苍术酮的含量[9]。另外,米泔水炮制中药还可降低毒性,刘亚蕾等[14]考察了不同辅料炮制何首乌的减毒效果,结果发现,米泔水的减毒效果优于大枣和黑豆,且炮制前后化学成分发生了转化,其中顺式二苯乙烯苷、大黄素-8-O-β-D-葡萄糖苷含量下降明显,推测此2 种成分可能是何首乌潜在的毒性相关成分,初步推测是由于米泔水的吸附作用而导致其含量下降。王金辉等[6]研究表明,米泔水炮制藜芦可降低藜芦新碱的含量从而降低毒性。射干药材经米泔水炮制后,苷类成分含量降低,苷元类成分含量增加,表明苷类成分发生了生物转化,推测米泔水炮制射干过程中可能有微生物的参与从而使苷类转化为苷元[5]。本课题组前期预实验结果显示,桔梗经米泔水炮制后皂苷、多糖等成分的含量有升有降,而米泔水中仅含有少量淀粉和维生素等成分[9],故推测在浸泡过程中除了物理、化学作用外,可能还有微生物参与,米泔水可提供微生物所需的碳源和微量元素而有利于优势菌的生长繁殖,微生物产生的多种生物酶可促进桔梗中的成分发生生物转化。
本研究中16S rRNA基因测序结果表明,随着炮制时间的增加,浸泡液的菌群多样性下降,菌群丰度先增加后下降。β多样性分析结果显示,MZJ1 与MG 组菌落组成具有较高相似性,MZJ 炮制前期的微生物可能来自于米泔水,随着炮制时间的延长,浸泡液中适宜生长的菌群大量繁殖,菌落组成差异逐渐变大。MZJ3 与MZJ4 组菌落组成具有较高相似性,可能是浸泡液中菌群生长达到稳定期。MZJ 炮制过程中溶液中微生物群落结构呈动态变化,炮制初期,变形菌门占优势菌,随着炮制时间增加,营养物质和氧气不断被消耗,加之厚壁菌门的微生物不断产生有机酸,变形菌门微生物不能适应缺氧、高酸的极端环境,相对丰度逐渐下降。而厚壁菌门大多数为厌氧微生物,且能适应缺氧、高酸等极端环境,相对丰度逐渐增加,成为优势菌门[15]。进一步从属水平分析各组细菌群落组成,发现乳球菌属相对丰度随着炮制时间增加而增加,炮制72 h 高达40.15%。乳球菌属归属于乳酸菌[16],主要存在于乳制品、植物产品中,乳球菌属的乳酸乳球菌Lactococcus lactis是乳酸菌中最具代表性的菌株,也是全球公认的安全微生物,主要用于食品发酵、药物生产和饲料添加等[17-18]。魏斯氏菌属是一类广泛存在于发酵食品中的乳酸菌[16],在赋予发酵食品风味即通过代谢及转化合成反应生成酮类、醛类、醇类、酯类、萜类等风味物质的同时,也能提高发酵食品的安全性[19]。本研究中,随着炮制时间增加,MZJ浸泡液中魏斯氏菌属相对丰度逐渐上升,48 h 达到最大值24.71%。明串珠菌属是一类异型发酵乳酸菌[16],和魏斯氏菌属细胞均为短棒状,常成对或成链出现,共存于发酵食品中[19],随着炮制时间增加,MZJ 浸泡液中明串珠菌属相对丰度逐渐增加。葡糖杆菌属广泛应用于医药、化工、食品等多个领域,一般生活在含糖丰富的环境中,参与多种氧化反应,可将不同碳链长度的多羟基化合物氧化成对应的酮糖,可用于生产果聚糖[20-21]。本研究中葡糖杆菌属在MZJ1、MZJ2、MZJ3 组相对丰度均小于1.00%,而MZJ4 组中葡糖杆菌属相对丰度达到17.24%,推测MZJ4 中糖类物质含量较前3 组有明显增加,推测葡糖杆菌属的氧化特性对桔梗中多羟基化合物化学结构也会产生一定影响。
LEfSe 分析结果显示,γ-变形菌纲、肠杆菌科、肠杆菌目、变形菌门、欧文氏菌属是MZJ1 组的特征微生物。欧文氏菌属、肠杆菌属、泛菌属都属于肠杆菌科,归属于变形菌门、γ-变形菌纲、肠杆菌目,欧文氏菌属常寄生于植物并引起腐败病[22-23],MZJ1 组中欧文氏菌属相对丰度为50.44%,随着炮制时间增加,相对丰度大幅降低,MZJ4组中欧文氏菌属相对丰度仅为2.72%。肠杆菌属中细菌大部分属于致病菌,常出现于土壤、污水、腐烂蔬菜等中,对人类健康有危害[24]。本研究中,肠杆菌属为米泔水中主要优势菌属,相对丰度高达45.34%,但在MZJ 浸泡液中相对丰度较低,且随着炮制时间增加而降低,推测这可能和桔梗的抑菌作用相关[25]。泛菌属细菌具有致腐性,易引起油桃、青枣、多肉等水果及植物腐烂、变质[26-28]。本研究结果显示,泛菌属丰度随着炮制时间的增加而逐渐降低,在MZJ1组中为11.82%,在MZJ2组中仅为1.29%,在MZJ3、MZJ4组中不足1.00%。
综上分析,MZJ 炮制初期欧文氏菌属、肠杆菌属、泛菌属等有害菌属为优势菌属,随着炮制时间增加,乳球菌属、魏斯氏菌属、明串珠菌属等乳酸菌类群成为优势菌属,这可能是由于炮制初期溶液中丰富的营养成分、少量的氧气及适宜的pH为欧文氏菌属、肠杆菌属、泛菌属等有害微生物提供适宜环境,促使其在炮制初期大量繁殖,随着炮制时间增加,乳球菌属、魏斯氏菌属、明串珠菌属等乳酸菌大量分泌乳酸,环境pH下降,部分不耐酸的细菌死亡,同时乳酸菌的代谢产物细菌素、过氧化氢、双乙酰等也能有效抑制细菌生长[29],从而使欧文氏菌属、肠杆菌属、泛菌属等肠杆菌科微生物相对丰度大幅降低,而乳酸菌类群由于适应于低酸、少氧环境,因此随着炮制时间增加相对丰度增大,此外乳酸菌在生长代谢过程中可分泌大量胞外多糖,排出体外,炮制液中多糖含量增加,促进了葡糖杆菌属的生长,因此在炮制后期,葡糖杆菌属相对丰度激增。本研究明确了米泔水炮制桔梗过程中微生物的变化规律,后续将通过实验进一步考察MZJ 炮制过程中不同微生物间及微生物与桔梗中的成分之间相互作用机制,为揭示MZJ 炮制原理提供参考,为基于微生物发酵角度阐释米泔水炮制其他中药的科学内涵提供了新的思路。
