某教学医院耐碳青霉烯类高毒力肺炎克雷伯菌临床及分子特征
2022-12-26李江艳应冲涛黄永强郝斐然
乔 艳,孙 红,李江艳,应冲涛,黄永强,郝斐然,余 莲,郭 普
(1. 蚌埠医学院第一附属医院感染性疾病科,安徽 蚌埠 233004; 2. 蚌埠医学院第一附属医院检验科,安徽 蚌埠 233004; 3. 蚌埠医学院第一附属医院输血科,安徽 蚌埠 233004; 4. 齐齐哈尔医学院临床医学系,黑龙江 齐齐哈尔 161006)
随着细菌适应性进化,兼具高耐药性和高毒力的耐碳青霉烯类高毒力肺炎克雷伯菌(carbapenem-resistant hypervirulentKlebsiellapneumoniae,CR-hvKP)已逐渐在临床流行[1]。2015年Zhang等首次报道了CR-hvKP的存在[2],随后相继在中国上海等地出现了CR-hvKP流行,给临床带来严重的威胁[3]。除中国外,欧美等国也出现了CR-hvKP临床感染的报道[4]。CR-hvKP菌株携带大量毒力因子和耐药基因,其引起的感染治疗相当困难,患者病死率高[3]。近年来,不同ST类型的CR-hvKP不断出现,流行范围逐渐扩大,而且耐药及毒力不断发生新的突变,各地流行病学特征也有较大差异。研究[5]显示,肺炎克雷伯菌ST分型已超过2 000种型别,在中国,ST11为CR-hvKP主要流行型别,也有其他ST型别的报道,包括ST25、ST15和ST375等。目前,CR-hvKP相关研究报道较少,其致病、耐药机制及流行特点尚不十分明确。笔者调查分析安徽某教学医院临床分离CR-hvKP的耐药、毒力及流行病学特征,对于了解CR-hvKP的临床特征,制定感染控制措施,阻止其传播流行具有重要意义。
1 材料与方法
1.1 菌株鉴定 收集2018年1月—2020年12月蚌埠医学院附属第一医院临床分离的CRKP非重复分离株,基质辅助激光解析电离飞行时间质谱(法国生物梅里埃公司)鉴定细菌。根据菌株拉丝试验结果和rmpA、iutA和iucA基因结果将CRKP分为CR-hvKP和 碳青霉烯耐药非高毒力肺炎克雷伯菌(carbapenem-resistant non-hypervirulentKlebsiellapneumoniae, CR-non-hvKP)。其中拉丝试验和rmpA、iutA和iucA基因同时阳性为CR-hvKP。收集CR-hvKP和 CR-non-hvKP患者基本信息(如患者年龄、性别等)、基础疾病、侵袭性操作以及临床转归情况等。质控菌株为大肠埃希菌 ATCC 25922、肺炎克雷伯菌ATCC BAA1705。
1.2 药敏试验 采用全自动细菌药敏分析仪VITEK 2(法国生物梅里埃公司)检测抗菌药物敏感性。根据美国临床和实验室标准化协会(CLSI)2020版标准判读结果。替加环素和多粘菌素B结果分别采用美国食品药品监督管理局(FDA)标准和欧洲AST(EUCAST) 标准委员会制定的标准。
1.3 拉丝试验 用接种环轻轻挑取经过18~24 h 37℃培养的5%羊血琼脂平板上的纯菌落,形成黏连且长度均>5 mm的黏液丝,重复3次出现相同情况则认为拉丝试验阳性。
1.4 DNA提取 挑取经过18~24 h 37℃培养的血琼脂平板上的纯菌落加入3 mL LB肉汤培养基中,经37℃、220 r/min摇床12 h培养后,取菌液1 mL,12 000 r/min离心2 min后,弃上清,留沉淀,用DNA提取试剂盒(天根生化科技有限公司)提取菌株DNA,超微量分光光度计检测回收产物的纯度和浓度,合格样品OD260/OD280为1.7~1.9。
1.5 毒力和耐药基因检测 按1∶1配比从2018年1月—2020年12月该院分离的CR-non-hvKP中选取与CR-hvKP同病室或相近时间内分离菌株作为对照组,采用illumina Hiseq 2500测序平台(上海生工生物有限公司)对CR-hvKP和对照组CR-non-hvKP菌株进行全基因组测序。在Linnux系统下运行SPAdes-2.0软件拼接原始数据。
1.6 统计学方法 应用SPSS 25.0进行统计学分析,计数资料以率或构成比(%)表示,采用χ2检验或Fisher确切概率法进行统计学分析。双侧检验,检验水准α=0.05,以P≤0.05为差异有统计学意义。
2 结果
2.1 CR-hvKP菌株的分布情况 2018年1月—2020年12月该院临床共分离512株CRKP,其中CR-hvKP 30株,CR-non-hvKP 482株。30株CR-hvKP主要来源于重症监护病房(ICU,14株,46.67%)、神经外科(6株,20.00%)和急诊内科(4株,13.33%)等;标本来源为痰(14株,46.67%)、血(12株,40.00%)、尿(2株,6.67%)和脓液(2株,6.67%)。

2.3 耐药基因检测结果 30株CR-hvKP经全基因组测序共发现43种耐药基因。携带β-内酰胺类耐药基因主要有blaKPC-2(93.33%)、blaTEM-1(80.00%)、blaCTX-M-65(73.33%)、blaSHV-12(80.00%)。氨基糖苷类耐药基因主要有aadA2(80.00%)、rmtB(80.00%)、
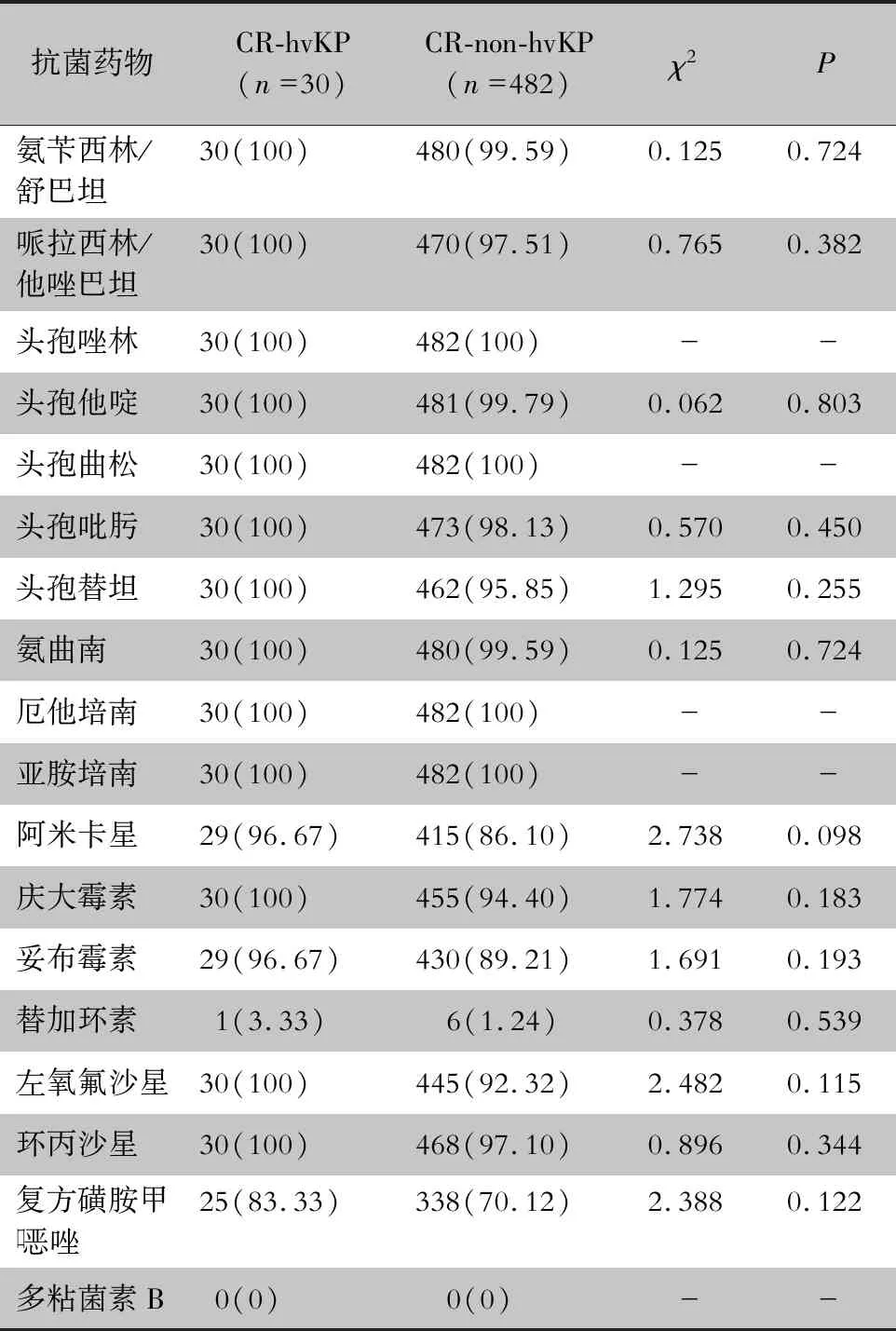
表1 CR-hvKP与CR-non-hvKP对常用抗菌药物的耐药情况比较[株(%)]
aac(3)-IId(30.00 %)、mph(A)(30.00%),喹诺酮类耐药基因qnrSl(46.67%)、qnrB4(6.67%),oqxA(6.67%)、oqxB(3.33%),磷霉素耐药基因fosA6(100%)和fosA3(20.00%),磺胺类耐药基因主要携带sul2(43.33%)和sul1(43.33%),四环素耐药基因tet(A)(36.67%)。30株CR-hvKP耐药基因SHV-11、mph(A)和armA的检出率低于CR-non-hvKP菌株,差异均有统计学意义(均P<0.05)。见表2。
2.4 毒力基因检测结果 30株CR-hvKP携带的毒力基因iucA、iutA、fimF、fimH、mrkD检出率高于CR-non-hvKP菌株,差异均有统计学意义(均P<0.05)。见表3。

表2 CR-hvKP与CR-non-hvKP耐药基因检测结果比较Table 2 Comparison of detection results between CR-hvKP and CR-non-hvKP resistance genes
2.5 荚膜血清型及ST分型 30株CR-hvKP菌株中ST11型28株,ST23型2株。通过荚膜和ST组合分成几个克隆基因型:ST11-K64(23株,76.67%)、ST11-K47(5株,16.67%)和ST23-K1(2株,6.67%);30株CR-non-hvKP菌株中ST11型27株,ST15型3株,荚膜和ST组合分成几个克隆基因型:ST11-K64(12株,40.00%)、ST11-K47(14株,46.67%)和ST15-K107(3株,10.00%)和ST11-K57(1株,3.33%)。CR-hvKP菌株中ST11-K64检出率(76.67%)高于CR-non-hvKP菌株

表3 CR-hvKP与CR-non-hvKP毒力基因检测结果比较Table 3 Comparison of virulence gene detection results between CR-hvKP and CR-non-hvKP
(40.00%);而CR-non-hvKP菌株中ST11-K47检出率(46.67%)高于CR-hvKP菌株(16.67%);差异均有统计学差异(均P<0.05)。见表4。

表4 CR-hvKP与CR-non-hvKP荚膜血清型及ST分型检测结果比较
2.6 CR-hvKP的临床特征 CR-hvKP感染患者多为老年患者(66.67%),存在呼吸系统疾病(96.67%)、消化系统疾病(40.00%)、感染性休克(33.33%)、侵入性治疗(23例,76.67%)以及高病死率(20例,66.67%)。见表5。CR-hvKP组病死率(20例,66.67%)高于CR-non-hvKP组(125例,25.93%),差异有统计学意义(P<0.01)。CR-hvKP死亡组与存活组患者临床特征比较,死亡组患者>60岁、感染性休克、气管插管及动静脉置管比率较存活组高,差异有统计学意义(均P<0.05)。见表6。
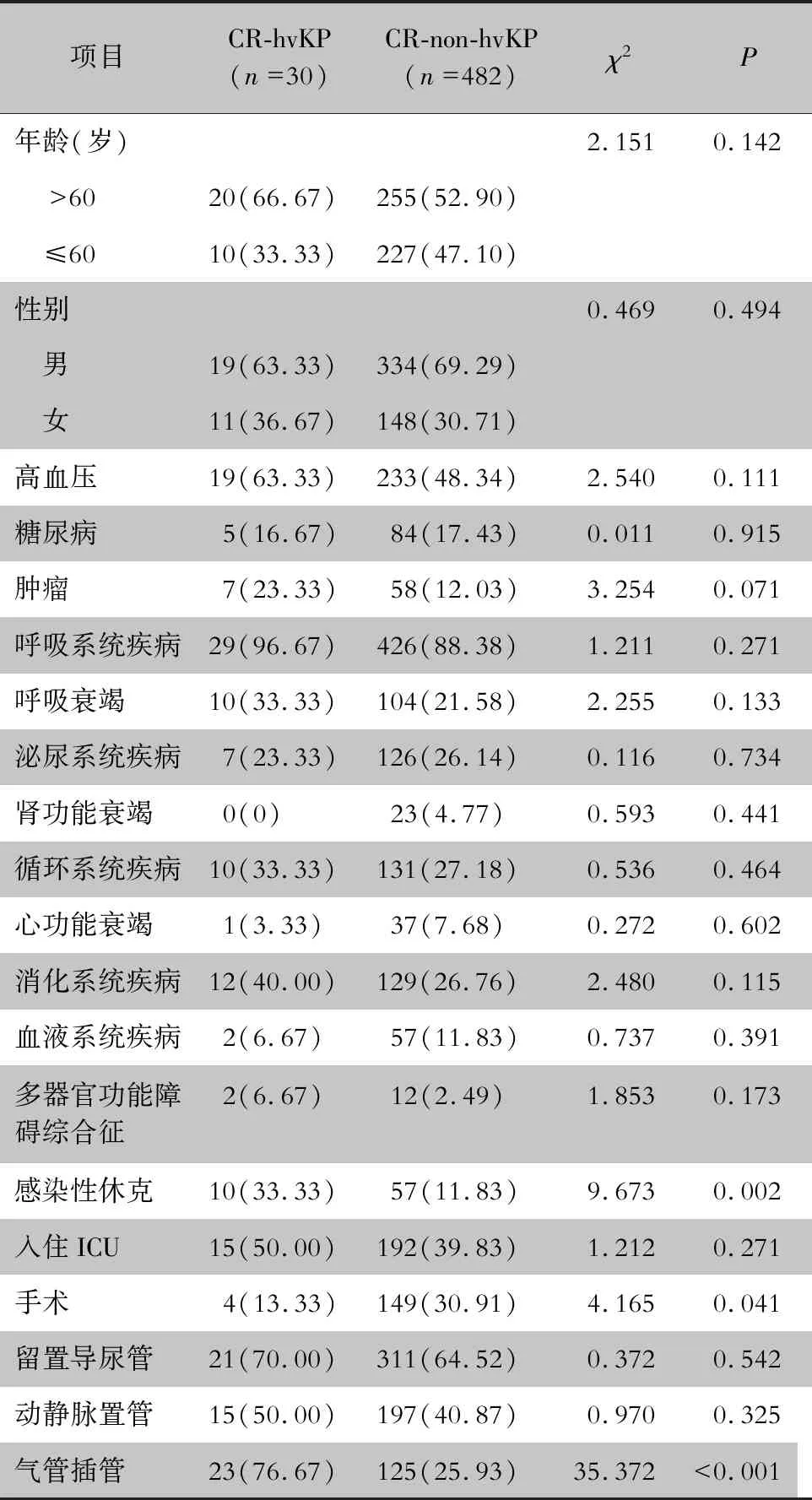
表5 CR-hvKP组与CR-non-hvKP组患者的临床特征分析[例(%)]
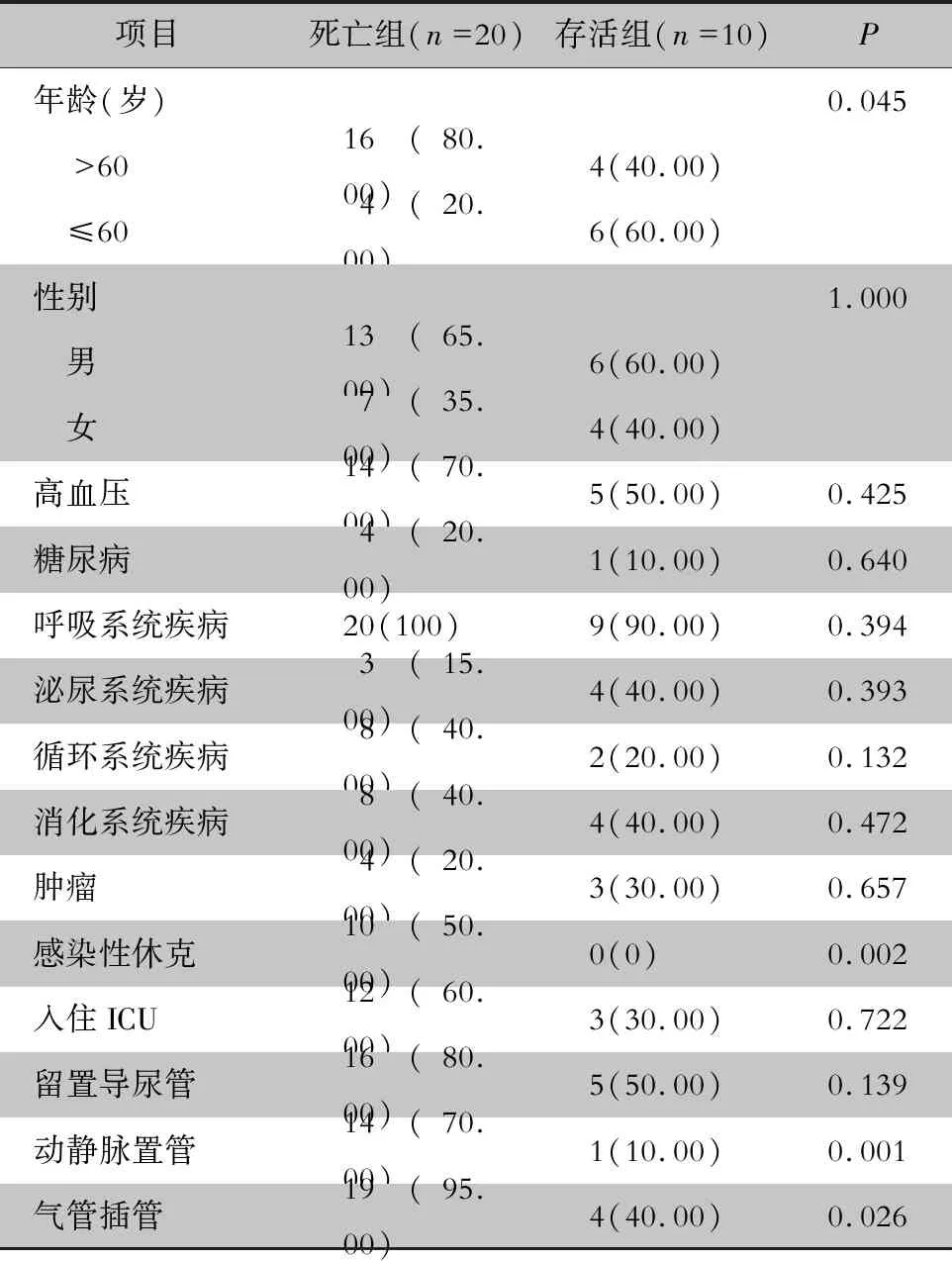
表6 CR-hvKP死亡组与存活组患者临床特征分析[例(%)]Table 6 Clinical characteristics of patients in death group and survival group of CR-hvKP (No. of cases[%])
3 讨论
近年来,CR-hvKP菌株的相关临床报道逐渐增多,由于CR-hvKP兼具多重耐药和高毒力特性,给公众健康带来严重威胁,成为真正的“超级细菌”。本研究中2018—2020年共收集30株CR-hvKP,检出率为5.86%。雷静等[6]对西安交通大学第二附属医院ICU的研究报道CR-hvKP检出率为13.2%。Zhang等[5]对中国56个中心的CR-hvKP检测情况进行分析,CR-hvKP感染患病率呈增长趋势,从2015年2.0%的检出率增长为2017年的8.1%,不同地区之间差异较大(0~25.8%),其中河南(25.4%)和山东(25.8%)较高。30株CR-hvKP来源于30例临床患者的不同感染部位,患者主要来自于ICU、急诊内科以及神经外科,均为成年人,年龄>60岁的患者占66.67%,说明老年患者是CR-hvKP感染的易感人群,与相关报道一致[7]。多数患者伴有呼吸及消化系统等基础疾病,23例患者有气管插管等侵入性操作史。30株CR-hvKP分离自患者的痰、血、尿和脓液标本,其中以痰标本为主,占46.67%,与老年患者呼吸道功能下降及呼吸机的使用有关,CR-hvKP也是引起血流感染的重要病原菌。与文献[7-8]报道CRKP感染的危险因素主要为患者有基础疾病、侵入性操作及抗菌药物暴露史等相近。尽管30例CR-hvKP感染患者均接受了抗感染治疗,依然有20例患者死亡,病死率高达66.67%,高于CR-non-hvKP菌株引起感染的患者,与相关研究[9-10]报道结果一致。提示临床需要对CR-hvKP菌株进行监测,以防止感染的发生与流行,给患者生命健康带来威胁。通过对CR-hvKP感染死亡组和存活组患者临床特征分析显示:年龄>60岁、感染性休克、动静脉置管和气管插管等侵入性操作史可能会增加感染患者的病死率。这部分患者常合并基础疾病,病情复杂,往往需要使用各种置管,侵入性操作也增加了感染CR-hvKP的机会,而CR-hvKP高毒力和高耐药特点,增加了死亡的风险。

肺炎克雷伯菌的重要毒力因子主要包括荚膜多糖、脂多糖和铁载体等[14]。rmpA可以促进荚膜多糖的合成,属于黏液表型调节基因,而铁载体在CR-hvKP的生长和感染中起着关键作用,其中气杆菌素为铁载体活性主要成分,占90%,气杆菌素由iucABCD操纵子编码,其同源受体由iutA基因编码[15]。目前大多研究都基于高黏液表型和携带rmpA和iucA基因作为hvKP的诊断标准[16]。通过测序发现本研究CR-hvKP菌株中荚膜相关基因(rmpA),菌毛相关基因(fimH、mrkD)以及铁载体相关基因(iucA)等主要毒力基因携带率为100%,高于CR-non-hvKP菌株,CR-hvKP菌株同时还携带其他的毒力基因,与相关报道相似[13]。荚膜为由糖和多肽组成的一层黏液物质,位于细菌细胞壁外,可以使细菌具有黏附性及远处定植,同时可抵抗血清杀菌及抗中性粒细胞吞噬。根据荚膜多糖的不同,可将高毒力肺炎克雷伯菌分为82个荚膜血清型,其中常见的K1及K2型毒力最强,容易引起感染迁移[17]。CR-hvKP报道的荚膜血清型与hvKP不同,常见的除Kl、K2外,还有K47、K64及少见血清型如K20、K54、K62等[18]。本试验中检测出的CR-hvKP以K64和K47荚膜血清分型为主,与国内相关研究[3, 5]结果报道相近。多位点序列分型(multilocus sequence typing, MLST)是一种基于核酸序列分析,常用于研究细菌的进化和流行病学监测的分型方法。ST11型是我国CRKP最主要克隆群,ST23是经典肺炎克雷伯菌(classical Klebsiella pneumonia, CKP)主要的克隆群[19]。通过荚膜血清型和ST分型组合,该院30株CR-hvKP主要为ST11-K64,其次为ST11-K47,仅有2株是ST23-K1型。目前,报道显示ST11-K64型是CR-hvKP较为常见的荚膜型,在国内外医疗机构均有检出[20-21]。研究[22]显示,ST11-K64型能够更快速杀灭大蜡螟幼虫,可以较强的抵抗人中性粒细胞的杀灭作用,易形成生物被膜,比ST11-K47型毒力强,更适合在医院环境中生存。本研究中ST11-K64在高毒力菌株中的分布高于非高毒力菌株,ST11-K47型非高毒力菌株检测率高于高毒力菌株,与相关研究[22]一致。CR-hvKP的进化路线主要有两种可能,一种是hvKP菌株从CRKP菌种中获得耐药质粒而表现出相关的耐药性;另一种是CRKP菌种从hvKP菌株获得毒力相关质粒从而表现出高毒力和高耐药性[5, 23]。本组CR-hvKP主要为ST11-K64型,因此推测该院分离的CR-hvKP是主要由CRKP获得毒力质粒进化而来。
利益冲突:所有作者均声明不存在利益冲突。
