阿克苏地区幽门螺杆菌CagA、VacA基因分型与胃溃疡及胃癌的关系*
2022-12-26郭新文马文颖古丽米热艾海提朱国林陈长凯
郭新文,马文颖,王 隽,古丽米热·艾海提,朱国林,陈长凯
新疆维吾尔自治区阿克苏地区第一人民医院消化内科,新疆阿克苏 842008
幽门螺杆菌是胃溃疡疾病的病原体,可导致胃癌的发展[1]。遗传多样性可能在幽门螺杆菌的基因型变异中发挥重要作用,使其毒性更强,致病性多样[2]。幽门螺杆菌携带不同的毒力因子,如脲酶、鞭毛、空泡细胞毒素A(VacA)和细胞毒素相关基因A(CagA),它们在侵袭、定植和细胞增殖中起重要作用[3]。CagA和VacA基因的高遗传变异与幽门螺杆菌感染严重程度有关[4]。VacA基因编码的VacA毒素可诱导胞质空泡,增加通透性,从而导致胃上皮细胞损伤[5]。VacA基因在信号(s)和中间(m)区域表现出显著的等位基因变异。s区由两种主要亚型(s1和s2)组成,s1区还有另外3种亚型(s1a、s1b和s1c),而m区有m1和m2亚型。s和m区域影响VacA基因的空泡形成活性。VacA区域的不同基因型组合导致不同的致病性水平,比如s1am1和s1bm1产生大量毒素,被认为与s1m2相比毒性要强,产生中度空泡毒素[6]。而s2m1和s2m2由于不能形成液泡,因此被认为毒性较小。s1am1和s1bm1亚型常见于急性胃炎、消化性溃疡和胃癌患者中,而s2m1和s2m2亚型见于胃溃疡患者中[7]。CagA是一种细胞毒素相关蛋白,与胃溃疡和胃癌有关。根据CagA基因重复区的多态性,幽门螺杆菌可分为西方亚型和东亚亚型。CagA基因区域由57 bp区域(第一重复区域;FR区域)和102 bp区域(Western型第二重复区域;WSR区域)两种类型的重复区域组成[8]。东亚菌株的FR区与西方菌株有相似的57 bp区,但162 bp的重复区完全不同。东亚类型的CagA(CagA AA)在东亚国家更为普遍,并且与西方亚型(CagA GG)相比毒理更强[9]。VacA是一种与幽门螺杆菌定植和相关疾病发生、发展密切相关的特定毒力因子。目前多个研究表明VacA可诱导胃上皮细胞产生自噬。自噬是真核细胞中高度保守的自我更新过程,其特征是将细胞质物质吞噬到双膜囊泡(自噬体)中,随后在溶酶体中降解[10]。通常自噬机制可清除功能异常的蛋白质和细胞器,但过度自噬会导致细胞死亡[11-12]。目前研究表明VacA在诱导细胞自噬的过程中必不可少,但其与胃癌发生、发展的关系以及诱导细胞自噬的具体分子机制并不明确。本研究拟探讨阿克苏地区幽门螺杆菌CagA、VacA基因分型与胃溃疡及胃癌的关系,为阿克苏地区胃溃疡及胃癌的防治提供依据。
1 资料与方法
1.1一般资料 选择2020年6月至2021年8月在本院接受胃镜检查的276例患者作为研究对象。在胃肠内窥镜检查期间,从上述人群胃窦和胃体部分获得胃组织。纳入研究者中胃溃疡90例(胃溃疡组)、胃癌86例(胃癌组)、胃组织正常100例(正常对照组)。胃溃疡或胃癌患者纳入标准:(1)符合胃溃疡或胃癌的诊断标准;(2)病理诊断确认为胃溃疡或胃癌;(3)幽门螺杆菌阳性。排除标准:(1)临床信息不完整;(2)随访失败或死亡原因不明;(3)有其他消化道肿瘤或疾病;(4)孕妇、严重心血管病患者。
本研究为了研究幽门螺杆菌的CagA、VacA基因分型与胃溃疡及胃癌的关系,还采集了所有研究对象的唾液标本。本研究经本院医学伦理委员会批准,所有患者及家属均签署知情同意书。
1.2方法
1.2.1标本的采集及相关资料的收集 所有标本在-20 ℃下处理和冷冻直至测试。所有标本均在内窥镜下收集。收集纳入研究者年龄、性别、既往病史、饮食习惯和生活方式等一般资料。
1.2.2各组胃组织幽门螺杆菌CagA、VacA基因组DNA提取和基因分型测定 外送金域医学检验中心检测。采用SDS-PK法从收集的胃组织中提取DNA。将胃组织手动压碎并重新悬浮在20 μL的10%SDS、80 μL蛋白酶K缓冲液(0.5 mol/L EDTA和4 mol/L NaCl,pH 7.5)、40 μL蛋白酶K(10 mg/mL)中并用无菌水增加至380 μL,将混合物在55 ℃下孵育过夜,加入100 μL的6 mol/L NaCl,然后以14 000 r/min离心5 min,将上清液分离到新管中。为了沉淀DNA,加入500 μL无水异丙醇,充分混合并在9 000 r/min下离心5 min。DNA沉淀用70%乙醇洗涤并风干。将颗粒重新悬浮在50 μL的TE缓冲液(10 mmol/L Tris和1 mmol/L EDTA,pH 8.0)中。样品储存在-20 ℃直至使用。使用特异性引物进行PCR以检测幽门螺杆菌。目标引物CagA:正向5′-TCGAGGGCGCGTAGCTAGCTAGCTGATCGATCGACGT CGTAGCC-3′,反向5′-TGGGTCGAGCTAGCTAGC GATCGTAGCTAGCTAGCTAGTCGCTC-3′;VacA:正向5′-TGGGTCGTAGCTAGCTAGCTAGCTGATCGA TCGATCGTCGTCA-3′,反向5′-TGGGCTGATCGAT CGGCGGCGTAGCTAGCTGATCGATGCTAC-3′。对于PCR扩增,将1~2 μg DNA样品添加到含有20 pmol正向和反向引物、1.5 mmol/L MgCl2、1.5 U PCR混合物中的Taq聚合酶(日本Takara公司)、2.5 μL PCR缓冲液和200 μmol/L dNTP的反应体系中,总体积为25 μL。在以下条件下进行PCR扩增:95 ℃初始变性3 min,然后95 ℃ 30 s变性30个循环,退火30 s,72 ℃聚合30 s,最后在72 ℃下聚合5 min(Bio Rad Thermocycler)。PCR反应产物在1.5%琼脂糖凝胶上用2 000 bp DNA梯(日本Takara)进行电泳,条带通过溴化乙锭染色显现,然后用Quantity One软件(Bio-Rad,USA)分析。使用靶向16S rRNA和ureA基因的特异性引物检测幽门螺杆菌菌株。CagA和VacA基因分型是通过PCR使用它们各自的引物从幽门螺杆菌阳性样品中确定。
1.2.3VacA对SIRT1、FOXO1、P62 mRNA的表达的影响 幽门螺杆菌在37 ℃、微需氧环境且含有10%胎牛血清的脑心浸液培养基中160 r/min振荡培养。用40%饱和硫酸铵从培养上清液中沉淀蛋白,沉淀的蛋白放到透析袋中透析,并采用抗VacA特异性的IgG抗体柱纯化。通过在pH 2.0的酸化F-12/ME培养基中于37 ℃孵育30 min来激活VacA。
从胃癌组织提取原代细胞,置于含VacA的RPMI1640培养基中,在37 ℃、5%CO2的条件下培养,培养至第3代,设为VacA组,用未添加VacA培养基培养的胃癌组织原代细胞设为对照组。细胞经过处理后小心移去6孔板中的培养液,每孔加入1 mL的Trizol裂解液,按照总RNA提取试剂盒(DP419,TIANGEN)进行RNA的提取。目标引物SIRT1:正向5′-GACTTCAGGTCAAGGGAT-3′,反向5′-CCC GCAACCTGTTCCAGCGTGTCTA-3′;FOXO1:正向5′-GTCAGGCTGAGGGTTAGT-3′,反向5′-ACTAAAAGGGAGTTGGTGAAAGACA-3′;P62:正向5′-CTGGGCATTGAAGTTGATAT-3′,反向5′-ATT CTGGCATCTGTAGGGACTGGAG-3′。对于PCR扩增,将1~2 μg DNA样品添加到含有20 pmol正向和反向引物、1.5 mmol/L MgCl2、1.5 UPCR混合物中的Taq聚合酶(日本Takara公司)、2.5 μL PCR缓冲液和200 μmol/L dNTP的反应体系中,总体积为25 μL。在以下条件下进行PCR扩增:95 ℃初始变性3 min,然后95 ℃ 30 s变性30个循环,退火30 s,72 ℃聚合30 s,最后在72 ℃下聚合5 min(Bio Rad Thermocycler)。分析VacA组和对照组胃癌组织原代细胞中SIRT1、FOXO1、P62 mRNA的表达差异。

2 结 果
2.1各组CagA基因型比较 胃癌组CagA AA基因型频率高于胃溃疡组、正常对照组,CagA GG基因型频率低于胃溃疡组、正常对照组,差异均有统计学意义(P<0.05);胃溃疡组CagA AA基因型频率高于正常对照组,CagA GG基因型频率低于正常对照组,其基因型频率分布比较差异均有统计学意义(P<0.001)。见表1。CagA AA基因型携带者胃溃疡(OR=10.40,95%CI:5.89~14.70,P<0.05)、胃癌(OR=10.60,95%CI:4.69~21.26,P<0.05)的发病风险增加。
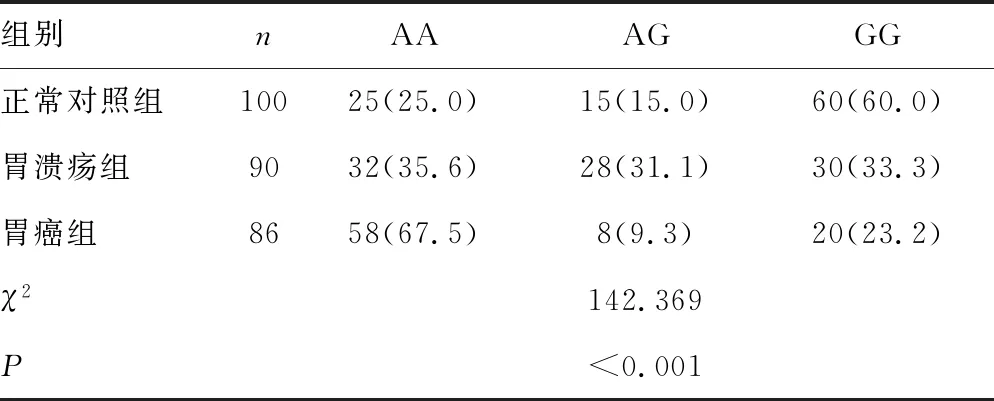
表1 各组CagA基因型比较[n(%)]
2.2各组VacA基因型比较 胃癌组VacA s1m1基因型频率高于胃溃疡组、正常对照组,VacA s2m2基因型频率低于胃溃疡组、正常对照组,差异均有统计学意义(P<0.05);胃溃疡组VacA s1m1基因型频率高于正常对照组,VacA s2m2基因型频率低于正常对照组,差异均有统计学意义(P<0.05)。见表2。VacA s1m1基因型携带者胃溃疡(OR=11.27,95%CI:5.25~13.22,P<0.05)、胃癌(OR=9.26,95%CI:4.19~15.66,P<0.05)的发病风险增加。

表2 各组VacA基因型比较[n(%)]
2.3CagA、VacA基因分型与胃癌发生风险的Logistic回归分析 多因素Logistic回归分析显示:CagA AA基因型、VacA s1m1基因型是胃癌发生的危险因素(P<0.05),见表3。
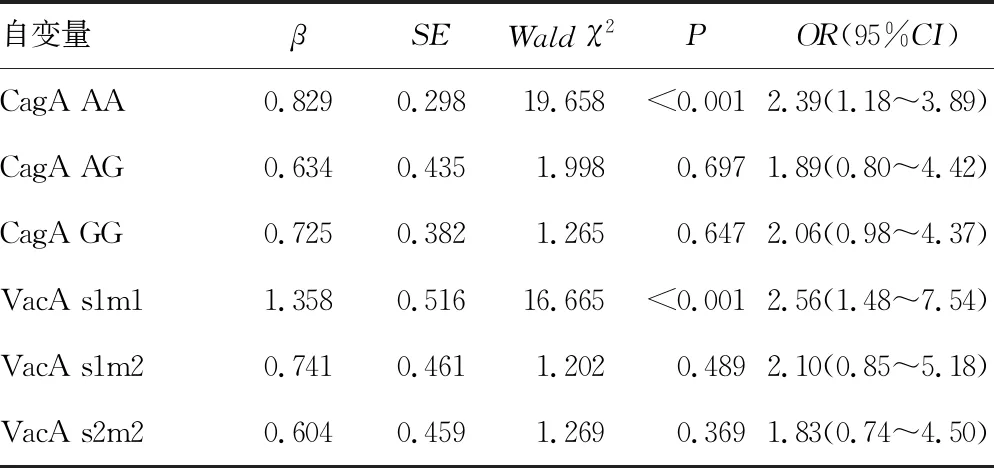
表3 CagA、VacA基因分型与胃癌发生风险的Logistic回归分析
2.4CagA、VacA基因分型与胃癌临床病理特征的关系 从表4可见,CagA、VacA基因分型在不同性别、年龄的胃癌患者中差异无统计学意义(P>0.05),但肿瘤最大径≥2 cm、TNM分期Ⅲ~Ⅳ期、病理级别高级别患者的CagA AA基因型、VacA s1m1基因型比例分别高于肿瘤最大径<2 cm、TNM分期Ⅰ~Ⅱ期、病理级别低级别的患者(P<0.05)。
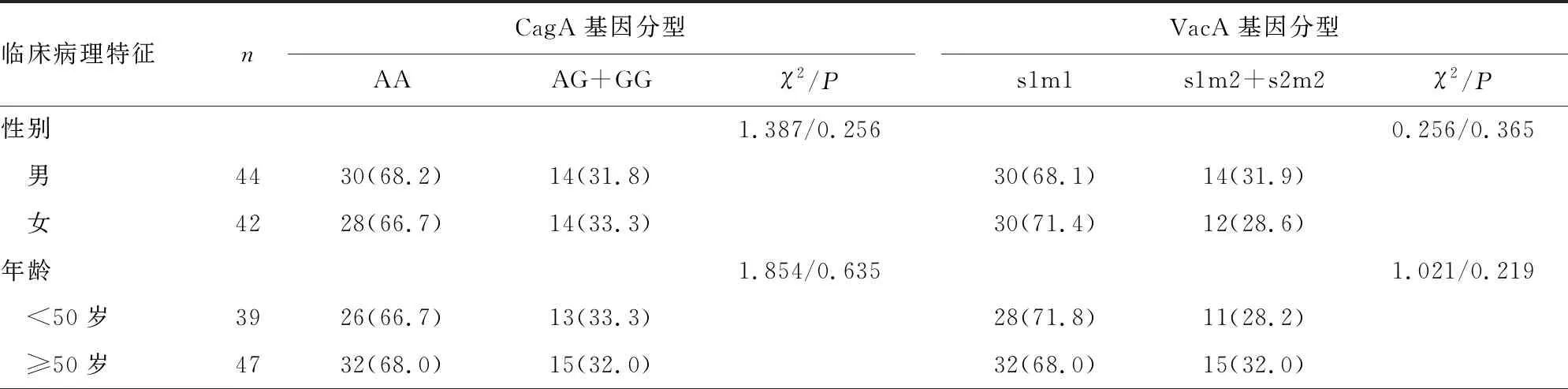
表4 CagA、VacA基因分型与胃癌临床病理特征的关系[n(%)]
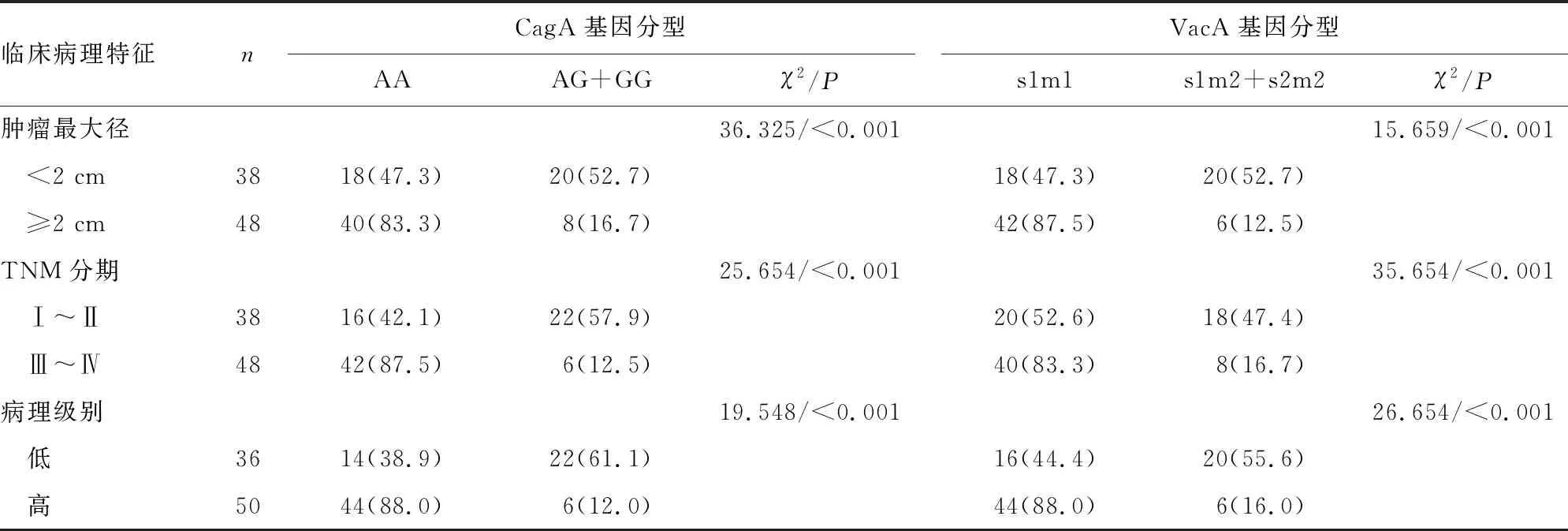
续表4 CagA、VacA基因分型与胃癌临床病理特征的关系[n(%)]
2.5VacA对SIRT1、FOXO1、P62 mRNA的表达的影响 试验结果显示,VacA组SIRT1、FOXO1 mRNA的相对表达水平较对照组显著升高(P<0.05),但P62 mRNA的相对表达水平较对照组显著降低(P<0.05),见表5。

表5 VacA对SIRT1、FOXO1、P62 mRNA表达的影响
3 讨 论
幽门螺杆菌感染具有流行病学多样性,在不同的地理位置表现出不同的流行程度。尽管有关幽门螺杆菌VacA和CagA毒力基因型多态性的研究较多,但是目前关于我国阿克苏地区幽门螺杆菌VacA和CagA基因型频率的相关信息很少。在本研究中确定了胃溃疡和胃癌患者胃组织标本中的CagA、VacA基因分型。
幽门螺杆菌CagA诱导病理改变,与胃炎、胃溃疡和胃癌的发展密切相关。幽门螺杆菌CagA AA阳性菌株毒性更强,在胃炎和胃癌中引起更高水平的胃黏膜炎症。在本研究中,胃癌组CagA AA基因型频率高于胃溃疡组、正常对照组,CagA GG基因型频率低于胃溃疡组、正常对照组,差异均有统计学意义(P<0.05);胃溃疡组CagA AA基因型频率高于正常对照组,CagA GG基因型频率低于正常对照组,差异均有统计学意义(P<0.05);CagA AA基因型频率能增加胃溃疡、胃癌易感性(OR=10.40、10.60)。本研究结果显示阿克苏地区患者中CagA GG基因型的患病率较低。幽门螺杆菌CagA AA基因型在上海的流行率高达93.2%[10]。据报道,我国周边国家的CagA AA基因型胃病患病率也很高,如:印度的CagA AA基因型胃病患病率高达96.2%[11],日本52%的幽门螺杆菌菌株携带CagA AA基因型,胃癌CagA AA基因型阳性率为80%,十二指肠溃疡CagA AA基因阳性率为63%[12]。本研究同时也发现,CagA AA基因型是胃癌发生的危险因素(P<0.05)。
VacA基因型的遗传变异与幽门螺杆菌的毒力状态直接相关[13]。在本研究中,主要发现了VacA基因的s1m1、s1m2、s2m2亚型,而未检测出VacA基因的s1b和s1c亚型。本研究结果显示,阿克苏地区幽门螺杆菌的VacA各基因亚型分布频率与其他报告数据的频率相当。流行病研究报道,s1m1、s1m2、s2m2基因型是中国更普遍的VacA基因亚型,而VacA s1a和VacA m1是印度的主要VacA基因亚型[14]。在另一项研究中,在香港VacA阳性的幽门螺杆菌感染患者中未检测到s1b亚型,而在67%的人群中发现了s1m1亚型[15]。同样,本研究也观察到胃癌组VacA s1m1基因型频率高于胃溃疡组、正常对照组,VacA s2m2基因型频率低于胃溃疡组、正常对照组,差异均有统计学意义(P<0.05);胃溃疡组VacA s1m1基因型频率高于正常对照组,VacA s2m2基因型频率低于正常对照组,差异均有统计学意义(P<0.05)。先前的研究报道了巴基斯坦成人消化不良患者中VacA s1m1基因型频率为59.6%,在印度人群中VacA s1m1基因型也是优势基因型[16]。VacA s1m1基因型与高毒素活性显著相关,并与疾病的临床结果相关[17]。在对CagA、VacA基因型的详细分析中,本研究发现,肿瘤最大径≥2 cm、TNM分期Ⅲ~Ⅳ期、病理级别高级别患者的CagA AA基因型、VacA s1m1基因型比例分别高于肿瘤最大径<2 cm、TNM分期Ⅰ~Ⅱ期、病理级别低级别的患者(P<0.05)。此外,在我国东北地区VacA s1m1基因型的胃炎患者存在多种流行病学特征,带有VacA s1m1基因型的幽门螺杆菌株与增加的毒力能力及更高的胃上皮损伤和溃疡有关[18]。本研究结果显示,用添加幽门螺杆菌VacA培养基培养的细胞中,SIRT1、FOXO1 mRNA的相对表达水平显著升高,但P62 mRNA的相对表达水平显著降低,提示VacA可通过诱导SIRT1/FOXO1信号轴导致胃癌细胞自噬从而抑制了细胞增殖。有研究表明SIRT1可以与FOXO1结合并使其脱乙酰基,导致FOXO1活化和核易位,在特定情况下,增强FOXO1转录活性可以促进自噬。FOXO1的脱乙酰化还可以促进FOXO1与自噬相关蛋白7(ATG7)之间的相互作用,同时增强线粒体自噬受体(BNIP3)的表达。
综上所述,CagA AA基因型频率、VacA s1m1基因型频率能增加胃溃疡、胃癌易感性。CagA AA基因型、VacA s1m1基因型是胃癌发生的危险因素。VacA能增加SIRT1和FOXO1 mRNA的表达但抑制P62 mRNA的表达,提示VacA可能通过SIRT1/FOXO1信号轴诱导胃癌细胞自噬,是幽门螺杆菌在胃上皮细胞内存活的自我保护机制。对自噬的深入研究将为预防胃癌的发生、发展提供新的思路,同时希望在将来可以通过精准地调节自噬来更有效地治疗胃癌。
