高效液相色谱-荧光检测器-二级阵列管检测器法测定烤羊肉串中16种多环芳烃
2022-12-26张永胜韩金花田铸张丹张珍师希雄
张永胜,韩金花,田铸,张丹,张珍,师希雄*
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)2(甘肃省干旱生境作物学重点实验室(甘肃农业大学),甘肃 兰州,730070)
我国西北地区的羊肉具有高蛋白、低脂肪、氨基酸和矿物质含量高等特点[1]。羊肉串因独特的色香味和高营养价值受到消费者的喜爱[2]。然而,羊肉串在烤制过程中容易产生多环芳烃(polycyclic aromatic hydrocarbons,PAHs)和杂环胺等有毒有害物质。PAHs是由两个或两个以上芳香环构成的烃类物质,作为重要的环境和食品污染物,其具有强致畸、致癌和致突变作用,能够引起生物体多个器官的癌变[3]。欧盟委员会国际癌症研究机构、欧洲食品安全局、美国有毒物质与疾病登记机构和我国国标将16种PAHs列为优先控制致癌物[4-6]。
目前,食品中检测PAHs的方法有HPLC和GC-MS法。GC-MS检测时,样品需要气化处理,气化时高温会引起目标物分解的可能,而HPLC可在室温下进行,避免了高温引起目标物分解的可能,且有较高的灵敏性、重现性以及准确度[6-8]。目前,白雪[6]建立一种HPLC法同时测定烤羊肉中5种硝基多环芳烃的方法,能够快速准确地测定5种强“三致”硝基多环芳烃的含量;姜三群[2]建立了HPLC-荧光检测器检测碳烤羊肉串中苯并芘的含量;王春蕾等[11]运用HPLC-紫外/荧光检测方法,能够准确检测熏肉制品中15种PAHs;而我国GB 5009.265—2016《食品中多环芳烃的测定》中规定了用液相色谱法测定食品中15种PAHs,并没有涉及对苊烯的检测[5]。
综上,关于烤羊肉串中16种PAHs的检测方法国内外研究报道较少,该试验用HPLC-荧光检测器串联二级阵列管检测器,通过系统优化前处理条件,建立16种PAHs的检测方法,以便为羊肉串中PAHs控制研究奠定理论基础。
1 材料与方法
1.1 材料与试剂

1.2 仪器与设备
Agilent 1260 Infinity Ⅱ HPLC(配有二极管阵列检测器和荧光检测器),Agilent SB C18柱(4.6 mm×250 mm,5 μm)、EV C18(50 mm×2.1 mm,4 μm)、symmetry R C18(4.6 mm×250 mm,5 μm)和AQ C18(4.6 mm×250 mm,5 μm)色谱柱,美国Agilent公司;FSH-2A型可调高速匀浆机,宁波新芝生物科技股份有限公司;RE52CS旋转蒸发仪,上海亚荣生化仪器厂;N-20多功能氮吹仪,长春乐镤科技有限公司;KQ-500E型超声波清洗器(500 W,40 kHz),昆山市超声仪器有限公司;HX202T型电子天平,慈溪市天东衡器厂;TGL-16MC型台式高速冷冻离心机,湖南湘仪集团;FCR1000-UF-E超纯水机,上海和泰仪器有限公司。
1.3 试验方法
1.3.1 标准溶液的配制
PAHs储备液的配制:用乙腈分别将16种PAHs标准品溶解于50 mL棕色容量瓶,配成不同浓度的标准储备溶液。
单标溶液的配制:移取适量的PAHs储备液,配制成16种50 ng/mL的等质量浓度单标溶液;
PAHs混标溶液的配制:移取适量PAHs储备液,配制成4 000 ng/mL的等质量浓度PAHs中间液,准确移取16种PAHs储备液各0.1 mL,配制成100 ng/mL的混标溶液,用乙腈稀释成质量浓度分别为1、5、10、20、50 ng/mL的混标溶液。所有标准溶液置于-18 ℃环境中储藏。
1.3.2 样品前处理条件优化
1.3.2.1 超声波辅助萃取时间的选择
称取市售碳烤羊肉串3 g(精确到0.001 g),匀浆样品置于50 mL离心管中,再加入1 mL 30 μg/mL PAHs混标溶液,提取溶剂为20 mL 乙腈和 10 mL乙腈饱和正己烷,设置固相萃取柱为Florisil,洗脱剂为二氯甲烷,洗脱剂体积为11 mL,考察超声波辅助时间(10、20、30、40、50 min)对PAHs回收率的影响,筛选出最佳时间。
1.3.2.2 固相萃取柱的选择
样品预处理同上,设置超声萃取时间为30 min,洗脱剂为二氯甲烷,洗脱剂体积为11 mL,考察固相萃取柱(Florisil、PAH-MIP、C18、PCX)对PAHs回收率的影响,筛选出最佳固相萃取柱。
1.3.2.3 洗脱剂种类的选择
样品预处理同上,设置超声波萃取时间为30 min,固相萃取柱为PAH-MIP,洗脱剂为11 mL,考察洗脱剂[正己烷-二氯甲烷(30∶70,体积比,下同)、环己烷、二氯甲烷、正己烷-二氯甲烷(50∶50)、乙酸乙酯]对PAHs回收率的影响,筛选出最佳洗脱剂。
1.3.2.4 洗脱剂体积的选择
样品预处理同上,设置超声波萃取时间为30 min,固相萃取柱为PAH-MIP,洗脱剂为正己烷-二氯甲烷(30∶70),考察洗脱剂体积(5、7、9、11、13 mL)对PAHs回收率的影响,筛选出最佳洗脱剂体积。
1.3.3 样品前处理
根据王冲[8]的方法稍作修改。提取:称取羊肉串肉样3 g(精确至0.001 g),置于50 mL棕色离心管a中,加入10 mL乙腈饱和正己烷(乙腈饱和的正己烷溶液的配制:量取400 mL正己烷,加入100 mL乙腈,摇匀后静置,上层为乙腈饱和正己烷)和20 mL乙腈溶液匀浆,在40 ℃水浴下超声波辅助萃取30 min,在4 500 r/min冷冻(4 ℃)离心30 min,用移液枪将乙腈层移取到50 mL棕色离心管b中,将20 mL乙腈加入棕色离心管a中复提一次,吸取乙腈提取液合并到棕色离心管b中,用100 mL梨形烧瓶将棕色离心管b中的提取液在35 ℃下旋转蒸发至近干,加入6 mL正己烷复溶,涡旋振荡溶解。
净化:先用5 mL二氯甲烷活化PAH-MIP,再用10 mL正己烷平衡PAH-MIP,将6 mL正己烷提取样液转移到PAH-MIP中,用6 mL正己烷洗涤离心管b,并将洗涤液注入萃取柱中,用9 mL正己烷-二氯甲烷(30∶70)洗脱萃取柱,在10 mL试管c中收集所有洗脱液,氮吹(30 ℃)至有机溶剂全部挥发,加入1 mL乙腈涡旋振荡,用0.22 μm油系滤膜过滤,制得上机待测液。
1.3.4 仪器分析条件
色谱柱:Agilent SB C18(4.6 mm×250 mm,5 μm);流动相为乙腈和水;进样量5 μL,流速0.8 mL/min,柱温30 ℃,根据出峰种类和峰的分离度优化梯度洗脱程序。检测器:荧光检测器和二级阵列管检测器串联。
1.3.5 方法的线性范围、检出限和定量限测定
在最优的测定方法下,对1.3.1配制的5种混标溶液(1、5、10、20、50 ng/mL)进行测定,横坐标为各混标的质量浓度,纵坐标为PAHs的峰面积,绘制标准曲线;检出限用3倍信噪比(S/N=3)确定,定量限用10倍信噪比(S/N=10)确定。
1.3.6 回收率和精密度测定
称取3 g市售羊肉串肉样,分别添加2、5、20 ng/mL混标溶液,按照1.3.3进行样品前处理,再进行上机分析,每个添加水平重复测定6次,计算肉样中回收率及精密度,即相对标准偏差(relative standard deviation,RSD)。
1.3.7 实际肉样检测方法
3种不同来源的市售烤羊肉串(每种来源的羊肉串各做3个平行肉样),用1.3.3前处理方法进行提取和纯化,用HPLC检测。
1.3.8 数据处理
采用HPLC自带的软件对峰面积进行积分处理。用SPSS 20.0对数据进行显著性分析(P<0.05),用Origin 2017作图,每组试验重复3次。
2 结果与分析
2.1 色谱柱的选择
反相色谱柱是HPLC分析中最常用的柱子,该试验选取了Agilent SB C18柱(4.6 mm×250 mm,5 μm)、EV C18(50 mm×2.1 mm,4 μm)、symmetry R C18(4.6 mm×250 mm,5 μm)和AQ C18(4.6 mm×250 mm,5 μm)色谱柱,对比4种不同规格色谱柱对16种PAHs分离效果和出峰情况,结果显示,EV C18、symmetry R C18和AQ C18色谱柱响应值低、出峰种类少和峰形分离不彻底,Agilent SB C18柱具有良好的分离效果,可供检测16种PAHs。
2.2 梯度洗脱条件和检测波长的选择
水和乙腈的不同比例直接影响PAHs的分离度和出峰时间。该试验中,Ch和BaA、F和Ac、BbF和BkF分离度不高,经过优化,在5~25 min时,水相在27%~25%时,Ch和BaA及其他分离度不高的PAHs能够较好的分离,具体洗脱程序见表1。Ace无荧光性,用二极管阵列检测器在 230 nm 处测定Ace,其他15种PAHs荧光检测波长见表2。在该梯度洗脱程序下,16种PAHs能够较好分离。
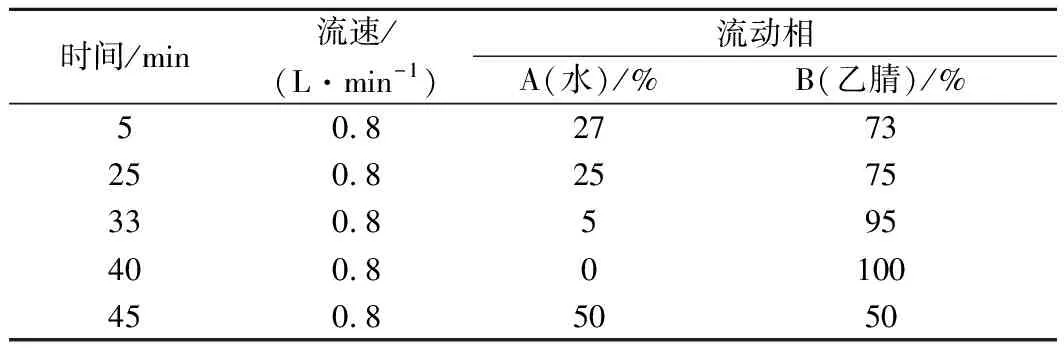
表1 HPLC 流动相洗脱梯度Table 1 HPLC mobile phase elution gradient

表2 HPLC 荧光检测梯度Table 2 HPLC fluorescence detection gradient
2.3 超声波辅助萃取时间的选择
超声波时间对PAHs的提取也有着至关重要的影响,时间过短,导致萃取不完全,从而影响样品检测;时间过长,容易使低分子质量(2~3个苯环)的PAHs组分挥发而损失[12-13]。如图1所示,超声时间为10 min和20 min时,回收率略低于30 min,其原因可能是超声波时间较短,肉中PAHs未完全被提取出来;超声波时间为40 min和50 min时,回收率为56.96%~67.86%和52.26%~63.74%,显著低于30 min时的回收率,其原因可能是超声波时间过长,低分子质量的PAHs挥发损失,造成回收率低;超声波时间在30 min时,PAHs回收率最高,为63.65%~74.49%,因此选30 min作为前处理超声波萃取时间。

图1 不同超声波时间对PAHs回收率的影响Fig.1 Effect of different ultrasonic time on the recovery rate of PAHs注:不同字母表示不同处理间差异显著(P<0.05)(下同)
2.4 固相萃取柱的选择
固相萃取柱可以达到净化和富集的双重功效,固相萃取柱填料种类不同,对PAHs有不同的吸附效果[14]。由图2可知,Florisil萃取柱回收率为62.5%~73.4%,显著低于PAH-MIP;PCX萃取柱和C18萃取柱对出峰前期低分子质量的PAHs有较高的回收率,但对Ch等高分子质量(4~6个苯环)PAHs回收率较低,其原因可能是萃取柱填充物质对高分子质量的PAHs吸附能力不强;PAH-MIP萃取柱回收率显著高于其他固相萃取柱,回收率为77.9%~91.9%,能够对PAHs特异性吸附,因此选择PAH-MIP萃取柱为前处理固相萃取柱。

图2 不同固相萃取柱对PAHs回收率的影响Fig.2 Effects of different solid phase extraction columns on the recovery of PAHs
2.5 洗脱剂种类的选择
PAHs属于非极性或极性较弱的碳氢化合物,洗脱剂的种类对PAHs的回收率有显著的影响[11],目前PAH-MIP萃取柱多用二氯甲烷作为洗脱剂,二氯甲烷单独洗脱时,能够显著阻止脂肪进入待测样品中,但二氯甲烷对PAHs的洗脱效率较低[5,14-15]。如图3所示,乙酸乙酯和环己烷洗脱效果显著低于正己烷-二氯甲烷(30∶70,体积比,下同);二氯甲烷单独洗脱时,回收率为77.94%~91.71%,但PAHs回收率显著低于正己烷-二氯甲烷(30∶70);正己烷-二氯甲烷(50∶50)对低分子质量的PAHs回收率较高,但对大部分高分子质量的PAHs回收率较低,且整体PAHs回收率显著低于正己烷-二氯甲烷(30∶70);洗脱剂为正己烷-二氯甲烷(30∶70)时,PAHs回收率最高,回收率为84.97%~103.82%,能够很好地从PAH-MIP萃取柱中将PAHs洗脱下来,因此选择正己烷-二氯甲烷(30∶70)为PAH-MIP的洗脱剂。

图3 不同洗脱剂种类对PAHs回收率的影响Fig.3 Effects of different eluents on the recovery of PAHs
2.6 洗脱剂体积的选择
固相萃取过程中,洗脱剂的体积往往直接影响目标化合物的洗脱效果,洗脱剂体积少容易造成洗脱不彻底,降低PAHs的回收率,但体积过高也会导致稀释效应,浓缩时也容易贴壁浪费,导致回收率降低[17]。如图4所示,当洗脱剂正己烷-二氯甲烷(30∶70)体积为5 mL和7 mL时,PAHs回收率显著低于9 mL时,其原因可能是洗脱体积少而造成洗脱不彻底,从而使PAHs回收率低;洗脱剂体积为11 mL时,回收率略低于9 mL,其原因可能由于稀释效应不明显;当洗脱剂体积为13 mL时,回收率显著低于9 mL,稀释效应明显。洗脱剂体积为9 mL时,PAHs回收率高于其他各体积,回收率为85.21%~105.74%,因此选9 mL正己烷-二氯甲烷(30∶70)为最优洗脱体积。

图4 不同洗脱剂体积对PAHs回收率的影响Fig.4 Effects of different volumes of N-hexane∶dichloromethane (30∶70) on the recovery of PAHs
2.7 线性范围、检出限和定量限
如表3所示,16种PAHs在1~50 ng/mL线性范围内均呈良好的线性关系,相关系数均大于0.99,方法检出限为0.33~3.30 μg/kg,定量限为1.0~10.0 μg/kg,能够满足16种PAHs的检测分析。
2.8 回收率和精密度
如表4所示,经过3个加标检测分析(2、5、20 ng/mL),目标物回收率在81.23%~101.1%,RSD为0.95%~5.84%,试验方法回收率高且精密度良好,能够满足烤羊肉串中16种PAHs的检测要求。

表3 16种PAHs方法学参数Table 3 Methodological parameters of 16 PAHs

表4 目标物的平均回收率和RSD(n=6)Table 4 Average recovery and relative standard deviation of target compounds (n=6)
2.9 实际样品检测
采用上述优化的方法,对市售3种来源的羊肉串检测PAHs含量,结果如表5所示,16种PAHs只有Ch、BaA、BkF、BaP和IP没有检出,其余PAHs均有检出。3份烤羊肉串样品中的16种PAHs总含量最低为127.59 μg/kg,最高为200.23 μg/kg。

表5 不同来源烤羊肉串中PAHs的含量 单位:μg/kg
3 结论
该试验通过高效液相色谱-荧光检测器-二级阵列管检测器建立了烤羊肉串中16种PAHs含量的检测方法,该方法净化效果好、灵敏度高、定量准确性高,能满足烤羊肉串中PAHs的检测要求,为今后烤羊肉串中PAHs的形成规律以及控制研究提供理论基础。
