L-乳酸对创伤性颅脑损伤后缺氧诱导因子-1α和突触可塑性相关蛋白的影响*
2022-12-25赵博张振李金英
赵博,张振,李金英
(1.大连市中心医院 麻醉科,辽宁 大连 116023;2.烟台毓璜顶医院 麻醉科,山东 烟台 264000)
创伤性颅脑损伤可引起脑缺氧缺血[1-2],脑血流不足和缺氧导致葡萄糖能量代谢异常,使轴突完整性和突触可塑性受损[3-5]。在脑缺血和缺氧期间,缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)的表达上调,可增加脑组织对缺氧的耐受性[6]。乳酸是糖酵解的产物,作为脑的能量底物参与线粒体呼吸。有研究证明L-乳酸参与神经细胞的能量代谢过程,在脑内L-乳酸可以由星形胶质细胞释放,并且在大脑能量需求增加时作为重要的能源供应给邻近的神经元,使神经元可以利用乳酸产生三磷酸腺苷[7-9]。另外,除了来源于星形胶质细胞的乳酸参与大脑的代谢,血浆中的乳酸也可能起着重要的作用[10-11]。颅脑损伤后脑内乳酸浓度显著升高,增加的乳酸既可以作为大脑能量来源,也可以作为信号分子,改善创伤性颅脑损伤大鼠的神经功能[6,12-14]。有研究[13,15]表明,中至重度脑损伤患者静脉输注高渗乳酸钠可以改善颅脑损伤后的能量代谢。然而,HIF-1α 和突触可塑性相关蛋白是否参与L-乳酸对创伤性脑损伤的神经保护作用尚不清楚。本研究旨在探讨L-乳酸对颅脑损伤后HIF-1α 及突触可塑性相关蛋白——突触后密度蛋白95(postsynaptic density protein-95,PSD-95)和生长相关蛋白43(growth associated protein-43,GAP-43)表达的影响,阐明L-乳酸对颅脑损伤的神经保护作用机制,为颅脑损伤的治疗提供新的潜在靶点。
1 材料与方法
1.1 实验动物和细胞
健康成年雄性SD 大鼠27 只,体重250~300 g,由大连医科大学实验动物中心提供(动物生产许可证号SCXK:[辽] 2004-0017,动物实验许可证号SYXK:[辽] 2004-0029)。大鼠在SPF 环境中饲养,室温(22±1)℃,24 h 昼夜循环光照,自由进食水。神经细胞株PC12 细胞系(江苏凯基生物技术股份有限公司)来源于大鼠肾上腺嗜铬细胞瘤,培养于37℃、5%二氧化碳孵育箱中,使用10% FBS 的完全高糖DMEM 培养基。
1.2 主要试剂和仪器
1.2.1 主要试剂 L-乳酸(批号:30108518,国药集团化学试剂有限公司),TRZol、TransScript Top Green qPCR SuperMix(北京全式金生物技术有限公司),全蛋白提取试剂盒KGP250/KGP2100、BCA 蛋白含量检测试剂盒(江苏凯基生物技术股份有限公司),兔抗鼠HIF-1α(1∶500)、兔抗鼠PSD-95(1∶1 000)、兔抗鼠GAP-43(1∶1 000)(北京博奥森生物技术有限公司),小鼠抗鼠GAPDH 抗体(1∶5 000)、Alexa Fluor 594-conjugated goat anti-rabbit IgG(1∶100)(武汉三鹰生物技术有限公司),DAPI(上海碧云天生物技术有限公司)。
1.2.2 主要仪器 自由落体打击器(北京众实迪创科技发展有限责任公司),冷冻切片机LEICACM1850、电子显微镜(美国Leica 公司),超净工作台(北京哈尔仪器制造有限公司),二氧化碳孵育箱(美国Thermo 公司),基因扩增仪ETC811(东胜创新生物科技有限公司),实时荧光定量PCR 仪(美国Bio-Rad 公司)。
1.3 方法
1.3.1 动物模型复制及给药 采用随机数字表法将实验大鼠分为3 组:假手术组(Sham 组)、创伤性颅脑损伤组(颅脑损伤组)和颅脑损伤+L-乳酸组(颅脑损伤+Lac 组),每组9 只。采用Fenney’s 自由落体打击模型[14,16]复制大鼠中度创伤性颅脑损伤模型。大鼠腹腔注射10%水合氯醛400 mg/kg 麻醉后,固定于立体定向框架内。在无菌条件下,用牙科钻于左侧顶骨行开颅术(后颅3.5 mm,侧颅2.5 mm,直径5 mm),避免损伤硬脑膜。将一根直径为4.5 mm、端部扁平的钢棒(20 g)从25 cm 的高处落在硬脑膜上的活塞上,将脑组织压缩到大约2 mm的深度,立即更换骨瓣并封闭,缝合头皮。Sham 组大鼠在相同位置行开颅术,但不撞击。颅脑损伤大鼠模型通过可见的肢体痉挛、短暂性呼吸暂停和无意识来验证是否复制成功[17]。待模型大鼠清醒后,采用改良大鼠神经功能缺损评分(mNSS)[18]从运动试验、感觉试验、反射丧失和不正常运动及癫病、肌阵挛、肌张力障碍4 个方面进行评分,并确保模型大鼠颅脑损伤程度为中度损伤。参照前期研究[9],颅脑损伤+Lac 组于颅脑损伤后腹腔注射L-乳酸500 mg/kg,1 次/d,连续7 d;Sham 组和颅脑损伤组腹腔注射等容量生理盐水,1 次/d,连续7 d。
1.3.2 细胞模型制备及给药 实验细胞分为对照组、机械划痕细胞模型组(MSC 组)和机械划痕细胞+L-乳酸组(MSC+Lac 组)。参照文献[19]制备中等机械划痕细胞模型。PC12 细胞接种于6 孔板上,两孔为一组。在超净工作台内,MSC 组和MSC+Lac组直视下用200 μL 黄色移液管进行纵横切割损伤细胞,使损伤程度和范围基本保持一致;参照文献[19]进行预实验(时间梯度实验和浓度梯度实验),确定MSC+Lac 组L-乳酸浓度20 mmol/L 为最佳治疗浓度,处理时间20 min 为最佳治疗时间。对照组细胞不做切割损伤。对照组和MSC 组给予相同剂量的0.9%无菌生理盐水。
1.3.3 大鼠行为学观察及评分 7 d 后,采用mNSS评分[18]评估各组大鼠神经功能缺损恢复程度。
1.3.4 Western blotting检测大鼠损伤侧皮层、海马中HIF-1α、PSD-95 和GAP-43 蛋白的相对表达量 行为学观察结束后,每组随机取3 只大鼠麻醉后断头处死,取其损伤侧皮层及海马组织。将各组脑组织裂解提取总蛋白,用BCA 标准蛋白定量法测定蛋白浓度,置入-80℃冰箱冷冻保存备用。采用SDS-PAGE 凝胶电泳、转膜。使用5%脱脂奶粉封闭2 h,洗膜后分别加入兔抗鼠HIF-1α(1∶500)、兔抗鼠PSD-95(1∶1 000)、GAP-43(1∶1 000)及小鼠抗鼠GAPDH 抗体(1∶5 000),4℃孵育过夜。然后,加入山羊抗兔或山羊抗鼠IgG 二抗(1∶10 000),室温孵育2 h。洗膜后进行化学发光显影,使用Image J 软件分析各条带灰度值,以目的蛋白条带灰度值与内参GAPDH 条带灰度值的比值反映目的蛋白的相对表达量。
1.3.5 Western blotting 检测PC12 细胞中HIF-1α、PSD-95 和GAP-43 蛋白的相对表达量 将各组细胞裂解提取总蛋白,用BCA 标准蛋白定量法测定蛋白浓度,置入-80℃冰箱冷冻保存备用。采用SDSPAGE 凝胶电泳、转膜。使用5%脱脂奶粉封闭2 h,洗膜后分别加入兔抗鼠HIF-1α(1∶500)、兔抗鼠PSD-95(1∶1 000)、GAP-43(1∶1 000)及小鼠抗鼠GAPDH 抗体(1∶5 000),4℃孵育过夜。然后,加入山羊抗兔或山羊抗鼠IgG 二抗(1∶10 000),室温孵育2 h。洗膜后进行化学发光显影,使用Image J 软件分析各条带灰度值,以目的蛋白条带灰度值与内参GAPDH 条带灰度值的比值反映目的蛋白的相对表达量。
1.3.6 qRT-PCR 检测损伤侧皮层HIF-1α mRNA相对表达量 行为学观察结束后,每组随机取3 只大鼠麻醉后断头处死,取损伤侧皮层组织。用TRIZol 试剂提取总RNA,测定RNA 纯度和浓度。总RNA 用TranScript Top Green qPCR Kit 逆转录成cDNA,合成的cDNA 立即用于定量PCR。HIF-1α 正向引物:5'-TCTAGTGAACAGGATGGAATGGAG-3',长度24 bp;反向引物:5'-TCGTAACTGGTCAGCTGT GGTAA-3',长度:23 bp。GAPDH 正向引物:5'-ATG CCGCCTGGAGAAACC-3',长度18 bp;反向引物:5'-GCATCAAAGGTGGAAGAATGG-3',长 度:21 bp。扩增条件:第一步94℃30 s;第二步94℃5 s、55℃15 s、72℃10 s,40 个循环;第三步添加熔解曲线,进行qRT-PCR,得到Ct 值。以GAPDH 为内参,采用2-ΔΔCt法计算大鼠损伤侧皮层HIF-1α mRNA 的相对表达量。
1.3.7 免疫荧光染色检测大鼠损伤侧皮质和海马PSD-95 的荧光强度 行为学观察结束后,每组随机取3 只大鼠麻醉后,4%多聚甲醛经心脏灌注,断头取脑,4%多聚甲醛固定,蔗糖梯度脱水,浓度依次是10%、20%、30%、30%,使用OCT 包埋剂将脱水完全的脑组织放入-80℃冰箱保存备用。使用冷冻切片机将包埋好的脑组织切成10 μm 厚的切片,放入-80℃冰箱保存备用。将冷冻组织切片取出,37℃烘箱烘片后,使用4%多聚甲醛固定,使用0.2% Triton X-100 通透,滴加3% BSA-PBS 封闭。敷一抗,兔抗PSD-95(1∶100),敷二抗,Alexa Fluor 594-conjugated goat anti-rabbit IgG(1∶100)。细胞核使用DAPI 染色,荧光显微镜下观察。Image J 软件分析损伤侧皮质和海马CA1 区PSD-95的平均光密度值(靶蛋白的光密度值/受试大脑区域的总面积),统计PSD-95 荧光强度。
1.4 统计学方法
数据分析采用SPSS 23.0 统计软件,计量资料以均数±标准差()表示,比较采用方差分析,两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 3组大鼠mNSS评分的比较
Sham 组mNSS 评分为(0.67±0.71),颅脑损伤组mNSS 评分为(8.00±1.58),颅脑损伤+Lac 组mNSS 评分为(4.89±0.78)。3 组大鼠mNSS 评分比较,差异有统计学意义(P<0.05);进一步两两比较,与Sham 组比较,颅脑损伤组mNSS 评分升高(P<0.01),与颅脑损伤组比较,颅脑损伤+Lac 组mNSS 评分降低(P<0.01)。
2.2 3 组大鼠损伤侧皮层、海马中HIF-1α 蛋白、mRNA相对表达量比较
3 组大鼠损伤侧皮层、海马中HIF-1α 蛋白和mRNA 相对表达量比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,与Sham 组比较,颅脑损伤组损伤侧皮层、海马中HIF-1α 蛋白和mRNA 相对表达量降低(P<0.05);与颅脑损伤组比较,颅脑损伤+Lac 组损伤侧皮层、海马中HIF-1α 蛋白和mRNA 相对表达量增加(P<0.05)。见图1和表1。
表1 3组大鼠损伤侧皮层、海马中HIF-1α蛋白和mRNA表达比较(n=9,)
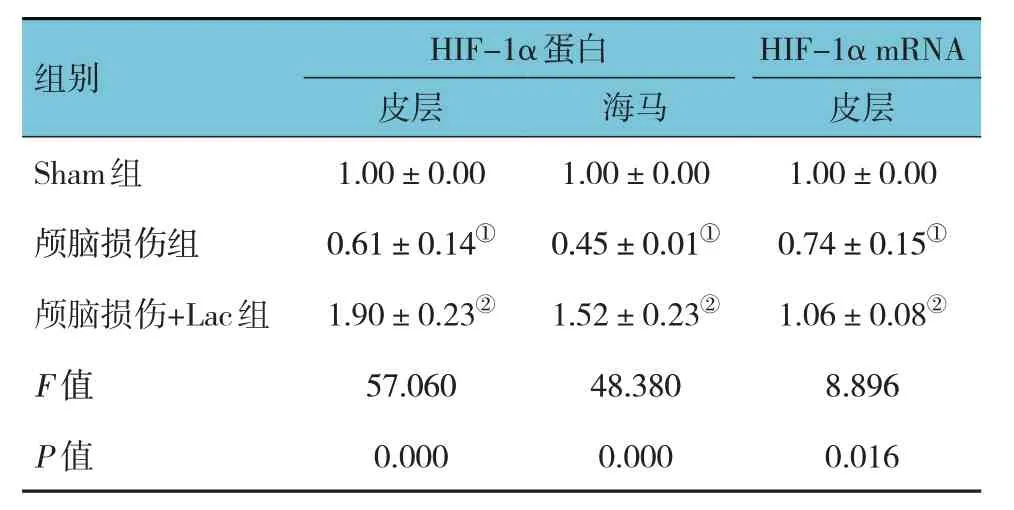
表1 3组大鼠损伤侧皮层、海马中HIF-1α蛋白和mRNA表达比较(n=9,)
注:①与Sham组比较,P<0.05;②与颅脑损伤组比较,P<0.05。
2.3 3组细胞中HIF-1α蛋白相对表达量比较
3 组细胞中HIF-1α 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,与对照组比较,MSC 组HIF-1α 蛋白相对表达量降低(P<0.05);与MSC 组比较,MSC+Lac组HIF-1α 蛋白相对表达量增加(P<0.05)。见图1和表2。
表2 3组细胞中HIF-1α蛋白相对表达量比较()

表2 3组细胞中HIF-1α蛋白相对表达量比较()
注:①与对照组比较,P<0.05;②与MSC组比较,P<0.05。
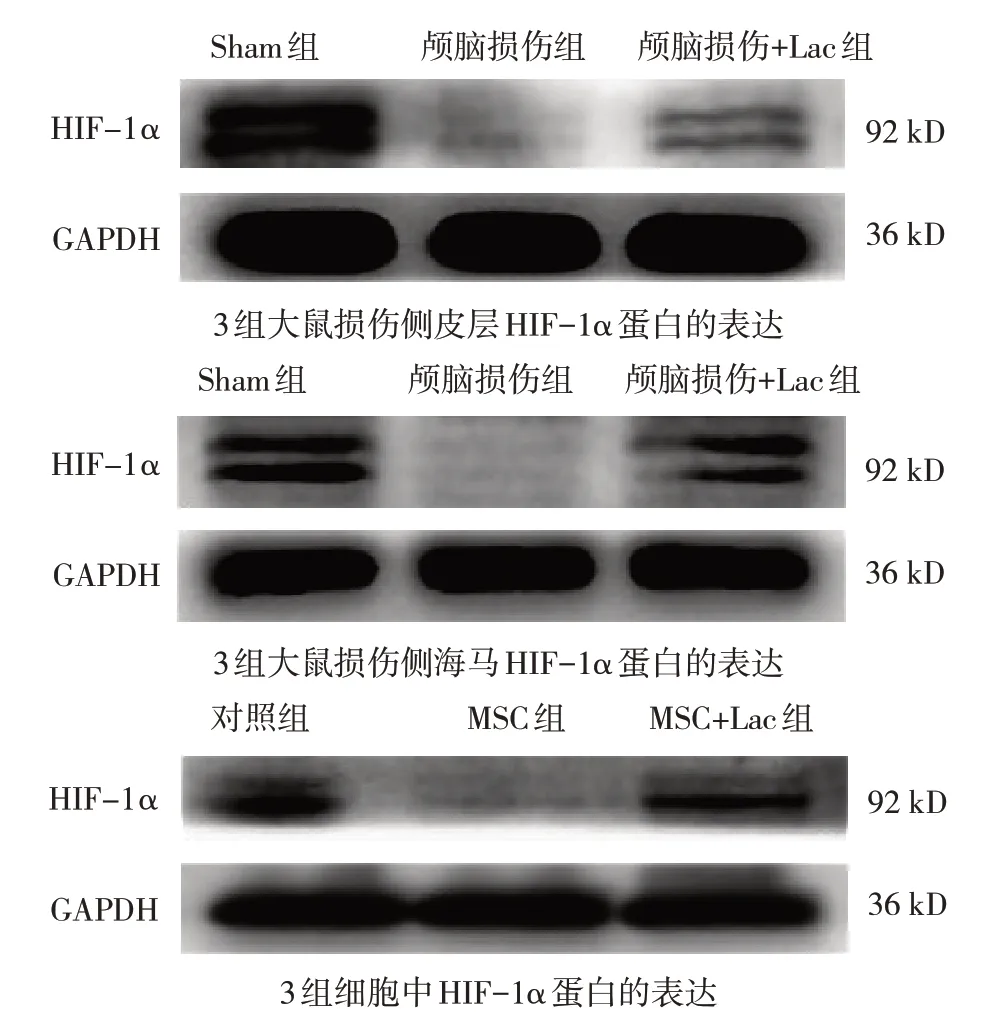
图1 HIF-1α蛋白表达
2.4 3 组大鼠突触可塑性相关蛋白相对表达量和免疫荧光强度比较
3 组大鼠损伤侧皮层、海马中PSD-95 和GAP-43 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,与Sham 组比较,颅脑损伤组PSD-95 和GAP-43 蛋白相对表达量明显降低(P<0.01);与颅脑损伤组比较,颅脑损伤+Lac 组PSD95 和GAP43 蛋白相对表达量增加(P<0.05)。见图2、3 和表3。

图2 3组大鼠损伤侧皮层中PSD-95和GAP-43蛋白的表达
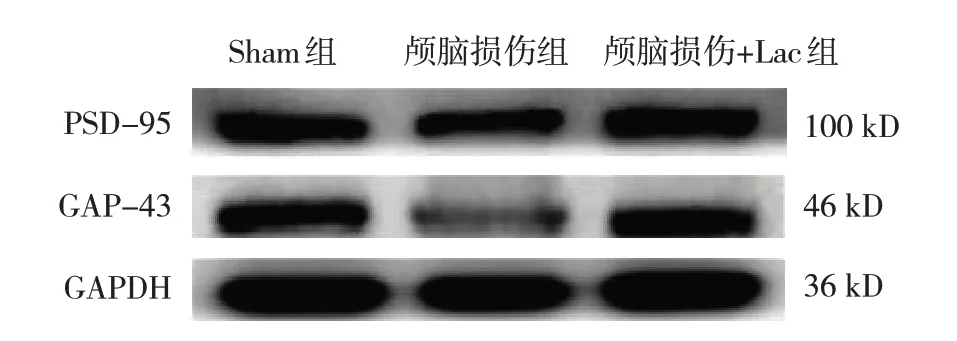
图3 3组大鼠损伤侧海马中PSD-95和GAP-43蛋白的表达
表3 3组大鼠损伤侧皮层、海马中PSD95和GAP43蛋白相对表达量比较()

表3 3组大鼠损伤侧皮层、海马中PSD95和GAP43蛋白相对表达量比较()
注:①与Sham组比较,P<0.05;②与颅脑损伤组比较,P<0.05。
3 组大鼠损伤侧皮层和海马中CA1 区PSD-95荧光强度比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,与Sham 组比较,颅脑损伤组PSD-95 荧光强度降低(P<0.05);与颅脑损伤组比较,颅脑损伤+Lac 组PSD-95 荧光强度增强(P<0.05)。见图4 和表4。
表4 3组大鼠损伤侧皮层、海马中PSD-95荧光强度比较(n=9,)
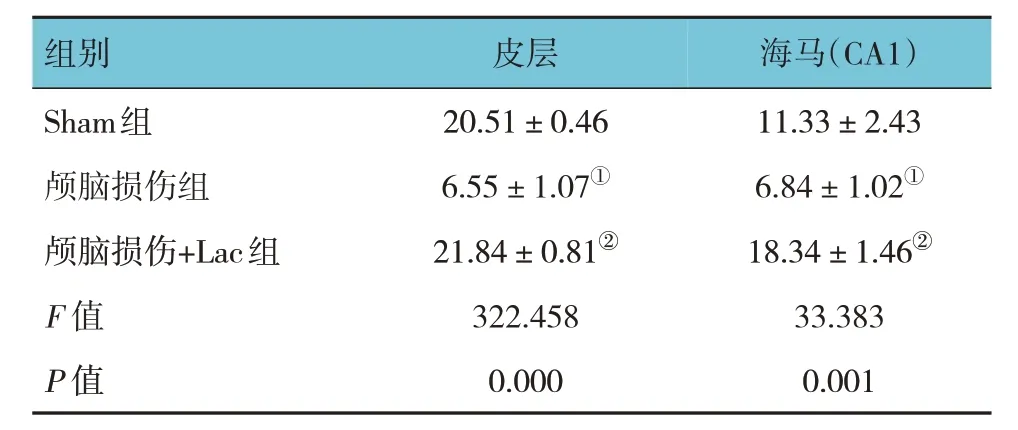
表4 3组大鼠损伤侧皮层、海马中PSD-95荧光强度比较(n=9,)
注:①与Sham组比较,P<0.05;②与颅脑损伤组比较,P<0.05。


图4 PSD-95免疫荧光图(×200)
2.5 3组细胞突触可塑性相关蛋白相对表达量比较
3 组细胞的PSD95 和GAP43 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,与对照组比较,MSC 组PSD95 和GAP43 蛋白相对表达量降低(P<0.05),与MSC 组比较,MSC+Lac 组PSD-95 和GAP-43 蛋白相对表达量增加(P<0.05)。见图5 和表5。

图5 3组细胞中PSD-95和GAP-43蛋白的表达
表5 3组细胞的PSD95和GAP43蛋白相对表达量比较()
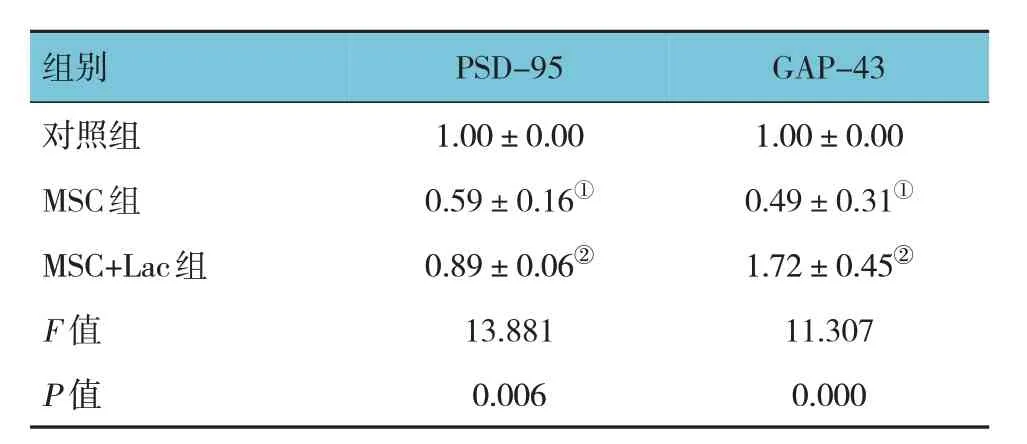
表5 3组细胞的PSD95和GAP43蛋白相对表达量比较()
注:①与对照组比较,P<0.05;②与MSC组比较,P<0.05。
3 讨论
Fenney’s 自由落体打击模型是通过去颅骨手术,将打击力量作用于完整的硬脑膜引起皮质局灶性脑损伤[16,20]。这些损伤是在几个小时内直接由挫伤皮层处发生的损伤和坏死腔引起的[16]。本研究采用mNSS 评分评估大鼠神经功能缺损情况,确保模型大鼠损伤程度为中度损伤。本研究结果表明,与Sham 组比较,颅脑损伤组大鼠的mNSS 评分增高,提示颅脑损伤动物模型复制成功。在前期实验[14]中给予乳酸预适应后能改善颅脑损伤大鼠的神经功能,故本研究参照前期实验的大鼠给药剂量和方法,选用乳酸持续治疗7 d,进一步验证在颅脑损伤后持续L-乳酸治疗的效果及机制。
本研究制备机械划痕细胞模型,能有效地模仿脑损伤后神经细胞的病理变化[21]。有研究证明,大脑皮层神经元损伤后30 min,大鼠存活率明显下降,乳酸脱氢酶明显增加[22],使用15~30 mmol/L L-乳酸能保护缺血大鼠海马星形胶质细胞[23]。本研究使用PC12 细胞系制备中度损伤的机械划痕细胞模型,通过预实验确定损伤时间为20 min,L-乳酸浓度为20 mmol/L,处理时间20 min。本研究结果显示,与对照组比较,损伤20 min 后MSC 组HIF-1α蛋白相对表达量降低;与MSC 组比较,经20 mmol/L L-乳酸处 理20 min 后,HIF-1α 蛋白相 对表达 量增加。
大量研究[24-28]表明,外源性给予乳酸对脑缺血和创伤性脑损伤有保护作用。持续静脉输注L-乳酸钠对严重创伤性脑损伤患者有益[13];在动物实验中,L-乳酸预处理可减轻创伤性脑损伤[14]。本研究结果表明,与Sham 组比较,颅脑损伤组大鼠的mNSS评分升高;与颅脑损伤组比较,颅脑损伤+Lac 组大鼠的mNSS 评分降低,提示L-乳酸持续治疗7 d后可改善颅脑损伤大鼠的神经功能缺损程度。
HIF-1 是一种异二聚体,由HIF-1β 和HIF-1α组成[29]。研究表明,HIF-1α 可改善缺氧缺血损伤[30-31]。HIF-1α 在颅脑损伤早期表达上调[6],本研究结果表明,HIF-1α 在脑损伤后第7 天时表达降低,可能是由于颅脑损伤后7 d 大鼠处于失代偿状态导致HIF-1α 表达降低。本研究的动物实验结果表明,与Sham 组比较,颅脑损伤组HIF-1α 表达降低;与颅脑损伤组比较,颅脑损伤+Lac 组HIF-1α表达增加。本研究的细胞实验结果表明,与对照组比较,MSC 组HIF-1α 表达降低;与MSC 组比较,MSC+Lac 组HIF-1α 表达增加。以上结果提示HIF-1α 参与创伤性脑损伤的发生,L-乳酸减轻脑损伤的机制与促进HIF-1α 蛋白和mRNA 表达有关。
突触可塑性在创伤性脑损伤中严重受损[31],可塑性相关蛋白PSD-95 和GAP-43 减少[31-33],L-乳酸预处理可促进PSD-95 和GAP-43 表达[14]。有研究表明,激活HIF 信号通路,可促进抑郁大鼠海马神经发生和突触可塑性增加[34]。本研究结果进一步表明,在动物实验中,与Sham 组比较,颅脑损伤组PSD-95 和GAP-43 表达降低;与颅脑损伤组比较,颅脑损伤+Lac 组PSD-95 和GAP-43 表达增加。细胞实验中,与对照组比较,MSC 组PSD-95 和GAP-43表达降低;与MSC 组比较,MSC+Lac 组PSD-95 和GAP-43 表达增加。以上结果均提示L-乳酸通过激活HIF-1α 进而促进PSD-95 和GAP-43 表达,对创伤性脑损伤神经具有保护作用。
综上所述,L-乳酸通过上调HIF-1α 表达进而增加突触可塑性相关蛋白(PSD-95、GAP-43)的表达来减轻大鼠创伤性脑损伤。
