细胞羧肽酶1 调控小鼠睾丸初级精母细胞GC-2增殖的作用与机制研究
2022-12-25王万伦刘桐佳边艳超张传领
张 婷 王万伦 刘桐佳 刘 爽 边艳超 张传领 肖 瑞
1.内蒙古医科大学内蒙古自治区分子病理学重点实验室,内蒙古呼和浩特 010059;2.内蒙古医科大学药学院,内蒙古呼和浩特 010110
生殖细胞发育异常会导致男性不育[1]。哺乳动物的精子发生包括精原细胞的增殖、精母细胞的减数分裂及精子的形成等过程,任何一个阶段发生异常均会影响成熟精子的产生[2-3]。
细胞羧肽酶1(Cytosolic carboxypeptidase 1,CCP1),由Agtpbp1 基因编码形成,在脑、睾丸及心脏中呈高表达[4-5]。CCP1 具有去谷氨酰化酶活性[6-7],参与调控微管的组装、运输和信号转导等过程[8-10]。Agtpbp1 基因缺失会导致小鼠浦肯野细胞的变性[11-12]、精子发生缺陷等[13-17]。微管是细胞分裂和迁移的重要组成部分,α和β 微管蛋白的多聚谷氨酸化改变与细胞的增殖分裂密切相关[18-19]。在肺癌A549 细胞中敲低AGTPBP1后,该细胞的增殖与迁移均增加[20],但CCP1 在睾丸等其他高表达组织中是否也影响细胞的增殖尚未有报道。
本研究利用小鼠初级精母细胞GC-2 作为体外细胞模型,研究CCP1 过表达对GC-2 细胞增殖与周期的影响,并为CCP1 在精子发生中发挥作用的分子机制研究奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 细胞系 小鼠精母细胞(GC-2)购自中国科学院干细胞库。
1.1.2 主要材料与试剂 MEM NEAA、高糖DMEM(美国Gibco 公司,货号:11140050、C11995500BT);慢病毒颗粒(中国上海吉凯基因公司,货号:LVCON335);CCK-8 试剂盒(中国上海生工公司,货号:E606335);总RNA 提取试剂盒(中国北京天根公司,货号:DP419);反转录试剂盒与q-PCR 试剂盒(日本TaKaRa 公司,货号:RR047A、RR820A);兔抗鼠CCP1、兔抗鼠CDK2、兔抗鼠GAPDH 中国武汉三鹰公司,货号:14067-1-AP、10122-1-AP、60004-1-Ig);红外荧光染料标记的羊抗兔IgG(美国LICOR 公司,货号:RK-611-130-002)。
1.2 实验方法
1.2.1 细胞培养GC-2 细胞接种于10%胎牛血清、1%链霉素/青霉素及1%MEM NEAA 的高糖DMEM 培养基37℃、5%CO2培养。
1.2.2 模型制备方法与分组 阴性对照组(NC 组,感染携带空载体慢病毒);GC-2 细胞过表达CCP1 组(GC-2+CCP1 组,感染携带CCP1 重组质粒慢病毒)。感染6 h 撤去病毒37℃、5%CO2培养。
1.2.3 CCK-8 实验 不同时间每组细胞各接种5 个复孔,37℃、5%CO2培养6、12、24、48、72 h 后,加入CCK-8溶液孵育2 h 后使用酶标仪测定各孔在450 nm 波长处的光密度(OD)值并绘制折线图。
1.2.4 流式细胞术实验 收集两组细胞各3 管,70%乙醇固定过夜,次日收集细胞沉淀并加入PI 溶液重悬细胞,37℃避光孵育30 min 后流式细胞仪检测细胞周期并计算G1期、S 期、G2/M 期细胞的百分比。
1.2.5 RNA 提取和q-PCR 提取细胞总RNA,反转录得到浓度为100 ng/μl 的cDNA。按照总体积20 μl 的反应体系(TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2 倍)10 μl,正反向引物各0.8 μl,ROX Reference Dye Ⅱ(50 倍)0.4 μl,cDNA 2 μl,灭菌水6 μl),进行95℃30 s;95℃3 s,60℃30 s,40 个循环的q-PCR反应。PCR 引物序列包括Gapdh 正向引物:5’-AGGTCGGTGTGAACGGATTTG-3’,反向引物:5’-TGTAGACCATGTAGTTGAGGTCA-3’;Ccp1 正向引物:5’-GGGGTCGAAGAGCGAGTTTC-3’,反向引物:5’-GAATGGAGTGAGTCTGCACCA-3’;细胞周期蛋白B1(Cyclin B1,Ccnb1)正向引物:5’-AAGGTGC-CTGTGTGTGAACC-3’,反向引物:5’-GTCAGCCCCATCATCTGCG-3’;细胞周期蛋白D1(Cyclin D1,Ccnd1)正向引物:5’-GCGTACCCTGACACCAATCTC-3’,反向引物:5’-CTCCTCTTCGCACTTCTGCTC-3’;细胞周期蛋白依赖性激酶2(Cyclin-dependent kinase 2,Cdk2)正向引物:5’-CCTGCTTATCAATGCAGAGGG-3’,反向引物:5’-TGCGGGTCACCATTTCAGC-3’。q-PCR 结果通过2-△△Ct方法统计分析。
1.2.6 Western blot 提取细胞总蛋白,95℃8 min后进行SDS-PAGE 胶;电泳70 V 1 h,110 V 1 h;200 mA转膜1 h;室温封闭1 h;一抗(CCP1 1∶1 000、CDK2 1∶1 000、GAPDH 1∶10 000)室温孵育2 h;室温孵育二抗1 h。在避光条件下将NC 膜置于Odessey CLX 红外激光成像系统扫描并观察结果。
1.3 统计学方法
采用SPSS 22.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,比较采用t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 成功构建CCP1 过表达的稳定细胞系
NC 组与GC-2+CCP1 组细胞在感染24 h 后均观察到gcGFP 绿色荧光蛋白的表达,提示获得了GC-2+CCP1 细胞株。见图1。

图1 GC-2 细胞过表达CCP1
2.2 两组CCP1 mRNA 和蛋白表达水平比较
与NC 组比较,GC-2+CCP1 组CCP1 mRNA 和蛋白表达水平均升高(t=79.55,P <0.000 1)。见图2。

图2 两组CCP1 mRNA 和蛋白表达情况
2.3 CCP1 过表达抑制GC-2 细胞的增殖
与NC 组比较,GC-2+CCP1 组细胞在培养72 h后增殖能力降低(t=3.132,P=0.035)。见图3。
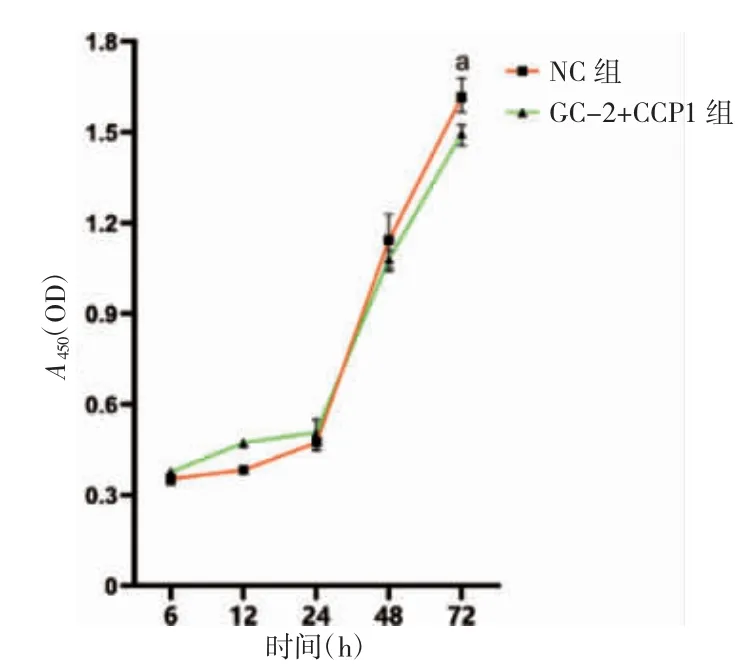
图3 CCP1 过表达对GC-2 细胞增殖能力的影响
2.4 CCP1 过表达导致GC-2 细胞发生G2/M 期阻滞
与NC 组比较,GC-2+CCP1 组细胞周期G1期降低,G2/M 期增高(P <0.05),两组S 期比较,差异无统计学意义(P >0.05)(表1、图4A~B),Ccnb1 与Ccnd1 的mRNA 表达水平降低(P=0.010、0.006)(图4C),而Cdk2 的mRNA 及蛋白表达水平均升高(P=0.003)(图4C~D)。
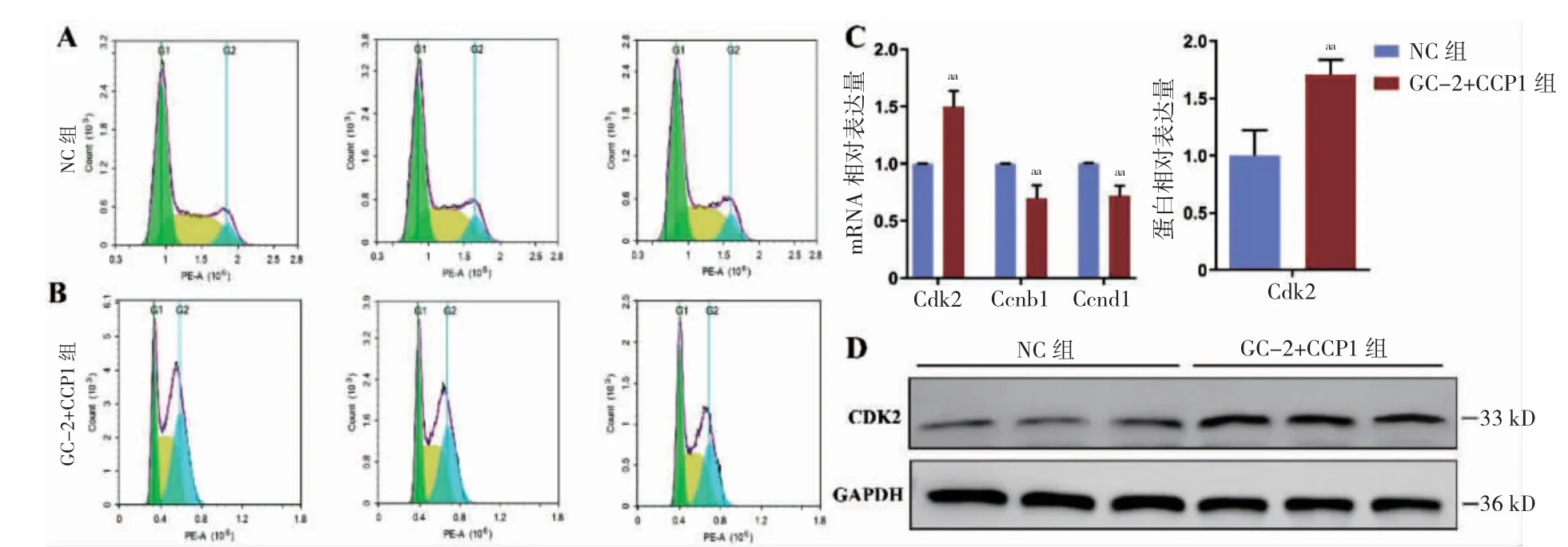
图4 CCP1 过表达对GC-2 细胞周期及细胞周期蛋白的影响
表1 两组细胞周期分布比较(%,)

表1 两组细胞周期分布比较(%,)
3 讨论
精子发生过程包括连续的细胞周期增殖、有丝分裂、减数分裂和分化,对产生精子很重要[21]。在CCP1缺失的pcd 小鼠中不仅出现神经退行性病变,还表现出精子发生缺陷[15-17]。
本研究选择GC-2 细胞作为研究对象,发现CCP1过表达会抑制GC-2 细胞的体外增殖能力发生G2/M期阻滞。CCP1 的过表达抑制生殖细胞GC-2 的增殖,则会影响小鼠睾丸的生殖和发育及正常精子的产生,但这还需要进一步的动物实验进行验证。
Cdk2、Ccnb1 及Ccnd1 是调控细胞周期的关键因子,三者的异常表达均会导致细胞周期与增殖发生异常[22-25]。本研究发现当过表达CCP1 时GC-2 细胞的Cdk2、Ccnb1 及Ccnd1 的表达会发生改变,这一现象可能是CCP1 过表达抑制GC-2 细胞体外增殖能力的重要机制。
综上所述,本研究发现调控CCP1 过表达可能通过调控Cdk2、Ccnb1 及Ccnd1 的表达抑制GC-2 细胞的增殖发生G2/M 期阻滞。因此,CCP1 在睾丸生殖细胞的增殖过程中发挥着重要作用,但确切的作用机制仍需进一步实验验证。
