牛乳和双峰驼乳中乳脂球膜蛋白的差异分析
2022-12-22豆智华杨迎春
豆智华,杨迎春,杨 洁
(新疆大学生命科学与技术学院,新疆生物资源基因工程重点实验室,新疆 乌鲁木齐 830046)
驼乳富含多种维生素及矿物质,其蛋白质、脂类、氨基酸、微生物等物质的组成含量与其他乳类有显著差异。与牛乳、羊乳等常见的反刍动物乳相比,驼乳具有低糖、低胆固醇、高矿物质(钾、钠、铜、铁、镁和锌)、高维生素和高浓度胰岛素的特性[1-3]。同时由于驼乳中含有丰富的α-乳白蛋白,不含β-乳球蛋白或含量很少,具有与母乳相似的蛋白组成,一般不会引发牛乳蛋白过敏症[4]。随着对驼乳营养价值及生物学功能研究,大众对驼乳营养价值和保健功能的认知度越来越高,驼乳及其乳制品受到越来越多消费者的青睐,以前一直被忽视的一些低丰度蛋白质已经成为乳蛋白研究中的重要组成部分。
乳脂作为乳的重要组成部分,约占总乳成分的3%~5%,主要是以圆球/椭圆球形状的脂肪球形式存在于乳中。乳脂肪球一般以球状小液滴的方式存在于乳中,直径约为0.2~15 μm,表面覆盖着一层10~20 nm的薄膜,称为乳脂肪球膜(milk fat globule membranes,MFGM)[5-6]。MFGM上的25%~70%的膜蛋白,称为乳脂球膜蛋白(milk fat globule membrane proteins,MFGMP)[7]。MFGMP是膜结合的蛋白,主要是吸附在乳脂肪球的表面,包括蛋白质、糖蛋白、酶、中性脂质和极性脂类(如磷脂和鞘糖脂)等[8]。MFGMP作为MFGM的主要组成成分,以不对称的形式分布在乳脂肪球中,占MFGM总量的25%~60%,仅占乳中蛋白质总量的1%~2%[9]。MFGMP虽然只占总乳蛋白的一小部分,但却具有丰富的生物学功能,其营养价值和组成分布取决于不同物种的乳[10-11]。目前人乳、山羊乳、牛初乳与常乳、驴初乳与常乳等之间MFGMP的组成的差异已经被广泛研究[12-17],但双峰驼乳的乳脂肪球膜蛋白组成、以及与牛乳的乳脂肪球模蛋白之间组成的差异尚未被探讨。本实验以双峰驼乳和牛乳为研究对象,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)和双向电泳(two-dimensional electrophoresis,2-DE)对2种乳的MFGMP蛋白进行组成分析,基于液相色谱-串联质谱(liquid chromatograph-tandem mass spectrometry,LC-MS/MS)技术对双峰驼乳的MFGMP进行鉴定,并通过基因本体(Gene Ontology,GO)功能注释、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)代谢通路分析等生物信息学方法对鉴定到的蛋白进行功能及作用的生物学途径的探讨,为驼乳和其乳制品在乳品行业的进一步应用提供一定理论依据。
1 材料与方法
1.1 材料与试剂
驼乳:选择乌鲁木齐红雁池的哈族村自然放牧的10 峰双峰骆驼;现场采集驼乳混匀后用低温保存带回实验室,-20 ℃中保存备用。牛乳:采自农十二师五一农场饲养的奶牛,低温保存带回实验室于-20 ℃中保存备用。
ImmobilineTMDryStrip pH3-10 NL、IPG Buffer美国GE公司;四甲基乙二胺、三(羟甲基)氨基甲烷、SDS、丙烯酰胺、甲叉双丙烯酰胺、硫脲、溴酚蓝、尿素、3-[(3-胆酰胺丙基)-二乙胺]-丙磺酸、二硫苏糖醇、碘乙酰胺、过硫酸铵、甘氨酸、低熔点琼脂糖、无水乙醇、冰醋酸、蛋白质染色试剂 生工生物工程(上海)股份有限公司;α-氰基-4-羟基肉桂酸 美国Sigma公司;乙腈、三氟乙酸 美国Thermo Scientific公司;Mass Standards Kit for Proteomics Analyzer 美国ABI公司;非预染蛋白Marker 美国Fermentas公司。
1.2 仪器与设备
Mini Protein II型垂直电泳系统 美国Bio-Rad公司;DYY-10型三恒电泳仪 北京六一仪器厂;ALPHA 1-2 LD型真空冷冻干燥机 德国贺利氏公司;Alphalmager 2200型凝胶处理及分析系统 美国阿尔法公司;Scientz-IID型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;Heal Force NW系列低温离心机 美国Sigma公司;UV-1600型分光光度仪 美谱达仪器公司;BYJ0型纯水装置 美国摩尔公司;SE-600型电泳仪、ImageScannerIII型光密度扫描仪、LX300冷却水循环系统 美国GE公司;4800 Plus型MALDI TOF/TOFTM Analyzer、Opti-TOF 123 mm×81 mm美国ABI公司;Q Exactive LC/MS二级质谱仪 美国Thermo Scientific公司。
1.3 方法
1.3.1 MFGMP的提取
MFGMP提取方法1:取新鲜双峰驼乳乳样1 000 mL,在4 ℃、5 000 r/min离心15 min,上层为含MFGM的乳脂肪。将离心得到的乳脂肪置于50 mL离心管中,加入40 mL磷酸盐缓冲液(phosphate buffered saline,PBS),搅拌均匀后8 000 r/min离心15 min,除去上清液,重复清洗乳脂肪2次(目的将脂肪中残留的酪蛋白胶束清洗干净)后收集即为乳脂肪球。用超纯水溶解乳脂肪球,37 ℃摇床孵育10 min(清洗残留的PBS)后,在4 ℃、8 000 r/min离心15 min后将取上层乳脂肪,4 ℃过夜使其结晶化;弃去上清液,用超纯水溶解沉淀,于-20 ℃冰箱中保存备用。次日,往结晶化的乳脂肪球膜中加入超纯水用磁珠搅拌器均质20 min后45 ℃水浴30 min以促进乳脂肪熔化,4 ℃、10 000 r/min离心15 min,所得沉淀即为MFGMP。
MFGMP提取方法2:取新鲜双峰驼乳乳样1 000 mL,在4 ℃、5 000 r/min离心15 min,上层为含MFGM的乳脂肪。将离心得到的乳脂肪置于50 mL离心管中,加入40 mL PBS,搅拌均匀后在4 ℃、8 000 r/min离心15 min,除去上清液,重复清洗乳脂肪3次(目的将脂肪中残留的酪蛋白胶束清洗干净)后收集即为乳脂肪球。用超纯水溶解乳脂肪球,37 ℃摇床孵育10 min(清洗残留的PBS)后,8 000 r/min离心15 min后将取上层乳脂肪,4 ℃过夜使其结晶化;弃去上清液,用超纯水溶解沉淀,于-20 ℃冰箱中保存备用。次日,再往MFGM组分中加入超纯水用超声波细胞破碎机超声(超声2 s,间隔8 s,共20 min),使MFGM均质。将均质后MFGM置于45 ℃摇床中孵育30 min促进乳脂肪熔化后在4 ℃、10 000 r/min离心15 min后,所得沉淀即为MFGMP。
在实验室用同样的方法来提取牛乳的MFGMP。将方法1和方法2中所得到的MFGMP用分别超纯水溶解,并用2D蛋白定量试剂盒检测MFGMP的浓度。所得MFGMP样品于-80 ℃中预冻后用冷冻干燥机冻干保存,于-20 ℃冰箱保存备用。
1.3.2 SDS-PAGE
电泳前样品的制备:准确称取3 mg的MFGMP冻干粉,分别用500 μL超纯水溶解混匀。将溶解的样品(40 μL)与SDS-PAGE样品缓冲液(10 μL)混合,沸水浴10 min后,12 000 r/min离心5 min。
配制8%、10%、12%、13%、15%的分离胶及5%的浓缩胶,每孔上样10 μL。采用恒流电泳,当溴酚蓝染料前沿迁移至凝胶底部约0.5 cm时,停止电泳,凝胶染色后脱色至无背景色、显现清晰的条带。采用Alphalmager 2200系统扫描凝胶,凝胶蛋白条带相对分子质量和相对含量的信息利用Gel-PRO ANALYZER软件进行凝胶定量分析,P<0.05,差异显著。采用GraphPad Prism 8.0软件进行电泳图谱差异性分析。所有的样品均重复实验3次。蛋白条带的相对分子质量和相对含量用表示。
1.3.3 2-DE
1.3.3.1 第一向等电点聚焦
采用预制IPG干胶条(pH 3~10 NL,13 cm),蛋白上样量为60 μg。将蛋白样品与水化液相互混匀,加入IPG水化盘,将IPG胶条完全放入样品溶液后,20 ℃左右过夜水化(至少20 h)后进行等电聚焦电泳,设置胶条等电点聚焦(IPGphor)仪器的运行依据。等电点聚焦参数见表1。
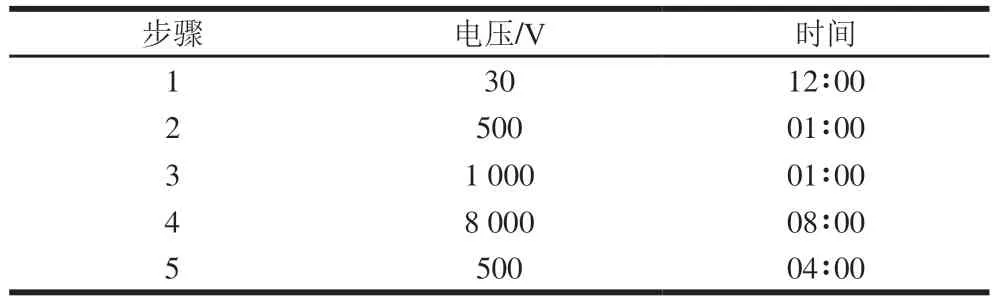
表1 等电聚焦电泳参数Table 1 Operating parameters of isoelectric focusing electrophoresis
1.3.3.2 第二向SDS-PAGE分析
等电点聚焦结束后,将胶条分别放在10 mL的平衡液I(含100 mg DTT)和10 mL的平衡液II中(含250 mg碘乙酰胺)分别平衡15 min。平衡结束后,用电极缓冲液润洗1~2 s,进行SDS-PAGE。当溴酚蓝迁移至胶底部0.5 cm处停止电泳,然后进行凝胶染色,每个蛋白样品至少重复3次,用Image MasterTM2D Platinum进行2-DE图谱的分析。
1.3.4 LC-MS/MS测定
样品处理:取冻干后100 μg的MFGMP的样品加入到30.93 μL尿素(8 mol/L含0.1% SDS)、41 μL超纯水(含0.1% SDS)、9 μL三乙基碳酸氢铵(500 mmol/L)中,还原后加入胰酶,37 ℃振荡酶切过夜。样品分级:用强阳离子交换色谱进行样品分级(A液:5 mmol/L KH2PO4pH 2.55、20%乙腈、H3PO4,B液:5 mmol/L KH2PO4pH 2.75、20%乙腈、600 mmol/L KCl、H3PO4),样品用A液稀释5 倍,调pH值到2.5,离心取后上清上样,洗脱。收集上样流出液进行质谱检测。质谱条件:液相梯度洗脱(A液:99.9%水、0.1%甲酸,B液:99.9%乙腈、0.1%甲酸)。检测质谱全扫描范围m/z350~1 800。全扫描中选择离子强度TOP20的母离子进行二级质谱鉴定。母离子使用HCD方法碎裂后进行二级质谱序列测定。
2 结果与分析
2.1 双峰驼乳MFGMP提取方法的选择
选取2种方法提取双峰驼乳中MFGMP,结果如图1所示,2种方法(泳道1、2、3和泳道6、7、8、9)所提取的MFGMP在SDS-PAGE图谱中的蛋白条带分布有所差异。提取MFGMP方法中PBS的作用是清洗残留在MFGM上的酪蛋白胶束,泳道5为PBS清洗后离心得到的沉淀,它在电泳图谱中的高丰度蛋白条带集中在30~35 kDa之间,这与酪蛋白的分子质量吻合,因此可进一步判断PBS清洗后的沉淀主要为酪蛋白。方法1所分离的双峰驼乳MFGMP与PBS清洗后沉淀中的高丰度酪蛋白,说明在提取过程中PBS后未将MFGM上吸附的酪蛋白清洗干净。泳道6~9为优化后的方法2所分离的双峰驼乳MFGMP电泳图,几乎没有酪蛋白及其他杂蛋白影响。值得注意的是,方法2所分离的双峰驼乳MFGMP的电泳图与文献报道的绵羊MFGMP的SDS-PAGE图谱的蛋白条带分布大致相同,虽然部分蛋白组分还是有所差异,这可能是由于乳的来源不同造成的。由SDS-PAGE结果除了可以看出不同方法在提取双峰驼乳MFGMP的差异,还可以得出在提取过程中用超纯水洗后离心沉淀与过夜结晶溶解脂肪后离心沉淀的蛋白质条带分布基本相同,推断方法2用超纯水清洗过程中不仅可以排除杂蛋白的干扰外,而且不至于损失过多MFGMP,得到的MFGMP纯度较高,因此后续的实验中都采用方法2提取双峰驼乳的MFGMP。
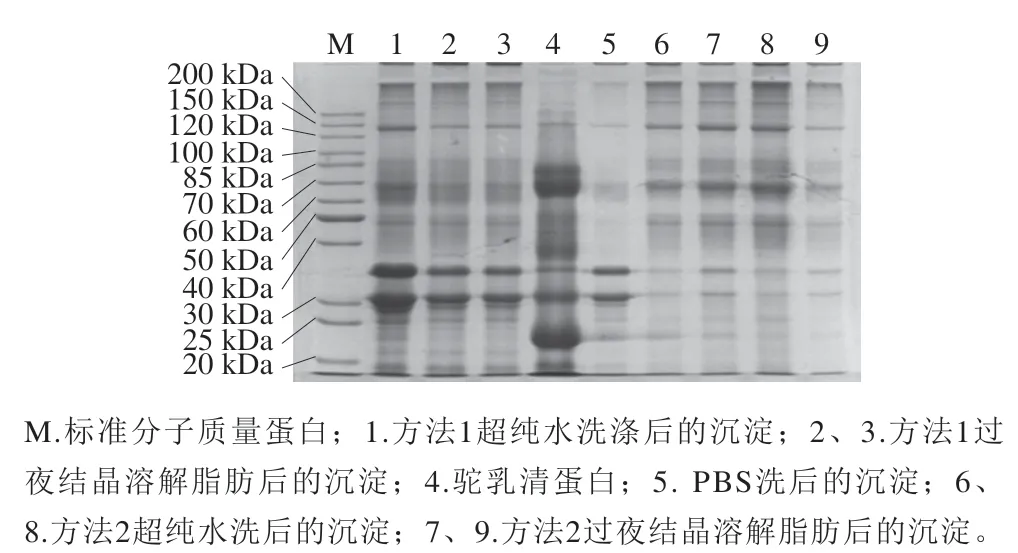
图1 不同提取方法双峰驼乳MFGMP的SDS-PAGE图谱Fig. 1 SDS-PAGE profile of MFGMP from bactrian camel milk extracted by different extraction methods
2.2 双峰驼乳和牛乳中MFGMP的SDS-PAGE差异
同一批次提取的牛乳及双峰驼乳MFGMP的SDSPAGE差异见图2,同一批次提取的双峰驼乳MFGMP(泳道2、3、4)中高丰度蛋白质电泳图谱表现为一致性,蛋白条带分布基本相同;而不同批次提取的双峰驼乳MFGMP(泳道5、6与2、3、4)中高丰度蛋白的图谱较为一致,但是部分低丰度的蛋白存在差异,这可能与提取MFGMP的乳脂肪原料、乳脂肪球过夜结晶后的均质化和溶解脂肪的温度、时间有关。结果表明:牛乳和双峰驼乳MFGMP的电泳图谱具有一定的差异,在60~70 kDa分子质量范围,牛乳与双峰驼乳MFGMP的高丰度蛋白(依据分子质量推测为嗜乳脂蛋白(butyrophilin,BTN)分子质量有明显区别。与双峰驼乳相比,牛乳MFGMP中200 kDa以上和40 kDa以下的蛋白条含量较低或缺失,30 kDa左右(推测为GTP-结合蛋白)蛋白条带几乎不存在。本实验中双峰驼乳、牛乳MFGMP与文献中的牛乳、山羊乳MFGMP中的高丰度蛋白条带分布基本一致[13,16],MFGMP中的高丰度蛋白分别为黏液素1(mucins 1,MUC1)、黄嘌呤氧化还原酶/脱氢酶(xanthine oxidoreductase,XO/XDH)、黏液素15(mucins 15,PAS III)、CD36(或PAS IV)、BTN、乳凝集素(乳脂肪球-EGF因子8(milk fat globule-EGF factor VIII,MFG-E8)或PAS6/7)、GTP结合蛋白(GTP-binding protein)及脂肪酸结合蛋白(fatty acidbinding protein,FABP)等。乳的来源不同,蛋白质的分子质量略有不同,因此来源于驼乳、牛乳、山羊乳的MFGMP中蛋白质的分子质量都略有差异。
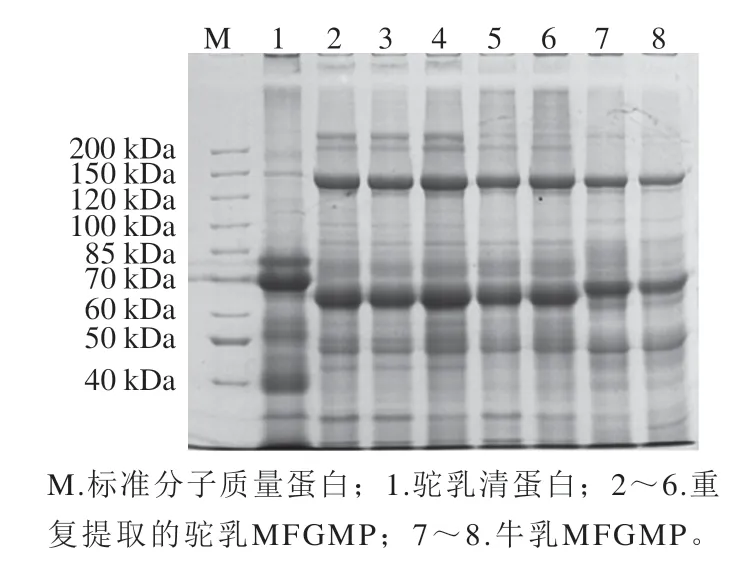
图2 牛乳和双峰驼乳中MFGMP的SDS-PAGE图谱Fig. 2 SDS-PAGE profile of MFGMP from bovine milk and bactrian camel milk
选取用不同浓度的分离胶分离提取的牛乳和双峰驼乳MFGMP,并利用Gel-PRO ANALYZER软件同时分析不同浓度分离胶的电泳图谱,计算各蛋白质组分的相对含量,并通过蛋白标准分子质量Marker的迁移率确定蛋白条带的相对分子质量,结果见图3和表2。根据文献中报道的MFGMP相关信息推测MFGMP组分F1为MUC1,F3为XO/XDH,F5为PAS III,F6/F7为CD36,F9为BTN,F11/F12为乳凝集素(MFG-E8或PAS6/7),F14为GTP-binding protein,F19为FABP。
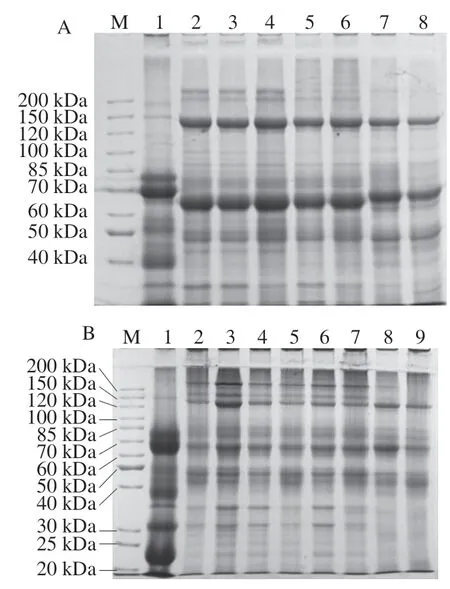
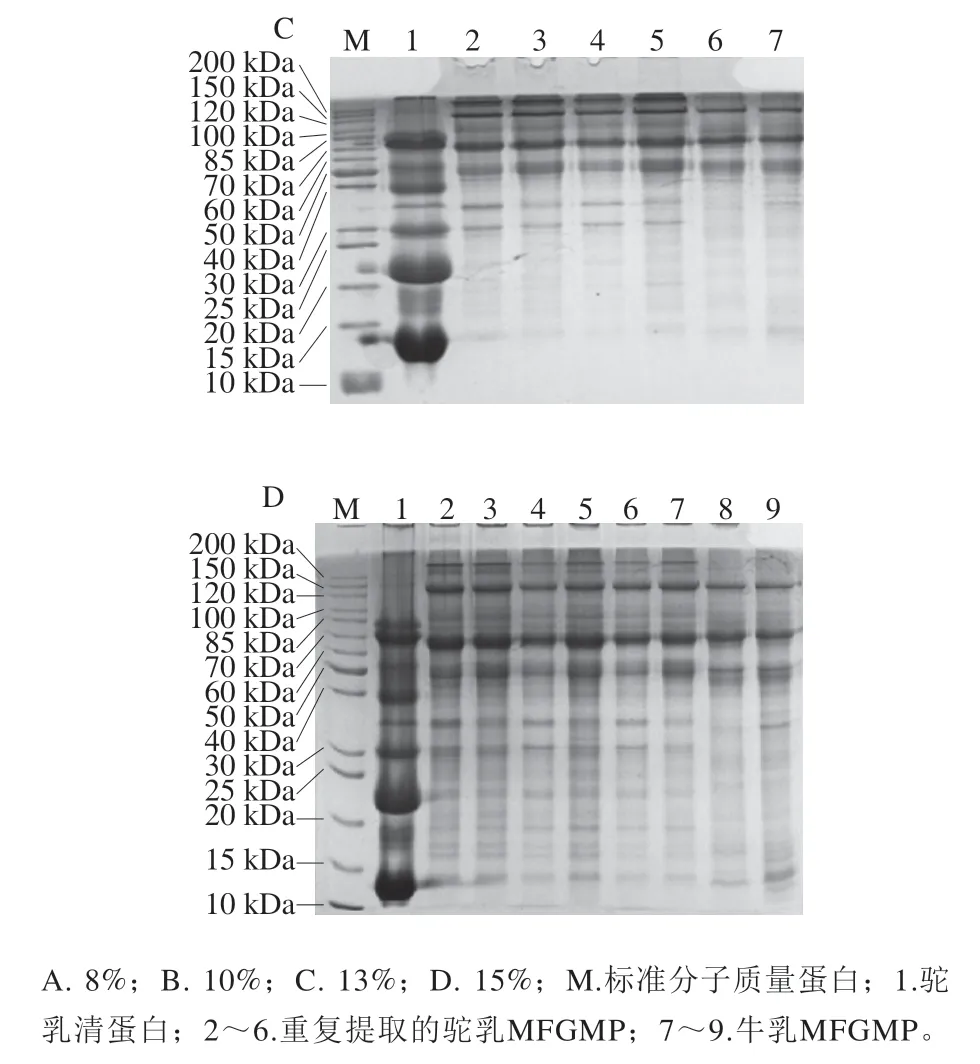
图3 牛乳和双峰驼乳中MFGMP的不同浓度分离胶的SDS-PAGEFig. 3 SDS-PAGE profile of different concentrations of MFGMP isolates from bovine and Bactrian camel milk

表2 双峰驼乳和牛乳中MFGMP的组分信息Table 2 Information on the components of MFGMP in bovine milk and bactrian camel milk
2.3 双峰驼乳和牛乳中MFGMP的2-DE图谱差异
相同条件下,利用2-DE技术对从牛乳和双峰驼乳中提取的MFGMP进行分离分析,为提高实验的准确性和可靠性,本研究对每个样品至少重复3次。牛乳MFGMP中可检测蛋白质斑点数为1 304、1 235、1 358,双峰驼乳MFGMP中可检测蛋白质斑点数分别为925、870、1 003(表3),表明所得2-DE图谱具有较好的重复性,可以满足分离分析的要求。由于MFGMP分别来自于驼、牛两个不同的物种,MFGMP组分相对分子质量和等电点差异较大,所以无法匹配共同斑点而进行蛋白质组学差异性分析。如图4所示,双峰驼乳和牛乳的MFGMP的2-DE图谱中存在3个相似的蛋白斑点区域(如图4A和图4D中红色标记区域),同时,双峰驼乳和牛乳的MFGMP的2-DE图谱中存在两个显著差异的蛋白斑点区域(如图4A和图4D中蓝色标记区域)。参照文献中牛乳MFGMP[18]和绵羊乳MFGMP[19]的2-DE图谱,根据文献中所报道的蛋白斑点信息,推测图与4A、D中红色标记区域中相同的蛋白斑点,从低等电点到高等电点分别是BTN、MFG-E8、脂肪分化相关蛋白(ADRP或PLIN2)。
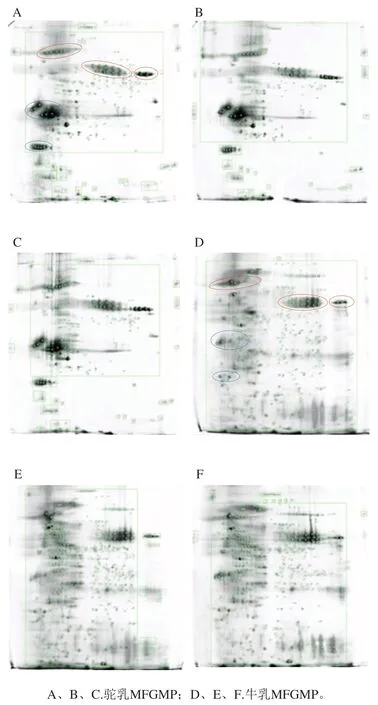
图4 牛乳和双峰驼乳中MFGMP的2-DE凝胶图谱Fig. 4 2-DE gel profiles of MFGMP from bovine milk and bactrian camel milk
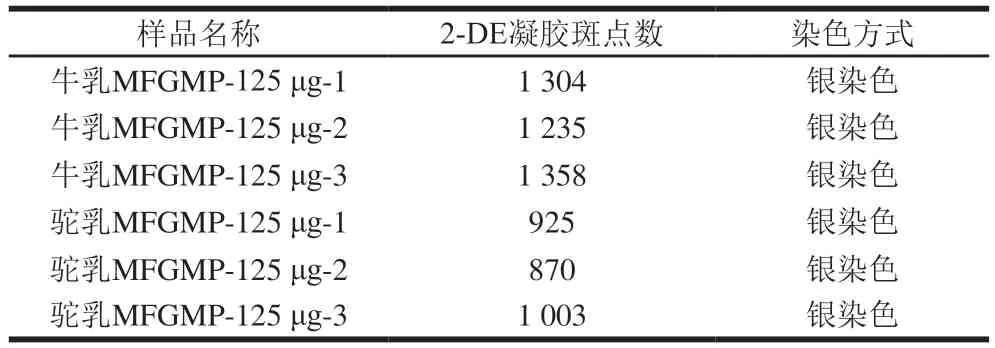
表3 牛乳和双峰驼乳MFGMP的2-DE凝胶斑点数Table 3 Number of 2-DE spots for MFGMP from bovine milk and bactrian camel milk
2.4 双峰驼乳MFGMP的质谱鉴定
为了进一步确认双峰驼乳的MFGMP具体蛋白组分,从NCBI下载蛋白质组数据库用于质谱数据分析,数据库为txid419612-Camelus-ferus-refseq-23637s.fast,23637entries,用Proteome Discoverer软件进行搜库分析。与数据库比对发现,二级质谱成功鉴定出双峰驼乳的MFGMP中有2 086个蛋白组分;其中120个蛋白组分得分大于100;有14个蛋白组分相对丰度大于1%(表4),其中有4个为酪蛋白组分,可能是在MFGMP分离过程中酪蛋白未清洗完全。质谱结果表明,双峰驼乳中高丰度MFGMP组分依次为:BTN、XO/XDH、乳凝集素(MFG-E8或PAS6/7)、脂肪分化相关蛋白(ADRP或PLIN2)等。
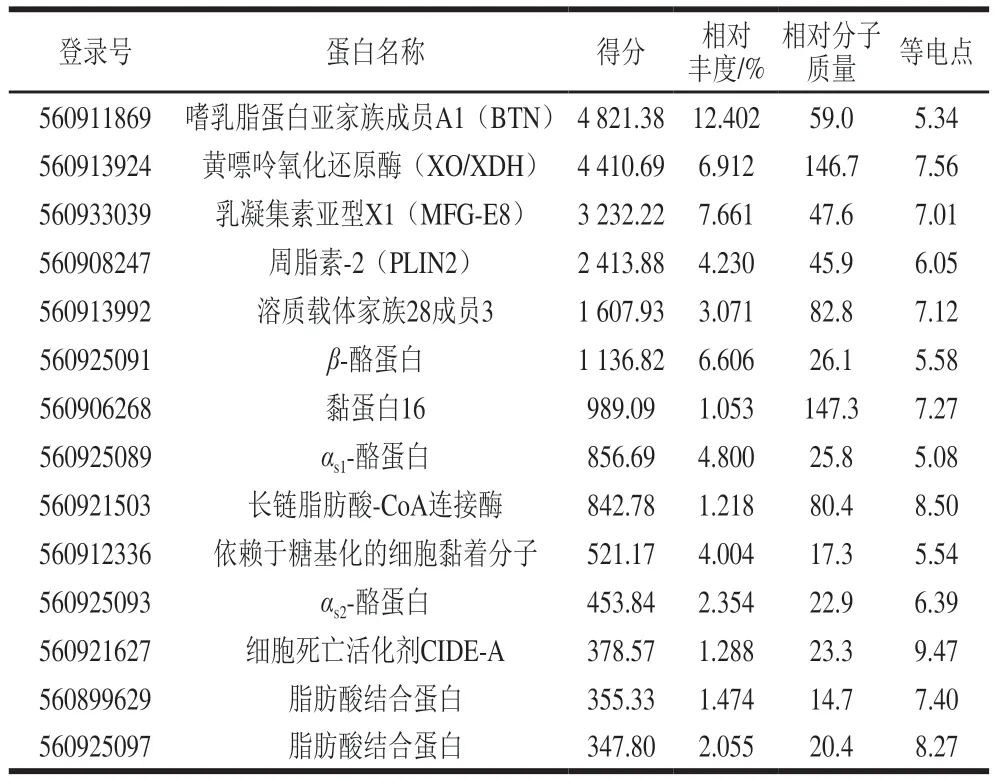
表4 双峰驼乳MFGMP的二级质谱鉴定结果(部分高丰度蛋白)Table 4 Secondary mass spectrometric identification of some highabundance MFGMP from bactrian camel milk
2.5 双峰驼乳MFGMP的GO注释和KEGG通路代谢路径分析
为进一步了解双峰驼乳的MFGMP的功能,将MFGMP用DAVID在线分析进行蛋白质的GO注释和KEGG代谢路径分析。如图5A~C所示,分别对其生物学过程、细胞成分以及分子功能进行分析和归类。双峰驼乳的MFGMP的主要参与很多生物途径,其中有16.59%的蛋白参与翻译和翻译的起始,10.25%蛋白参与氧化还原过程,8.3%的蛋白参与细胞内蛋白质转运,7.81%蛋白参与蛋白质折叠,其余的蛋白参与了细胞间黏附、ER相关的泛素依赖性蛋白质分解代谢过程、蛋白质转运、基因表达的负调控、ER到高尔基体囊泡介导的转运、细胞氧化还原稳态、蛋白质加工响应线粒体去极化的线粒体自噬等。双峰驼乳的MFGMP,13.36%为膜、11.54%为胞质溶胶、9.54%为线粒体、6.11%为内质网膜以及细胞内核糖核蛋白复合物、蛋白酶体辅助复合物、高尔基体;双峰驼乳的MFGMP的分子功能主要是结合活性和分子催化,其中结合活性包括poly(A) RNA结合、mRNA结合、翻译起始因子活性、蛋白质结合、钙离子结合、糖蛋白结合、受体结合、肝素结合、泛素蛋白连接酶结合等多个分子功能。
采用DAVID分析对双峰驼乳的MFGMP进行KEGG代谢路径分析,结果有399种蛋白有代谢路径信息,共有37个代谢路径,其中前20个代谢路径见图5D,分别核糖体、蛋白体、内质网中的蛋白质加工、内吞作用氧化磷酸化、脂肪酸代谢、非酒精性脂肪肝、军团病、不饱和脂肪酸的生物合成、抗生素的生物合成、PPAR信号传导途径、碳代谢等代谢途径。
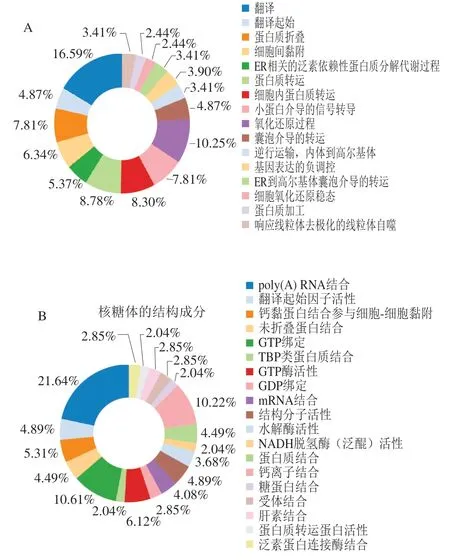
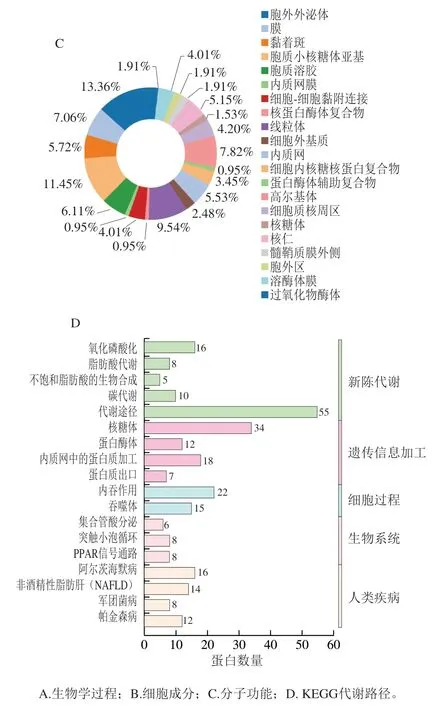
图5 驼乳MFGMP的GO注释和KEGG代谢路径分析图Fig. 5 GO annotation and KEGG metabolic pathway analysis of MFGMP from bactrian camel milk
3 讨 论
本研究以牛乳和双峰驼乳为原料经优化提取方法后,利用SDS-PAGE和2-DE技术对双峰驼乳与牛乳中MFGMP进行分离分析。研究结果表明,双峰驼乳、牛乳中的MFGMP中BTN的相对含量最高,分别为(22.55±1.52)%、(24.05±1.94)%,其次是XO/XDH,分别为(15.12±0.71)%、(18.54±1.36)%,这与Ye Aiqian等[20]报道的牛乳MFGMP中含量最高的为BTN,其次为XO的结果一致,但是相对含量有所差异,可能是乳的来源不同造成。牛乳MFGMP中乳凝集素(MFG-E8或PAS6/7)糖基化程度不同使它们的分子质量不同,乳凝集素是继BTN之后最丰富的MFGM糖蛋白,分子质量范围为43~59 kDa[21]。山羊乳在50~55 kDa范围表现为2个蛋白条带,占MFGMP的7.9%,变异系数低[14]。本实验结果显示,双峰驼乳、牛乳MFGMP中F11/F12两个蛋白组分与乳凝集素相对分子质量一致,分别为47.51±0.24/43.76±0.27,48.31±0.15/43.88±0.73,乳凝集素在双峰驼乳、牛乳MFGMP中相对含量仅次于XO/XDH,分别为11%、17%左右。当乳冷却和搅动时,MUC1容易从脂肪球上脱落到脱脂乳中。本研究所分离的双峰驼乳MFGMP样品在大于200 kDa范围存在2个蛋白条带,可以说明MUC1在双峰驼乳中表现为多态性,这与文献报道的MUC1在山羊乳中表现出蛋白多态性的结果一致[22-24]。
研究报道,牛乳中CD36在MFGMP中占5%,分子质量在75~88 kDa[21]。Zamora等[14]的研究表明,山羊乳MFGMP中CD36的分子质量约为83 kDa。在本实验中双峰驼乳和牛乳MFGMP中都存在88、75 kDa左右的蛋白条带,推测这2个蛋白条带可能为CD36,相对含量也为5%左右,与文献报道结果一致。PAS III是一种糖蛋白特征很弱的MUC15,它在SDS-PAGE凝胶上呈现出相对分子质量为95~100 kDa的弥漫扩散条带,这种蛋白条带的多分散特点可能是由于大量的可变数值的碳水化合物引起的。本实验的凝胶电泳图谱分析结果显示双峰驼乳(100.22±0.45)和牛乳(102.51±1.47)MFGMP中均存在与PAS III相对分子质量相应的蛋白条带,相对含量分别为(2.43±0.30)%、(2.51±0.28)%。Sun Ye等[13]发现在20~44 kDa范围至少有10~12个条带,17~18 kDa范围内有许多弥漫的蛋白条带,其中有些蛋白条带被鉴定为GTP-结合蛋白。双峰驼乳MFGMP在20~44 kDa范围内存在一系列弥漫的蛋白条带,可确认为GTP-结合蛋白,但是牛乳MFGMP在这个分子质量范围内蛋白组分缺失。FABP是一个分子质量为14 kDa的多肽,在牛乳MFGMP中占2%~3%,在山羊乳中占总MFGMP的3.7%。本研究中双峰驼乳、牛乳的MFGMP中分别存在13.96±0.02、13.65±0.42的蛋白条带,根据相对分子质量推测该条带FABP。
芦晶等[25]使用过滤器辅助样品前处理法测定在牛乳MFGMP检测共出169种蛋白质。杨梅等[12]将牛乳MFGMP酶解后,用电喷雾离子源质谱最终鉴定出488种蛋白质且大多数的蛋白为糖基化蛋白。景萌娜等[15]运用纳升高效液相色谱与静电场轨道阱组合式高分辨质谱技术在牛乳的MFGMP鉴定出具有可靠定量信息的蛋白质有593种。本实验中质谱成功鉴定出双峰驼乳的MFGMP中有2 086个蛋白组分,双峰驼乳中高丰度MFGMP组分依次为BTN、XO/XDH、乳凝集素(MFG-E8或PAS6/7)、脂肪分化相关蛋白(ADRP或PLIN2)等。与Sabha等[10]和Han Bin等[26]在单峰驼驼乳和双峰驼乳中鉴定MFGM蛋白主要为脂肪酸合成酶、XO/XDH、BTN、乳凝集素(MFG-E8或PAS6/7)和脂肪分化相关蛋白(ADPH)结果一致。Li Weixuan等[17]和Cebo等[27]利用质谱的方法鉴定出马乳和驴乳中主要MFGMP为XO/XDH、BTN,乳凝集素(MFG-E8或PAS6/7)和脂肪分化相关蛋白(ADPH)。此外,利用David生物信息学资源将双峰驼乳的MFGMP进行GO注释和KEGG通路分析发现这些蛋白主要是细胞膜、线粒体、内质网膜等组分,参与的生物途径有翻译和翻译的起始、氧化还原过程、细胞内蛋白质转运、蛋白质折叠、细胞氧化还原稳态等,具有结合活性和分子催化等分子功能。
研究表明MFGMP与多发性硬化症、自闭症、冠心病等疾病之间具有相关性[28]。近几年驼乳中蛋白以及MFGMP因其特殊的营养价值和功能特性越来越受到食品行业广泛的关注[29-30]。MFGMP是由种类繁多的功能性蛋白质所组成,很多蛋白质能够在极微量的条件下起到至关重要的生理作用[31]。MFGMP在组成及功能上的研究,能够促进深入地了解乳蛋白,并为以乳为原料的产品添加功能性蛋白提供参考。因此,对双峰驼乳MFGMP在蛋白质组成及功能上以及与牛乳MFGMP对比寻找差异蛋白进行深入研究,不但能够增加双峰驼乳的利用率及利用价值,还能够为以双峰驼乳为原料的产品添加功能性蛋白提供理论依据。本实验的样本量小,尚需加大样本量和样品量,建立简单有效的区分双峰驼乳与其他来源乳(牛乳等)中蛋白质的方法,为乳制品的鉴别和质量监控提供理论依据。
