基于LC-MS/MS分析‘塔罗科’血橙优系果实花青素组分特征
2022-12-22侯慧芳杨海健
杨 蕾,侯慧芳,王 敏,洪 林,杨海健,王 武,程 杨,谭 平
(重庆市农业科学院果树研究所,重庆 401329)
血橙(Citrus sinensis(L.) Osbeck),芸香科柑橘属植物,是柑橘中唯一含花青素的品种[1]。花青素为天然的水溶性色素,属类黄酮物质,大多以花青素苷的形式存在,和糖结合形成花色苷[2-4]。花青素主要有6 大类:矢车菊素、飞燕草素、芍药花素、天竺葵素、锦葵素、矮牵牛素[5-6]。矢车菊素及芍药花素呈紫红色,天竺葵素表现为红橙色,飞燕草素、锦葵素及矮牵牛素表现为蓝紫色[7-8]。花青素抗氧化能力极强,具有抗癌、抗炎、降低心血管病、治疗糖尿病和降低其他慢性疾病风险等多种药理作用[9-12]。
国内外学者对血橙花青素多年前就已有研究,血橙中花青素组分和含量因品种而异,还受到环境因素等多种条件的影响。经前人研究,血橙花青素主要成分为矢车菊素-3-O-丙二酰葡萄糖苷、矢车菊素-3-O-葡萄糖苷等[13-14]。Dugo等[15]利用微量高效液相色谱-电喷雾离子化串联质谱联用技术首次鉴定出‘摩洛’、‘塔罗科’和‘桑吉耐洛’血橙中含芍药花素-3-O-葡萄糖苷、矢车菊素-3-O-芸香糖苷、飞燕草素-3-O-丙二酰葡萄糖苷、芍药花素、矮牵牛素5种少量成分。Hillebrand等[16]研究商业化血橙果汁花青素组成为2种主要成分:矢车菊素-3-葡萄糖苷和矢车菊素-3-(6-丙二酰葡萄糖苷),6种次要成分:矢车菊素-3,5-O-二葡萄糖苷、飞燕草素-3-O-葡萄糖苷、矢车菊素-3-O-槐糖苷、飞燕草素-3-O-(6-丙二酰葡萄糖苷)、芍药花素-3-O-(6-丙二酰葡萄糖苷)和矢车菊素-3-(6-二乙二酰葡萄糖苷)。Cebadera-Miranda等[17]鉴定出‘桑吉耐洛’和‘塔罗科’血橙中10种花青素组分,主要包括7种矢车菊素和3种飞燕草素。曹少谦[18]利用高效液相色谱-质谱联用技术鉴定出‘塔罗科’血橙中8种花青素物质,2种主要组分及6种次要成分。杨海健等[19]发现‘塔罗科’血橙果皮中主要有矢车菊素-3-葡萄糖苷、矢车菊素-3(6''-丙二酰)葡萄糖苷和飞燕草素-3-芸香糖苷3种花青素。
塔罗科血橙是我国主栽血橙品种,果肉色泽是其关键品质指标之一,花青素含量高低决定其商业价值,但在重庆地区血橙表现出果肉着色浅或不均匀、品质下降等问题,制约产业发展。目前,高花青素商业血橙品种匮乏,血橙花青素代谢调控机制研究尚不透彻。液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)因分辨率高、灵敏度高,适合检测高沸点、高分子质量化合物、热不稳定物质等,在植物代谢组学方面的应用越来越广泛[20-21]。本研究基于LC-MS/MS技术测定‘塔罗科’血橙优系和对照品种果肉花青素代谢物的种类和含量,筛选两者的差异代谢物,为优系后续基础应用研究提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
供试品种为‘塔罗科’血橙优系,系本实验室前期从普通‘塔罗科’血橙中筛选的芽变材料,具有高花青素、高可溶性固形物含量两大优良性状。供试材料‘塔罗科’血橙优系和对照品种‘塔罗科’血橙种植于重庆市开州区鸿情香橙果园,海拔385 m,基砧均为枳,中间砧为锦橙,高接5年,普通管理水平。2月下旬果实成熟期采样,选取‘塔罗科’血橙优系(G)和对照品种‘塔罗科’血橙(CK)各9 株树,内膛(N)和外围(W)分别采集果样,设置GN、GW、CKN和CKW 4个实验组,每个实验组每株采集果实样品5个,每3 株样树的15个果实混合为1个生物学样品并设置3个重复,用于果实基础品质和花青素代谢物测定。
甲醇(色谱纯) 德国Merck公司;甲酸(色谱纯) 美国Sigma-Aldrich公司;盐酸(优级纯)信阳市化学试剂厂;标准品:矢车菊素类(矢车菊素-3-O-丙二酰葡萄糖苷、矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-桑布双糖苷、矢车菊素-3-O-槐糖苷、矢车菊素-3-O-木糖苷、矢车菊素-3-O-阿拉伯糖苷、矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-芸香糖苷、矢车菊素-3,5-O-二葡萄糖苷、矢车菊素-3-O-桑布双糖苷-5-葡萄糖苷、矢车菊素-3-芸香糖苷-5-葡萄糖苷、矢车菊素-3-O-对香豆酰葡萄糖苷、矢车菊素-3-(6-咖啡酰)-葡萄糖苷、矢车菊素-3-(6-咖啡酰槐糖苷)-5-葡萄糖苷、矢车菊素-3-O-5-O-(6-O-对香豆酰)二葡萄糖苷、矢车菊素-3-O-阿魏酰槐糖苷-5-葡萄糖苷、矢车菊素-3,5,3'-O-三葡萄糖苷)、黄酮类(柚皮素-7-O-葡萄糖苷、芦丁、柚皮素、查耳酮、二氢杨梅黄酮、阿福豆苷、香橙素(二氢山柰酚)、异槲皮苷)、锦葵色素类(锦葵色素-3,5-O-二葡萄糖苷、锦葵色素-3-O-丙二酰葡萄糖苷、锦葵色素-3-O-阿拉伯糖苷、锦葵色素-3-O-对香豆酰葡萄糖苷、锦葵色素-3-O-半乳糖苷、锦葵色素-3-O-葡萄糖苷、锦葵色素、锦葵色素-3-O-5-O-(6-O-对香豆酰)-二葡萄糖苷、锦葵色素-3-O-(6''-乙酰基葡萄糖苷)-5-葡萄糖苷、锦葵色素-3-O-芸香糖苷、锦葵色素-3-O-桑布双糖苷、锦葵色素-3-O-槐糖苷、锦葵色素-3-O-桑布双糖苷-5-葡萄糖苷)、原花青素类(原花青素A1、原花青素A2、原花青素B1、原花青素B2、原花青素B3、原花青素C1)、芍药花色素类(芍药花色素-3-(咖啡酰葡萄糖基葡萄糖苷)-5-葡萄糖苷、芍药花素-3-O-对羟基苯甲酰槐糖-5-葡萄糖苷、芍药花色素-3-O-咖啡酰-阿魏酰-槐糖苷-5-葡萄糖苷、芍药花色素-3-O-阿魏酰-槐糖苷-5-葡萄糖苷、芍药花色素-3-O-桑布双糖苷-5-葡萄糖苷、芍药花素-3,5,3'-O-三葡萄糖苷、芍药花色素、芍药花色素-3-O-5-O-(6-O-对香豆酰)-二葡萄糖苷、芍药花色素-3-O-桑布双糖苷、芍药花色素-3-O-槐糖苷、芍药花色素-3-O-丙二酰葡萄糖苷、芍药花色素-3-(6-p-对香豆酰)-葡萄糖苷、芍药花色素-3-O-葡萄糖苷、芍药花色素-3-O-半乳糖苷、芍药花色素-3-O-芸香糖苷、芍药花色素-3,5-O-二葡萄糖苷、芍药花色素-3-O-阿拉伯糖苷)、飞燕草素类(飞燕草素-3-O-乙酰基葡萄糖苷、飞燕草素-3-O-(6-O-丙二酰基)-葡萄糖苷-3'-葡萄糖基、飞燕草素、飞燕草素-3-O-对香豆酰葡萄糖苷、飞燕草素-3-O-5-O-(6-O-对香豆酰)二葡萄糖苷、飞燕草素-3-O-阿拉伯糖苷、飞燕草素-3-O-葡萄糖苷、飞燕草素-3-O-丙二酰葡萄糖苷、飞燕草素-3-O-半乳糖苷、飞燕草素-3-O-芸香糖苷、飞燕草素-3-O-槐糖苷、飞燕草素-3,5-O-二葡萄苷、飞燕草素-3-芸香糖苷-5-葡萄糖苷、飞燕草素-3-O-鼠李糖苷、飞燕草素-3-O-桑布双糖苷、飞燕草素-3-O-桑布双糖苷-5-葡萄糖苷)、天竺葵素类(天竺葵素、天竺葵素-3-O-对香豆酰葡萄糖苷、天竺葵素-3-O-(6''-阿魏酰桑布双糖苷)-5-O-(丙二酰基)-葡萄糖苷、天竺葵素-3-O-5-O-(6-O-对香豆酰)-二葡萄糖苷、天竺葵素-3-O-[2-O-葡萄糖基-6-O-p-对香豆酰-葡萄糖苷]-5-O-葡萄糖苷、天竺葵素-3-O-阿拉伯糖苷、天竺葵素-3-O-半乳糖苷、天竺葵素-3-O-芸香糖苷、天竺葵素-3-芸香糖苷-5-葡萄糖苷、天竺葵素-3-O-桑布双糖苷、天竺葵素-3-O-槐糖苷-5-O-(丙二酰基)-葡萄糖苷、天竺葵素-3-(6-咖啡酰槐糖苷)-5-葡萄糖苷、天竺葵素-3-O-阿魏酰葡萄糖基葡萄糖苷-5-葡萄糖苷、天竺葵素-3,5,3'-O-三葡萄糖苷、天竺葵素-3-O-桑布双糖苷-5-葡萄糖苷、天竺葵素-3-O-丙二酰葡萄糖苷、天竺葵素-3-O-葡萄糖苷、天竺葵素-3-O-槐糖苷、天竺葵素-3,5-O-二葡萄糖苷)、矮牵牛素类(矮牵牛素-3,5-O-二葡萄糖苷、矮牵牛素-3-O-5-O-(6-O-对香豆酰)二葡萄糖苷、矮牵牛素-3-O-阿拉伯糖苷、矮牵牛素-3-O-半乳糖苷、矮牵牛素-3-O-芸香糖苷、矮牵牛素-3-O-桑布双糖苷、矮牵牛素-3-O-槐糖苷、矮牵牛素-3-O-桑布双糖苷-5-葡萄糖苷、矮牵牛素-3-O-丙二酰葡萄糖苷、矮牵牛素-3-O-葡萄糖、矮牵牛素-3-O-对香豆酰葡萄糖苷)(纯度>99%) 上海isoReag公司。
1.2 仪器与设备
QTRAP 6500+LC-MS/MS联用仪 美国SCIEX公司;5424R离心机 德国Eppendorf公司;AS 60/220.R2电子天平 波兰RADWAG公司;MM400球磨仪德国Retsch公司;MIX-200多管涡旋振荡器 上海净信公司;KQ5200E超声清洗仪 昆山舒美公司。
1.3 方法
上述4 组果实样品中,设置CKN_vs_CKW、CKN_vs_GN、CKN_vs_GW、CKW_vs_GN、CKW_vs_GW、GN_vs_GW 6个不同的对比组筛选花青素差异代谢物。
1.3.1 果实品质指标分析
取10个大小均匀的果实,单果质量使用电子天平测定;可溶性固形物含量用手持糖度折光仪测定;可滴定酸含量采用酸碱滴定法测定;固酸比计算得出;总花青素含量采用试剂盒(苏州格锐思生物科技有限公司)测定。
1.3.2 样品前处理
将血橙于液氮条件下剥离的汁胞进行真空冷冻干燥,总量约为50 g;球磨仪(30 Hz,1.5 min)研磨至粉末状;称取50 mg粉末,溶解于500 μL提取液(50%甲醇溶液,含0.1%盐酸),涡旋5 min,4 ℃、40 kHz超声5 min,离心(12 000 r/min,3 min),吸取上清液,重复操作1次;将2次上清液合并,用0.22 μm微孔滤膜过滤样品,并保存于进样瓶中,用于LC-MS/MS分析。
1.3.3 色谱条件
ACQUITY BEH C18(2.1 mm×100 mm,1.7 μm);流动相:A为超纯水(含0.1%甲酸),B为甲醇(含0.1%甲酸);洗脱梯度:0.0~6.0 min,95%~50% A,5%~50% B;6.0~12.0 min,50%~5% A,50%~95%B;12.0~14.0 min,5% A、95% B;14.0~16.0 min,95%A、5% B;流速0.35 mL/min;柱温40 ℃;进样量2 μL。
1.3.4 质谱条件
电喷雾离子源;温度550 ℃;正离子模式下质谱电压5 500 V;气帘气压力35 psi。在LC-MS/MS联用仪中,每个离子对是根据优化的去簇电压和碰撞能进行扫描检测。
1.3.5 标准曲线的绘制及样本含量
配制0.01、0.02、0.05、0.1、0.5、1、5、10、50、100、500、1 000、2 000、5 000 ng/mL不同质量浓度的标准品溶液,获取各个质量浓度标准品的对应定量信号的质谱峰强度数据;以标准品质量浓度为横坐标,峰面积为纵坐标,绘制不同物质的标注曲线,相关系数R大于0.99。样本中代谢物的含量按下式计算:
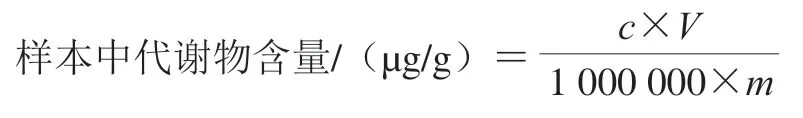
式中:c为样本中色谱峰的峰面积代入标准曲线得到的质量浓度/(ng/mL);V为提取时所用溶液的体积/μL;m为称取的样本质量/g。
1.3.6 差异代谢物的筛选
项目计算差异倍数(fold change,FC),其表示两对比组间表达量的比值,选取FC不小于2和FC不大于0.5的代谢物为最终差异代谢物。
1.4 数据处理
基于标准品构建MWDB(Metware Database)数据库,对质谱数据进行定性分析;利用三重四极杆质谱的多反应监测模式完成定量分析。获得样本的质谱分析数据后,对所有物质的色谱峰进行积分,并对每种物质在不同样本的质谱峰进行校正。利用Analyst 1.6.3处理质谱数据。并对样本质控分析,检测总离子流图重叠性,以此判断项目检测期间仪器的稳定性。代谢组数据由武汉迈维代谢公司进行分析。
2 结果与分析
2.1 果实基础品质分析及着色表现
由图1可见,‘塔罗科’血橙优系果肉着色明显优于对照组。品质分析数据见表1,‘塔罗科’血橙优系果实总花青素与可溶性固形物含量优势显著。其中,GW组花青素质量浓度最高(52.34 mg/L),GN组质量浓度次之(46.81 mg/L),CKN组花青素质量浓度最低(11.37 mg/L),GW组/CKW组、GW组/CKN组花青素含量比值分别约为2.07和4.60,而GW组/GN组比值约为1.12,表明‘塔罗科’血橙优系树冠外围和内膛果实中花青素含量均显著高于对照,且优系外部和内膛之间差异较小;可溶性固形物含量GW组(14.1%)和GN组(13.4%)显著高于CKW组和CKN组,优系和对照品种树冠外围果实的可溶性固形物含量均高于内膛,GW组果实的可滴定酸含量稍高于GN以及对照组,与对照品种相比,优系外围与内膛果实的固酸比值接近。综上,‘塔罗科’血橙优系果实关键品质性状优良,且树冠内外果实可溶性固形物、花青素含量高且差异较小。
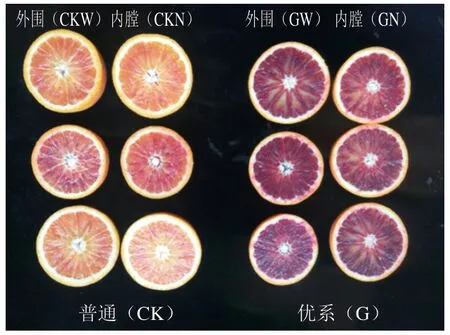
图1 ‘塔罗科’血橙优系与对照品种果实着色情况Fig. 1 Flesh color of the superior strain common ‘Tarocco’ blood orange

表1 果实品质指标测定结果Table 1 Fruit quality indexes of the superior strain common ‘Tarocco’blood orange
2.2 花青素定量定性分析


图2 样本总离子流色谱图(A)、提取离子流色谱图(B)、样本总离子流色谱重叠图(C)Fig. 2 Total ion current chromatogram (A), extracted icon chromatogram (B), and overlapped total ion current chromatograms (C)of anthocyanidins
如图2所示,样本质控总离子流色谱图重叠性高,保留时间和峰强度均一致,表明检测期间此仪器稳定,数据可信。
由表2可以看出,本实验检出的花青素代谢物分为矢车菊素(9种)、飞燕草素(6种)、芍药花素(6种)、天竺葵素(3种)、矮牵牛素(3种)、锦葵素(2种)以及花青素合成前体物质黄酮(4种)7个类别。‘塔罗科’血橙优系共检测出33种花青素代谢物,GN组和GW组数量一致;而对照品种‘塔罗科’血橙外围和内膛果检测出的花青素代谢物数量不一,CKW组和CKN组分别检测出30种和27种,外围果实检出数量多于内膛。4 组果实共同存在的花青素代谢物为27种,相比对照品种‘塔罗科’血橙,芍药花素-3-O-半乳糖苷、锦葵色素-3-O-丙二酰葡萄糖苷和柚皮素为GN和GW组特有的种类;4 组果实中主要花青素代谢物均为矢车菊素-3-O-丙二酰葡萄糖苷和矢车菊素-3-O-葡萄糖苷,两者为血橙果肉呈色和色泽深浅的关键因子,在GN、GW、CKN和CKW组中含量分别为22.40(42.30%)、27.60(41.00%)、6.10(39.50%)、13.10 μg/g(41.00%)和21.50(40.60%)、27.90(41.40%)、5.68(36.80%)、13.00 μg/g(40.60%),矢车菊素类花青素总量在GN、GW、CKN和CKW组中分别为48.68(91.90%)、62.16(92.28%)、12.79(82.89%)、28.16 μg/g(88.03%),‘塔罗科’血橙优系果实中矢车菊素类花青素绝对含量和占比均显著高于对照品种,飞燕草素、芍药花素以及黄酮类代谢物绝对含量也高于对照品种,但占比低于对照品种。GN和GW组矢车菊素、飞燕草素、芍药花素以及黄酮4 类代谢物占各自花青素总量的百分比相近。花青素绝对定量结果显示,GW和GN组的花青素代谢物含量均显著高于CKW和CKN组,GW组花青素代谢物含量最高,约67.37 μg/g,为CKN组的4.37 倍,GN组次之,CKW组约为CKN组的2.07 倍,与总花青素测定结果吻合。
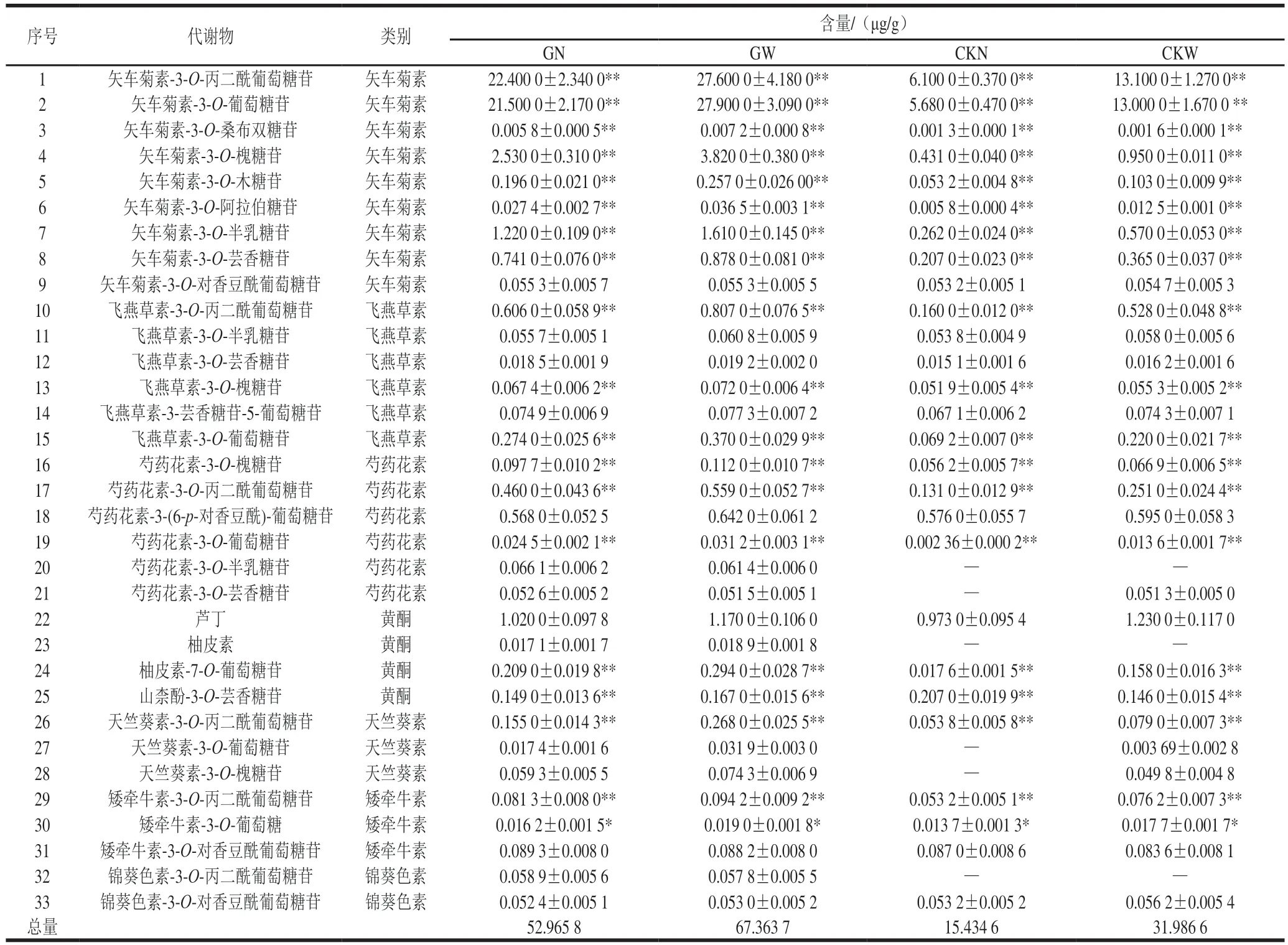
表2 绝对定量结果Table 2 Anthocyanidin metabolite contents in blood organge
2.3 聚类分析
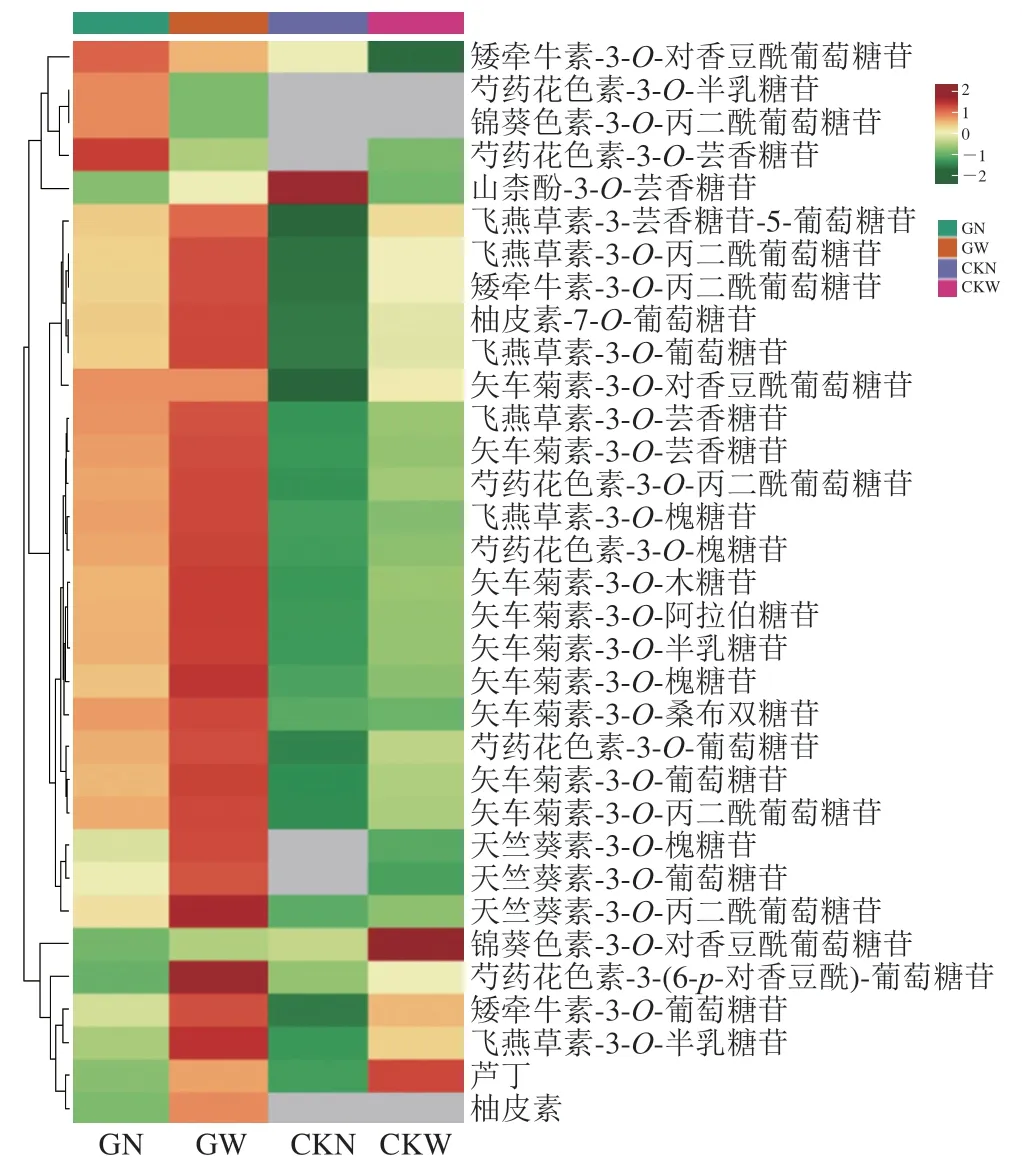
图3 聚类热图分析Fig. 3 Heatmap of cluster analysis
采用极差法对代谢物含量数据进行归一化处理,通过R语言对4 组果实花青素代谢物进行聚类热图分析。如图3所示,颜色越红表示含量越高,各组间差异明显。GW组整体以红色为主,矢车菊素、飞燕草素、芍药花素、天竺葵素、矮牵牛素、锦葵素等花青素含量较高;而CKN组偏向于绿色,总体含量较低,上述结果表明‘塔罗科’血橙优系花青素含量较对照品种高,与果实品质分析结果一致。然而,并非检测出的所有物质均以GW组含量最高,如CKN组山柰酚-3-O-芸香糖苷含量最高,CKW组最低;GN组芍药花色素-3-O-芸香糖苷、矮牵牛素-3-O-对香豆酰葡萄糖苷含量最高,CKN组未检出;芦丁、锦葵色素-3-O-对香豆酰葡萄糖苷在CKW组含量最高,GN组最低。
2.4 差异代谢物筛选
如表3所示,CKN_vs_GN和CKN_vs_GW对比组的差异代谢物最多,同为14种,且差异代谢物的种类相同,分属矢车菊素、飞燕草素、芍药花色素、天竺葵素和黄酮5 类物质;CKW_vs_GN对比组中差异代谢物为6种,分属矢车菊素和天竺葵素2 类物质;CKW_vs_GW对比组差异代谢物为12种,分属矢车菊素和芍药花色素2 类物质;CKN_vs_CKW对比组差异代谢物为9种,分属矢车菊素、飞燕草素、芍药花色素和黄酮4 类物质;GN_vs_GW对比组中无差异代谢物。上述结果表明该‘塔罗科’血橙优系中花青素的合成可能不受空间的影响。此外,除GN_vs_GW对比组外,其余对比组差异代谢物均上调。

表3 差异代谢物统计数目Table 3 Statistics of differential metabolites between different groups
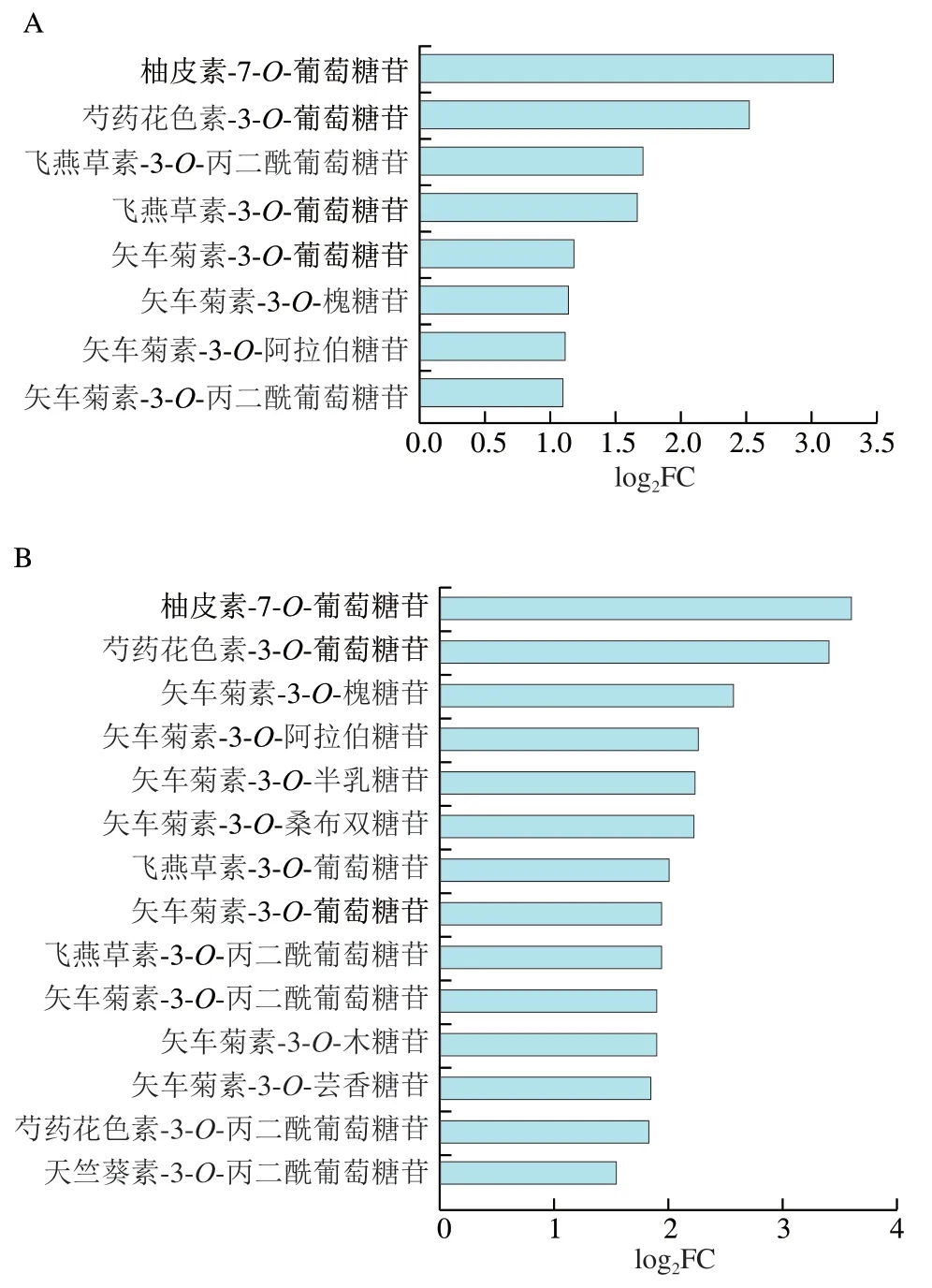
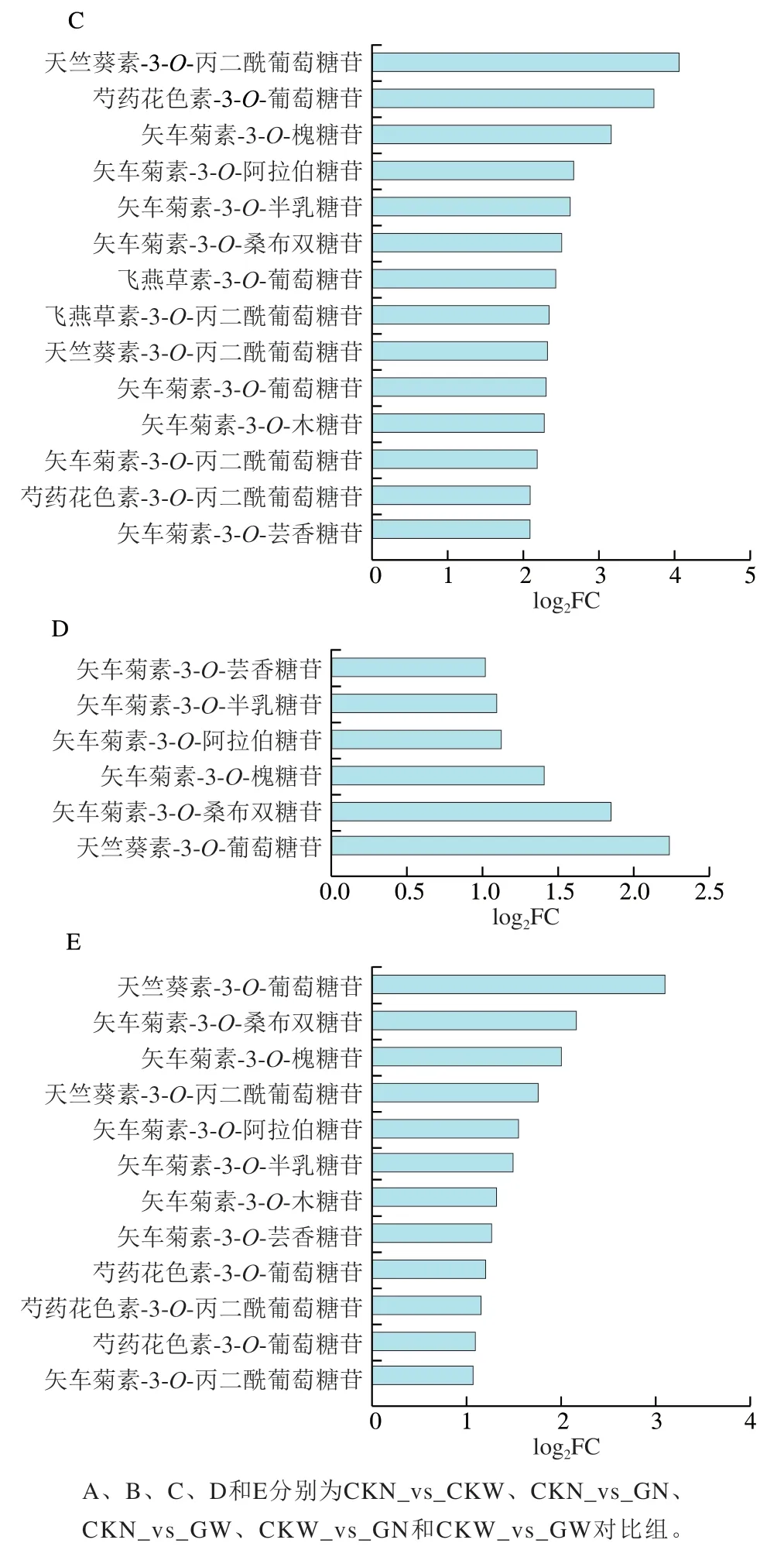
图4 不同对比组差异代谢物差异倍数条形图Fig. 4 Fold changes of differential metabolites between different groups
如图4所示,除GN_vs_GW组外,其他对比组差异代谢物均上调。CKN_vs_CKW对比组中,柚皮素-7-O-葡萄糖苷和芍药花素-3-O-葡萄糖苷上调明显,差异倍数为8.98和5.76(图4A)。CKN_vs_GN和CKN_vs_GW两个对比组中,上述2种物质也均上调,FC分别为11.88、10.38和16.70、13.22(图4B、C)。CKW_vs_GN和CKW_vs_GW对比组中,上调倍数前两位的物质为芍药花素-3-O-葡萄糖苷和矢车菊素-3-O-桑布双糖苷,上调倍数分别为4.72、3.60和8.65、4.46(图4D、E)。
进一步将6个对比组进行组间共有和特有的差异代谢物信息分析,见图5。CKN_vs_GN和CKW_vs_GW对比组共有矢车菊素、芍药花素、天竺葵素类差异代谢物11种,其中矢车菊素有8种(图5A);CKN_vs_GW和CKW_vs_GN对比组共有差异代谢物5种,均为矢车菊素类(图5B);CKN_vs_CKW和GN_vs_GW对比组没有交集(图5C)。以上结果说明了矢车菊素是‘塔罗科’血橙优系与对照‘塔罗科’血橙果肉呈色的花青素主要差异代谢物质基础,同时也表明了2个品种花青素的积累特性存在明显差异。

图5 不同对比组共有差异代谢物Venn图Fig. 5 Venn charts showing shared differential metabolites between different groups
2.5 KEGG通路分析
差异代谢物在生物体内相互作用,形成不同的通路。利用KEGG数据库对不同对比组的差异代谢物进行注释,CKN_vs_CKW、CKN_vs_GN、CKN_vs_GW对比组中在花青素合成途径中分别被注释6、9、9种物质,占比为85.71%、90%、90%(图6A、B);CKW_vs_GN在植物代谢、次生生物代谢及花青素合成途径注释的代谢物数目分别为1、1、4,所占比例为20%、20%、80%;CKW_vs_GW对比组中上述3 条途径注释数目为1、1、8,所占比例为11.11%、11.11%和88.89%(图6C、D)。

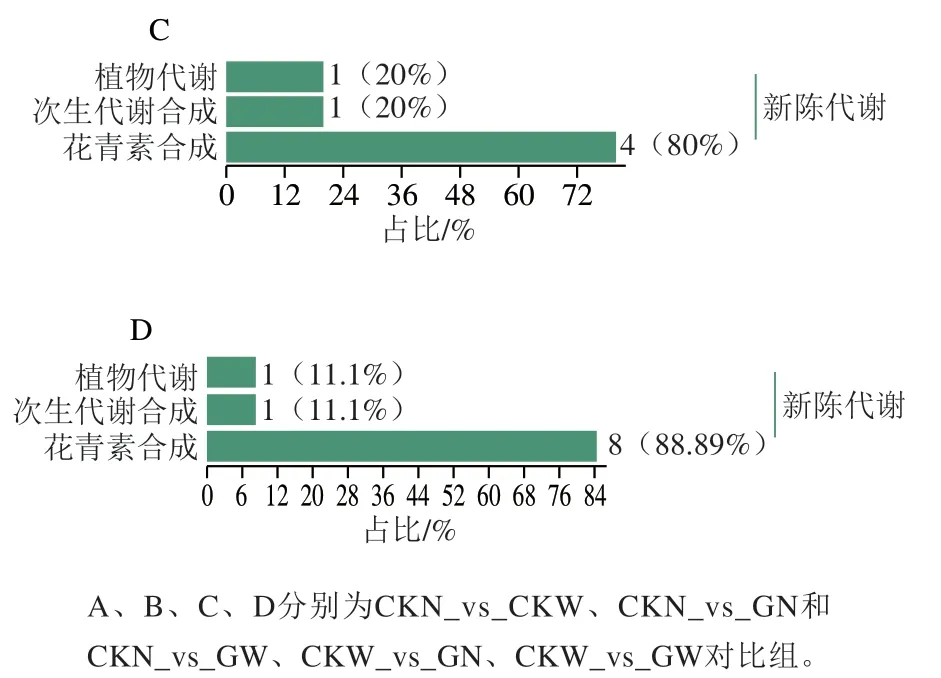
图6 不同对比组差异代谢物KEGG分类图Fig. 6 KEGG classification of differential metabolites between different groups
不同对比组筛选的差异代谢物映射到3 条通路:ko00942花青素合成、ko01100植物代谢和ko01110次生代谢合成。代谢通路共映射14种物质,分别为矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-丙二酰葡萄糖苷、矢车菊素-3-O-槐糖苷、矢车菊素-3-O-桑布双糖苷、矢车菊素-3-O-芸香糖苷、矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-阿拉伯糖苷、矢车菊素-3-O-木糖苷、天竺葵素-3-O-丙二酰葡萄糖苷、飞燕草素-3-O-葡萄糖苷、飞燕草素-3-O-丙二酰葡萄糖苷、天竺葵素-3-O-葡萄糖苷、天竺葵素-3-O-丙二酰葡萄糖苷和芍药花素-3-O-葡萄糖苷。其中ko00942通路的差异代谢物最多,共有14种物质,天竺葵素-3-O-葡萄糖苷参与了3 条代谢通路。
3 讨 论
血橙作为柑橘类唯一含花青素的品种,具有较高的营养与保健价值,已成为育种者关注的热点品种之一。花青素由于其自然界来源广、生理功能丰富和抗病机理独特的特性,具有很高的研究价值[6,22]。比如矢车菊素-3-葡萄糖苷,是自然界最常见的花色苷,进入体内后较容易被吸收,其降解代谢产物多达41种,可减少体内炎性物质的产生,降低心血管疾病等慢性疾病的风险[23]。此外,花青素还可应用于食品、药品和化妆品等行业,花青素在抗癌和抗氧化[22]、抗炎和抗肥胖[24]、治疗青光眼和保护视力[25]等方面也具有作用,深受医药工作者青睐。马越等[26]发现由黑加仑浓缩汁、苹果浓缩汁调配而成的花青素饮料,可有效缓解视疲劳。
已有研究表明低温易促进花青素苷的合成,高温加速花青素苷的分解[27]。黄冬华等[28]发现适宜低温刺激可促进富贵籽果实的着色,方鹏[29]研究发现‘红阳’猕猴桃在高温胁迫下花青素易降解,果实难以着色。血橙是以冷诱导的方式在果肉中积累花青素,其果皮在充足的光照条件下也能积累花青素。血橙Ruby1启动子是花青素合成的关键激活子,同时与光和低温诱导相关,CsRuby1启动子中的反转座子LTR区在低温诱导血橙果实花青素积累的过程中发挥核心调控作用[13]。短时低温刺激也能促进血橙采后贮藏期间花青素合成通路相关基因CHS、DFR、ANS、UFGT、GST的表达上调,增强花青素的合成[30]。相较树体外围而言,内膛的温度较高且变化幅度较小。本实验中对照品种‘塔罗科’血橙内膛(11.37 mg/L)和外围(25.21mg/L)果实总花青素含量差异显著,其受到温度的影响较大,而‘塔罗科’血橙优系的可溶性固形物和总花青素含量明显高于对照品种,其外围(52.34 mg/L)与内膛(46.81 mg/L)果实的花青素含量接近,且内外果实中矢车菊素、飞燕草素、芍药花素以及黄酮4 类代谢物占各自花青素总量的比例相当,与对照品种也有明显差异,充分展现了‘塔罗科’血橙优系果实花青素积累的独特性,推测其果实中花青素合成对于低温的响应机制可能不同于对照品种。
通过测定分析结果表明,本实验中‘塔罗科’血橙优系和对照品种果实花青素组分主要为矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-丙二酰葡萄糖苷,与前人研究结果一致[15-16]。相比对照,‘塔罗科’血橙优系果实中矢车菊素类物质绝对含量和总花青素占比均显著提高,其内膛和外围果实矢车菊素类花青素总量为48.68 μg/g(91.90%)和62.16 μg/g(92.28%)。在优系中矢车菊素-3-O-丙二酰葡萄糖苷与矢车菊素-3-O-葡萄糖苷含量比值接近1,而在对照品种中,内膛果矢车菊素-3-O-丙二酰葡萄糖苷含量约为矢车菊素-3-O-葡萄糖苷的1.07 倍,外围果实比值约为1;而在‘桑吉耐洛’、‘T. Ippolito’和‘T. Rosso’血橙上研究发现矢车菊素-3-O-丙二酰葡萄糖苷含量约为矢车菊素-3-O-葡萄糖苷的1.09~1.75 倍[17],曹少谦[18]则发现‘塔罗科’血橙上发现上述2种矢车菊素类物质含量比值约为0.82,与本实验2个品种的结果有差异,这可能与品种特性或是栽培条件差异紧密相关。‘塔罗科’血橙优系树体内膛和外围果实无差异代谢物,对照品种内膛和外围果实中有9种差异代谢物且均为上调代谢物,上述结果表明该‘塔罗科’血橙优系中花青素的合成可能不受果实在树体中着生方位的影响。芍药花素-3-O-半乳糖苷、柚皮素、锦葵色素-3-O-丙二酰葡萄糖苷3种物质是优系较对照品种特有的花青素相关代谢物质。值得关注的是,本实验中在对照品种中内膛与外围果实花青素合成前体物质黄酮在总花青素含量中的比例(分别为7.76%和4.80%)明显高于优系品种,推测相比对照品种,优系花青素合成通路的结构基因表达水平更高,其下游合成转化能力更强。此外优系中还特有的芍药花色素、锦葵色素,这可能是优系果肉呈现更深紫红色的原因。
根据KEGG通路结果显示,不同对比组筛选的差异代谢物参与植物代谢、次生代谢、花青素合成3 条途径,共14种差异代谢物,主要分为矢车菊素、飞燕草素、芍药花素和天竺葵素类物质。本实验发现天竺葵素-3-O-葡萄糖苷参与到三条代谢通路中,但该物质含量甚少。先前研究表明天竺葵素-3-O-葡萄糖苷为草莓中主要的色素,可依据该物质的有无,对草莓进行分类[31]。此外,天竺葵素-3-O-葡萄糖苷还可影响金花茶组植物花色的鲜艳程度[32]。目前该物质在柑橘中尚未发现相关的细致研究。植物代谢途径网络交错复杂,不同对比组所筛选的差异代谢物在代谢途径扮演的角色还需进一步深入研究。
4 结 论
利用LC-MS/MS技术共检测出‘塔罗科’血橙优系及对照品种果实花青素代谢物共33种,主要成分均为矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-丙二酰葡萄糖苷。‘塔罗科’血橙优系较普通品种花青素含量高且代谢物种类多,优系的内膛和外围果实分别检测出33种花青素代谢物,且二者无差异代谢物,上述结果表明该‘塔罗科’血橙优系中花青素的合成可能不受空间的影响;而对照品种‘塔罗科’血橙内膛和外围果实花青素代谢物分别检测出27种和30种,差异代谢物达9种且均为上调代谢物。相比对照,‘塔罗科’血橙优系具有花青素和可溶性固形物含量高、内外膛着色差异小的显著优势,该品种花青素的合成机制及开发利用仍有待后续深入研究。
