超高效液相色谱-质谱联用分析茶叶中酚酸类化合物的组成及分布
2022-12-22刘碧琴刘少明高晨生
刘碧琴,傅 红,杨 方,刘少明,高晨生,陈 珊
(1.福州大学生物科学与工程学院,福建 福州 350108;2.福州海关技术中心,福建 福州 350001;3.福建满堂香茶叶股份有限公司,福建 福州 350001)
酚酸及缩酚酸是茶叶多酚类物质中的一种[1],酚酸是指苯环上有多个酚羟基取代的芳香族羧酸类化合物,缩酚酸是由酚酸上的羧基与另一酚酸分子上的羟基缩合而成的化合物。酚酸广泛存在于水果、蔬菜、粮食等植物中,目前已从植物中分离出多种酚酸类化合物,主要包括没食子酸类、茶多酚类、间苯三酚类、绿原酸及奎宁酸类衍生物、聚黄烷醇多酚及苯丙素类化合物等[2]。近年来,大量研究表明酚酸类化合物具有抗氧化、抗癌、抗炎、抗菌等生理活性作用,对防御紫外线辐射和降低多种疾病的发生等效果显著[3-5]。
酚酸类化合物在包括茶叶在内的各类植物中发挥重要的生理活性作用[6-8],酚酸类化合物本身存在形式复杂,在茶叶等植物中少量以游离型酚酸存在,主要是以酯键、糖苷键、醚键与其他物质(纤维素、蛋白质、黄酮、单糖、有机酸等)结合的形式存在,包括游离酯型、结合型和糖苷型酚酸等[9-10]。由于酚酸结构中有较多的酚羟基取代,结构并不稳定,容易受到水分、温度、光、酶等自然因素的影响而改变,给分析带来一定困难。
目前,酚酸类化合物的分析方法主要有分光光度法[11-12]、液相色谱法[13-15]、超高效液相色谱-质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)联用法[16-18]等。采用UPLC-MS/MS的多重反应监测(multiple reaction monitoring,MRM)模式进行定性定量分析,更适用于多种酚酸类化合物的分离和测定。赵珊等[17]在分析游离型、游离酯型和结合型酚酸的基础上加入糖苷型酚酸的分析,建立了UPLC-MS/MS测定稻米中19种酚酸类化合物的分析方法,该方法分析时间短、灵敏度高且重复性好;马帅等[18]利用UPLC-MS/MS法测定了花椰菜和西兰花中23种酚酸类化合物,该方法简便、快速。目前稻米、蔬菜等基质中酚酸类化合物的测定[17-20]方法相对完善,但关于茶叶中酚酸类化合物测定的报道较少,且涉及的酚酸种类和形态均较为单一,主要集中在游离型酚酸测定方法的开发[21-23],鲜见报道茶叶中结合型酚酸的分析方法。为了更全面、深入地了解酚酸类化合物在茶叶中的组成类型、分布和含量,本实验在前人研究[17-21,23-25]基础上,对茶叶中游离型、游离酯型、结合型、可溶性和不溶性糖苷型酚酸的前处理及仪器条件进行优化比较,开发建立方便、快捷的UPLC-MS/MS联用的痕量分析检测方法,为快速全面富集、检测茶叶中酚酸类化合物提供一种新的思路,同时为其他植物中该类化合物的测定提供参考。
1 材料与方法
1.1 材料与试剂
没食子酸(gallic acid,GA)、绿原酸(chlorogenic acid,CGA)、水杨酸(salicylic acid,OHBA)(纯度>96%) 德国Dr. Ehrenstorfer公司;咖啡酸(caffeic acid,CFA)、对羟基苯甲酸(p-hydroxybenzoic acid,PHBA)、对香豆酸(p-coumaric acid,PCMA)、鞣花酸(ellagic acid,EGA)、阿魏酸(ferulic acid,FRA)、丁香酸(syringic acid,SRA)、新绿原酸(neochlorogenic acid,NCGA)、香草酸(vanillic acid,VNA)、3-羟基肉桂酸(trans-m-coumaric acid,TMCMA)、2-羟基肉桂酸(trans-o-coumaric acid,TOCMA)、异阿魏酸(isoferulic acid,IFRA)、反式肉桂酸(trans-cinnamic acid,TCNA)(EGA纯度>89%,其他酚酸纯度>98%) 北京曼哈格生物科技有限公司;原儿茶酸(protocatechuic acid,PCA)、2,3-二羟基苯甲酸(2,3-dihydroxybenzoic acid,2,3-diHBA)(纯度>97%) 美国ChromaDex公司;芥子酸(sinapic acid,SNA)、龙胆酸(gentisic acid,GTA)、3,5-二羟基苯甲酸(3,5-dihydroxybenzoic acid,3,5-diHBA)、奎宁酸(quinic acid,QNA)(纯度>98%) 加拿大Toronto Research Chemicals公司;香豆酸(coumaric acid,CMA)、2,3,4-三羟基苯甲酸(2,3,4-trihydroxybenzoic acid,2,3,4-triHBA)(纯度>97%) 日本TCI公司;乙腈、甲醇(均为色谱纯)美国Fisher Scientific公司;甲酸(优级纯) 美国Merck公司;乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、丁基羟基茴香醚(butyl hydroxy anisd,BHA)(均为分析纯) 上海麦克林生化科技有限公司;Oasis HLB固相萃取柱(60 mg/3 mL) 美国Waters公司。
1.2 仪器与设备
Nexera X2 LC-30A超高效液相色谱仪 日本岛津公司;3200 QTRAP质谱仪、Analyst Software 1.5工作软件 美国AB SCIEX公司;SBHCONC/1氮吹仪英国Stuart公司;低温高速离心机 美国Beckman Coulter公司。
1.3 方法
1.3.1 游离型及游离酯型酚酸的提取
称取约0.5 g样品于10 mL离心管中,加入5 mL 70%甲醇溶液,40 ℃超声提取30 min,10 000 r/min离心5 min后将上清液转移至50 mL容量瓶中,重复上述提取步骤,合并上清液,用体积分数0.28%甲酸溶液(pH 2)定容至50 mL得到游离型酚酸提取液,净化后测定游离型酚酸;取上述收集的上清液,40 ℃氮吹至约2 mL,加入2 mL 4 mol/L NaOH溶液(含1 g/100 mL抗坏血酸和10 mmol/L EDTA),充入氮气于40 ℃振荡避光水解4 h,以4 mol/L HCl溶液调节pH值至2,3×2 mL乙酸乙酯(含1 g/500 mL BHA)涡旋萃取,合并萃取液于40 ℃氮吹近干,以5 mL 50%甲醇溶液复溶,取1 mL复溶液加入4 mL体积分数0.28%甲酸溶液得到游离酯型酚酸提取液,净化后测定游离酯型酚酸。
1.3.2 结合型酚酸的提取
取1.3.1节离心后残渣加入3 mL水和3 mL 4 mol/L NaOH溶液(含1 g/100 mL抗坏血酸和10 mmol/L EDTA),充氮于40 ℃振荡避光水解4 h,以4 mol/L HCl溶液调节pH值至2,以3×2 mL乙酸乙酯(含1 g/500 mL BHA)涡旋萃取,合并萃取液于40 ℃氮吹近干,以5 mL 50%甲醇溶液复溶,取1 mL复溶液加入4 mL体积分数0.28%甲酸溶液,待净化。
1.3.3 可溶性糖苷型酚酸的提取
于1.3.1节游离酯型酚酸提取液中加入1.5 mL 4 mol/L HCl溶液,85 ℃水浴水解1 h,以4 mol/L NaOH溶液调节pH值至2,3×2 mL乙酸乙酯(含1 g/500 mL BHA)涡旋萃取,合并萃取液于40 ℃氮吹近干,以5 mL 50%甲醇溶液复溶,取1 mL复溶液加入4mL体积分数0.28%甲酸溶液,待净化。
1.3.4 不溶性糖苷型酚酸的提取
于1.3.2节提取液中加入1.5 mL 4 mol/L HCl溶液,85 ℃水浴水解1 h,以4 mol/L NaOH溶液调节pH值至2,用3×2 mL乙酸乙酯(含1 g/500 mL BHA)涡旋萃取,合并萃取液于40 ℃氮吹近干,以5 mL 50%甲醇溶液复溶,取1 mL复溶液加入4 mL体积分数0.28%甲酸溶液,待净化。
茶叶样品中不同形态酚酸提取流程图见图1。

图1 茶叶样品中不同类型酚酸提取流程图Fig. 1 Flow chart for the extraction of different types of phenolic acid from tea samples
1.3.5 净化
HLB SPE净化[26]:先后以3 mL甲醇、3 mL体积分数0.28%甲酸溶液(pH 2)活化小柱,取1 mL样液过柱,6 mL甲醇洗脱,洗脱液氮吹至近干后用1 mL 50%甲醇溶液复溶,过0.22 μm滤膜,待测。
MAX SPE净化[27]:先后以3 mL甲醇、3 mL去离子水和3 mL体积分数5%氨水活化小柱,取1 mL样液过柱,6 mL 5%甲酸-甲醇溶液洗脱,洗脱液氮吹至近干后用1 mL 50%甲醇溶液复溶,过0.22 μm滤膜,待测。
1.3.6 UPLC-MS/MS分析条件
1.3.6.1 UPLC条件
Torus 1-AA色谱柱(100 mm×3.0 mm,1.7 μm);柱温40 ℃;进样量5 μL;流动相:A为乙腈,B为0.02%甲酸溶液;流速0.5 mL/min;梯度洗脱程序:0~1.0 min,10% A、90% B;1.0~1.5 min,10%~15% A、90%~85% B;1.5~3.5 min,15%~25% A、85%~75% B;3.5~4.0 min,25%~28% A、75%~72% B;4.0~5.0 min,28%~30% A、72%~70% B;5.0~5.5 min,30%~90% A、70%~10% B;5.5~7.5 min,90% A、10% B;7.5~8.0 min,90%~10% A、10%~90% B;8.0~12.0 min,10% A、90% B。
1.3.6.2 MS条件
电喷雾离子源;MRM模式;扫描模式:TCNA为正离子模式,其他酚酸为负离子模式;雾化电压4 500 V;离子化温度400 ℃;雾化气压力345 kPa;辅助气压力345 kPa;碰撞气为Medium;气帘气压力207 kPa;具体参数见表1。
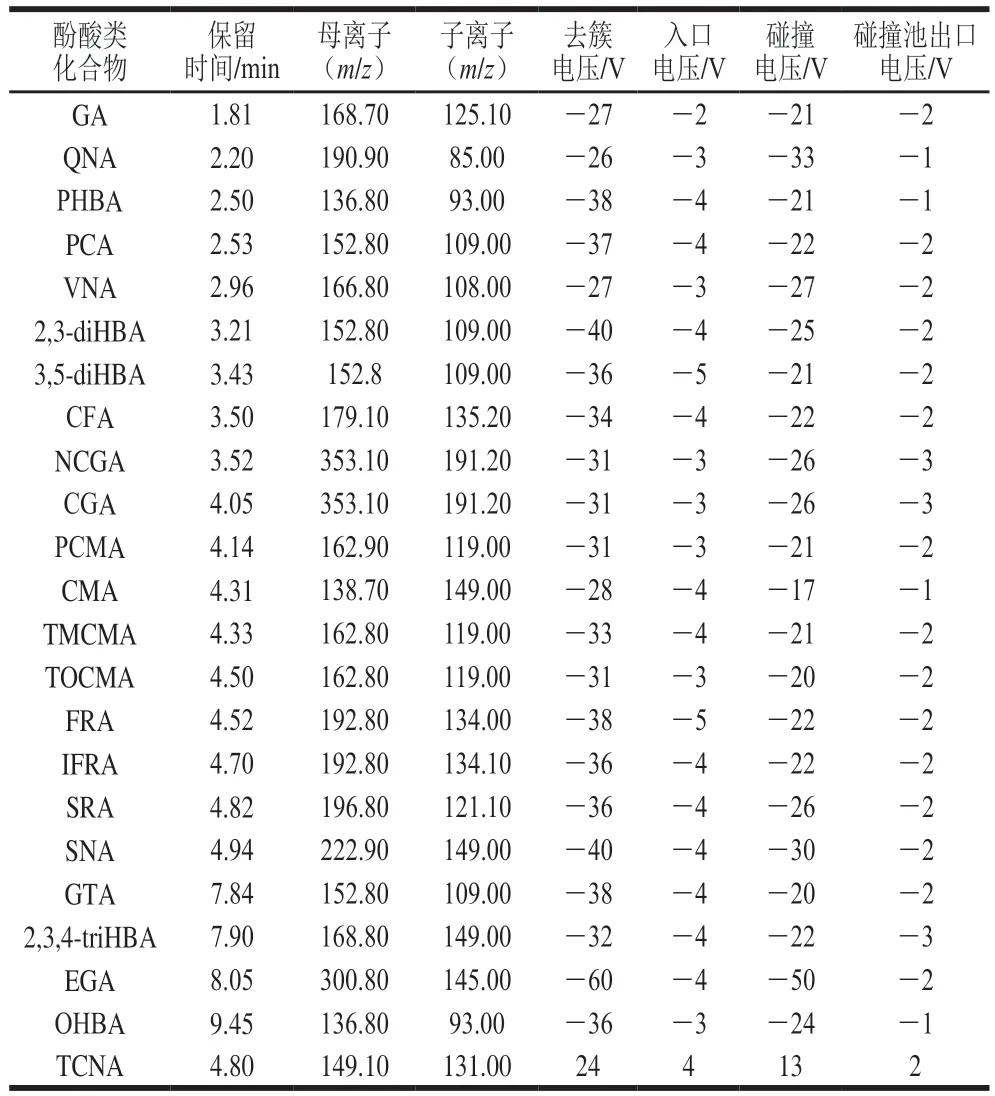
表1 酚酸类化合物的质谱分析参数Table 1 Mass spectrometric parameters for phenolic acid compounds
2 结果与分析
2.1 UPLC-MS/MS分析条件
采用UPLC-MS/MS的MRM模式进行定性定量分析,比较C18色谱柱、HHS T3色谱柱、Torus 1-AA色谱柱对23种酚酸的分离效果及峰形的影响,结果表明Torus 1-AA色谱柱可实现23种酚酸的分离,且峰形优于前两者。文献[17]报道流动相中添加少量甲酸可改善峰形,提高分离效果。本实验比较在水相中添加体积分数0.01%、0.02%、0.05%和0.1%甲酸对酚酸化合物分离效果的影响,结果表明若水相中甲酸含量过高(当增至0.05%时),PCA和3,5-diHBA、PCMA和TMCMA分离效果不佳,甲酸过低(0.01%)则效果不明显。最终采用乙腈-0.02%甲酸溶液作为流动相,可获得较好的分离效果,混合对照品中酚酸类化合物的总离子流色谱图见图2,样品中酚酸类化合的总离子流色谱图见图3。
取100 ng/mL 23种酚酸化合物标准溶液,分别在全扫描模式下进行质谱条件优化。结果除肉桂酸外,其余目标化合物在负离子模式下响应更高。通过子离子扫描得到目标物碎片离子信息,选择响应最强的产物离子作为23种酚酸化合物的定量离子和定性离子,并对去簇电压和碰撞能量等进行优化,结果见表1。

图2 23种酚酸类化合物标准品的总离子流色谱图Fig. 2 Total ion current chromatogram of mixture of 23 phenolic acid standards

图3 茶样中酚酸类化合物的总离子流色谱图Fig. 3 Total ion current chromatogram of phenolic acid compounds in tea samples
2.2 前处理条件的优化
2.2.1 游离型酚酸提取条件的优化
酚酸类化合物为极性化合物,易溶于水和甲醇[24],现有报道[17-20]采用甲醇-水溶液提取游离型酚酸。本实验比较去离子水、甲醇和不同比例的甲醇溶液(甲醇体积分数分别为50%、70%和90%)对茶叶中游离型酚酸提取效率的影响。结果表明,除GA外,甲醇溶液对大部分酚酸类化合物的提取效果优于纯水和纯甲醇,其中70%甲醇溶液的提取效率总体最佳(图4),因此最终选用70%甲醇溶液作为提取溶剂。
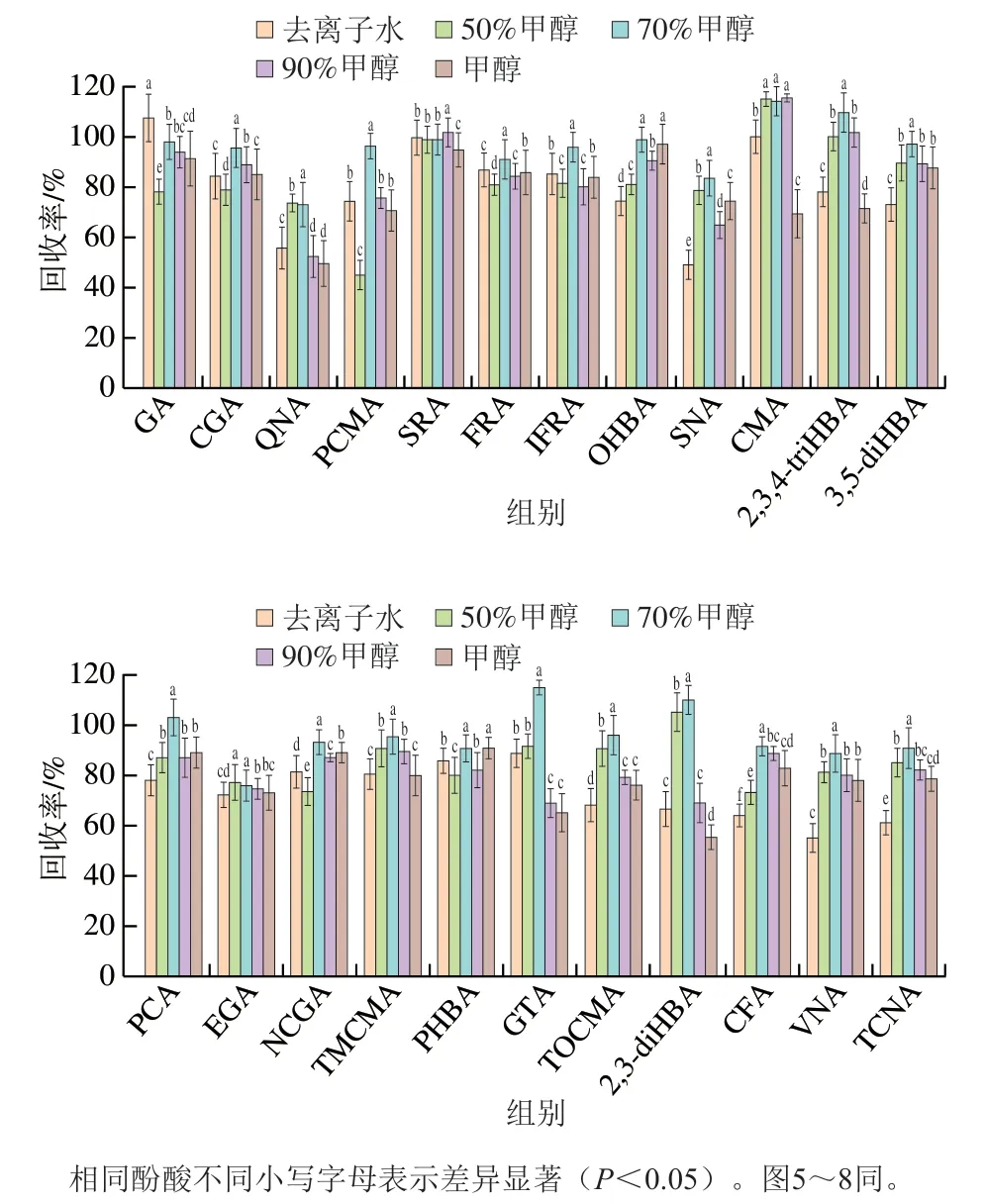
图4 提取溶剂对提取效率的影响Fig. 4 Effects of different solvents on the extraction efficiency
2.2.2 碱水解、酸水解条件的优化
2.2.2.1 碱水解对酚酸类化合物的提取效率
对游离型酚酸提取液及提取后的样品残渣分别进行碱水解,可分别释放茶叶基质中存在的游离酯型酚酸和结合型酚酸。以往研究表明[17,28],酚酸类化合物在碱水解过程中会产生不同程度的损失。通过对比不同碱水解条件,发现在未加保护剂的情况下,GA、2,3,4-triHBA、3,5-diHBA、PCA、CFA、2,3-diHBA和GTA等均发生一定程度的降解,回收率均低于51%;QNA、CMA、CGA和NCGA降解严重,均无法测定回收率(图中未显示)。尝试在碱水解过程中添加抗坏血酸和EDTA等保护剂,结果表明除严重降解的QNA、CGA、NCGA和CMA外,其余19种酚酸类化合物的回收率均有所提高,回收率提高至75.3%~108.9%(图5),可见加入一定的保护剂能有效防止部分酚酸类化合物的降解。研究报道[29-30]QNA和CMA在碱水解过程中极易发生氧化降解和热分解,CGA和NCGA在碱性条件下完全水解为QNA和CFA,因此上述4种酚酸类化合物即使在添加保护剂条件下水解,其降解现象并未得到改善。在此基础上,进一步比较碱水解浓度和时间对酚酸类化合物回收率的影响,经比较,在2 mol/L NaOH溶液中添加1 g/100 mL抗坏血酸和10 mmol/L EDTA、水解4 h的效果最佳。
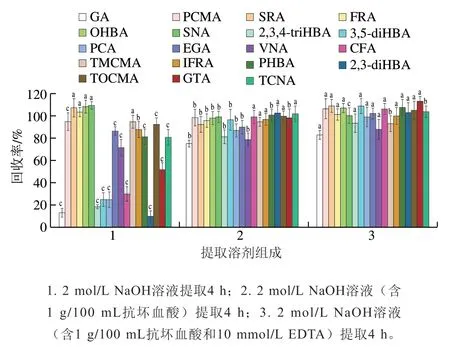
图5 碱水解溶液对酚酸类化合物提取效率的影响(n=3)Fig. 5 Effects of different alkaline solutions on the extraction efficiency of phenolic acids (n = 3)
2.2.2.2 酸水解对酚酸类化合物的提取效率
为释放茶叶基质中存在的可溶性和不溶性糖苷型酚酸,需在碱水解的基础上进一步酸水解。通过对比不同酸水解条件,发现在未添加保护剂的情况下,GA、PCMA、FRA、OHBA、EGA、CFA和TCNA等均发生降解,回收率均低于67%;QNA、CGA、NCGA和CMA等降解严重,均无法测得回收率,这一结果与Maria[28]和Mattila[31]等的研究一致。在酸水解过程中添加抗坏血酸和EDTA等保护剂,但酚酸类化合物的降解现象未能得到明显的改善(图6)。

图6 酸水解溶液对酚酸类化合物提取效率的影响(n=3)Fig. 6 Effects of different acid solutions on the extraction efficiency of phenolic acids (n = 3)
2.2.2.3 酸水解浓度和时间对酚酸类化合物的提取效率
通过对比不同酸水解条件,发现随着酸浓度的增加和水解时间的延长,除VNA和GTA外,其余酚酸类化合物降解越来越严重(图7),其原因在于酚酸类化合物在不同酸水解条件下的降解敏感性不同,较高的酸浓度和较长的水解时间均加重了酚酸类化合物的氧化降解[31];而较低酸浓度(低于0.5 mol/L)和较短的水解时间(小于0.5 h)均无法释放糖苷型酚酸,综合考虑酸水解条件选择1 mol/L HCl溶液水解1 h。
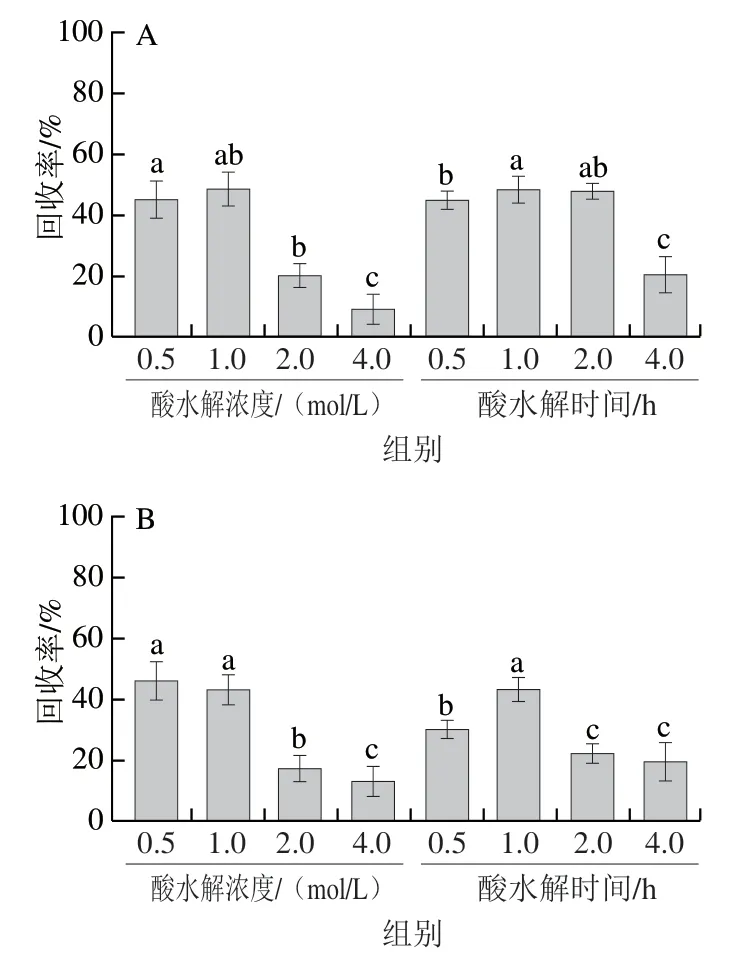
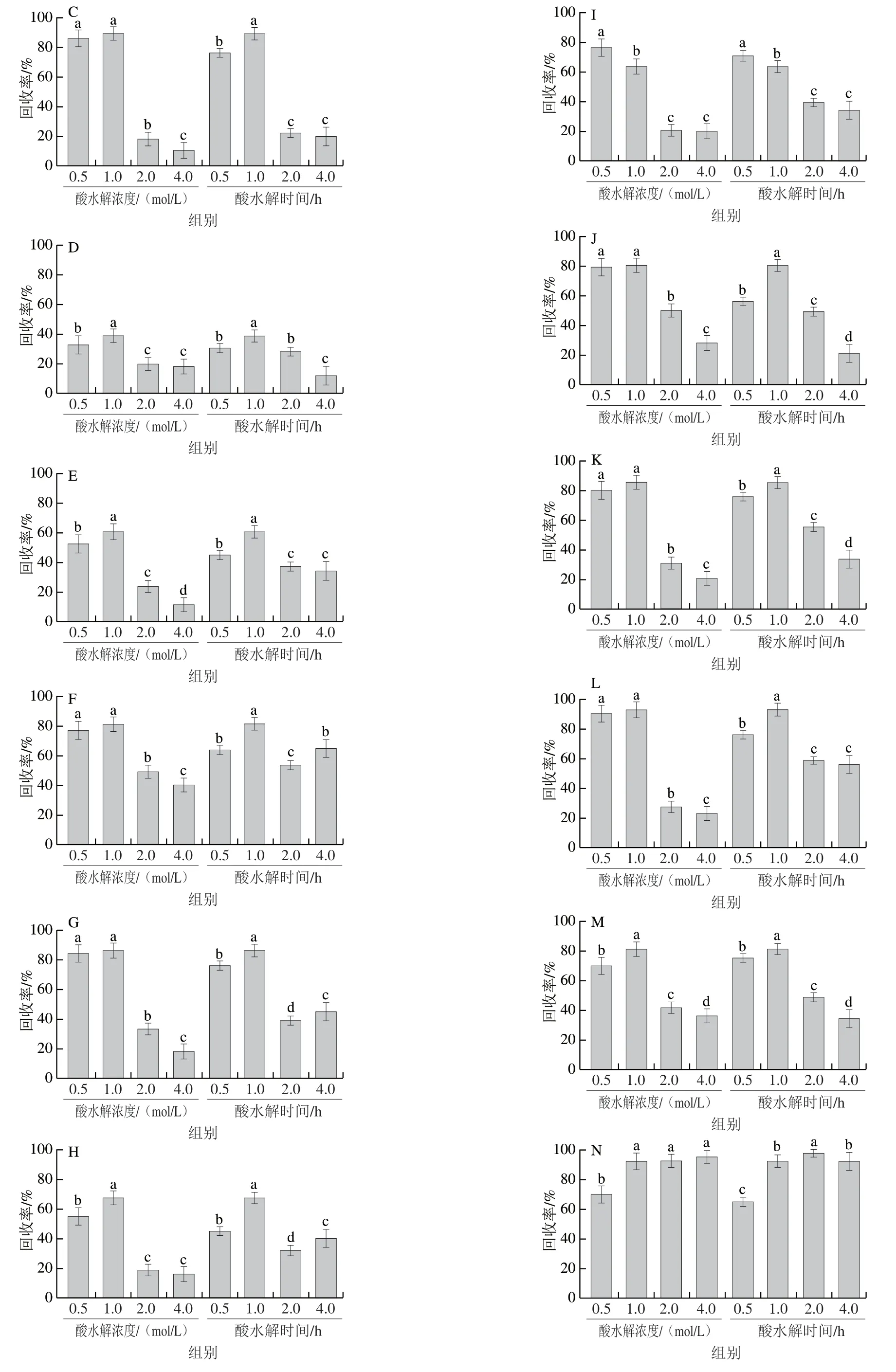

图7 酸水解浓度和酸水解时间对酚酸类化合物提取效率的影响(n=3)Fig. 7 Effects of different acid concentrations and hydrolysis times on the extraction efficiency of phenolic acids (n = 3)
2.2.3 净化方式的选择
茶叶样品基质较为复杂,前期实验结果表明,若将茶叶提取液直接上机分析,各化合物绝对基质效应[32]为44.1%~79.7%,存在明显基质抑制。比较HLB和MAX SPE柱的净化效果,结果表明,2种SPE柱均有较好的净化效果,净化后23种酚酸化合物的绝对基质效应分别为84.9%~108.2%和83.6%~110.8%,基质效应得到明显改善。鉴于MAX SPE柱在净化时需调节溶液pH值[27],操作相对繁琐,最终采用HLB SPE柱净化。
2.3 方法学考察
2.3.1 线性、检出限、定量限、精密度、稳定性结果
配制不同质量浓度梯度的酚酸标准溶液,按已建立的方法进样分析,以峰面积(y)对质量浓度(x)绘制标准曲线,计算标准曲线的回归方程和相关系数。结果表明,23种酚酸类化合物在50~1 000 μg/L范围内线性良好(r≥0.996 0),可以满足定量分析的要求。以3 倍信噪比计算检出限(limits of detection,LOD),质量浓度范围为0.03~8.34 μg/L;以10 倍信噪比计算定量限(limits of quantification,LOQ),质量浓度范围为0.10~25.00 μg/L,具体结果见表2。

表2 23种酚酸的线性方程、相关系数、LOD、LOQ、精密度和稳定性(n=6)Table 2 Linear equations, correlation coefficients, limits of detection,limits of quantification, precision and stability for 23 phenolic acids (n = 6)
取100 μg/L的混合标准溶液连续进样6次,计算23种目标成分峰面积的相对标准偏差(relative standard deviation,RSD),考察其精密度;取同一样品分析溶液,分别在0、2、4、8、12 h和24 h进样6次,测定目标化合物峰面积的RSD,考察其稳定性。结果见表2,23种酚酸类化合物精密度的RSD范围为0.50%~4.58%,稳定性的RSD范围为0.53%~8.84%,具有较高的精密度和较好的稳定性。
2.3.2 准确度结果
按照1.3.1节方法称取试样并进行样品制备,根据样液中酚酸质量浓度加入不同质量浓度的标准物质,进行茶叶中游离型酚酸的回收实验,结果见表3。茶叶样品中游离型酚酸的回收率为71.14%~105.43%,RSD为4.09%~7.25%。
取1.3.1节收集的上清液,根据样液中酚酸质量浓度加入不同质量浓度的标准物质,按照1.3.1节中游离酯型酚酸的提取方法进行样品制备,以及茶叶中游离酯型酚酸的回收实验;另取1.3.1节游离酯型酚酸提取液,根据样液中酚酸质量浓度加入不同质量浓度的标准物质,按照1.3.3节方法进行样品制备,以及茶叶中可溶性糖苷型酚酸的回收实验,结果见表3。结果表明,茶叶样品中游离酯型和可溶性糖苷型酚酸的回收率分别为82.81%~108.93%、39.09%~102.25%,RSD分别为4.04%~9.01%、3.93%~11.63%;此外如2.2.2节所述,QNA、CMA、CGA和NCGA在水解过程中降解严重,无法进行回收率验证。
2.4 实际样品检测
采用本法对市售绿茶、白茶、红茶、乌龙茶、普洱茶(熟茶)共15 份进行检测,每个样品重复测定3次,结果见图8。每种茶叶样品均鉴定出14种酚酸类化合物,GA、QNA和PCMA的含量相对较高,分别为6.52~10.41、0.19~0.85 mg/g和0.19~0.40 mg/g;VNA、EGA和FRA的含量较低,均低于0.08 mg/g。每种茶叶样品均鉴定出9种游离型酚酸,分别为GA、CGA、QNA、PCMA、FRA、OHBA、PCA、NCGA、PHBA;8种游离酯型酚酸和8种结合型酚酸,分别为GA、PHBA、PCMA、PCA、FRA、OHBA、TCNA、CFA;9种可溶性糖苷型酚酸和9种不溶性糖苷型酚酸,分别为GA、PCMA、PHBA、PCA、EGA、VNA、CFA、IFRA、OHBA,各形态酚酸中游离型和游离酯型酚酸含量较高(图9),分别为1.93~3.58 mg/g和2.35~5.15 mg/g,约占酚酸总量的16.40%~35.21%和30.02%~45.50%。不同茶叶样品酚酸总含量由高到低依次为白茶>绿茶>乌龙茶>红茶>普洱茶,酚酸总含量范围为7.84~12.90 mg/g,其中白茶中酚酸类化合物含量最高,酚酸类化合物总含量为12.90 mg/g,白茶经自然干燥制成,其酚酸类化合物的种类和含量较为丰富。

表3 23种酚酸在茶叶样品中的加标回收率(n=6)Table 3 Recoveries of 23 phenolic acids in spiked tea samples (n = 6)

图8 不同茶叶样品酚酸化合物的组成和含量(n=3)Fig. 8 Composition and content of phenolic acids in different tea samples (n = 3)

图9 不同类型酚酸在茶叶中的分布情况Fig. 9 Distribution of different types of phenolic acid in tea
3 结 论
建立UPLC-MS/MS测定茶叶中的23种酚酸类化合物的分析方法。在前处理的碱水解过程中加入保护剂,有效改善了部分酚酸类化合物的降解,在测定中增加游离酯型、结合型、可溶性糖苷型和不溶性糖苷型酚酸的鉴定和分析,使茶叶中酚酸的鉴定更加全面。通过方法学验证,证明该法具有分析时间短、灵敏度高且重复性好等特点,可应用于实际茶叶样品中酚酸类化合物的直接测定,方法的建立为快速全面富集、检测茶叶中多酚类化合物提供一种新的思路,为其他植物中该类化合物的测定提供有价值的参考,同时为进一步开展茶叶营养功能及品质研究提供技术手段。
