嗜热酸性III型普鲁兰多糖水解酶TK-PUL保守基序中关键氨基酸残基对其催化性质的影响
2022-12-22何础阔郭建军侯安伟聂俊辉
曾 静,何础阔,郭建军,侯安伟,聂俊辉,袁 林,*
(1.江西省科学院微生物研究所,江西 南昌 330096;2.海南大学食品科学与工程学院,海南 海口 570228)
淀粉糖消费领域广、数量大,是淀粉深加工的支柱产品[1-2]。我国的淀粉制糖工业发展迅速,淀粉糖的产量、种类、质量、规模都处于较高水平,其中产量仅次于美国,居世界第二位[1-2]。因此,优化淀粉制糖工艺的相关研究对我国淀粉制糖工业进一步发展具有重要的技术和经济意义。现行工业淀粉制糖工艺包括液化和糖化两个步骤[3-5]。淀粉首先经过高温液化步骤,经过α-淀粉酶水解,将高聚糖水解为低聚糖,这一过程的反应条件为pH 6.0、95~105 ℃。液化产生的低聚糖随后在β-淀粉酶、葡萄糖淀粉酶和普鲁兰酶以及异淀粉酶等作用下,残留的直链α-1,4-糖苷键和支链α-1,6-糖苷键被进一步水解,最终形成葡萄糖浆,该过程称为糖化步骤,其最适酶促条件为pH 4.5、60~62 ℃。液化步骤和糖化步骤的反应温度、pH值均不同,并且淀粉制糖工艺中使用了多种淀粉水解酶,这些因素使得工业淀粉制糖的生产成本增加、生产效率降低。因此,如果能够获得一种在高温液化条件下具有较强水解α-1,4-糖苷键和α-1,6-糖苷键能力的酶,则可大大降低生产成本,提高生产效率。
III型普鲁兰多糖水解酶(EC 3.2.1.1/41)属于糖苷水解酶类的第13家族(GH13_20),是一种双功能淀粉水解酶,可同时水解α-1,4-糖苷键和α-1,6-糖苷键,具有α-淀粉酶和普鲁兰酶的功能[6-9]。嗜热酸性III型普鲁兰多糖水解酶可在高温的液化条件下完全水解淀粉为淀粉糖,有望实现“液化糖化一步法”淀粉酶法制糖工艺。嗜热酸性III型普鲁兰多糖水解酶TK-PUL来源于极端嗜热古生菌(Thermococcus kodakarensis)KOD1,具有优良的热稳定性和高温活性,并且其热稳定性和高温活性均不依赖于Ca2+,即TK-PUL的酶学性质完全符合淀粉酶法制糖工业的需求[10-14]。已有研究表明,将TK-PUL以1 mg/g(淀粉干物质计)的使用量加入30%玉米淀粉乳中(100 mmol/L柠檬酸钠缓冲液,pH 4.2),100 ℃反应10 min,然后于90 ℃反应96 h后,玉米淀粉乳完全转化为淀粉糖,产物中聚合度(degree polymerization,DP)1~7所占比例为80.5%,DP7以上所占比例为8.3%,DPn所占比例为11.2%[12]。因此TK-PUL在淀粉酶法制糖工业中具有巨大的应用潜力。
另外,TK-PUL是目前已知的催化活性最高的III型普鲁兰多糖水解酶,其也可作为模板研究III型普鲁兰多糖水解酶以单一活性中心同时水解α-1,4-糖苷键和α-1,6-糖苷键的双功能催化机制。TK-PUL具有糖苷水解酶类第13家族酶分子结构和催化机制上的共同特征,例如保守基序(CSR-I、CSR-II、CSR-III、CSR-IV)、保守的催化活性中心(Asp503、Glu534、Asp601)、3个结构域(N末端结构域、催化结构域、C末端结构域)等[15]。将TK-PUL与其同源酶进行分子结构对比,发现TK-PUL具有氨基酸序列和分子结构的特异性[15-16]。TK-PUL的氨基酸序列和分子结构的特异性可能与其双功能催化机制相关。例如,TK-PUL中结构域N2的缺失可影响其底物选择性,导致其α-淀粉酶活性与普鲁兰酶活性的比值由0.49提高至0.60[16]。本研究选取TK-PUL的保守基序中非保守氨基酸残基进行定点突变,构建定点突变体,并通过比较TK-PUL与突变体的酶学特性,以确定TK-PUL保守基序中关键氨基酸残基对其催化性质的影响。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichia coli)JM109、枯草芽孢杆菌(Bacillus subtilis)RIK1285、TK-PUL表达载体pBES-Atkp均由本实验室保存;TaqDNA聚合酶、限制性内切酶、DNA Marker、蛋白质Marker、质粒DNA小量纯化试剂盒 日本TaKaRa公司;QuickMutation™基因定点突变试剂盒 上海碧云天生物技术有限公司;Chelating SepharoseTMFast Flow 美国GE Healthcare公司;TLC Silica gel 60硅胶板 美国Sigma公司;普鲁兰糖、可溶性淀粉、麦芽糖、麦芽三糖、麦芽四糖、潘糖、异潘糖上海惠诚生物科技有限公司;Bradford法蛋白质定量检测试剂盒 生工生物工程(上海)股份有限公司;实验所用试剂均为国产分析纯。
1.2 仪器与设备
Mastercycler gradient聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Eppendorf公司;TY04S-3C凝胶成像系统 北京君意东方电泳设备有限公司;SP-752PC紫外-可见分光光度计 上海光谱仪器有限公司。
1.3 方法
1.3.1 生物信息学分析
采用NCBI在线软件BLASTP对TK-PUL的氨基酸序列进行相似性分析,选取与其氨基酸序列相似性高的淀粉水解酶。采用Clustal-Omega(http://www.ebi.ac.uk/)[17]对TK-PUL以及这些淀粉水解酶中4个保守基序(CSR-I、CSR-II、CSR-III、CSR-IV)的氨基酸序列进行多序列比对,生成氨基酸序列比对文件。将得到的序列比对文件导入在线工具WebLogo 3.6(http://weblogo.berkeley.edu/)[18],生成TK-PUL以及多种淀粉水解酶中4个保守基序的氨基酸序列相关的序列识别图。
采用SWISS-MODEL(http://swissmodel.expasy.org)[19],以TK-PUL(PDB ID:5OT1)的蛋白质分子结构为模板,同源模建突变体的蛋白质分子结构。并采用三维图像软件PyMOL v0.99显示TK-PUL及突变体的三级结构。
1.3.2 定点突变体的构建及鉴定
根据QuickMutationTM基因定点突变试剂盒的说明书,结合基因tk-pul的碱基序列和拟突变的氨基酸位点设计引物,如表1所示。以定点突变体I500W的构建为例,采用引物I500W-F和I500W-R,以重组质粒pBE-S-Atkp为模板,经PCR扩增得到包含载体序列和突变基因序列的线性片段。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,68 ℃延伸2 min,35个循环;68 ℃延伸10 min。PCR扩增产物经限制性内切酶DpnI处理后,直接转化E. coliJM109,涂布于卡那霉素抗性平板进行筛选。提取转化子中重组质粒,将重组质粒送至生工生物工程(上海)股份有限公司进行测序,并与相应基因序列进行比对确认。其他定点突变体的构建参照突变体I500W的构建方法。

表1 构建重组质粒所用引物Table 1 Primer sequences used for the construction of recombinant plasmids
1.3.3 重组酶的诱导表达和纯化
将重组质粒转入B. subtilisRIK1285感受态细胞,获得重组B. subtilis。B. subtilisRIK1285感受态细胞的制备和转化采用改进的Spizizen法[20]进行。重组酶的诱导表达与纯化参照文献[16]进行。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测重组酶的纯度[21],并采用Bradford法[21]测定重组酶的浓度。
1.3.4 重组酶的α-淀粉酶活性和普鲁兰酶活性测定
分别以1 g/100 mL可溶性淀粉或普鲁兰多糖为底物,测定重组酶的α-淀粉酶活性和普鲁兰酶活性[16]。酶活力单位[22]定义:在一定反应条件下,每分钟催化产生1 μmol还原糖的酶量为一个酶活力单位(U)。
1.3.5 重组酶的酶学性质测定
分别以1%可溶性淀粉或普鲁兰多糖为底物,测定重组酶的最适反应pH值、pH值稳定性、最适反应温度及热稳定性[16]。
1.3.6 重组酶的动力学常数测定
分别以可溶性淀粉、普鲁兰多糖、麦芽三糖、或异潘糖为底物,采用50 mmol/L 2-(N-吗啡啉)乙磺酸(2-morpholinoethanesulfonic acid monohydrate,MES),pH 4.5缓冲液配制不同浓度的底物,并分别向不同浓度底物中加入等量的酶液。按照1.3.4节方法测定酶分别以可溶性淀粉或普鲁兰多糖为底物的比活力,参照文献[23]测定酶分别以麦芽三糖或异潘糖为底物的比活力。根据双倒数作图法,以底物浓度倒数为横坐标,以酶比活力倒数为纵坐标作图,计算米氏常数Km、最大反应速度Vmax和反应常数kcat。其中可溶性淀粉和普鲁兰多糖质量浓度梯度依次设定为0.5、1.0、1.5、2.0、2.5、3.0、3.5 mg/mL;麦芽三糖和异潘糖质量浓度梯度依次设定为1.6、3.2、6.4、12.8、16.0、20.0 mg/mL。
1.3.7 薄层色谱(thin layer chromatography,TLC)分析
以低聚糖为底物时,向100 μL含1 g/100 mL低聚糖的50 mmol/L MES、pH 4.5缓冲液中加入0.1 U的酶液,于90 ℃反应1 h后,迅速放入冰水浴中终止反应,12 000×g离心5 min,取上清液进行TLC分析;以可溶性淀粉或普鲁兰多糖为底物时,向500 μL含1 g/100 mL可溶性淀粉或普鲁兰多糖的50 mmol/L MES、pH 4.5缓冲液中加入1.5 U的酶液,于90 ℃反应16 h后,迅速放入冰水浴中终止反应,12 000×g离心5 min,取上清进行TLC分析。
酶解产物的TLC分析参照文献[23]进行。用毛细管点样,点样时用吹风机迅速吹干样品,将点好样品的薄层板放入层析缸,展层时间为2 h左右。其中用于可溶性淀粉的酶解物分析的展开剂(体积比)为正丁醇∶乙酸∶水=3∶3∶1,用于普鲁兰多糖及低聚糖酶解产物分析的展开剂(体积比)为正丁醇∶乙醇∶水=5∶3∶2。展层结束之后,将薄层板取出,浸没在显色剂溶液中,显色剂配方为苯胺-二苯胺,0.1 g二苯胺溶于2.5 mL丙酮,100 μL苯胺溶于2.4 mL丙酮;将上述两液混合后,加入500 μL磷酸,摇匀至白色沉淀消失,4 ℃保存。再立即用吹风吹干,放在95 ℃烘干显色15 min即可观察。
1.4 数据处理
酶学性质研究实验中,每个实验做3个平行。运用软件SigmaPlot 12.5对实验数据进行统计分析并作图,数据均以表示。
2 结果与分析
2.1 TK-PUL保守区域中突变位点的选择及突变体的构建
采用NCBI的在线软件BLASTP对TK-PUL(UniProt ID:Q5JID9)的氨基酸序列进行相似性分析,并选取其中序列相似性较高且催化特性不同的9种淀粉水解酶。这9种淀粉水解酶包括来源于Thermococcus aggregans的III型普鲁兰多糖水解酶(UniProt ID:Q9P9A0)[24]、来源于Desulfurococcus mucosus的淀粉普鲁兰酶(UniProt ID:Q9HHB0)[25]、来源于Bacillus acidopullulyticus的麦芽糖淀粉酶(UniProt ID:P32818)[26]、来源于Thermoanaerobacter ethanolicus的环糊精水解酶(UniProt ID:P29964)[27]、来源于Thermoactinimyces vulgaris的I型普鲁兰多糖水解酶(UniProt ID:Q08751)[28]、来源于Bacillus stearothermophilus的I型普鲁兰多糖水解酶(UniProt ID:P38940)[29]、来源于Bacillussp. KSM-1876的I型普鲁兰多糖水解酶(UniProt ID:Q57482)[30]、来源于Geobacillus stearothermophilus的麦芽糖淀粉酶(UniProt ID:Q45490)[31]、来源于Bacillus cereus的I型普鲁兰多糖水解酶(UniProt ID:Q819G8)[32]。
采用Clustal-Omega对TK-PUL以及这9种淀粉水解酶中4个保守基序(CSR-I、CSR-II、CSR-III、CSR-IV)的氨基酸序列进行多序列比对,生成氨基酸序列比对文件。将得到的序列比对文件导入在线工具WebLogo 3.6,生成TK-PUL以及多种淀粉水解酶中4个保守基序的氨基酸序列相关的序列识别图(图1)。可以得出,与以上9种淀粉水解酶相比,TK-PUL中4个保守基序的一些氨基酸位点存在不同的氨基酸残基。选取保守基序中在蛋白质一级结构(即氨基酸序列)上邻近酶催化活性位点(Asp503、Glu534、Asp601)的氨基酸残基进行定点突变,构建定点突变体I500W、V502L、P505A、L531I、T537H、D598G。并通过比较TK-PUL与定点突变体的酶学性质研究TK-PUL保守基序中关键氨基酸残基对其催化性质的影响。

图1 TK-PUL和多种淀粉水解酶中4个保守基序的序列标识图Fig. 1 Sequence logo for the four conserved regions of TK-PUL and other amylolytic enzymes
2.2 突变体的表达纯化及比活力分析
于B. subtilis表达系统中表达TK-PUL及各突变体,重组酶TK-PUL以及各突变体均得到成功表达,且主要位于发酵上清液中。采用Ni2+亲和层析法对重组酶进行纯化,并采用SDS-PAGE检测各重组酶的纯度。如图2所示,TK-PUL以及各突变体(I500W、V502L、P505A、L531I、T537H、D598G)的表观分子质量均约为84 kDa,大小均与理论值相符。

图2 重组蛋白质的SDS-PAGEFig. 2 SDS-PAGE analysis of the recombinant proteins
采用Bradford法测定TK-PUL及各突变体的蛋白质浓度,并测定各重组酶分别以可溶性淀粉和普鲁兰多糖为底物的比活力,结果如表2所示。与TK-PUL相比,突变体V502L、P505A、L531I、T537H、D598G的α-淀粉酶活性和普鲁兰酶活性基本不变;突变体I500W的α-淀粉酶比活力为46.15 U/mg,约为TK-PUL的83.03%;I500W的普鲁兰酶比活力为82.27 U/mg,约为TK-PUL的73.02%。即位于CSR-II的氨基酸残基Ile500突变为Trp500,导致TKPUL的α-淀粉酶活性和普鲁兰酶活性均明显下降。本研究进一步比较分析TK-PUL和突变体I500W的其他催化特性(如最适反应pH值、pH值稳定性、最适反应温度、热稳定性、动力学常数等),确定I500W位点变化对TK-PUL催化性质的影响。

表2 TK-PUL及突变体的比活力Table 2 Specific activities of TK-PUL and its mutants
2.3 TK-PUL与突变体I500W的酶学性质比较
如图3所示,以1 g/100 mL可溶性淀粉或普鲁兰多糖为底物时,TK-PUL及突变体I500W的最适反应pH值均约为4.5,并且TK-PUL及突变体I500W的最适反应pH值曲线的变化趋势基本相同。此外,在pH 3.0~9.0的范围内,TK-PUL及突变体I500W的pH值稳定性也基本一致(图4)。这表明TK-PUL中I500W位点变化不影响其最适反应pH值和pH值稳定性。

图3 重组酶的最适反应pH值Fig. 3 Optimal pH of recombinant enzymes

图4 重组酶的pH值稳定性Fig. 4 pH stability of recombinant enzymes
如图5所示,以1 g/100 mL可溶性淀粉或普鲁兰多糖为底物时,TK-PUL及突变体I500W的最适反应温度均为100 ℃,并且在40~110 ℃范围内两者的相对酶活力随温度变化趋势也基本相同。同时,由图6可知,TK-PUL及突变体I500W于100 ℃的热稳定性也基本一致,均约为2 h。即TK-PUL中I500W位点变化也不影响其最适反应温度和热稳定性。

图5 重组酶的最适反应温度Fig. 5 Temperature dependence of recombinant enzymes

图6 重组酶于100 ℃的热稳定性Fig. 6 Thermal stability of recombinant enzymes at 100 ℃
2.4 TK-PUL及突变体I500W对可溶性淀粉、普鲁兰多糖及低聚糖的水解作用
采用TLC法检测TK-PUL及突变体I500W分别水解低聚糖如麦芽糖、潘糖、麦芽三糖、异潘糖、普鲁兰多糖及可溶性淀粉(糖类分子结构见图7)的水解产物,结果如图8所示。TK-PUL及突变体I500W均不能水解麦芽糖和潘糖,两者的最小作用底物均为麦芽三糖。并且根据TK-PUL及突变体I500W水解麦芽糖和潘糖所得的水解产物,可以推断TK-PUL及其突变体I500W可水解麦芽三糖中α-1,4-糖苷键和异潘糖中α-1,6-糖苷键。在添加0.1 U酶以及90 ℃反应1 h的条件下,TK-PUL及突变体I500W均将麦芽三糖完全水解为麦芽糖和葡萄糖。同样的条件下,TK-PUL作用于异潘糖,将其大部分水解为麦芽糖和葡萄糖,残留的异潘糖量较少;突变体I500W仅将小部分异潘糖水解为麦芽糖和葡萄糖,残留的异潘糖量较多。以上结果表明,TK-PUL及其突变体I500W对麦芽三糖中α-1,4-糖苷键的水解效率基本一致;此外,与TKPUL相比,突变体I500W对异潘糖中α-1,6-糖苷键的水解效率较低。
另外,在添加1.5 U酶以及90 ℃反应16 h的条件下,TK-PUL和突变体I500W可完全水解底物,并且作用于普鲁兰多糖或可溶性淀粉产生的产物类型基本一致。但是突变体I500W作用于普鲁兰多糖或可溶性淀粉产生的产物中高分子质量糖的含量更高。这表明突变体I500W相对于TK-PUL作用于普鲁兰多糖或可溶性淀粉的催化效率更低。

图7 糖类的分子结构示意图Fig. 7 Schematic structures of sugars


图8 酶解产物的TLC分析Fig. 8 TLC analysis of the enzymatic hydrolysates

表3 TK-PUL及突变体I500W的动力学常数Table 3 Kinetic parameters of TK-PUL and the mutant I500W
测定并比较了TK-PUL及突变体I500W于100 ℃以可溶性淀粉或普鲁兰多糖为底物时的比活力和动力学常数,以此确定TK-PUL中I500W位点变化对其底物结合能力和底物降解能力的影响。由表3可知,与TK-PUL相比,突变体I500W以可溶性淀粉或普鲁兰多糖为底物的Km值基本不变,kcat值均明显降低。其中以可溶性淀粉为底物时,突变体I500W的kcat/Km值约为TK-PUL的87.05%;以普鲁兰多糖为底物时,突变体I500W的kcat/Km值约为TK-PUL的77.82%。这些结果表明,TK-PUL中I500W位点变化不影响其对可溶性淀粉或普鲁兰多糖的底物结合能力,但导致其对可溶性淀粉或普鲁兰多糖的水解活性降低。另外,本研究分别以麦芽三糖和异潘糖为底物测定并比较了TK-PUL及突变体I500W的α-1,4-糖苷键水解活性和α-1,6-糖苷键水解活性。如表3所示,与TK-PUL相比,突变体I500W以麦芽三糖和异潘糖为底物的Km值基本不变,即突变体I500W对麦芽三糖和异潘糖的结合能力基本不变;以麦芽三糖为底物的kcat值基本不变;以异潘糖为底物的kcat值明显降低,kcat/Km值约为TK-PUL的64.78%。这些结果表明,TK-PUL中I500W位点变化不影响其α-1,4-糖苷键水解活性,但使其α-1,6-糖苷键水解活性明显降低。
以上研究结果表明,TK-PUL中I500W位点变化不影响TK-PUL对可溶性淀粉、普鲁兰多糖、麦芽三糖和异潘糖的底物结合能力,但导致其对可溶性淀粉、普鲁兰多糖、异潘糖的水解能力明显降低。TK-PUL中I500W位点变化可能通过降低其α-1,6-糖苷键水解活性,降低其对可溶性淀粉、普鲁兰多糖以及异潘糖的水解效率。
2.5 突变位点分析与分子结构模拟
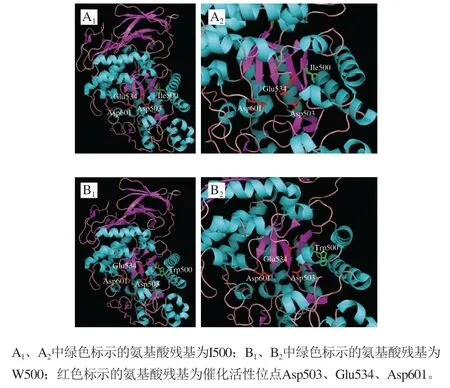
图9 TK-PUL(A)和突变体I500W(B)的三级结构模拟图Fig. 9 Three-dimensional modelling of TK-PUL (A) and the mutant I500W (B)
以TK-PUL(PDB ID:5OT1)的蛋白质分子结构为模板,采用SWISS-MODEL同源模建突变体I500W的蛋白质分子结构。采用三维图像软件PyMOL v0.99显示TKPUL及突变体I500W的三级结构。由于蛋白质的分子结构具有较强的稳定性,单个氨基酸的突变不会引起蛋白质分子三维结构的明显改变,所以突变体I500W与TKPUL的三级结构基本一致(图9A1、B1)。TK-PUL中第500位氨基酸残基Ile位于其催化结构域的βM5片层结构上,将Ile替换为Trp未明显引起βM5片层结构的构象位移变化(图9A2、B2)。已有研究结果表明,淀粉水解酶保守基序中氨基酸残基的分子构象大小以及侧链性质影响酶分子水解糖苷键的活性和特异性[33]。Ito等[34]研究发现,I型普鲁兰多糖水解酶TVA II的保守基序II中第326位氨基酸残基的分子构象大小及侧链的性质影响其水解糖苷键的特异性。将Vla326突变为分子构象更小的Ala,突变体V326A更倾向于水解α-1,4-糖苷键;将Vla326突变为分子构象更大的Ile,突变体V326I更倾向于水解α-1,6-糖苷键。本研究将TK-PUL的保守基序II中I500突变为分子构象更大的Trp,突变体I500W的α-1,4-糖苷键水解活性基本不变,其α-1,6-糖苷键水解活性明显降低。另外,在与TK-PUL序列相似性较高且仅作用底物中α-1,4-糖苷键的淀粉水解酶中,与TK-PUL中I500对应的氨基酸残基为W。根据以上研究结果可以推断:在该氨基酸位点,氨基酸残基为Trp使得酶分子倾向于水解α-1,4-糖苷键;氨基酸残基为Ile则使得酶分子倾向于水解α-1,4-糖苷键和α-1,6-糖苷键。即TK-PUL保守基序II中第500位氨基酸残基对其水解糖苷键的特异性起到关键作用,第500位氨基酸残基侧链大小可影响其催化糖苷键的特异性。
3 结 论
对III型普鲁兰多糖水解酶TK-PUL保守基序中非保守氨基酸残基进行定点突变,通过比较TK-PUL与突变体的酶学性质,确定保守基序中关键氨基酸残基对其催化性质的影响。其中TK-PUL保守基序II中第500位氨基酸残基Ile对其水解糖苷键的偏好性起到关键作用。第500位氨基酸残基为Trp使得酶分子倾向于水解α-1,4-糖苷键;第500位氨基酸残基为Ile则使得酶分子倾向于水解α-1,4-糖苷键和α-1,6-糖苷键。根据前人研究结论以及本研究结果,初步推断TK-PUL保守基序II中第500位氨基酸残基侧链大小可影响其催化糖苷键的特异性。本研究结果表明TK-PUL保守基序II中第500位氨基酸残基可作为其酶学特性改造的靶点。研究有利于深入了解TK-PUL的双功能催化机制,也可以为TK-PUL的分子改造提供理论依据和设计思路。
