钾盐替代和附属发酵剂对切达干酪品质的影响
2022-12-22余鹏飞马春丽韩秀娥王家栩贾丽丽
余鹏飞,马春丽,韩秀娥,王家栩,贾丽丽
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
在干酪制作中,NaCl起着至关重要的作用,如改善口感和质地、促进凝乳的脱水和抑制腐败微生物的生长[1]。然而,过量食用NaCl会促进健康损害,如血压升高和心血管疾病风险增加[2]。由于KCl具有与NaCl相似的化学性质[3-5],因此利用KCl盐代替NaCl降低干酪中的钠含量已进行广泛研究[6-7]。
与发酵剂乳酸菌相比,在干酪中添加附属发酵剂具有改善干酪品质和促进其成熟的作用,比如增加干酪的蛋白水解以及降低苦味肽改善口感[8-10]。在益生方面,发现以瑞士乳杆菌作为附属发酵剂可以明显提高干酪的血管紧张素转换酶(angiotensin-converting enzyme,ACE)抑制性[11],这些都表明附属发酵剂可以把干酪当作优良载体,提升干酪相关的品质和赋予其健康功能。副干酪乳杆菌在食物中的益生功能被广泛的研究,能够降低血压和提高ACE抑制率[12],但作为附属发酵剂对干酪成熟过程特性变化研究尚少。
本实验选取实验室保藏的在脱脂乳中表现较高的ACE抑制率的Lactobacillus paracaseiM3作为附属发酵剂,正常盐干酪为空白组,以在正常盐添加附属发酵剂、部分钾盐替代钠盐和在部分钾盐替代钠盐添加附属发酵剂为实验组,研究部分钾盐替代钠盐和添加附属发酵剂L. paracaseiM3对切达干酪品质和ACE抑制活性的影响,为开发具有降压功能的干酪提供相关理论支持。
1 材料与方法
1.1 材料与试剂
原料乳(新鲜无抗乳) 哈尔滨市香坊农场;副干酪乳杆菌(L. pacasei)M3 实验室保藏菌株;商业发酵剂R-704(由Lactococcus lactissubsp.lactis和Lactococcus lactissubsp.cremoris组成)、凝乳酶Stamix 1150 北京科汉森公司;马尿酰-组氨酰-亮氨酸(N-hippuryl-His-Leu hydrate,HHL)、ACE 美国Sigma公司;MRS培养基、营养琼脂培养基 北京奥博星生物技术有限责任公司;茚三酮 上海山浦化工有限公司;甘氨酸 上海慧世生化试剂有限公司。
1.2 仪器与设备
K9840自动凯氏定氮仪 山东海能科学仪器有限公司;SYQDSX-280B 手提式蒸汽灭菌锅 上海申安医疗器械厂;ULTRA-TURRAX T8均质机 德国IKA公司;SA402B电子舌 日本Insent司;Pilot10-15M制备型冷冻干燥机 北京博医康实验仪器有限公司;HYCV-30小型干酪槽 黑龙江赫益乳液科技有限公司;XF-3A型水分活度仪 厦门雄发仪器仪表有限公司;TA.XT plus型质构仪 英国Stable-Micro Systems公司。
1.3 方法
1.3.1 菌种的活化与培养
将L. paracaseiM3冻存菌种接种于MRS液体培养基中,37 ℃培养12 h,连续传代活化后,再按体积分数4%接种量接种于质量分数12%的脱脂乳培养基中37 ℃培养,待其凝乳,备用。
1.3.2 切达干酪的制作
参照Hannon等[13]的干酪制作方法。干酪实验分组为:A组,加入100% NaCl;B组,加入50% NaCl-50% KCl;C组,加入100% NaCl和0.5%L. paracaseiM3(V/V);D组,加入50% NaCl-50% KCl和0.5%L. paracaseiM3(V/V),每组干酪添加质量分数1.7%盐和质量分数0.01%商品发酵剂R-704。干酪放于4 ℃成熟6个月。
1.3.3 干酪理化性质的测定
取成熟6个月的切达干酪测定其组成成分。水分含量测定:采用直接干燥法参考GB 5009.3—2010《食品中水分的测定》;蛋白质含量测定:采用凯氏定氮法,参考GB 5009.5—2010《食品中蛋白质的测定》;脂肪含量测定:采用索氏抽提法,参考GB 5009.6—2016《食品中脂肪的测定》;水分活度测定:参考GB 5009.238—2016《食品水分活度的测定》;灰分含量测定:参考GB 5009.4—2016《食品中灰分的测定》。pH值测定:将干酪与去离子水按1∶9(m/m)的比例混合并均质,用pH值计测定。
1.3.4 干酪活菌数的测定
对干酪成熟期第0、1、2、3、4、5、6个月进行微生物的检测,具体方法如下:取1 g干酪样品无菌条件下研磨并和9 mL 2%的柠檬酸钠混合均质,并用灭菌的0.1%的蛋白胨进行梯度稀释,吸取0.1 mL涂布于固体营养琼脂,(35±1)℃培养48 h进行细菌总数的计数[14];再吸取0.1 mL涂布于MRS琼脂培养基,37 ℃培养48 h进行乳酸菌的计数。
1.3.5 pH 4.6可溶性氮含量的测定
根据Fenelon等[15]的方式并作适当修改,对干酪成熟期每个月进行取样分析。称取5 g干酪研磨并加入20 mL pH 4.6的乙酸钠溶液进行均质,40 ℃水浴1 h,4 ℃、8 000 r/min离心15 min,将上清液转移至消化瓶,自动凯氏定氮测定,用所占干酪总氮量的百分比表示。
1.3.6 干酪水溶性提取物的制备
取成熟期每个月干酪20 g加入适当的去离子水,并在40 ℃水浴锅加热0.5 h,使用均质机均质3~4 min,除去上层脂肪,离心(4 ℃、8 000 r/min、20 min),上清液进行过滤,所得滤液进行冷冻干燥后贮存于-20 ℃冰箱。
1.3.7 干酪总游离氨基酸的测定
对干酪成熟期每个月取样1次进行测定。采取镉-茚三酮法[16]测定,将上述1 mL干酪水溶性提取物的上清液用100 mL容量瓶定容,取0.40 mL稀释液、1.60 mL蒸馏水、1.00 mL茚三酮显色剂,振荡摇匀,保持15 min的沸水浴,同时作空白实验,于570 nm波长处测定吸光度。利用甘氨酸标准曲线计算蛋白水解能力。
1.3.8 干酪ACE抑制活性测定
根据舒国伟[17]的方法并稍加修改,将冻干样品配制成20 mg/mL,用0.05 mmol/L硼酸盐缓冲液配制成5 mmol/L HHL和0.1 U/mL酶活的ACE,冷藏备用。具体方法如下:取200 μL HHL、100 μL样品溶液分别装入5 mL离心管混合振荡,在37 ℃水浴3 min,再加入20 μL ACE酶液,再水浴30 min,添加200 mL 1mol/L盐酸终止反应,最后加入1.7 mL乙酸乙酯,离心(4 ℃,4 000 r/min,10 min),吸取上层的乙酸乙酯层1 mL。旋转蒸发后再加入3 mL去离子水,振荡10 s,使用紫外分光光度计在波长228 nm处测定吸光度,按下式计算:

式中:Aa为包含干酪样品的吸光度;Ab为未加入干酪样品的吸光度;Ac为酶失活的吸光度。
1.3.9 干酪质构的测定
对干酪成熟期每个月取样1次进行测定。根据屈倩[18]的方法并稍加修饰。用TA.XT plus型质构仪测干酪各成熟期质构,具体如下:将干酪样品切成(2.00±0.10)cm的立方体,并在室温下放置40 min,测试前探头下降速率2 mm/s,测试速率1 mm/s,测试后探头回程速率2 mm/s,下压距离10 mm,两次下压间隔时间5 s,触发压5 g,探头型号P/0.5,每组干酪平行测定3次。
1.3.10 干酪电子舌的测定
根据Lipkowitz等[19]的方法并稍加修饰,取成熟第6个月的干酪进行电子舌测定。取5 g干酪加入100 mL去离子均质3~4 min,除去脂肪,4 ℃、5 000 r/min离心20 min,取上清液并用0.45 μm的滤膜过滤,置于专属烧杯,待测。
1.3.11 干酪感官评价
干酪成熟6个月的样品进行感官评价。根据Amalshori等[20]的方法并略加修饰,选择10 名专业成员(5 位男生和5 位女生)进行干酪感官评价,采取10 分评价表代表接受程度。主要针对色泽、苦味、质地、裂缝、咸味五方面进行打分,根据整体接受程度分为4个等级,1~3 分为差,4~5 分为一般,6~8 分为好,9~10 分为较好。每个成员品尝干酪样品都需要事先漱口,随机将干酪样品分配给成员进行独立打分。
1.4 数据处理
每组样品重复3次平行,用SPSS 22.0进行分析,结果以表示,P<0.05,差异显著,用GraphPad 2018软件进行作图,采用主成分分析(principal component analysis,PCA)进行电子舌分析。
2 结果与分析
2.1 干酪主要成分分析

表1 切达干酪组成成分分析Table 1 Analysis of chemical composition in Cheddar cheese
钾盐替代50%钠盐和L. paracaseiM3的添加对干酪的水分、脂肪、蛋白质、水分活度均无显著影响(P>0.05)(表1),主要是KCl与NaCl在物理化学性质方面有着较为相似的结构[21]。部分钾盐替代的干酪B、D在灰分低于没有添加钾盐的干酪A、C,一般而言,灰分含量主要受干酪中的盐和矿物质比例的影响[22],说明KCl比起NaCl更容易使得干酪盐和矿物质比例下降,导致灰分降低。
2.2 干酪pH值分析
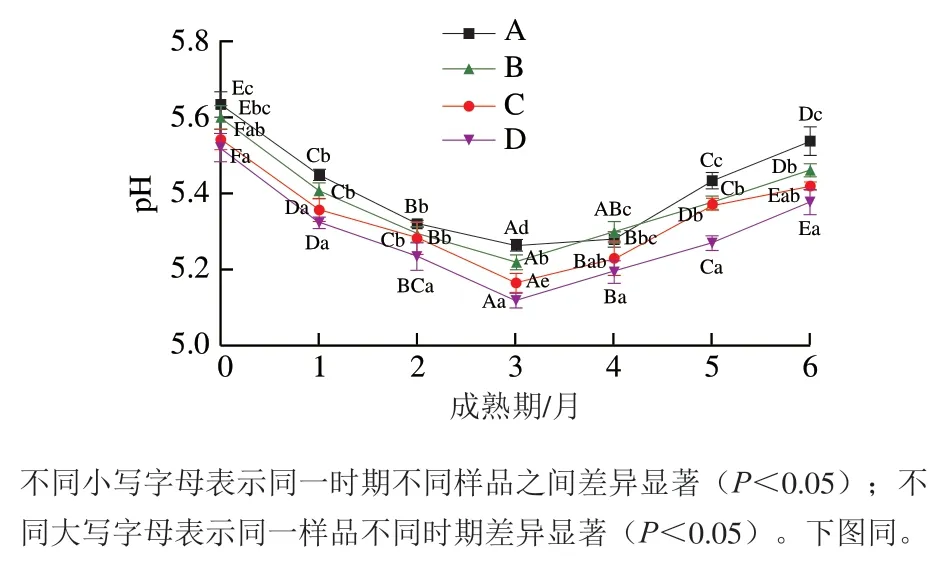
图1 切达干酪成熟期pH值的变化Fig. 1 Change in pH of Cheddar cheese during ripening
由图1可知,各成熟期的干酪样品pH值整体上呈现出先下降后上升的规律,主要原因是成熟前期干酪中存在着残留乳糖,附属发酵剂和主发酵剂分解乳糖继续产生酸性物质,使pH值下降,随着成熟时间延长,乳糖被消耗殆尽,以及蛋白质降解产生肽和氨基酸等物质使干酪pH值上升[23]。在相同成熟期,由于附属发酵剂代谢产生酸性物质,干酪C、D的pH值显著低于对照组(P<0.05),同时钾离子提供的环境有利于微生物发酵[24],使干酪B的pH值低于对照组干酪A,即钾盐替代和附属发酵剂L. paracaseiM3的添加使干酪pH值降低。
2.3 干酪微生物分析

图2 切达干酪成熟期细菌总数(A)和乳酸菌数(B)的变化Fig. 2 Changes in total bacterial count (A) and Lactobacillus count (B)in Cheddar cheese during ripening
细菌总数检测是衡量乳制品质量安全的一个重要指标[25]。如图2所示,总细菌数和乳酸菌数都随成熟时间的延长呈现逐渐下降趋势,且乳酸菌的数量低于总细菌,可能是由于随着成熟期的进行,干酪的营养物质被消耗,碳源减少,微生物生存受限,在Pappa等[26]研究Kashkaval干酪中也得到的相似的结论。成熟6个月时干酪的细菌总数、乳酸菌数,干酪B高于对照组A,干酪D组显著高于干酪C,说明钾盐的环境更有利于微生物的生长,Karimi等[27]研究的钾盐部分替代钠盐在Feta干酪也有类似的结果。在成熟期6个月时添加L. paracaseiM3的干酪C、D的乳酸菌数分别为7.90和8.26(lg(CFU/g)),显著高于干酪A和B(P<0.05),说明添加附属发酵剂L. paracaseiM3使干酪乳酸菌数量增加,可能进而影响干酪蛋白质的水解和ACE抑制活性。
2.4 干酪pH 4.6可溶性氮分析
由图3可知,各组干酪的pH 4.6可溶性氮的含量随成熟时间呈现显著上升的趋势(P<0.05),并在成熟6个月时分别达到20.16%、21.03%、22.46%、23.84%,主要原因是由于残留在干酪中的凝乳酶以及发酵剂有较强的蛋白水解能力,有助于发生初级水解[28],添加L. paracaseiM3的干酪C、D明显高于对照组A,说明L. paracaseiM3促进蛋白水解产生中小分子肽[29],钾盐替代的干酪B蛋白水解程度高于空白组A,说明钾盐提供了更有利于微生物的水解环境[30]。
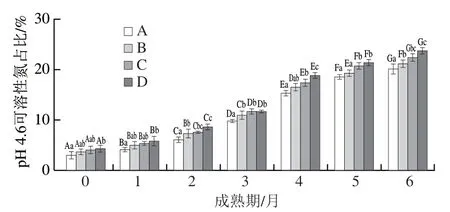
图3 切达干酪成熟期pH 4.6可溶性氮含量的变化Fig. 3 Change in pH 4.6-SN content in Cheddar cheese during ripening
2.5 干酪总游离氨基酸分析

表2 干酪成熟期总游离氨基酸含量Table 2 Total free amino acid content in Cheddar cheese during ripening
甘氨酸标准曲线方程y=0.008x-0.005 9(R2=0.995 3),干酪中的微生物尤其是乳酸菌产生的蛋白酶将初级水解得到的小肽再次进行次级水解得到游离氨基酸[31]。由表2可知,成熟时间对干酪的总游离氨基酸含量有显著影响(P<0.05),呈现上升的趋势。在相同成熟期,添加L. paracaseiM3的干酪C、D显著高于对照组干酪(P<0.05),且第6个月都超过了20 mg/mL,分别比对照组提高了32.7%和43.3%,说明附属发酵剂的添加是有利于深层次的蛋白水解。钾盐替代对干酪总游离氨基酸含量没有显著影响(P>0.05)。
2.6 切达干酪ACE抑制活性分析

图4 切达干酪成熟期ACE抑制率的变化Fig. 4 Change in ACE inhibitory activity of Cheddar cheese during ripening
由图4可知,各组干酪在成熟期ACE抑制率呈现明显上升的趋势(P<0.05),随着蛋白水解深度进行,酶分解酪蛋白产生生物活性肽,其中包括ACE抑制肽,使其抑制率上升,郝欣悦等[32]将瑞士乳杆菌添作为益生菌加到切达干酪也发现相似结果。其中添加部分钾盐的干酪C高于对照组,主要原因是钾离子环境增加了乳酸菌的蛋白酶活力[33],从而有利于生物活性肽的生成。干酪B、C、D在成熟6个月之后ACE抑制率达到了65.2%、74.3%和78.7%,比空白组分别高出19.6%、36.2%和44.4%,说明L. paracaseiM3具有促进ACE抑制肽的产生,同时L. paracaseiM3在部分钾盐环境中酶活力更强。因此,在切达干酪配方中部分钾盐替代和附属发酵剂有助于具有益生功能的生物活性肽的产生。从功能角度考虑,部分钾盐替代和附属发酵剂在切达干酪配方中存在积极影响。
2.7 干酪质构分析

表3 干酪成熟6个月的质构分析Table 3 Texture analysis of Cheddar cheese after six months of ripening
由表3可知,胶黏性大小看其绝对值,负号代表受力方向向下,各组干酪随成熟期的进行,硬度、弹性、内聚性、咀嚼性呈现下降趋势且硬度、咀嚼性下降幅度较大,而胶黏性却呈现上升趋势。干酪B、C、D的硬度分别是(997.65±14.08)、(1 013.04±25.27)、(942.53±19.93)g显著低于对照组A(P<0.05),说明KCl提供的环境和L. paracaseiM3的加入促进微生物发生蛋白水解产生小分子物质以及肽键断裂的程度更高,使酪蛋白的网络结构受到更高程度的破坏并发生坍塌[34],导致硬度降低,而弹性、内聚性、黏性、咀嚼性也因此发生相应的变化。总的来说,KCl和L. ParacaseiM3很好的加速了干酪的成熟。
2.8 切达干酪电子舌分析

图5 切达干酪第6个月电子舌分析Fig. 5 Electronic tongue analysis of Cheddar cheese ripened for six months
如图5所示,3个点代表样品3个重复。PC1贡献率为68.6%,PC2贡献率为20.1%,PC1占据了主要的贡献率,累计贡献率超过80%,说明很好地代表样品之间的整体信息,距离风味指标越近,说明样品在这指标强度就越高[35]。PC1与苦味、丰富度、酸味呈正相关,PC2与咸味呈正相关。从PC1看出,干酪D的鲜味、酸味、丰富度、苦味高于其他组,说明钾盐替代和附属发酵剂混合使用明显影响着干酪的风味(P<0.05)。
2.9 切达干酪感官评价分析
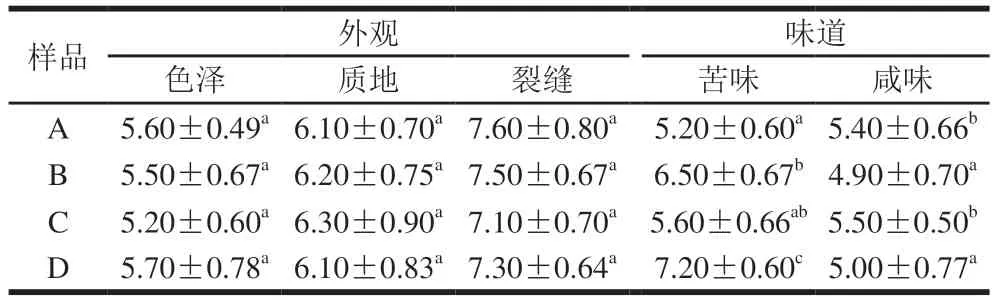
表4 切达干酪第6个月的感官评价分析Table 4 Sensory evaluation of Cheddar cheese ripened for six months
由表4可知,4 组切达干酪的色泽,质地以及裂缝没有明显的差别,说明部分钾盐替代以及附属发酵剂的添加对干酪外观几乎没有影响(P>0.05);干酪B、C、D的苦味值显著大于对照组,说明KCl具有明显的金属苦味以及附属发酵剂L. ParacaseiM3具有水解蛋白产生苦味肽的功能,干酪B、D咸味值显著低于干酪A、C(P<0.05),主要原因是KCl不仅提供咸味,还提供其他味道,而NaCl提供的味道比较单一咸味[36],Li Feng等[37]研究部分KCl取代NaCl在腊肉中的咸味评价也得到相似结果。附属发酵剂对干酪咸味几乎没有影响。
3 结 论
部分盐替代和附属发酵剂L. paracaseiM3单独或者混合使用,对切达干酪主成分几乎没有影响,其中,附属发酵剂的添加使干酪pH值下降,而微生物、pH 4.6可溶性氮、总游离氨基酸、ACE抑制率显著增加,但是会使硬度有明显下降,同时产生苦味肽,而部分钾盐替代,增加了微生物的存活,提高ACE抑制率但也降低硬度和伴随金属苦味的生成。总的来说,部分钾盐替代和附属发酵剂影响干酪蛋白水解和有助于具有抗高血压潜力的ACE抑制肽的产生。在后续的研究中,可以考虑添加风味增强剂来弥补附属发酵剂和钾盐带来的苦味和其他味道的缺陷。
