CTCF通过抑制p53信号通路促进胆管癌细胞的生长、迁移和侵袭
2022-12-22闫晗石培培王亚会高成明周钢桥
闫晗,石培培,王亚会,高成明,周钢桥,
(1.河北大学 化学与环境科学学院,河北 保定 071002; 2.河北大学 生命科学学院,河北 保定 071002;3.军事科学院军事医学研究院 辐射医学研究所,北京 100850)
肝脏胆管细胞癌(cholangiocarcinoma, CCA)简称胆管癌,是一种源于肝脏胆管上皮细胞的恶性肿瘤,占所有原发性肝癌(primary liver cancer, PLC)的10%~15%[1].近年来,在全球范围内胆管癌的发病率呈逐年上升趋势[2].中国是世界上胆管癌发病率最高的国家之一,胆管癌严重危害国民的生命和健康[3].不同地区胆管癌的风险因素差异较大,主要风险因素包括肝吸虫感染、胆总管囊肿、乙型肝炎病毒(hepatitis B virus, HBV)和丙型肝炎病毒(hepatitis C virus, HCV)感染、肝结石和原发性硬化性胆管炎等[4].早期的胆管癌患者首选手术切除.然而,大多数诊断为胆管癌的患者已处于晚期,因此长期预后较差,3年生存率低于15%[5],即使部分患者能够实施手术切除,术后复发的概率仍然很高.因此,研究胆管癌的发生发展过程,探索胆管癌相关分子的肿瘤生物学功能及其致病机制,对于提高胆管癌的防诊治水平具有重要意义.
CCCTC 结合因子(CCCTC-binding factor, CTCF)是1990年被发现的一种真核转录因子[6-7],其在哺乳动物遗传进化中高度保守.在人体中,CTCF位于染色体16q22.1[8],编码包含700个氨基酸的蛋白质,主要包含1个N端结构域、1个锌指结构域和1个C端结构域[9-10].作为锌指多功能蛋白,CTCF具有独特的分子功能,广泛参与基因调控的多个方面,主要包括转录抑制或激活[11-12]、隔离[13-14]、沉默或增强子[15]、基因印迹[16-17]和X染色体失活[18]等.已有研究表明,CTCF与肿瘤的发生发展密切相关,并且在不同种类的肿瘤中具有功能异质性,发挥着促癌基因或抑癌基因的作用.例如,CTCF在乳腺癌细胞系和乳腺癌组织中显著低表达,在乳腺癌细胞系MCF7中发挥抑制细胞生长的作用[19];CTCF在前列腺癌中发生基因组拷贝数缺失[20],并发挥抑癌基因的作用.与之相反的是,CTCF在肝癌中却作为原癌基因,可通过调控FOXM1(forkhead box protein M1)的表达进而影响肝癌的生长和转移[21];在结直肠癌中,CTCF可通过p53信号通路促进结直肠癌细胞的生长[22].然而,CTCF在胆管癌进展中发挥何种生物学功能迄今尚未被报道.因此,本研究旨在通过评价CTCF对胆管癌细胞的生长、迁移和侵袭能力的影响,探究其下游调控的信号通路,以期初步揭示CTCF在胆管癌进展中的功能和潜在的作用机制.
1 材料与方法
1.1 材料
1.1.1 细胞系
胆管上皮细胞系HIBEpiC;胆管癌细胞系QBC939、RBE、HCCC-9810、HuCCT1;人胚肾细胞系HEK293T.
1.1.2 质粒载体
用于CTCF基因过表达的慢病毒载体pECMV-3×Flag-puro购自北京淼灵生物科技有限公司;靶向CTCF基因的shRNA片段由华大基因合成;用于病毒包装的质粒为psPAX2和pMD2.G.
1.1.3 抗体
CTCF抗体(1∶1 000(体积比,下同), # 3418S, Cell Signal Technology);GAPDH抗体(1∶1 000, A01020, Abbkine);p53抗体(1∶1 000, sc-393031, Santa Cruz Biotechnology);p21抗体(1∶1 000, # 2947S, Cell Signal Technology);羊抗兔二抗(1∶2 000, BS13278, Bioworld Technology);羊抗鼠二抗(1∶2 000, BS12478, Bioworld Technology).
1.1.4 主要试剂
细胞培养所需的DMEM (Dulbecco′s Modified Eagle Medium, DMEM)培养基购自北京细工生物科技公司;质量分数0.25%胰蛋白酶和胎牛血清FBS(foetal bovine serum, FBS, 201172, AusGeneX)购于北京荣夏生物科技公司;一抗稀释液(P0023A)购于碧云天生物技术有限公司;RIPA(强)细胞/组织蛋白裂解液、RNA提取试剂盒、质粒DNA提取试剂盒和SDS-PAGE浓缩胶缓冲液均购于康为世纪生物有限公司;蛋白酶抑制剂购于罗氏制药有限公司;PBS缓冲液购于莫纳生物有限公司.
1.1.5 主要仪器
高压蒸汽灭菌锅(YAMATO);二氧化碳恒温细胞培养箱(Thermo Fisher);生化纯水仪(Thermo Fisher);光学显微镜(Nikon);生物洁净工作台(北京哈东联);高速离心机(Eppendorf 5810R);振荡培养箱(上海知楚);磁力加热搅拌器(赛格捷);电热水浴锅(长风);PCR仪(Eppendorf);微孔光栅酶标仪(TECAN);Wb电泳及转印仪(Bio-RAD);化学发光成像仪(Tanon);凝胶成像仪(Tanon)和移液器(Eppendorf)等.
1.2 方法
1.2.1 细胞培养
实验所用完全培养基均为含体积分数10% FBS和体积分数1%双抗的DMEM,所有细胞系的培养条件均为37 ℃、体积分数5% CO2,并保持一定的湿度.
1.2.2 载体构建
在NCBI数据库中查找CTCF基因的全序列片段(NM_001191022),通过PCR扩增CTCF基因CDS区的全长序列,通过双酶切法将其改构至pECMV-3×Flag-puro慢病毒过表达载体上.扩增引物:正向5′-CCGGAATTCATGGAAGGTGATGCAGTCGAAGCCA-3′;反向5′-CGCGGATCCCCGGTCCATCATGC-TGAGGATCA-3′.载体经转化感受态DH5α后,挑取若干个单克隆,提取质粒并进行测序.测序验证正确的过表达质粒保存于-20 ℃待用.本课题组合成了2条特异性靶向CTCF的shRNA片段:shCTCF-1片段5′-GATCCGTGGACGATACCCAGATTATACTTCCTGTCAGATATAATCTGGGTATCGTCCACTTTTTG-3′;shCTCF-2片段5′-GATCCACGTGTCCACGGCGTTCAAATCTTCCTGTCAGAATTTGAACGCCGTGGACACGTTTTTTG-3′.然后通过退火形成双链,连接至慢病毒载体pGreen中,测序验证正确后保存于-20 ℃待用.
1.2.3 细胞转染及慢病毒包装
将HEK293T细胞用质量分数0.25%的胰酶消化、离心,按照70%的密度接种于6 cm小皿中培养.将目的质粒、病毒包装质粒psPAX2和pMD2.G按质量比3∶2∶1(总质量为12 μg)混合,然后在Lip2000(LipofectamineTM2000 Transfection Reagent, 11668-027, Invitrogen)介导下转染至HEK293T细胞.6~8 h后更换含血清无双抗的DMEM培养基.转染后48~72 h收集细胞培养上清液,采用0.45 μm滤器过滤后按照体积比1∶5加入病毒浓缩液,4 ℃过夜.次日,4 ℃、4 500 r/min离心30 min,去除上清液,加入1 mL无双抗培养基溶解,-80 ℃保存待用.将细胞RBE和HCCC-9810按照50%密度铺6孔板,细胞贴壁后,在8 μg/mL的polybrene介导下利用慢病毒感染细胞,6~8 h后更换无双抗的完全培养基,恒温培养72 h,然后加入5 μg/mL的嘌呤霉素筛选慢病毒感染的阳性细胞.扩大培养后收取蛋白进行表达鉴定.
1.2.4 蛋白质提取及蛋白质免疫印迹(Western blotting, Wb)实验
胆管癌组织及癌旁组织经液氮研磨后,按照1∶20的体积比加入适量的组织蛋白抽提液,冰上充分裂解30 min,并每5 min涡旋震荡1次;提取培养细胞的蛋白,经胰酶消化后收集等量的对照组和实验组细胞,用PBS洗2次,加入含有蛋白酶抑制剂的细胞裂解液,置于冰上充分裂解30 min.裂解完成后,4 ℃下将细胞裂解混合液12 000 r/min离心10 min.吸取蛋白上清混合液转移至新管中,与等体积的2×上样缓冲液混合均匀,沸水煮沸10 min后-20 ℃保存待用.配制质量分数10% SDS-PAGE胶,将蛋白样品加入分离胶加样孔,恒压80 V进行凝胶电泳,当蛋白样品中溴酚蓝跑至分离胶底层1~2 cm时停止电泳.用湿转法将蛋白从SDS-PAGE转移至硝酸纤维素膜,恒流200 mA转膜约2 h.TBST清洗硝酸纤维素膜2次,每次5 min.利用TBST配制含质量分数5 %脱脂奶粉的封闭液,将硝酸纤维素膜室温封闭1 h,然后用TBST洗膜2 min.用蛋白抗体稀释液孵育膜,4 ℃冰箱摇晃过夜.一抗孵育结束后,用TBST洗脱3次,每次5 min.用HRP标记的羊抗兔/鼠二抗稀释液室温孵育1~2 h.TBST洗脱3次,每次5 min.将发光试剂A液和B液等体积混匀后孵育硝酸纤维素膜,充分反应后放于成像仪(Tanon 5200)中进行曝光,记录并分析结果.
1.2.5 细胞CCK-8检测实验
细胞经胰酶消化、离心和重悬后进行计数,按照2 000/孔将细胞种植于96孔细胞培养板,然后置于37 ℃、体积分数5% CO2恒温箱中培养.细胞贴壁后,每孔加入90 μL的空DMEM和10 μL的CCK-8试剂混合液,37 ℃孵育1 h,然后取90 μL的上清液检测OD450值,持续监测5~7 d.
1.2.6 平板细胞克隆形成实验
消化、收集细胞并计数,按照1 000/孔将细胞种植于6孔细胞培养板中.将细胞培养板放置于37 ℃恒温细胞培养箱内培养,定期观察细胞生长状态.2~4周后,待平板细胞克隆形成,采用质量分数4%多聚甲醛固定,质量分数5%结晶紫溶液染色,轻缓清洗多余染料,避免细胞克隆脱落,晾干后采集数据,分析结果.
1.2.7 细胞迁移和侵袭实验
将细胞消化、收集并种植于6孔细胞培养板中,细胞贴壁后吸弃完全培养基,更换为空DMEM饥饿处理12 h.然后采用胰酶消化收集细胞,用空DMEM培养基重悬细胞,并计数.选择细胞迁移实验专用的24孔细胞培养板,在Transwell迁移小室上层每200 μL细胞重悬液(空DMEN重悬)加入6 × 104个细胞,下层加入800 μL的体积分数20%胎牛血清培养基,检测细胞迁移能力.24~36 h后,取出小室用质量分数4%的多聚甲醛固定15 min,再用质量分数5%结晶紫溶液染色10 min.最后用清水及棉签洗去多余的结晶紫染料及未迁移的小室内细胞,室温晾干后对其进行图像采集并计数.
细胞侵袭实验的基本步骤同上述的细胞迁移实验,不同之处在于所使用的Transwell小室内多了一层基质胶,用以模仿细胞外基质,所铺细胞量为上述细胞迁移实验的2倍,培养箱中培养30~48 h后取出小室固定、染色、清洗、拍照和计数.
1.2.8 实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)
按照试剂盒说明书进行细胞总RNA的提取.然后,取500 ng RNA逆转录为cDNA,以2 μL cDNA为模板,进行qRT-PCR扩增实验,引物如下:CTCF,正向5′-CAAGCTGAAAAGGCACATGA-3′,反向5′-TGTGTCACAGTGGGGAC-AGT-3′;p53,正向5′-GCGAGCACTGCCCAACAACA-3′,反向5′-GG-ATCTGAAGGGTGAAATATTCT-3′;p21,正向5′-ACTCTCAGGGTCGAAAACGG-3′,反向5′-GATGTAGAGCGGGCCTTTGA-3′;GAPDH,正向5′-CG-GAGTCAACGGATTTGGTCGT-3′,反向5′-TCTCAGCCTTGACGGTGCCA-3′.所有样本均设3个重复,以GAPDH基因为内对照,使用△△Ct法对mRNA的定量结果进行归一化处理.所有的PCR实验均进行熔解曲线分析,以排除非特异性扩增.
1.2.9 通路富集分析
为探索CTCF在肝内胆管癌细胞中的功能机制,下载了临床肿瘤蛋白质组分析联盟数据库(clinical proteomics tumor analysis consortium ,CPTAC)中胆管癌的mRNA测序数据集(n=255).使用DEseq2(v1.26.0)进行基因表达值标准化以及批间差效应的校正,根据CTCF基因mRNA测序读段数的中值(5613)分为高表达(>5613,n=127)和低表达(≤5613,n=128)2组.随后,采用NetworkAnalyst(v2019)软件在CCA数据集中筛选高、低表达2组间差异基因(差异倍数>1.2,错误发现率<0.05),共得到428个显著差异表达的基因.以428个基因作为输入进行Panther通路富集分析.此外,还使用全部转录组表达矩阵作为输入进行了基因富集分析(gene set enrichment analysis,GSEA).使用分子图谱数据库(molecular signatures database,MSigDB,v 7.0)定义GSEA分析的通路基因集,并对基因集进行1 000次置换检验以计算统计量,错误发现率<0.05的通路为显著富集的通路.通路富集分析的结果通过qRT-PCR和Wb实验进行验证.
1.2.10 临床相关性分析
为探索CTCF基因在肝内胆管癌组织中的异常表达情况及其与胆管癌病人预后的相关性,收集了国际癌症基因组图谱计划(the cancer genome atlas,TCGA)数据库中的胆管癌(cholangiocarcinoma,CHOL,包括36个癌组织和9个癌旁组织)和高通量基因表达数据库(gene expression omnibus database,GEO)中GSE107943数据集(包括30个癌组织和27个癌旁组织)的RNA测序数据,并下载了TCGA-CHOL的临床生存数据.根据癌组织中CTCF基因mRNA表达的中值(10.51)分为高表达(≥10.51、n= 18)和低表达(<10.51、n= 18)2组,首先比较了这2个数据集中CTCF在癌和癌旁组织间的差异表达情况,并进一步根据TCGA数据集的胆管癌组织中CTCF基因mRNA表达的中值(10.51)分为高表达(≥10.51、n=18)和低表达(<10.51、n=18)2组,分析了CTCF的表达与患者总体生存期和无病生存期的相关性.
1.2.11 统计学分析
采用SPSS 16.0和GraphPad(v6)进行统计学分析.实验组间数据的比较采用Student’s t检验.CTCF基因在癌和癌旁组织间的mRNA差异表达分析采用GraphPad软件(v6)的Mann-Whitney U检验.Kaplan-Meier法用于绘制生存曲线,2组间生存率的差异分析采用GraphPad中的Log-rank检验.所有表型实验均重复至少3次,所有统计学检验中,P<0.05视为具有显著性意义.
2 结果
2.1 CTCF在胆管癌组织及胆管癌细胞中的表达
首先,对配对的胆管癌组织和癌旁组织进行了CTCF蛋白表达水平的检测,Wb检测显示,在随机选取的12例胆管癌患者中,CTCF在10对胆管癌组织(T)中的表达均明显高于配对的癌旁组织(图1a).其次,检测胆管上皮细胞和胆管癌细胞系中CTCF的表达,结果显示,CTCF在胆管癌细胞系RBE、HCCC-9810、QBC939和HuCCT1中的表达明显高于肝内胆管上皮细胞系HIBEpiC(图1b).这些结果提示,CTCF可能在胆管癌中发挥癌基因的功能.

a.胆管癌组织及其配对癌旁组织中CTCF蛋白表达水平的检测(N.癌旁组织;T.胆管癌组织);b.肝内胆管上皮细胞HIBEpiC,胆管癌细胞系RBE、HCCC-9810、QBC939和HuCCT1中CTCF表达的检测(采用CTCF抗体进行Wb检测,GAPDH为内参)图1 Wb检测胆管癌组织及胆管癌细胞系中CTCF的表达Fig.1 Wb detects the expression of CTCF in cholangiocarcinoma tissue and cholangiocarcinoma cell lines
2.2 CTCF对胆管癌细胞生长能力的影响
采用慢病毒包装的方法构建稳定过表达CTCF的胆管癌细胞株,采用转染特异性靶向CTCF的shRNA构建稳定敲低CTCF的胆管癌细胞株,采用Wb实验验证CTCF的过表达和敲低效果.结果显示,在HCCC-9810和RBE细胞中,与对照组(Vector)相比,过表达(3 × Flag-CTCF)组中CTCF的蛋白表达水平显著增加,证明成功构建了稳定过表达CTCF的细胞株(图2a);与对照组(shCtrl)相比,敲低组(shCTCF-1和shCTCF -2)中CTCF的蛋白表达水平显著降低,证明成功抑制了内源性CTCF的表达(图2b).
随后,采用CCK-8法评价了CTCF对胆管癌细胞生长能力的影响.结果显示,与对照组相比,过表达CTCF可显著促进HCCC-9810(图2c)和RBE(图2e)细胞的生长能力,而敲低CTCF则显著抑制HCCC-9810(图2d)和RBE(图2f)细胞的生长能力.此外,还通过细胞平板克隆实验以检测CTCF对胆管癌细胞克隆生长能力的影响.结果显示,过表达CTCF可显著促进HCCC-9810和RBE细胞的克隆生长能力(图2g),而敲低CTCF则显著抑制HCCC-9810和RBE细胞的克隆生长能力(图2h).这些结果表明,CTCF可显著促进胆管癌细胞的生长能力.
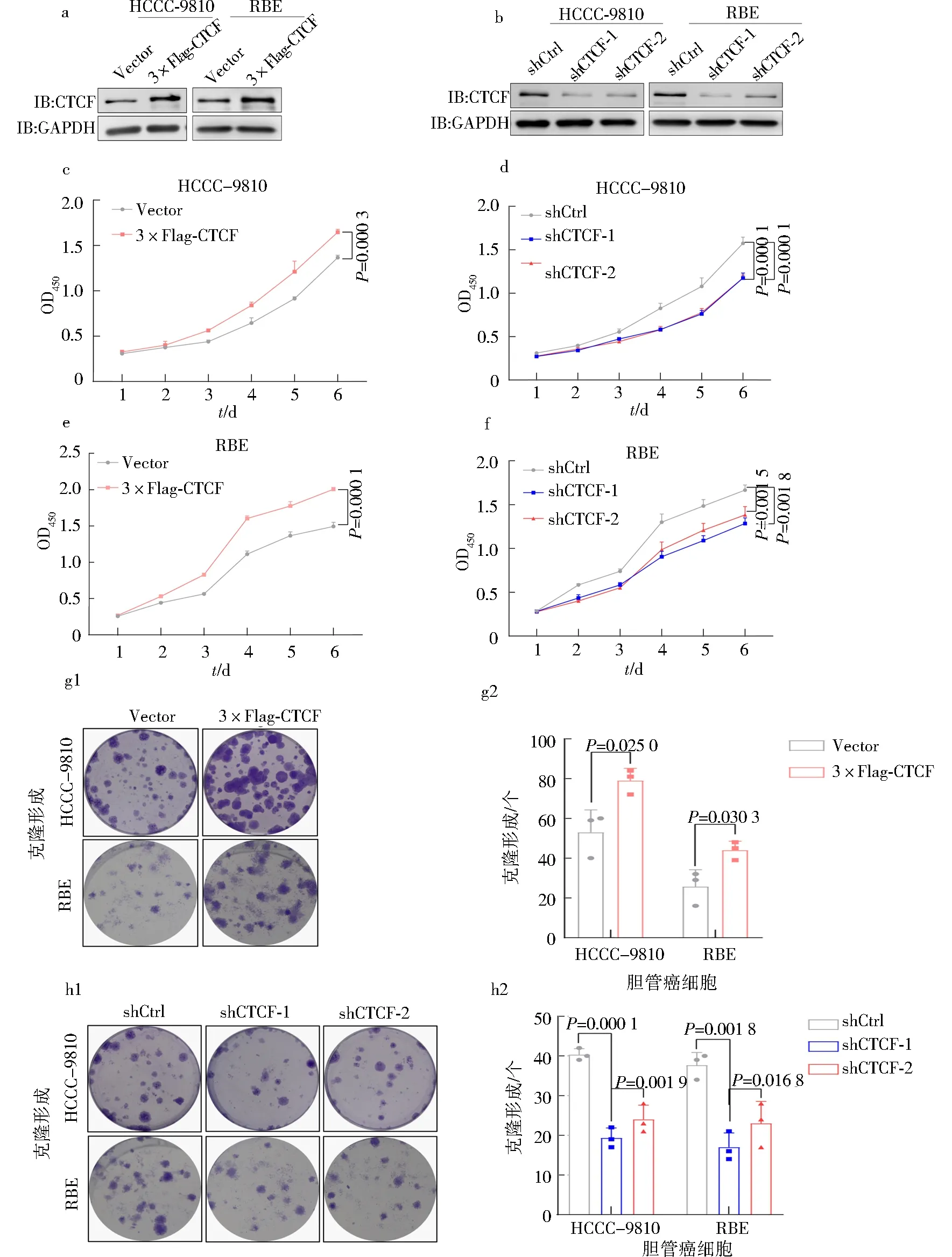
a-b.HCCC-9810和RBE细胞中对照组(Vector)和过表达组(3×Flag-CTCF)、对照组(shCtrl)和敲低组(shCTCF-1及shCTCF-2)中CTCF蛋白表达水平的检测;c-f.CCK-8实验检测过表达或敲低CTCF对胆管癌细胞HCCC-9810和RBE生长的影响;g-h.平板细胞克隆形成实验检测过表达或敲低CTCF对胆管癌细胞HCCC-9810和RBE克隆形成能力的影响图2 CTCF对胆管癌细胞生长能力的影响Fig.2 Effect of CTCF on the cholangiocarcinoma cells growth ability
2.3 CTCF对胆管癌细胞迁移和侵袭能力的影响
为评价CTCF是否影响胆管癌细胞系的迁移及侵袭能力,在胆管癌细胞HCCC-9810和RBE中稳定过表达或敲低CTCF,进而采用不同的Transwell小室进行迁移和侵袭实验.结果显示,过表达CTCF可显著促进胆管癌细胞的迁移和侵袭能力(图3a-b),而敲低CTCF则显著抑制胆管癌细胞的迁移和侵袭能力(图3c-d).上述结果表明,CTCF可显著促进胆管癌细胞的迁移及侵袭能力.
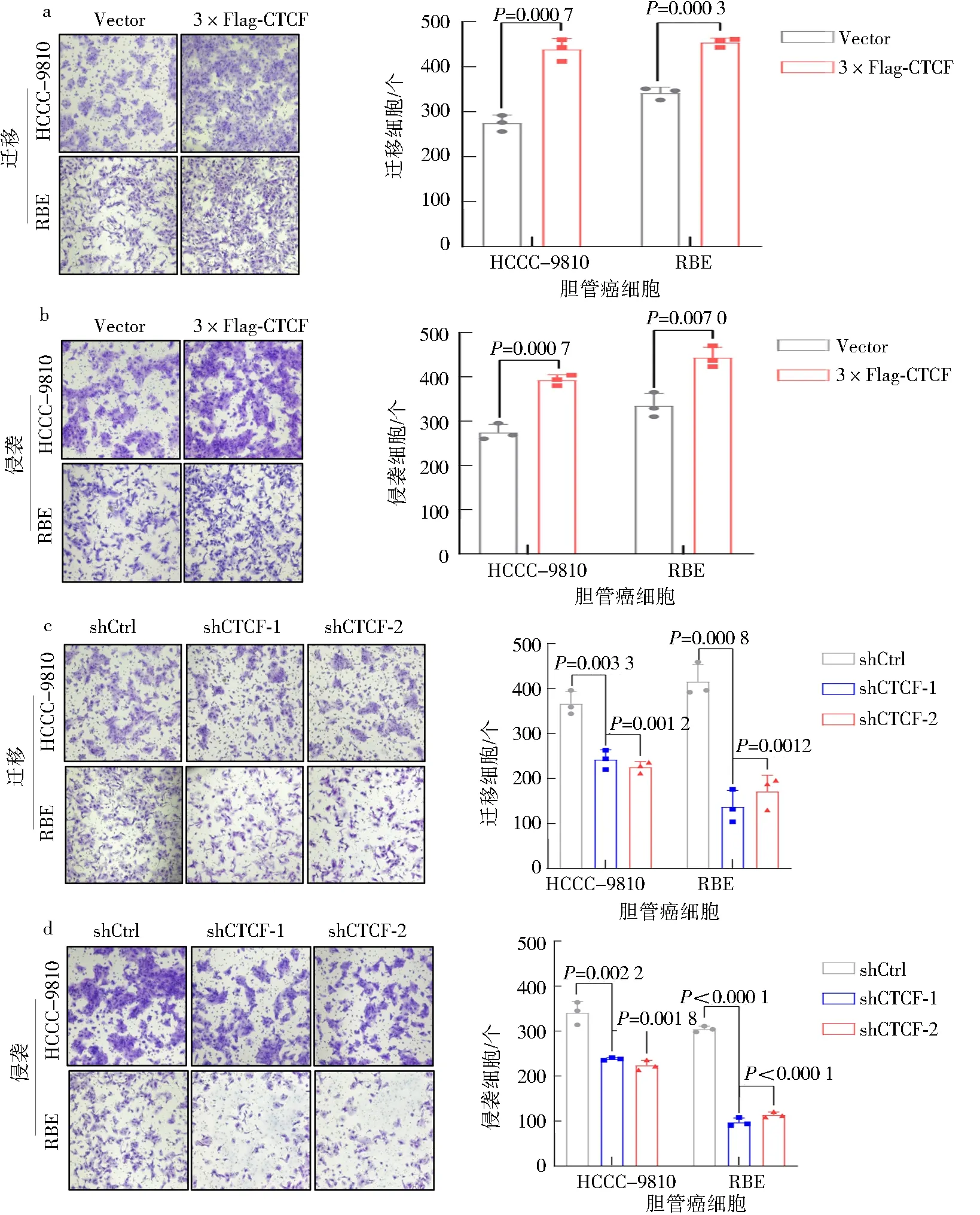
a, c.Transwell小室实验检测过表达或敲低CTCF对胆管癌细胞HCCC-9810和RBE迁移能力的影响;b,d.基质胶Transwell小室实验检测过表达或敲低CTCF对胆管癌细胞HCCC-9810和RBE侵袭能力的影响图3 CTCF对胆管癌细胞迁移和侵袭能力的影响Fig.3 Effect of CTCF on the cholangiocarcinoma cells migration and invasion ability
2.4 CTCF对p53信号通路的影响
将含有255例胆管癌的RNA测序数据集CPTAC,根据癌组织中CTCF基因mRNA表达水平的中值分为高表达和低表达2组,并使用Network Analyst(v2019)进行差异表达分析,结果显示,428个基因存在显著差异表达.进一步使用Enrichr进行富集分析,结果显示,这428个差异表达基因显著富集于p53、血管生成、钙黏素等信号转导通路.此外,还针对该数据集使用全转录组表达矩阵进行了GSEA分析,发现p53下游的靶基因(如编码p21的CDKN1A)显著富集于低表达组,提示CTCF的表达与p53信号通路的活性显著负相关(图4a-b).已有研究报道,在结直肠癌细胞中,CTCF可通过调控p53及其靶基因p21的表达来促进结直肠癌细胞的生长[22].因此,推测,CTCF在胆管癌细胞中可能通过调控p53通路来发挥促癌功能.

a-b.通路富集分析显示低表达组显著富集于p53信号通路;c-f.在HCCC-9810和RBE细胞中敲低CTCF后,p53和p21的表达水平显著增加,而过表达CTCF后,p53和p21的表达水平显著减少;g-h.在HCCC-9810和RBE细胞中过表达或敲低CTCF后,Wb检测p53和p21的蛋白水平变化图4 CTCF对p53通路的影响Fig.4 Effect of CTCF on the p53 signaling pathway
在稳定敲低或过表达CTCF的HCCC-9810和RBE细胞系中,采用qRT-PCR和Wb实验分别检测了p53及其下游的p21蛋白的表达水平.结果显示,在胆管癌细胞HCCC-9810和RBE中过表达CTCF后,与对照相比,p53和p21的转录水平(图4c-d)和蛋白表达水平(图4g)均显著降低;反之,敲低CTCF后,p53和p21的转录水平(图4e-f)和蛋白表达水平(图4h)均显著升高.上述结果初步提示,CTCF在胆管癌细胞中可能通过抑制p53信号转导通路而发挥促癌功能.
2.5 CTCF在胆管癌中的临床相关性研究
进一步探索CTCF在胆管癌中的异常表达情况及其与胆管癌患者预后的相关性.首先,在TCGA-CHOL和GSE107943数据集中分析了CTCF在癌组织和癌旁组织中的表达差异.结果显示,胆管癌组织中CTCF的mRNA表达水平均显著高于癌旁组织(图5a-b).然而,TCGA-CHOL数据集中评估了CTCF的表达水平和患者生存期之间的关系.结果显示,虽然CTCF高表达组的风险比(hazard ratio,HR)大于1,提示CTCF高表达是患者预后的风险因素,但是,由于样本量较少,组间的差异不显著(图5c-d).上述结果表明,CTCF在胆管癌组织中异常高表达,且其高表达可能是胆管癌患者预后的风险因素.

a-b. 在TCGA-CHOL和GSE107943数据集中,CTCF在胆管癌组织中的表达显著高于癌旁组织;c-d.在TCGA-CHOL数据集中,CTCF的表达与胆管癌患者的预后无显著相关性图5 CTCF在胆管癌组织中差异表达分析以及生存分析Fig.5 Differential expression analysis and survival analysis of CTCF in cholangiocarcinoma tissue
3 讨论
近年来,全球胆管癌的发病率呈逐年上升趋势.大多数胆管癌患者因早期没有明显症状,从而错过最佳的治疗时间[23].目前胆管癌的治疗手段仍然非常有限,并且复发率高[24],长期预后差,生存率低[5].因此,深入了解胆管癌相关基因的生物学功能以及作用机制,对胆管癌的防诊治至关重要.
CTCF是一种重要的表观遗传调控因子,涉及多种细胞过程,包括生长、增殖、分化和凋亡等.已有研究显示,CTCF的突变或异常表达与多种肿瘤的发生密切相关[8,14,25],但其在胆管癌中的生物学功能一直未有报道.在本研究中,发现CTCF不仅在胆管癌组织和胆管癌细胞系中显著高表达,同时,细胞学水平初步的功能研究证实其显著促进胆管癌细胞的生长、迁移和侵袭能力,提示CTCF在胆管癌中发挥癌基因的作用.
然而,已有的多项研究发现,CTCF在肿瘤中的功能具有高度的肿瘤异质性.例如,在结直肠癌中,CTCF在结直肠癌的癌组织中显著高表达;并且,CTCF可能通过转录调控抑制p53的表达,从而抑制细胞凋亡、促进细胞存活,发挥癌基因的功能[22].在原发性肝细胞癌(hepatocellular carcinoma, HCC)中,CTCF也作为癌基因通过转录调控FOXM1的表达促进肝癌的进展和转移[21].相反,CTCF在人乳腺癌细胞和组织中的表达显著低于正常乳腺细胞和组织.机制研究提示,CTCF可通过减弱p65与启动子区域的结合能力,抑制NF-κB通路及其靶基因的表达,从而抑制乳腺癌细胞的增殖、迁移和侵袭[26].在前列腺癌中,CTCF发生显著的基因组拷贝数缺失,提示其是潜在的抑癌基因[20].CTCF在肿瘤中功能异质性的机制尚不明确,未来尚需更多的研究.
为探索CTCF在胆管癌中发挥促癌功能的机制,利用TCGA和GSE107943数据集中胆管癌的表达谱数据,通过通路富集分析发现显著差异表达基因可显著富集于p53信号通路.初步的实验也验证CTCF确实能够抑制p53及其下游靶基因p21的表达,提示CTCF在胆管癌细胞中可能通过抑制p53信号转导通路而发挥促癌功能.众所周知,在大多数肿瘤中p53均可发生突变,引起基因组不稳定性,从而增强癌细胞的生长能力及耐药性[27].以往研究也发现,p53突变也广泛存在于胆管癌中.因此,CTCF在胆管癌中调控p53等信号通路的详细机制仍有待进一步的深入研究.
总之,本课题组发现CTCF在胆管癌中可能发挥癌基因的功能,并初步揭示了其在胆管癌进展中的机制线索.未来我们将进一步探索CTCF在胆管癌发生发展过程中的肿瘤生物学功能和分子机制,以期为研发新的胆管癌防诊治措施提供理论依据.
