贝莱斯芽孢杆菌YX-3的筛选鉴定及其抑菌效果
2022-12-22欧阳晓伦陈昭窦鑫张洪奇高亚梅晏磊邱化蛟王伟东
欧阳晓伦,陈昭,,窦鑫,张洪奇,高亚梅,晏磊,邱化蛟,王伟东
(1.黑龙江省寒区环境微生物与农业废弃物资源化利用重点实验室/黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.粮食副产物加工与利用教育部工程研究中心;3江苏进化树生物科技有限公司;4中国农业科学院麻类研究所)
生物防治(biological control)是利用有益生物及其产物控制或消灭有害生物的防治技术,常用于植物病虫害的治理。芽孢杆菌具有形成芽孢、产生多种抗菌活性物质以及促进植物生长的特性,这些特性使芽孢杆菌属被认为是一种很有前途的生物防治菌[1-2]。迟惠荣等[3]从多花黄精的根部分离出贝莱斯芽孢杆菌ZJU-3,该菌能够产生表面活性素、泛革素和伊枯草菌素等脂肽类化合物,其对尖孢镰刀菌(Fusarium oxysporum)具有拮抗作用。贝莱斯芽孢杆菌能够有效预防由子囊菌引起的植物真菌性病害,例如,从种植番茄的园艺大棚土壤中分离到贝莱斯芽孢杆菌S6,发酵液原液和100倍稀释液对由番茄早疫病原菌(Alternaria solani)和灰霉病原菌(Botrytis cinerea Pers.)引起番茄早疫病的田间防治效果分别为80.83%和64.88%[4]。Sun等[5-6]从梨园根际土壤中分离到一株贝莱斯芽孢杆菌L-1,其对贝伦格葡萄座腔菌和粉红单端孢菌等梨轮纹病菌的抑制率达到了76.55%。如今,以植物有益的芽孢杆菌为基础的制剂是目前生物农药市场上使用最广泛的制剂[7]。贝莱斯芽孢杆菌最初于西班牙贝莱斯河水中分离[8],普遍存在于植物组织、水体、土壤、空气及发酵食品等环境中[9-11]。贝莱斯芽孢杆菌具有几个明显的优势,包括特定地定植在给定作物的某些部分,形成生物膜,产生抗微生物代谢物,并诱导植物的系统抗性[12-14]。镰刀菌属拥有多种致病菌,可引起植物的萎蔫、穗腐和根腐等多种病症,如小麦赤霉病、玉米穗粒腐病和根腐病,已成为世界上重要的致病真菌之一[15]。弯孢菌能侵染水稻,高粱、玉米、番茄、辣椒、香蕉、唐菖蒲等多种作物及花卉,甚至可引起严重的病害[16]。弯孢菌是引起玉米叶斑病的主要病原菌,其中新月弯孢菌的致病性最强[17-18]。水稻易受到各种病害的危害,其中最具破坏性的是稻瘟病,稻瘟病每年造成水稻产量损失10%~30%,在疾病流行期间产量损失可达到50%[19-20]。
为了分离出对多种植物病害真菌具有生防潜力的拮抗细菌,从银杏果实外种皮中分离到一株贝莱斯芽孢杆菌YX-3,并进行了对藤仓镰刀菌等几种菌的拮抗作用研究,期待为该株作为生防菌的菌剂生产及田间病害生物防治提供依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株分离样品来源
供菌株分离筛选的银杏外种皮来源江苏省徐州市邳州市银杏种植林。
1.1.2 试验病原菌
试验的供试病原菌灰梨孢菌(Pyricularia oryzae)、禾谷镰刀菌(Fusarium graminearum)、藤仓镰刀菌(Fusarium fujikuroi)、新月弯孢菌(Curvularia lunata)、串珠镰刀菌(Fusarium moniliforme)、尖孢镰刀菌(Fusarium oxysporum)由黑龙江省寒区环境微生物与农业废弃物资源化利用重点实验室提供。
1.1.3 培养基
PDA培养基、LB培养基、NA培养基、淀粉水解培养基、明胶液化培养基、V-P培养基、甲基红培养基、柠檬酸盐利用培养基、葡萄糖氧化发酵培养基(含酚红指示剂)、基础培养基[21-22]。
1.2 试验方法
1.2.1 菌株YX-3的分离
银杏外种皮的表面消毒:首先,挑选外表皮完好的银杏果实,用纯净水冲洗表面附着的沙尘及土壤等大颗粒杂质,用滤纸吸干水分。然后对银杏果实进行表面消毒,第一步在超净台中,将银杏果实放在含有效氯1%的次氯酸钠溶液中浸泡5 min,接着使用无菌水缓慢充分冲洗5次;第二步使用75%乙醇溶液浸泡3 min,接着使用无菌水缓慢充分洗涤3次;最后使用1%升汞浸泡1 min,接着用无菌水缓慢充分冲洗5次。
表面消毒效果验证:取最后一次冲洗后的废液30 μL分别在PDA及LB培养基进行涂布,置于28℃中培养7 d,观察是否有菌落的生长。
菌株YX-3分离、纯化:在超净台中将表面消毒后的银杏果实剥离其果核,将外种皮的果肉部分贴附在LB培养基及PDA培养基上,每个培养基设5个重复,然后置于25℃黑暗培养,连续观察7 d,待有菌落生长,马上使用接种针挑取,在LB和NA培养基中划线培养,直至分离纯化出单一的菌落。
1.2.2 菌株YX-3形态学及生理生化特性研究
参考《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》的研究方法,对菌株YX-3分别进行淀粉水解试验、明胶液化试验、V-P试验、甲基红试验、硫化氢产气试验、柠檬酸盐试验、葡萄糖氧化发酵试验、碳源利用试验、接触酶利用试验,对菌株YX-3进行生理生化特性研究[21-22]。
1.2.3 分子生物学鉴定
使用细菌基因组DNA提取试剂盒(天根生化科技有限公司)提取菌体DNA,通用引物27F/1492R进行PCR扩增,送上海派森诺科技有限公司进行测序。用BLAST软件将所得序列与GenBank数据库进行同源性比对分析。
1.2.4 贝莱斯芽孢杆菌YX-3的生长曲线测定
将贝莱斯芽孢杆菌YX-3接种在NA固体培养基,28℃培养24 h,以较大量挑取贝莱斯芽孢杆菌YX-3的菌落接种于100 mL/250 mL NA液体培养基,28℃,200 rpm恒温摇床培养24 h得贝莱斯芽孢杆菌YX-3种子液。取贝莱斯芽孢杆菌YX-3种子液以1%接种量接种于100 mL/250 mL NA液体培养基,28℃,200 rpm恒温摇床培养,重复3组。每间隔6 h取样1 mL,使用紫外分光光度计测OD600值,使用Graphpad prism 8软件作图。
1.2.5 贝莱斯芽孢杆菌YX-3对6种病原菌的抑菌活性
取已于PDA培养基,28℃培养7 d的试验病原菌,在菌落最外周处使用φ6.5mm打孔器打取菌饼,接种在空白PDA培养基中心处,置于28℃培养3 d,将已培养24 h的菌株YX-3点样接种于距离菌饼中心25 mm处,以只接种病原菌的PDA培养基作为空白对照组,每种病原菌重复3组,置于28℃继续培养7 d。观察病原菌生长直径。
抑菌率公式如下:抑制生长率(%)=(对照组净生长直径-处理净生长直径)/对照组净生长直径×100%
1.2.6 数据统计与分析
应用软件IBM SPSS 19.0对数据进行单因素方差分析和多重比较(LSD)、邓肯(Duncan)法进行样本间差异显著性分析,使用Graphpad prism 8软件作图。
2 结果与分析
2.1 贝莱斯芽孢杆菌YX-3形态学及生理生化特性研究
贝莱斯芽孢杆菌YX-3菌落呈乳白色,边缘光滑,培养5 d后菌落由饱满转变为中心处塌陷,革兰氏染色结果为阳性(见图1),菌体呈杆状,大小约0.5×3.1 μm(图1-A),芽孢大小大小约为0.5×1.0 μm(图1-B)。生理生化试验结果如表1所示。
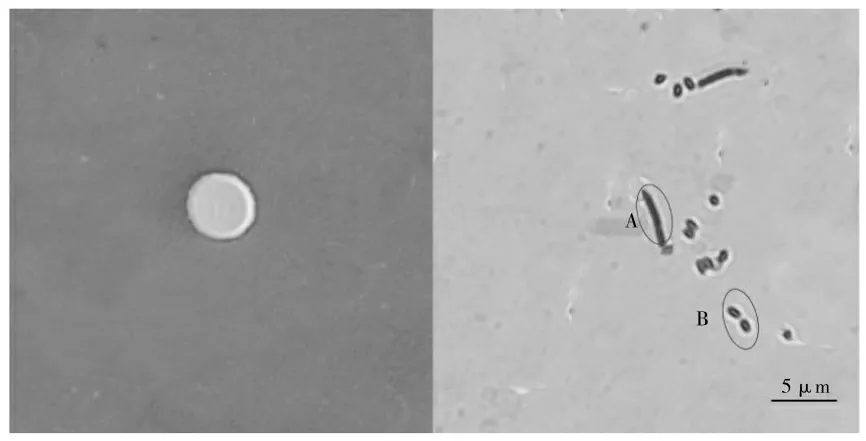
图1 贝莱斯芽孢杆菌YX-3的菌落形态及革兰氏染色(×100)Fig.1 Colony morphology and gram staining of Bacillus velezensis YX-3(×100)

表1 贝莱斯芽孢杆菌YX-3生理生化试验结果Table 1 Physiological and biochemical test results of Bacillus velezennsis YX-3
2.2 贝莱斯芽孢杆菌YX-3的生长曲线测定
如图2所示,0~24 h贝莱斯芽孢杆菌YX-3的增长速度较慢,为其延缓期。24~48 h其增长速度较快,为对数期。48~72 h细胞数几乎不变,为其平稳期,72 h后OD开始下降,是由于其细胞数的减少及芽孢的形成,芽孢的吸光值低于活体细胞,故为衰亡期。
2.3 分子生物学鉴定结果
将菌株YX-3测序后,NCBI数据库进行blast比对,比对结果显示:菌株YX-3为贝莱斯芽孢杆菌(Bacillus velezennsis);将菌株YX-3的序列通过MAGE 7.0软件构建系统发育树,结果如图3所示。

图2 贝莱斯芽孢杆菌YX-3的生长曲线Fig.2 The growth curve of the of Bacillus velezensis YX-3

图3 贝莱斯芽孢杆菌YX-3及相关菌株构建的系统发育树Fig.3 Phylogenetic tree of Bacillus velezensis YX-3 and its related strains
2.4 贝莱斯芽孢杆菌YX-3对6种病原菌的抑菌活性
贝莱斯芽孢杆菌YX-3对6种病原菌均表现出拮抗作用,其中一组对峙试验如图4所示,抑菌率均在50.0%以上。贝莱斯芽孢杆菌YX-3对藤仓镰刀菌的拮抗作用较强,抑菌率为69.19%±0.24%。对灰梨孢菌、禾谷镰刀菌、新月弯孢菌、串珠镰刀菌及尖孢镰刀菌的抑菌率分别为63.74%±0.68%、68.02%±0.89%、64.92%±0.49%、66.28%±0.03%;对新月弯孢菌的拮抗作用较弱,抑菌率为60.47%±0.09%。
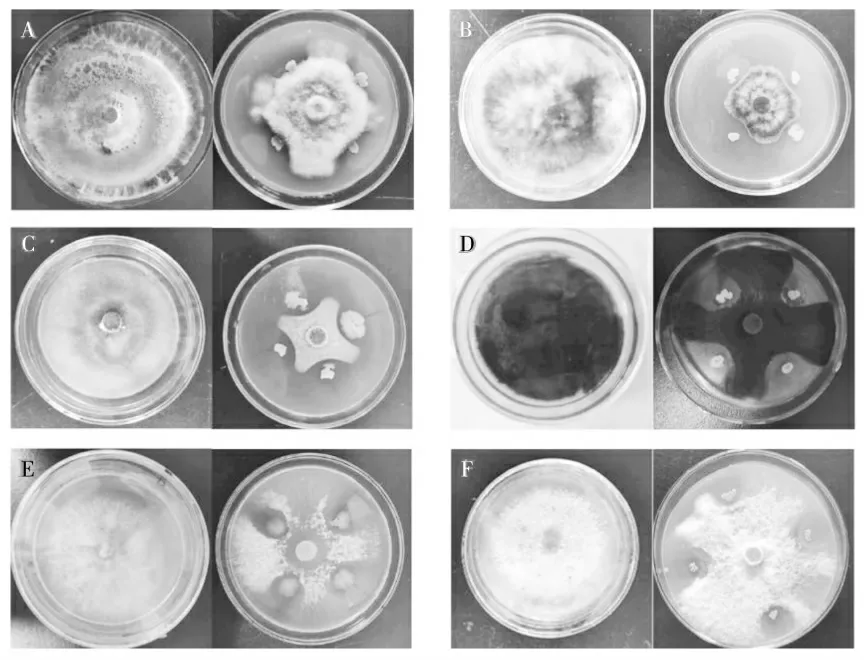
图4 贝莱斯芽孢杆菌YX-3对6种植物病原菌平板对峙Fig.4 The antagonism of the Bacillus velezennsis YX-3 to 6 plant diseases
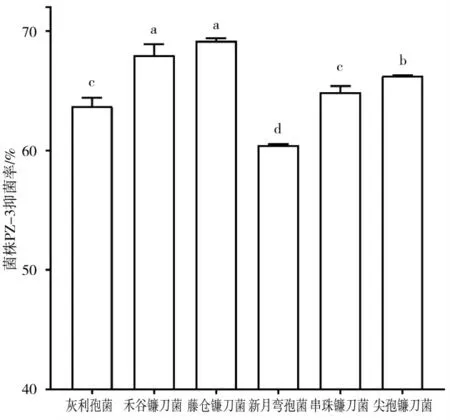
图5 贝莱斯芽孢杆菌YX-3对6种病原菌的抑菌率(P<0.01)Fig.5 Inhibition rate of Bacillus velezensis YX-3 to 6 kinds of pathogens(P<0.01)
3 结论
芽孢杆菌作为一类防治植物病害的重要生物资源,其主要抑菌物质来源于自身产生的蛋白、脂肽、挥发类物质,并能促使植株分泌一定的拮抗物质及促生长物质[23]。此外,芽孢杆菌次级代谢物能诱导植物对潜在的植物病原菌产生系统性抗性,部分产酸芽孢杆菌还能增强作物的抗逆性[24-25]。贝莱斯芽孢杆菌在早期时被认定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的同物异名种[26],Dunlap和Fan等[27-28]研究表明,解淀粉芽孢杆菌、暹罗芽孢杆菌(Bacillus.siamensis)和贝莱斯芽孢杆菌(包括Bacillus.velezensis、Bacillus.methylotrophicus和Bacillus.amyloliquefaciens sp.Plantarum)应保持其自身物种的分类地位。贝莱斯芽孢杆菌主要从植物和土壤中分离,并展现出对植物病原真菌的拮抗作用。李永丽等[29]分离自新疆野苹果的内生贝莱斯芽孢杆菌Mr12对南天竹炭疽病菌、小麦赤霉病菌及葡萄座腔菌等多种植物病原菌具有抑制作用,其中以对南天竹炭疽病菌的抑菌效果最强达91.17%。贝莱斯芽孢杆菌ZSY-1从梓树中分离,其产生的挥发性有机物能有效抑制茄链格孢菌、葡萄孢菌、桃褐腐病菌,以对葡萄孢菌的抑制率达93.8%[30]。贝莱斯芽孢杆菌XT-1由Marta等[31]从盐碱土地中分离出,其对桃褐腐病菌的抑菌率超过80%。Myo等[32]对分离自青海祁连山土壤的芽孢杆菌NKG-2的代谢产物对尖孢镰刀菌的抑制作用为60%,代谢产物中的挥发性物质对禾谷镰刀菌的抑制率为57%。贝莱斯芽孢杆菌HC6分离于健康仔猪的肠道,其对禾谷镰刀菌的抑制能力最强,抑制率约为60.3%[33]。贝莱斯芽孢杆菌8-4对加利链霉菌、燕麦镰刀菌和辣椒炭疽病菌等马铃薯病原菌均有抑制作用,其对辣椒炭疽病菌的拮抗活性最高67.84%[34]。
综上所述,贝莱斯芽孢杆菌已从多种环境中分离出来,并展示出对植物病原菌的抑制作用,但由于菌株特异性基因簇的存在,不同菌株的活性可能存在差异,因此,由于产生了特殊的酶和代谢物,它们在抑制病原体和促进植物生长等方面都起着重要的作用[35-36]。目前,在玉米真菌病害防治中使用的微生物菌株主要为蜡状芽孢杆菌、解淀粉芽孢杆菌及假单胞菌等[37],其中蜡状芽孢杆菌B25在PDA中对轮枝镰刀菌的抑制率仅有53%,但其菌剂于田间试验中,将由轮枝镰刀菌引发的茎腐和穗腐病分别降低了50%和76.3%[38]。研究中的贝莱斯芽孢杆菌YX-3分离自银杏外种皮,该菌株在平板对峙试验中,对引起玉米、水稻及大豆等作物根腐病害的镰刀菌及灰梨孢菌等有抑制作用,其抑菌率达60%以上,对引起玉米根腐及穗腐病害的藤仓镰刀菌,其抑菌率达69.19%,一方面,证实了贝莱斯芽孢杆菌YX-3的抗菌广谱性,对由多种镰刀菌共同侵染所致的根腐及穗腐具有潜在的防治作用,另一方面其在平板对峙中有较好的抑菌效果,其有望于大田试验和大田生产中得到应用。研究拓展了其在玉米、水稻及小麦等重要粮食作物的微生物病害防治。后续研究将在研究基础上,提取、分离纯化菌株发酵液的主要抑菌活性成分,深入探究贝莱斯芽孢杆菌YX-3的抑菌机理、防病效应及其稳定性。
4 结论
从银杏外种皮中分离获得的菌株YX-3,经鉴定确定为贝莱斯芽孢杆菌,其对藤仓镰刀菌、灰梨孢菌、禾谷镰刀菌、新月弯孢菌、串珠镰刀菌及尖孢镰刀菌抑菌率均超过60%,贝莱斯芽孢杆菌YX-3对引起禾本科作物病害的真菌有较好抑制效果,对藤仓镰刀菌的抑制能力较强,而对新月弯孢菌较弱。
