改性废利乐包炭材料对苯酚的吸附研究*
2022-12-21刘文贵
刘文贵
(1.福建省环境科学研究院,福建 福州 350013;2.福建省环境工程重点实验室,福建 福州 350013)
1 概述
苯酚是一种具有毒害作用且难以降解的原型质毒物,广泛存在于石油化工、印染、焦化、木材加工等行业排放废水中,可对水体及水生物造成非常严重的危害,人类长期摄入被苯酚污染的水会诱发多种神经系统疾病[1-2]。因此,研究更加有效、经济的废水脱酚技术显得尤为必要。
废水中苯酚处理手段有吸附法、氧化法、萃取法,以及生物降解法等,而吸附法由于成本低廉、工艺简单、效果优良,已成为常用且有广阔前景的含酚废水处理技术[3-4]。
目前常用的吸附剂如沸石、活性炭等因较高的使用成本限制了其在实际工业废水处理中的应用。因此,开发廉价、高效的新型吸附剂已成为研究的主要方向[5-6]。炭材料具有比表面积大、孔隙发达、吸附能力强等特点,在含酚废水处理领域有着广泛的应用[1]。通过掺杂、活化、负载等改性方式,可改变炭材料的孔隙结构和表面理化性质,从而显著提升其对特定物质的吸附选择性和吸附容量[7-8]。
在我国,每年会产生大量的废弃复合包装物,利用其制备炭材料易于实现。采用废旧利乐包作为原料,将其高温热解炭化并改性后作为废水中苯酚的吸附剂在国内尚未见报道。本研究在单因素试验基础上进行响应曲面优化实验,探究不同因素对改性废利乐包炭材料吸附废水中苯酚的影响,找出最佳吸附工艺条件。通过扫描电镜(SEM)、全自动比表面积/孔径分析仪(BET)和傅里叶变换红外光谱(FTIR)对改性后的炭材料的结构特征、理化性质进行表征分析,并利用等温吸附和吸附动力学曲线对吸附机理进行深入探究。
2 材料与方法
2.1 材料和仪器
2.1.1 主要材料
废旧利乐包,拆解清洗、干燥备用。苯酚、NaOH、KOH、HCl、国药试剂等,以上均为分析纯。
2.1.2 主要仪器
扫描电镜(日本电子)、全自动比表面积/孔径分析仪(日本拜尔)、紫外光分光光度计(日本岛津)、台式恒温振荡箱(上海圣科)。
2.2 炭材料的制备与改性
2.2.1 炭材料的制备
将废旧利乐包裁剪分解成纸质纤维、PE薄膜和铝箔三部分,并将纸质纤维和PE薄膜裁切为碎片,取一定质量碎片置于管式炉中热解炭化。炭化过程保持120mL/min的N2吹扫,升温速率5℃/min,到600℃时保持120min,将制备的炭材料研磨备用。
2.2.2 炭材料的改性
将KOH和制备出的炭材料按1∶3混合,研磨至均匀置于管式炉内,保持120mL/min的N2吹扫,升温速率10℃/min,至700℃时保持60min。冷却至室温后用去离子水洗涤至滤液pH值恒定,鼓风干燥后得到本研究所用改性炭材料。
2.3 实验方法
2.3.1 苯酚的测定
苯酚的测定采用纳氏试剂分光光度计法(270nm波长),吸附容量计算公式如式(1):
Qe=[(C0-Ce)V]/m
(1)
式(1)中,Qe为苯酚平衡时的吸附容量,单位为mg/g;V为苯酚废水体积,单位为L;m为吸附剂质量,单位为g。
2.3.2 扫描电镜(SEM)分析
采用扫描电子显微镜观察炭材料的表面形态,测试前先喷金60s,放大倍数10000倍。
2.3.3 比表面积(BET)分析
利用全自动比表面积/孔径分析仪,以BET液氮吸附法(77 K)进行N2吸附,测定改性后炭材料的表面积、孔容和孔径。
2.3.4 傅里叶红外光谱(FTIR)分析
用红外光谱仪测定炭材料的红外谱图,扫描范围400~4000 cm-1,分辨率4.0 cm-1。
2.3.5 吸附动力学试验
称取0.075 g改性炭材料加入到100 mL初始浓度为140 mg/L的苯酚溶液中,pH值调节为6后置于恒温振荡器内分别振荡4h、8h、12h、14h、16h、18h、20h、22h和24h,过滤后测定上清液的苯酚含量。
2.3.6 吸附等温线试验
取0.05g改性炭材料依次加入到50 mL浓度分别为50mg/L、80mg/L、100mg/L、120mg/L、140mg/L、160mg/L、200mg/L的苯酚溶液中,pH值调节为6后,置于恒温振荡器内振荡24h,过滤后测定上清液的苯酚含量。
2.3.7 响应曲面试验
根据单因素试验数据,pH=6,炭材料投加量0.075g,苯酚浓度140mg/L时改性炭对苯酚吸附容量达到53mg/g以上。由Box-Behnken设计原理,将炭材料投加量(X1)、初始浓度(X2)、pH值(X3)设置为变量因素,吸附容量设置为响应值,由此设计响应曲面试验,编码表如表1所示。
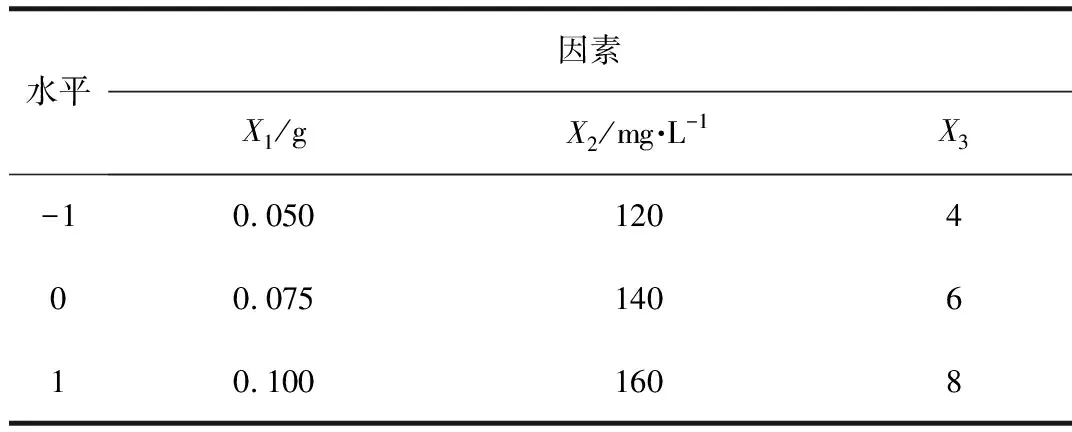
表1 Box-Behnken 实验设计因素与水平
3 结果与讨论
3.1 改性炭材料表征
3.1.1 扫描电镜(SEM)分析
图1(a)和图1(b)分别为改性前与改性后废利乐包炭材料扫描电镜图(放大10000倍)。从图中可以看出,改性前炭材料表面呈现纤维状,这是典型的木质纤维素结构,表面存在少量孔洞。改性后炭材料仍保持部分的纤维结构,但材料表面孔洞结构明显增加,大小不一,呈随机分布。这些孔洞结构的产生一部分来自于改性过程中部分有机物质高温分解挥发作用,另一部分则可能是因为KOH对纤维表面的高温刻蚀过程引起的[9-10]。孔洞的增加有利于提升炭材料对苯酚的吸附能力,前期单因素实验结果显示,在苯酚浓度为140mg/L、吸附16h的条件下,以改性前后炭材料分别作为吸附剂时,炭材料对苯酚的吸附容量由16mg/g显著提升至47mg/g。
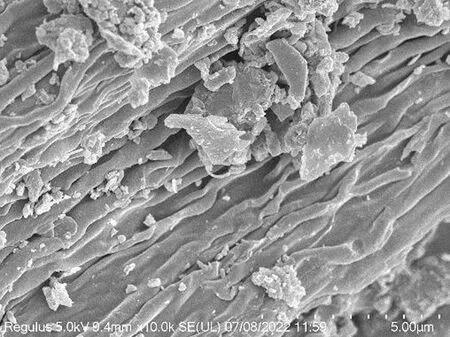
(a) 改性前
3.1.2 比表面积(BET)分析
改性后废利乐包炭材料比表面积值为133.24m2/g,略大于其他研究报道的热解生物炭BET值[6,9],总孔容为0.166cm3/g,平均孔径为4.988nm。制备得到的改性废利乐包炭材料属于介孔材料(孔径2~50nm),与SEM表征显示的孔隙形态特征相吻合。
3.1.3 傅里叶红外光谱(FTIR)分析
改性废利乐包炭材料的傅里叶红外谱图如图2所示,3423.08cm-1处存在一个较为显著吸收峰,是由纤维素中的-OH振动产生;在1423.36cm-1处为纤维素的C=C和C=O键的振动造成的,说明改性炭材料具有芳香族网状结构,且掺杂有大量的氧原子;C-O-C的伸缩振动使得红外谱图在1001.22cm-1处出现吸收峰,而在873.72cm-1处对应的则是Si-O和C-O键的振动,是脂肪烃侧链的特征表现[11-12]。
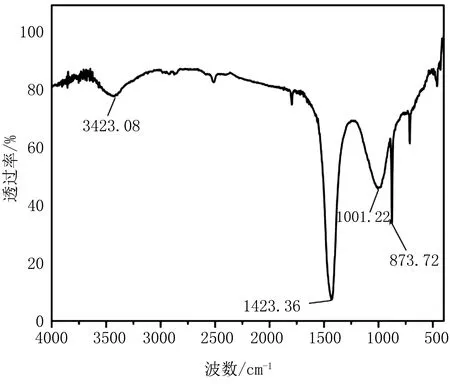
图2 改性废利乐包炭材料的FTIR图
3.2 吸附动力学
如表2所示,相较于颗粒内部扩散模型和准二级动力学模型,Lagergren准一级动力学模型方程的拟合度更好,达到0.98857,证明利用该模型能够更加准确地描述改性废利乐包炭材料吸附苯酚的动力学特性。而准一级动力学方程吸附的主要影响因素是分子间作用力[11,13],反映出该改性炭材料吸附苯酚的过程是以物理吸附为主。
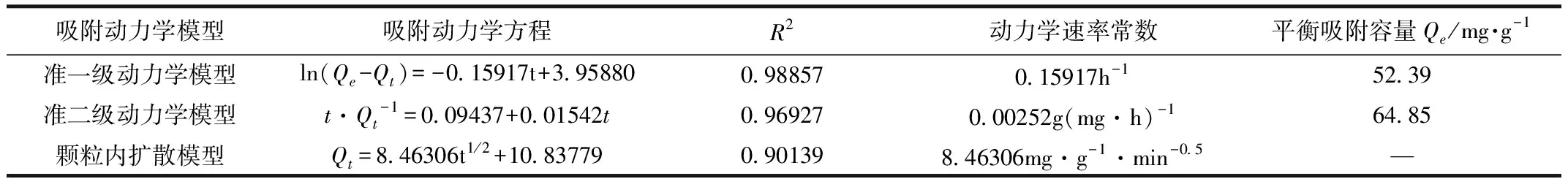
表2 改性炭材料对苯酚的吸附动力学参数
3.3 吸附等温线
利用常用的两种吸附等温方程分别对废利乐包炭材料吸附苯酚的数据进行拟合,结果如表3所示。两种等温吸附方程均能较好地描述常温下改性炭材料对苯酚的吸附行为,但Langmuir方程的相关系数更高,因此该吸附过程是主要以单分子层吸附为主[14]。

表3 改性炭材料对苯酚的等温吸附曲线参数
3.4 响应曲面分析
依据表4设计本研究的响应曲面实验,模型的方差分析如表5所示,可得到响应曲面二次回归方程:Y=51.80-1.62X1+4.50X2-0.38X3-0.75X1X2+0.000X1X3-0.25X2X3-5.15X12-19.40X22-0.65X32。

表4 响应曲面实验方案及结果
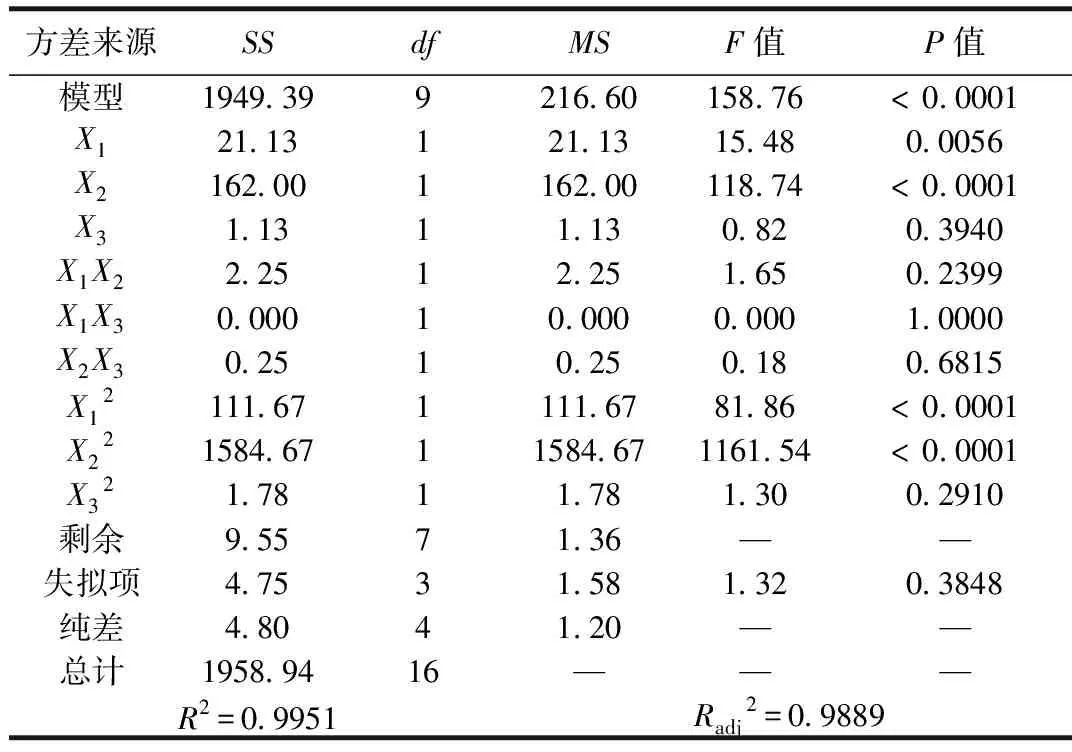
表5 回归模型方差分析表
各因素对响应值的影响显著性情况由P值大小反映,由大到小的影响显著性排序为苯酚初始浓度>投加量>pH值。预测最优条件为:投加量0.07g,苯酚初始浓度142.43mg/L,pH值5.37,此条件下的预测吸附容量为52.27mg/g。据此,本研究按照预测最优条件设置实验参数(投加量0.07g,苯酚初始浓度142mg/L,pH值5.3),实际测得改性生物质炭对苯酚的吸附容量为51mg/g,对比响应曲面模型预测值的误差仅为2mg/g,因此说明经响应曲面优化后的确定的工艺参数较为可靠。
图3~图5展示了改性废利乐包炭材料吸附苯酚的响应曲面。从图3、图4可直观看出,苯酚初始浓度和炭材料投加量的交互作用及pH值和苯酚初始浓度的交互作用对苯酚吸附容量的影响显著;而图5显示,pH值和炭材料投加量交互作用对苯酚吸附容量的影响不显著,随着pH值和炭材料投加量的增加,响应曲面逐渐趋向平直。
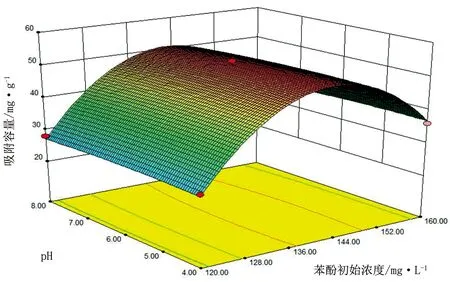
图4 pH值和苯酚初始浓度的交互作用对吸附容量的响应曲面图

图5 pH值和炭材料投加量的交互作用对吸附容量的响应曲面图
4 结论
①废利乐包炭材料经KOH改性后,炭材料仍保持部分的纤维结构,但材料表面孔洞结构明显增加,大小不一,呈随机分布。孔洞的增加有利于提升炭材料对苯酚的吸附能力,在苯酚浓度为140mg/L、吸附16h的条件下,以改性前后炭材料分别作为吸附剂时,炭材料对苯酚的吸附容量由16mg/g显著提升至47mg/g。改性后废利乐包炭材料比表面积值为133.24m2/g,平均孔径为4.988nm,总孔容为0.166cm3/g,所制备得到的改性炭材料属于介孔材料。
②Lagergren准一级动力学模型能够更加准确地描述改性废利乐包炭材料吸附苯酚的吸附动力学特性,吸附过程是以物理吸附为主。
③利用Langmuir模型能更好地模拟常温下改性炭材料对苯酚的吸附行为,该吸附过程以单分子层吸附为主。
④通过响应曲面分析可得在改性废利乐包炭材料对苯酚的吸附过程中,对苯酚吸附容量的影响显著性顺序为:苯酚初始浓度>炭材料投加量>pH值;模型预测最优条件为:炭材料投加量为0.07,苯酚初始浓度为142.43mg/L,pH值5.37,此条件下实测吸附容量为51mg/g。
