共培养条件下大鼠骨髓间充质干细胞分化为胰岛样细胞团的研究
2022-12-21刘鑫岑妍慧贾微杨瑞李森姜娜黄泽萍宁志莹黄威
刘鑫 岑妍慧 贾微 杨瑞 李森 姜娜 黄泽萍 宁志莹 黄威
广西中医药大学组织学与胚胎学教研室,南宁 530200
糖尿病是影响人类健康的主要疾病之一,除外源性胰岛素治疗外,胰岛移植是目前较理想的治疗方法,但面临胰岛供体短缺、移植排斥和手术后遗症等问题,制约了其在糖尿病治疗领域的临床应用。因此寻找可替代的其他来源的胰岛β细胞成为近年研究的热点。干细胞诱导分化为胰岛细胞是目前重要的研究方向之一,骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)是骨髓中除造血干细胞以外的另一种多能干细胞,既可分化为造血组织,又可分化为造血以外的组织细胞,取材方便,容易进行体外分离、培养和纯化。目前一些研究均表明特定的诱导剂或培养体系可使BMSCs定向分化为胰岛细胞[1-3],也有研究者使用共培养体系对BMSCs进行诱导分化[4-5],但其主要探讨共培养体系对BMSCs功能改变的影响,而对于诱导过程中BMSCs形态变化的动态观察、胰岛素分泌量、表达特征及超微结构的变化等方面未见有关报道。本研究将大鼠胰岛细胞与BMSCs共培养作为诱导体系,最大程度模拟类似胰腺的微环境,探讨BMSCs在与胰岛细胞共培养后分化为胰岛样细胞团的可能性,以期为胰岛移植的临床应用奠定基础。
材料与方法
一、BMSCs的分离、纯化与鉴定
健康SPF级成年Wistar大鼠12只,购自广西中医药大学实验中心(动物许可证号:桂医动字第11004号)。无菌条件下取大鼠的股骨及胫骨,用含10%胎牛血清的低糖DMEM培养液冲洗骨髓腔获取骨髓(DMEM培养液、胎牛血清均购自美国Hyclone公司),稀释后加入淋巴细胞分离液(比重1.077 kg/L)离心,吸取白膜层细胞,加入含10%胎牛血清的低糖DMEM培养液进行培养。待细胞铺满瓶底70%~80%面积时,使用2.5 g/L的胰蛋白酶消化传代,取对数生长期细胞,流式细胞仪检测BMSCs表面标志物CD44和CD90;行成骨方向诱导分化及成脂肪方向诱导分化,以明确BMSCs的干细胞性质和特性。诱导分化具体操作:取第5代细胞,更换为成骨诱导培养液(10%胎牛血清的低糖DMEM,1×107mmol/L地塞米松、10 mmol/L β-甘油磷酸钠和50 μg/ml维生素C),连续诱导培养4周后细胞行茜素红染色;或更换为成脂肪诱导培养液(10%胎牛血清的高糖DMEM,1 μmol/L地塞米松、0.5 mmol/L的3-异丁基-1-甲基黄嘌呤、100 μmol/L吲哚美辛和10 mg/L胰岛素),连续诱导培养4周后细胞行油红O染色。
二、胰岛的分离、纯化和鉴定
向大鼠胆总管内逆行注入浓度为1 mg/ml的V型胶原酶消化胰腺,将获得的细胞悬液使用Percoll不连续密度梯度离心法获取胰腺内分泌部的细胞团——胰岛,将其悬浮于完全培养液(DMEM培养基、15%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素、2 mmol/L谷氨酰胺、4 U/ml肝素)中,接种于96孔培养板,置37℃、5% CO2培养箱培养28 d,倒置相差显微镜下观察胰岛的细胞形态和生长状况。取胰岛细胞悬液与双硫腙溶液混匀,室温下放置10 min,因双硫腙可与胰岛β细胞胞质内分泌颗粒中的锌离子螯合使胰岛β细胞的胞质呈铁红色,故在倒置相差显微镜下计算每个胰腺的胰岛数。
采用ELISA法检测胰岛细胞培养液的基础胰岛素水平,试剂盒购自美国Bioswamp公司;取完全培养基培养2 d的胰岛细胞,弃培养液,用PBS清洗后,分别加入含葡萄糖5.6 mmol/L(低糖)和25.0 mmol/L(高糖)的培养液继续培养2 h,收集培养液,采用ELISA法检测胰岛素释放量。
三、与胰岛共培养条件下BMSCs的诱导分化
取第5代BMSCs和纯化的胰岛细胞,随机分为干细胞单独培养组(干细胞组)、干细胞-胰岛细胞共培养组(共培养组)和胰岛细胞单独培养组(胰岛组)。各组细胞均采用含10%胎牛血清的低糖DMEM培养液培养,诱导28 d后进行检测。(1)形态学特征:倒置相差显微镜下观察细胞的形态学特征和生长特性。(2)基础胰岛素水平:采用ELISA法检测培养液中的基础胰岛素水平。(3)胰岛素释放量:采用ELISA法检测胰岛组和共培养组培养液中的胰岛素释放量。(4)胰岛样细胞团胰岛素的表达:采用免疫细胞化学染色法检测共培养组诱导形成的胰岛样细胞团胰岛素蛋白表达情况。胰岛素抗体购自美国Bio-Rad公司,抗胰岛素多克隆抗体工作浓度为1∶200。最后苏木精复染、封片。以细胞质内出现棕黄色为胰岛素阳性细胞。(5)胰岛样细胞团超微结构:取共培养组诱导形成的胰岛样细胞团,去诱导液,用消毒好的细胞刮将细胞团刮下,低速离心(1 000 r/min,10 min),收集细胞团,去上清,沿壁小心加入新鲜的 2%戊二醛固定液,制备超薄切片,置透射显微镜下观察细胞团的超微结构。
四、统计学处理

结 果
一、大鼠BMSCs的形态学特征及生物学特性
培养7 d后BMSCs形成明显集落,集落呈漩涡状或辐射状,细胞形态比较一致,胞体为长梭形,核呈椭圆形,有1~2个核仁(图1A)。细胞表面抗原标志物CD44、CD90的阳性率分别为99.48%、99.50%(图1B、1C)。成骨诱导结果发现,经诱导分化后,细胞由长梭形变成立方形或矮柱状,伸出许多细胞突起,一些突起互相连接;细胞外出现大量钙盐沉积,并形成多个钙结节(图2A);茜素红染色显示钙结节呈红色(图2B)。成脂肪诱导结果发现,细胞形态开始变短、变圆,细胞胞质内形成许多高折光性的脂滴,部分脂滴融合、增大(图2C);油红O染色显示脂滴呈红色(图2D)。提示成功分离、纯化出原代BMSCs,且BMSCs具有成骨、成脂多向分化能力。

图1 BMSCs形成的集落呈螺旋状或辐射状(1A,×20)及流式细胞仪检测表面标志物CD44(1B)和CD90(1C)
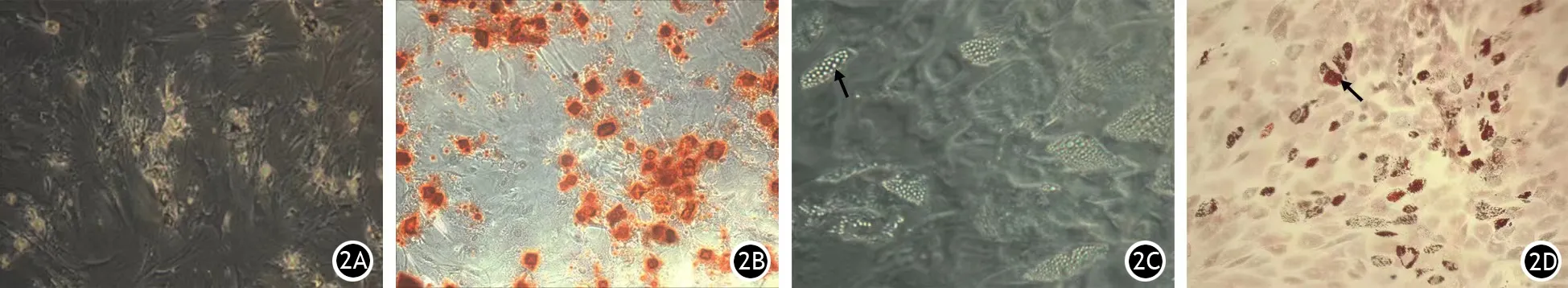
图2 成骨诱导后BMSCs形成多个钙结节(2A,×40),茜素红染色钙结节呈红色(2B,×40),成脂肪诱导后BMSCs细胞胞质内出现多个脂滴(↑,2C,×40),油红O染色脂滴呈红色(↑,2D,×40)
二、大鼠胰岛的形态学特征、产量、纯度及其生物学活性
培养3 d时,胰岛悬浮状生长(图3A),呈圆形或椭圆形;培养4~5 d时,胰岛开始贴壁生长,有折光性,立体感强(图3B);培养14 d时,部分胰岛开始出现凋亡征象,但结构仍完整;培养20 d时,可见有少量胰岛结构变松散,边界不清;培养至28 d时,仅有少量完整胰岛,大部分胰岛细胞凋亡。
双硫腙染色显示胰岛中β细胞呈棕红色,经计数,每个胰腺可获得胰岛约450个,平均纯度达80%(图3C)。
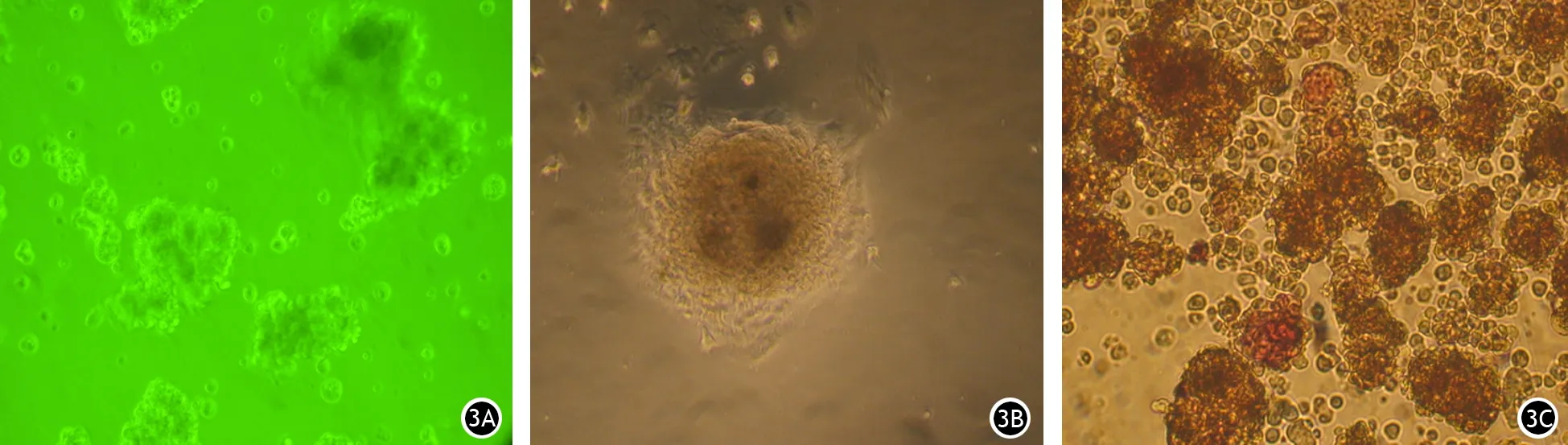
图3 培养第3天(3A,×20),第5天(3B,×40)的胰岛及双硫腙染色的胰岛(3C,×20)
胰岛单独培养时,第3天胰岛素分泌量高于第1天,4~5 d时达到培养过程中胰岛素分泌的高峰值,随后胰岛素分泌逐渐下降,培养至第13天,胰岛素分泌量约降为最高值的20%(图4)。低糖组和高糖组胰岛的胰岛素释放量分别为(7.105±1.551)mIU/ml和(20.231±1.592)mIU/ml,差异有统计学意义(P﹤0.05)。

图4 胰岛的基础胰岛素分泌量
三、BMSCs诱导分化成胰岛细胞
干细胞组细胞一直保持BMSCs典型的形态学特征,未见明显改变,即细胞集落呈漩涡状或辐射状,胞体为长梭形,核呈椭圆形(图5A);胰岛组胰岛在培养中始终成团块状散落并贴壁生长,立体感强,未见明显改变(图5B);共培养组培养7 d后见局部干细胞开始聚拢,同时较多分裂产生的细胞以出芽的方式向上生长成小团块状(图5C),培养14 d左右形成球形的胰岛样胞团结构,并以较细长的蒂部与瓶底连接,漂浮于培养液中(图5D),随着共培养时间的延长,胰岛样细胞团仍保持良好的生长状态,并不断增大,团块状更明显(图5E),直至共培养至第28天仍可见胰岛样细胞团生长情况良好。

图5 各培养组细胞的形态学特征。5A 干细胞组细胞的形态未见明显改变(×20);5B 胰岛组的胰岛成团块状贴壁生长(×20);5C 共培养组的局部干细胞聚拢成小团块(↑,×20);5D 胰岛样细胞团结构以较细长的蒂部与瓶底连接(↑,×40);5E 胰岛样细胞团生长增大成明显团块状(×20)
基础胰岛素水平测定结果显示,干细胞组培养液的基础胰岛素分泌量均<0.5 mIU/L(低于试剂盒所能检测的最低浓度),故无法测出;胰岛组第5天胰岛素分泌达峰值,随后逐渐下降,至第13天,胰岛素分泌量约降至最高值的20%(图6);共培养组胰岛素水平在培养第5天达到峰值,第13天仍维持在峰值水平的40%左右。培养第8、10、13天,共培养组的基础胰岛素分泌量显著高于胰岛组,差异有统计学意义(P值均<0.05,图6)。
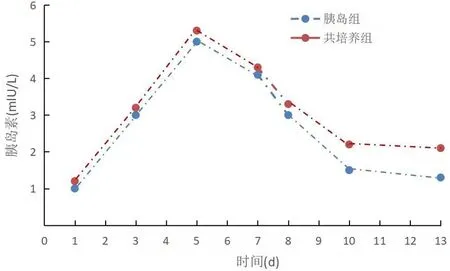
图6 共培养组和胰岛组的胰岛素分泌量
胰岛素释放结果显示,5.6 mmol/L低糖和25.0 mmol/L高糖刺激下,胰岛组的胰岛素释放量分别为(7.105±1.551)mIU/ml和(20.231±1.592)mIU/ml,共培养组诱导形成的胰岛样细胞团胰岛素释放量分别为(7.008±1.429)mIU/ml和(20.561±1.547)mIU/ml,差异无统计学意义(P值均﹥0.05)。
培养14 d,共培养组的胰岛样细胞团胞质中出现大量棕黄色颗粒,分布较均匀,表明诱导分化形成的胰岛样细胞团胞质内含有胰岛素(图7)。电镜下见胰岛样细胞团胞质中出现分泌颗粒和粗面内质网,体现胰岛样细胞团具有蛋白质分泌能力,提示BMSCs有朝胰岛β细胞分化的趋势(图8)。

图7 共培养组的胰岛样细胞团中有胰岛素表达(呈棕黄色,↑,×40) 图8 共培养组的胰岛样细胞团胞质内可见分泌颗粒(红↑)和粗面内质网(黑↑,×40 000)
讨 论
细胞共培养技术发展于20世纪70年代后期,多项研究表明将成熟体细胞与干细胞共培养可以诱导干细胞定向分化[7-8],这是因为干细胞所处的微环境对于其分化起调节作用,即干细胞的分化受微环境中细胞与细胞、细胞与细胞外基质间相互作用的影响,在特定的微环境中通过与其他细胞、细胞基质及各种细胞因子、激素的相互作用,可以调控干细胞分化的某些关键基因的表达,决定其分化的方向[9],所以共培养条件下干细胞可分化为所处微环境的成熟体细胞[10-11],且这种方法在很多领域均有成功报道[12-13]。关于BMSCs的共培养分化研究,早期多是探讨BMSCs对与其共培养细胞的功能发育方面的影响,如BMSCs与皮肤成纤维细胞共培养,能使皮肤成纤维细胞转化为肌成纤维细胞[14];BMSCs与软骨细胞共培养,能促进软骨细胞表型维持等[15]。近年关于与BMSCs共培养的细胞是否能影响BMSCs分化的研究开始逐渐增多。徐丽丽等[16]用Transwell小室建立了BMSCs与神经细胞共培养体系,利用神经细胞分泌的物质来诱导BMSCs分化为神经样细胞;还有研究者将BMSCs与髁突软骨细胞共培养,共培养的髁突软骨细胞与同代单独培养的髁突软骨细胞相比,前者增殖能力增强,软骨细胞特征性蛋白分泌活跃,表明髁突软骨细胞诱导 BMSCs 向软骨细胞方向分化的同时,还有利于髁突软骨细胞表型的维持和促进软骨细胞增殖[17]。有关利用共培养体系将BMSCs诱导分化成胰岛,目前国内主要有2008年沈浩亮等[18]和2010年李伟娟等[19]的研究,他们均发现BMSCs与胰岛细胞共培养后可以被诱导分化为胰岛样细胞。这些研究均运用Transwell小室设置共培养体系,且主要观察共培养体系对BMSCs功能改变的影响,而对于诱导过程中BMSCs形态、结构和表达特征变化等方面还未见有关报道。
本研究则是基于以上认识,将纯化的BMSCs与成年大鼠胰岛“直接”共培养,利用胰岛细胞作为“诱导剂”,最大程度模拟类似胰腺的微环境,通过动态跟踪观察干细胞和胰岛细胞在共培养过程中的形态、结构变化,观察和检测诱导形成的胰岛样细胞的内部超微结构和表达特征,结果证实本研究所获得BMSCs是单一的细胞群,不含造血系细胞, 具有多向分化潜能,符合典型的BMSCs特征,是可靠的细胞模型;与其共培养的胰岛经双硫腙染色呈阳性,说明其胞质内富含锌离子,具有胰岛细胞的特性;两种细胞共培养的过程中,与同代单独培养的干细胞相比,BMSCs在共培养后逐渐失去典型的长梭形和呈漩涡状或辐射状的生长特征,而以出芽的方式向上生长成小团块状,直至最后形成球形的胰岛样胞团结构,说明BMSCs向胰岛细胞方向分化;而基础胰岛素水平测定结果表明共培养体系中诱导形成的胰岛样细胞团具有分泌胰岛素的功能,且共培养条件能有效维持诱导分化形成的胰岛样细胞团的胰岛素分泌量,使之持续保持在较高水平;此外通过ELISA检测发现在不同糖浓度刺激下,诱导形成的胰岛样细胞团胰岛素释放量能随着葡萄糖刺激浓度的增高而增加,且该细胞团胰岛素释放量与单独胰岛的胰岛素释放量的差异无统计学意义,表明诱导形成的胰岛样细胞团具有较成熟的胰岛素释放功能;进一步免疫细胞化学染色法检测了胰岛样细胞团的胰岛素表达情况,与ELISA法的实验结果相吻合;最后透射电镜观察胰岛样细胞团的内部结构,发现其细胞胞质内出现较多的分泌颗粒和粗面内质网,体现了较活跃的蛋白质分泌能力,提示胰岛样细胞团具有较成熟的结构和功能,证实了细胞共培养方法可以使BMSCs随着微环境的改变而向胰岛样细胞团分化。
关于共培养中细胞之间作用的机制目前尚不十分清楚。推测是微环境中细胞与细胞、细胞与细胞外基质间、细胞基质及各种细胞因子、激素的相互作用等参与了BMSCs的生存和分化,使之发生环境依赖性变化,但具体的信号转导及途径尚不明确,且细胞共培养技术仍不能完全反映体内环境的变化,共培养体系的条件如培养液pH值、细胞培养时间和种植密度等仍需要进一步完善。因此,逐步完善细胞共培养技术以及共培养诱导分化形成的胰岛样细胞团移植后能否长期保持分泌胰岛素的能力,从而更好的发挥降糖作用,都是亟待解决的问题。
利益冲突所有作者声明无利益冲突
作者贡献声明刘鑫:研究操作、论文撰写;李森、黄泽萍、宁志莹、黄威:数据整理、统计学分析;岑妍慧、贾微、杨瑞、姜娜:研究酝酿、研究指导、工作支持;岑妍慧、贾微:研究设计、研究指导、论文修改、经费支持
