早期胰腺癌患者血清外泌体差异miRNA筛选及hsa-let-7f-5p的诊断价值
2022-12-21李源任帅曹营营郭凯杨梦赵雅桐张雅平王中秋
李源 任帅 曹营营 郭凯 杨梦 赵雅桐 张雅平 王中秋
南京中医药大学附属医院(江苏省中医院)放射科,南京 210000
胰腺癌早期症状隐匿,临床诊断困难,CA19-9是目前临床上最常用的胰腺癌诊断标志物,但由于其在非胰腺癌中的假阳性率较高,导致诊断准确率下降[1-2]。因此,临床亟待寻找一种高敏感性和高特异度的生物标志物来提示早期胰腺癌。外泌体是一类直径40~100 nm的细胞外囊泡,包含蛋白质、核酸、脂质等成分,广泛分布于人体,在细胞通信间扮演重要角色。微小RNA(microRNA,miRNA)是真核生物中广泛存在的一种小分子非编码RNA,长度19~24 nt,是外泌体RNA载体中最丰富的类型,在肿瘤的发生、发展中起着重要的调控作用[3]。本研究拟对早期胰腺癌、慢性肿块型胰腺炎及健康志愿者的血清外泌体miRNAs进行差异表达分析及验证,并探讨血清外泌体hsa-let-7f-5p在早期胰腺癌中的诊断价值。
材料与方法
一、一般资料
选取2019年1月至2020年1月间南京中医药大学附属医院行手术并经病理证实的19例早期胰腺癌患者和16例慢性肿块型胰腺炎患者。参照AJCC第八版胰腺癌分期系统[4],将19例早期胰腺癌患者(ⅠA、ⅠB、ⅡA、ⅡB期)作为早期胰腺癌组,16例慢性肿块型胰腺炎患者作为胰腺炎组。纳入标准:年满18周岁;无其他恶性肿瘤;无基础代谢性疾病;临床资料完整。同时选取19名健康志愿者作为正常对照组。将2019年1月至2019年6月收集的21例纳入测序组以筛选差异表达的miRNA:早期胰腺癌8例,其中男性5例,女性3例,年龄48~78岁,平均年龄62岁;慢性肿块型胰腺炎5例,其中男性2例,女性3例,年龄50~58岁,平均年龄53岁;健康对照8例,其中男性5例,女性3例,年龄32~59岁,平均年龄45岁。将2019年7月至2020年1月收集的33例纳入验证组以验证筛选出的差异表达的miRNA:早期胰腺癌11例,其中男性7例,女性4例,年龄52~73岁,平均年龄62岁;慢性肿块型胰腺炎11例,其中男性4例,女性7例,年龄41~61岁,平均年龄53岁;健康对照11例,其中男性4例,女性7例,年龄41~63岁,平均年龄53岁。记录患者的体重是否下降,是否有高血压史、吸烟史、饮酒史及血清CA19-9水平。本研究经医院伦理委员会审批通过(2017NL-137-05),患者及健康对照者均签署知情同意书。
二、样本收集
清晨空腹肘静脉采血,抽取5 ml于EDTA抗凝管中;室温静置30 min后,4℃、1 200×g离心10 min,吸取上清液于15 ml离心管内;4℃、3 000×g再次离心15 min,冻存于-80℃备用。
三、外泌体的分离与鉴定
采用exoEasy Maxi Kit试剂盒(德国QIAGEN公司)分离血清外泌体,透射电子显微镜(transmission electron microscope,TEM)下观察外泌体的结构特征,纳米颗粒追踪分析(nanoparticle tracking analysis,NTA)观察外泌体的粒径大小,蛋白质免疫印迹法检测外泌体表面特异性标志物CD63、CD81蛋白表达。
四、外泌体总RNA抽提与质检
采用miRNeasy Serum/Plasma Kit试剂盒(德国QIAGEN公司)抽提外泌体总RNA,采用Agilent 2100生物分析仪及RNA 6000 Nano Reagents PartⅠ试剂盒(德国QIAGEN公司Cat.No 1545)检测总RNA的完整性,以RNA完整系数(RNA integrity number, RIN)表示,为1~10,完整性越高数值越接近于10。
五、小RNA文库构建与质检
取上述提取的总RNA作为原料进行小RNA的文库构建,在小RNA两端加上3′和5′接头,以其作模板进行反转录,得到cDNA片段,通过PCR扩增技术,使用凝胶电泳分离出长度不同的小RNA文库。Illumina小RNA建库试剂盒标准文库条带理论值为145~150 bp,故将此范围内的片段进行割胶回收和纯化,借助Aglient 2100观察切胶纯化后的条带分布。
六、小RNA高通量测序及miRNA的筛选
采用Illumina高通量测序技术完成对小RNA的测序,参照miR Base数据库,比对测序结果,去除miRNA以外的其他小RNA后,对早期胰腺癌组、胰腺炎组及正常对照组差异表达的外泌体miRNA进行筛选。筛选标准为差异倍数(fold change,FC)>2或<0.5;P<0.05;以每百万比配成对序列做miRNA表达量指标(transcript per million,TPM)>2。
七、差异表达miRNA的验证
采用实时荧光定量PCR法对筛选出的差异miRNA进行定量验证。PCR反应体系:95℃预变性10 min,95℃变性10 s,60℃退火30 s,反应45个循环。hsa-miR-486-5p、hsa-miR-423-5p在所有样本中的表达稳定且无差异,因此以两者表达量的平均值来计算目标miRNA的相对表达量,利用扩增循环数法(cycle threshold,Ct)计算研究中miRNA的表达量(2-ΔΔCt),其中ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt实验组样本-ΔCt对照组样本。
八、差异表达miRNA的功能富集分析
使用R语言软件中clusterprofiler包对差异表达miRNA的功能进行功能富集分析。利用基因本体(gene ontology,GO)数据库富集分析筛选出差异miRNA的靶基因,对其生物过程、分子功能及细胞组分3个方面进行分类注释,并应用京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)数据库分析靶基因在细胞中参与的信号通路及功能。
九、统计学处理

结 果
一、一般情况
与胰腺炎组及正常对照组比较,早期胰腺癌组CA19-9水平增高、年龄大、体重下降,差异有统计学意义(P值均<0.05),其余指标差异均无统计学意义(表1)。
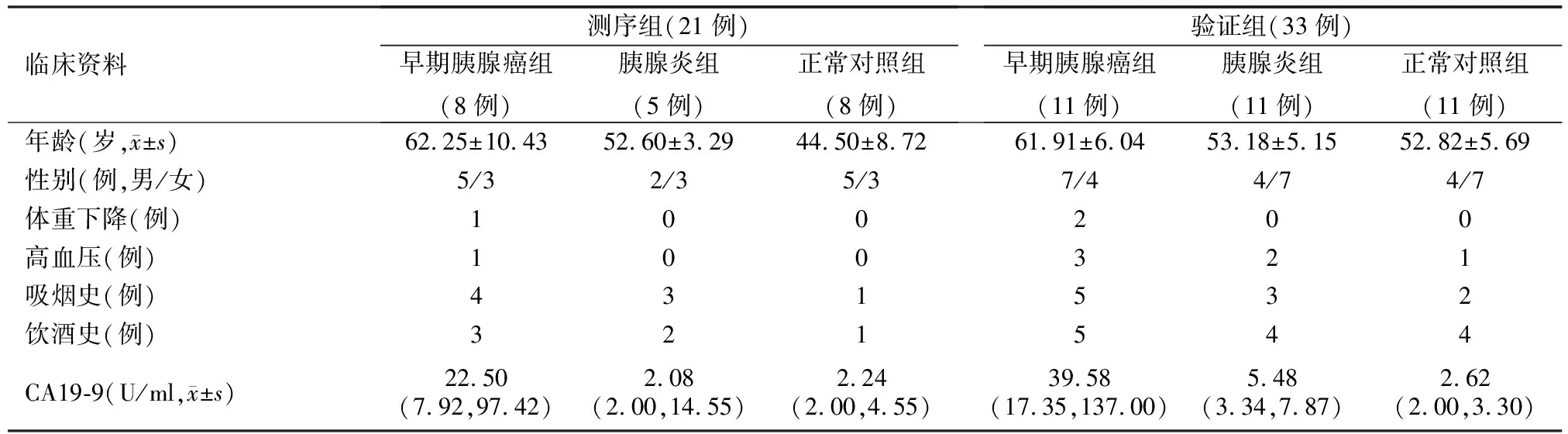
表1 早期胰腺癌组与胰腺炎组、正常对照组患者临床资料比较
二、外泌体的鉴定
TEM下可见外泌体特征性碟形双层囊膜结构(图1A)。NTA显示外泌体粒径主峰在150 nm左右,符合外泌体的粒径分布范围(图1B)。蛋白质免疫印迹结果显示,外泌体特异性蛋白CD63、CD81表达阳性(图1C、1D)。

图1 外泌体鉴定。外泌体特征性碟形双层囊膜结构(1A);外泌体NTA粒径图(1B);外泌体蛋白CD63(1C)、CD81(1D)表达阳性(1~9代表9个独立的外泌体样本)
三、外泌体总RNA质检及小RNA文库构建
研究结果显示,各样本的RIN均在6~8之间,可适用于后续实验。所有样本切胶前与切胶后的条带分布均集中在145~150 bp之间,与标准条带分布范围接近,说明小RNA文库构建成功。
四、miRNA筛选结果
对比早期胰腺癌组与胰腺炎组,筛选出93个miRNA,其中表达上调73个,下调20个;对比早期胰腺癌组与正常对照组,筛选出99个miRNA,其中表达上调69个,下调30个(图2)。两比较组共有的差异miRNA为42个,其中表达上调33个,下调9个。排除尚未明确命名的miRNA,得到2个表达上调的miRNA:hsa-let-7f-5p和hsa-miR-11401。目前hsa-miR-11401被证实可减轻阿霉素诱导的骨髓间充质干细胞凋亡[5],而hsa-let-7f-5p在多种癌症中被证实具有调控作用,且与胰腺癌的发生有关[6],因此最终选取hsa-let-7f-5p进行验证。

图2 早期胰腺癌组与胰腺炎组差异外泌体miRNA的分布情况(2A)及早期胰腺癌组与正常对照组差异外泌体miRNA的分布情况(2B)
五、差异表达外泌体hsa-let-7f-5p的验证
与胰腺炎组及正常对照组比较,早期胰腺癌组外泌体hsa-let-7f-5p表达量均上调,差异有统计学意义(P值均<0.05,表2)。ROC曲线评估血清外泌体hsa-let-7f-5p及CA19-9分别在早期胰腺癌组中的诊断效能见图3。外泌体hsa-let-7f-5p鉴别早期胰腺癌组和胰腺炎组的AUC值为0.843(95%CI为0.640~1.000),灵敏度和特异度分别为100%和81.82%;鉴别早期胰腺癌组和正常对照组的AUC值为1.000(95%CI1.000~1.000),灵敏度和特异度均为100%。CA19-9鉴别早期胰腺癌组和胰腺炎组的AUC值为0.893(95%CI0.721~1.000),灵敏度和特异度分别为81.82%和100%;鉴别早期胰腺癌组和正常对照组的AUC值为0.909(95%CI0.739~1.000),灵敏度和特异度分别为90.9%和100%。Delong检验结果显示,外泌体hsa-let-7f-5p诊断早期胰腺癌的效能与CA19-9相当,差异无统计学意义(P>0.05)。
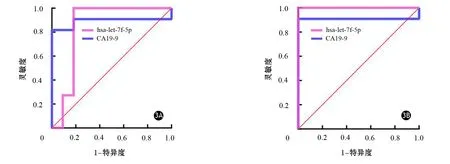
图3 hsa-let-7f-5p、CA19-9在早期胰腺癌组与胰腺炎组(3A)、早期胰腺癌组与正常对照组(3B)鉴别中的ROC曲线

表2 早期胰腺癌组与胰腺炎组患者及正常对照组血清外泌体hsa-let-7f-5p相对表达量比较
六、外泌体hsa-let-7f-5p的功能富集分析
GO分析结果表明,hsa-let-7f-5p的靶基因主要参与补体激活凝集素途径;表达蛋白主要分布于纤毛层发挥作用;主要发挥与一氧化氮合酶结合的功能(图4A)。KEGG通路富集分析结果表明,hsa-let-7f-5p的靶基因主要参与丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路(图4B)。
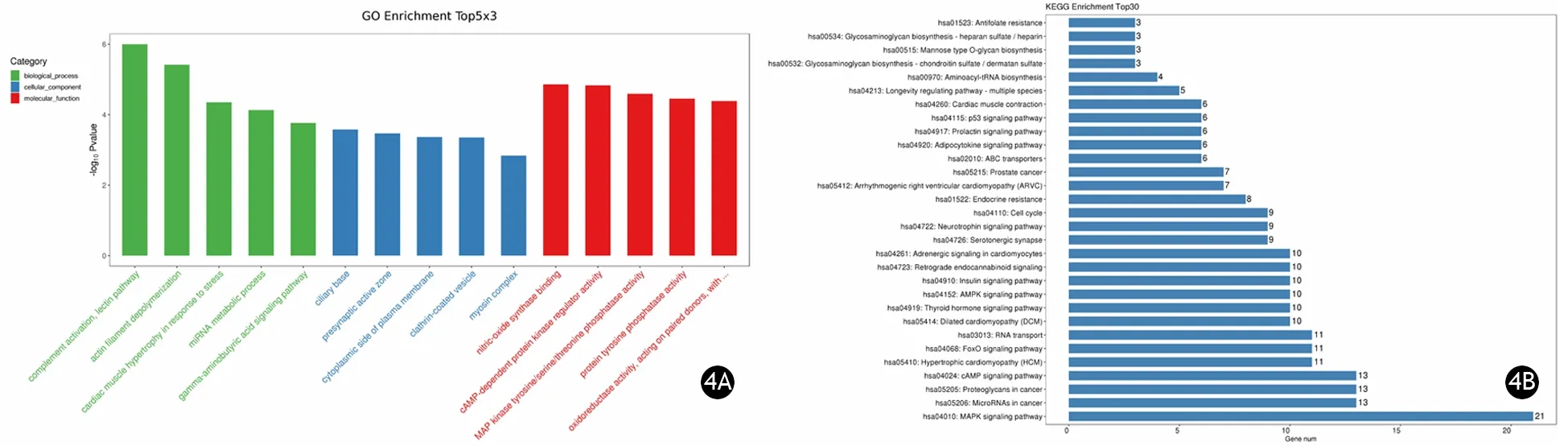
图4 外泌体hsa-let-7f-5p的GO富集分析(4A)及KEGG通路分析(4B)
讨 论
胰腺癌早期诊断困难、恶性程度高。研究表明,外泌体miRNAs表达的上调或下调在多种癌症中具有诊断意义[7]。血清外泌体miRNAs作为诊断标志物具有如下优势:(1)其在癌症的发生和发展中广泛表达,便于取样;(2)通过测定外泌体miRNAs的表达谱,可以在不进行活检的情况下检测肿瘤细胞的miRNAs表达谱;(3)携带细胞内生物活性物质至靶细胞,传递遗传信息,发挥调节作用;(4)其脂质双层结构,可以保护miRNAs不被核糖核酸酶降解,保持活性及稳定性[8]。此外,有研究表明外泌体miRNAs对癌症早期诊断的灵敏度和特异度较好,可作为潜在标志物[7]。
本研究结果表明,外泌体hsa-let-7f-5p在鉴别早期胰腺癌与慢性肿块型胰腺炎和健康人群中的诊断效能与CA19-9相当,可作为早期胰腺癌的诊断标志物。外泌体let-7f-5p与早期胰腺癌之间的关系尚未见详细报道,但其在其他恶性肿瘤中的作用已有研究。let-7可以靶向多种致癌因子,通过直接靶向蛋白的转录因子或靶向其下游效应分子来调控肿瘤的发生[9],其家庭成员let-7f在卵巢癌[10]、乳腺癌[11]等肿瘤中表达下调。Shee等[12]研究发现外泌体let-7f-5p是非基层浸润型膀胱癌复发的生物标志物。此外,外泌体let-7f-5p在甲状腺癌[9]中表达上调,在结直肠癌[13]、肺癌[14]中表达下调。刘宇亭等[15]研究发现同时使用miR-34a和miR-let7转染人胰腺癌细胞,可以使其增殖活性、细胞迁移和侵袭力显著下降,细胞凋亡率显著增加,从而发挥更显著的协同抗肿瘤作用。
本研究结果显示,血清外泌体hsa-let-7f-5p的靶基因主要参与补体激活凝集素途径,表达蛋白位于纤毛层,功能方面主要发挥与一氧化氮合酶结合的功能,且靶基因与MAPK信号通路关系密切。炎症参与肿瘤发生和癌症进展的各个阶段,而补体系统是炎症反应的重要组成部分,激活补体的凝集素途径可促进肿瘤发生、驱动巨噬细胞募集并抵抗抗PD-1免疫治疗[16],其相关蛋白MASP-2在胰腺癌中高表达[17]。一氧化氮主要由一氧化氮合酶催化而成,通过诱导硝基氧化应激,干扰氧化还原平衡,导致癌变,因此抑制诱导型一氧化氮合酶,在抑制胰腺癌细胞生长、诱导其凋亡中起重要作用[18-19]。MAPK信号通路是一类将信号从细胞膜传递到细胞核的蛋白激酶家族,参与调控细胞的增殖、分化、死亡,已被证实在胰腺癌的侵袭和转移中起重要作用[20]。
本研究存在以下不足:(1)测序组及验证组的样本量较小;(2)仅将早期胰腺癌组与胰腺炎组及正常对照组进行比较,未与胰腺其他良性肿瘤比较;(3)组间年龄未匹配,早期胰腺癌组较胰腺炎组及正常对照组年龄大,但这符合胰腺癌好发于老年人的流行病学特征[4]。未来会在本研究结果基础上,加大样本量,增加分组,以评估外泌体hsa-let-7f-5p的诊断和预测作用,并进一步探索其在胰腺癌治疗和预后方面的价值。
利益冲突所有作者声明无利益冲突
作者贡献声明李源:研究操作、论文撰写;任帅:数据整理、统计学分析;曹营营、郭凯、杨梦、赵雅桐、张雅平:研究酝酿、研究指导、工作支持;王中秋:研究设计、研究指导、论文修改、经费支持
