胰腺癌新辅助治疗的困境和未来影像学潜力
2022-12-21朱蒙蒙边云
朱蒙蒙 边云
海军军医大学第一附属医院放射诊断科,上海 200433
【提要】 近年来,胰腺癌新辅助治疗得到了前所未有的重视。然而,胰腺癌新辅助治疗在人群选择、治疗方案选择、疗效评价三大方面仍然面临一定困境。随着影像组学和人工智能的飞速发展有望弥补传统影像学评价的不足,为目前面临的困境提供新方法、新思路,为胰腺癌患者个体化精准治疗带来曙光。
胰腺癌作为“癌中之王”,近20年来总体生存率无明显改善,5年生存率低于10%。随着近年外科手术的进步和肿瘤综合治疗理念的推广,胰腺癌新辅助治疗模式逐渐得到重视,并且有望改善预后。胰腺癌新辅助治疗是指术前进行化疗或联合放化疗,旨在获得肿瘤降期、消灭亚临床转移灶,变不可切除肿瘤为可切除肿瘤,并提高胰腺癌的R0切除率,从而最终改善胰腺癌的疗效[1]。但是,目前胰腺癌新辅助治疗在人群选择、治疗方案选择、疗效评价三大方面仍然面临一定困境,笔者就此结合所在团队在影像学方面的研究成果,阐述影像组学在胰腺癌新辅助中的进展和未来的潜力。
一、可切除胰腺癌新辅助治疗的困境
胰腺癌根据肿块与周围血管的关系及有无远处转移分为4类[2]:可切除胰腺癌、交界可切除胰腺癌、局部进展期胰腺癌和转移性胰腺癌。目前对于交界可切除胰腺癌和局部进展期胰腺癌,优先采取新辅助治疗策略已基本达成共识,术前新辅助治疗可以提高R0切除率,延长患者的生存期,让患者获益[3-4]。但是,对于可切除胰腺癌患者治疗方案仍存在争议。一部分人认为应该直接手术切除,新辅助治疗可能导致部分患者失去根治性切除机会。一项研究[5]纳入了59例可切除胰腺癌患者,结果发现因肿瘤进展而错过根治性手术切除的患者占7.9%。另一部分人认为应先给予新辅助治疗,然后再进行手术切除。他们认为新辅助治疗可帮助筛选出肿瘤进展迅速、不适合手术的胰腺癌患者,从而减少了不必要的手术创伤。PREP-01研究结果[6]显示,新辅助治疗能使可切除胰腺癌患者的总生存期显著延长。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[7]从2019年开始就在可切除胰腺癌治疗方案章节将手术优先和新辅助治疗优先并列推荐。2020年NCCN胰腺癌临床实践指南指出,可切除胰腺癌若伴有肿瘤原发病灶大、区域淋巴结肿大、患者极度消瘦和极度痛苦、CA19-9显著升高等高危因素,推荐优先行新辅助治疗。然而,区域淋巴结肿大与淋巴结转移并非等同,这给可切除患者是否选择新辅助治疗带来一定困境。笔者所在团队发现胰腺癌的影像组学特征与淋巴结转移高度相关[8],并且建立了组学预测模型[9],进一步建立了基于淋巴结和肿瘤全自动分割和诊断的人工智能模型,有望给可切除胰腺癌患者是否选择新辅助治疗提供重要依据[10]。能否在术前不拘于NCCN可切除人群分类,建立无创预测模型将人群分层,找出适合新辅助化疗的人群,是影像学亟待解决的问题。
二、胰腺癌新辅助治疗方案选择的困境
新辅助治疗在策略上存在优势,但治疗方案尚无明确定论。目前研究较多的方案是联合化疗方案,如FOLFIRINOX方案、吉西他滨+清蛋白结合型紫杉醇(AG)方案和吉西他滨+替吉奥方案,FOLFIRINOX方案和AG方案针对转移性胰腺癌治疗分别较吉西他滨治疗患者中位生存时间提高了5个月和2个月,从而成为转移性胰腺癌一线用药方案[11-12]。NEPAFOX试验和NorPACT-1试验的研究目的是评估FOLFIRINOX方案在新辅助治疗中的作用。NEONAX试验评估AG方案作为新辅助治疗方案对可切除胰腺癌治疗的作用。SWOGl505试验则直接比较AG方案与mFOLFIRINOX方案(改良的FOLFIRINOX)作为新辅助治疗方案在可切除胰腺癌治疗中的效果。目前,除围绕FOLFIRINOX方案、AG方案开展研究外,其他相关药物方案也在研究中,如NEOPAC试验(吉西他滨联合奥沙利铂)、术前放化疗联合pembrolizumab(派姆单克隆抗体)试验等。此外,新辅助化疗是否要联合立体定向放疗,也存在争议。因为胰腺癌是高间质的肿瘤,对肿块进行局部放疗后,会导致肿瘤高度纤维化,治疗间隔时间过长会造成周围血管过度致密粘连,增加手术难度和风险。但也有部分研究者认为,术前新辅助化疗联合短程的立体定向放疗可以有效减少受累血管侧的肿瘤残余,显著提高手术切缘阴性率[13]。目前,新辅助治疗方案的选择仍然以诊疗医师的经验用药为主,缺乏对胰腺癌患者术前制定个体化治疗方案起指导作用的无创评价指标,这也是影像学迫切需要解决的问题。
三、胰腺癌新辅助治疗疗效评价的困境
目前,胰腺癌患者的新辅助治疗疗效的评价指标主要包括胰腺癌血清肿瘤标志物、病理学评估、影像学评估以及液体活组织检查、新辅助治疗后机体组成的变化。
血清肿瘤学标志物,特别是CA19-9作为评估新辅助治疗疗效的常用指标,有助于预测新辅助治疗后胰腺癌患者的预后,并且在某种程度上对肿瘤的可切除性有提示作用。一项纳入了240例胰腺癌患者的多中心研究[14]结果显示,新辅助治疗后CA19-9降低的患者,预后较好。NCCN指南建议对于最初诊断为可切除胰腺癌和交界可切除胰腺癌的患者,如果新辅助治疗后CA19-9水平下降或稳定并且影像学检查未提示明显进展,应考虑手术;对于局部进展期胰腺癌患者,若CA19-9下降的幅度超过50%并且临床症状有好转,应考虑手术切除。尽管CA19-9是公认的胰腺癌血清肿瘤标志物,但是其诊断的特异度及灵敏度均不高。CA19-9在Lewis抗原阴性的个体中通常不升高,使得其诊断的灵敏度降低[15]。而CA19-9在部分消化系统恶性肿瘤、胆管炎症或梗阻性黄疸中表达也会升高,导致其诊断的特异度降低[16]。
新辅助治疗后,肿瘤会发生病理组织学改变。在对新辅助治疗后的胰腺癌手术切除标本进行病理评估时,通常会评估新辅助治疗后肿瘤退缩分级(tumor regression grade,TRG),以评估肿瘤在体状态下对接受的新辅助治疗的敏感性,从而指导新辅助治疗策略并预测患者预后。目前有多个病理学评估系统可用于评估新辅助治疗后的TRG,其中美国病理学家协会(College of American Pathologists,CAP)推荐使用Ryan提出的用于直肠癌病理分级的CAP评估系统应用最为广泛。其主要的缺陷是毁损细胞和未毁损细胞镜下很难界定;在不明确肿瘤治疗前负荷的情况下,量化残存肿瘤细胞不够准确,确定其cut-off值没有依据;CAP标准中1级与2级甚至缺乏具体量化标准。由此导致了病理医师对胰腺癌新辅助治疗评价结果一致性较差[17]。
影像学评估胰腺癌新辅助治疗后疗效最常用的是实体肿瘤疗效评估标准1.1版(response evaluation criteria in solid tumors,RECIST1.1)。该标准是根据肿瘤在横断面影像上最大直径的变化对新辅助治疗进行动态观测。然而较多研究发现RECIST1.1并非是评价肿瘤化疗反应较好的方法,评价结果与病理TRG结果无显著相关性[18-20]。在临床工作中RECIST1.1与病理TRG间存在两个矛盾:(1)新辅助治疗后胰腺癌病灶最大径变化不显著,或者仅轻微缩小,术后CAP-TRG为0~1级。影像判断新辅助治疗无明显效果,但病理显示完全缓解(图1)。(2)新辅助治疗后胰腺癌病灶最大径明显缩小,术后CAP-TRG为2~3级(图2)。影像判断新辅助治疗效果显著,但病理显示无明显缓解。这样的矛盾会导致临床医师和胰腺癌患者对新辅助治疗失去信心,甚至导致部分胰腺癌患者延误手术治疗时机。
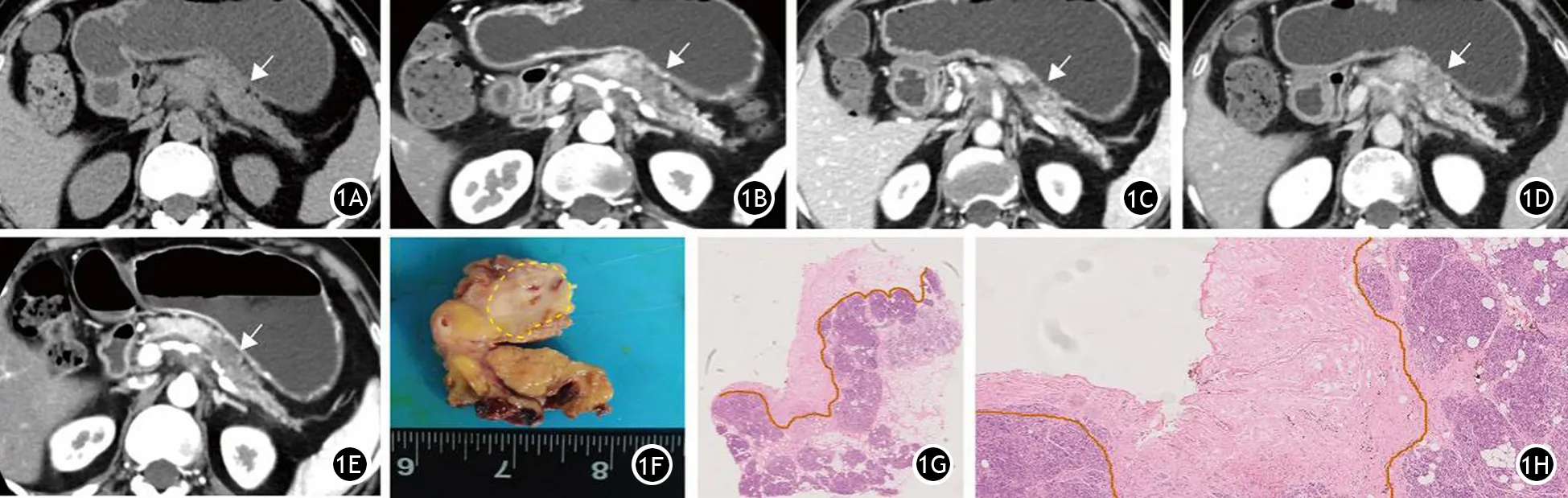
图1 胰腺癌新辅助治疗后影像显示肿块缩小不明显,但病理肿瘤退缩分级为0级。1A~1D分别为治疗前CT检查横断面平扫、胰腺实质期、门静脉期和延迟期图像,可见肿块强化不明显;1E为治疗后CT检查横断面胰腺实质期图像,可见肿瘤体积减小不显著;1F为手术后大体图,黄线内为肿瘤大致轮廓;1G为全组织病理大切片图,橙色线为肿瘤和正常胰腺的分界线(苏木精-伊红染色 ×1);1H为肿瘤区域放大图,镜下可见无残留肿瘤细胞,病理肿瘤退缩分级为0级
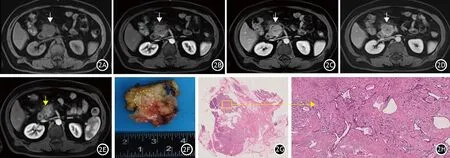
图2 胰腺癌新辅助治疗后影像显示肿块明显缩小,但病理肿瘤退缩分级为3级。2A~2D分别为治疗前MRI检查T1WI横断面平扫、动脉期、胰腺实质期和静脉期图像,可见肿块呈延迟强化,推测其为肿瘤细胞丰富型;2E为治疗后MRI检查T1WI横断面动脉期图像,可见肿瘤体积明显减小;2F为手术后大体图,黄线内为肿瘤大致轮廓;2G为全组织病理大切片图(苏木精-伊红染色×1);2H为肿瘤区域放大图,镜下可见肿瘤细胞极为丰富,病理肿瘤退缩分级为3级
矛盾的产生可能有如下原因:矛盾(1),虽然治疗后肿瘤体积未变化,但治疗杀死的是肿瘤细胞,对于间质丰富的肿瘤,可能存在肿瘤体积无变化,但疗效已产生;矛盾(2),可能因为胰腺癌本身就是细胞丰富的肿瘤,接受新辅助治疗后,虽然大部分肿瘤细胞被杀灭,但残存肿瘤依然具有细胞丰富的特征。此外,上述两类矛盾的出现还有一个共性原因是病理取材的局限性(是选点切片而非全组织大切片)。肿瘤的消退程度是胰腺癌新辅助化疗的一个重要标志,病理一般认为是定性、定量诊断的金标准,但似乎结果也并非可靠,根本原因是对所切除的肿瘤评价是否完整。从目前研究报道看,很少有胰腺癌标本取材信息,故其结果缺少说服力。病理检查技术的非标准化,完全肿瘤消退率的差异是否真实反映了不同治疗方案的疗效尚无科学依据。
目前除了RECIST,CT和MRI的一些功能量化指标也可以用来评估胰腺癌新辅助治疗的疗效。MRI弥散加权成像是最广泛用于胰腺癌新辅助治疗疗效评价的MRI技术,该技术可以在肿瘤的形态学变化之前先看到肿瘤内部组织的结构变化。Nishiofuku等[21]研究发现,对于不可切除的胰腺癌患者来说,新辅助化疗后表观扩散系数(apparent diffusion coefficient, ADC)升高比ADC下降的患者的生存期长。Okada等[22]研究显示,胰腺癌治疗前ADC值低,新辅助治疗后的应答反应也较差。以胰腺癌治疗前肿瘤的ADC临界值(1.2×10-3mm2/s)区分应答组和无应答组,准确率为83%。CT和MRI灌注成像也可用于评价胰腺癌新辅助治疗的疗效。研究显示新辅助治疗后疗效与治疗前后肿瘤内的灌注参数变化显著相关[23-24]。PET-CT的相关研究表明新辅助治疗前后肿瘤标准摄取值的降低与疗效显著相关[25-26]。影像组学在预测新辅助治疗的疗效方面也发挥着重要的作用。影像组学通过高通量提取图像特征,挖掘它们与疾病预后的关系。一项研究发现,CT图像的特征,如熵的总值,可用来评价可切除胰腺癌患者的新辅助治疗后的总生存率[27]。Borhan等[28]的研究比较了新辅助治疗反应良好和治疗反应较差的胰腺癌患者的纹理特征,发现标准差、中滤过峰度值可以用来评价治疗疗效。Nasief等[29]的研究发现归一化熵-标准差、粗糙度及峰度这些特征的组合能评价新辅助治疗的疗效(AUC=0.94)。
此外,液体活组织检查通过检测外周血的循环肿瘤细胞、循环肿瘤DNA等,未来也许能准确检测机体的瘤荷[30]。有研究[31]显示,循环肿瘤DNA在评价胰腺癌患者对新辅助治疗的疗效优于常规影像学检查。新辅助治疗后CT定量机体肌肉组织变化也可能对新辅助治疗的疗效进行评估。有研究发现胰腺癌患者新辅助治疗后脂肪组织增加会使肿瘤无法切除的风险加大,肌肉组织增加与肿瘤的可切除性有关[32]。但是目前该技术尚存一些因素干扰其稳定性,相信未来可用于胰腺癌新辅助治疗疗效的评价[33]。
综上所述,胰腺癌新辅助治疗在临床上已得到了广泛的应用,尤其是在潜在可切除胰腺癌患者中,新辅助治疗后使得部分无法手术切除的患者获得了手术切除的机会,从而改善了患者的预后。传统影像学评价对肿瘤异质性的生物学信息反应欠佳,影像组学有望弥补传统影像学评价的不足。未来随着人工智能的发展,必将推动影像学和病理学在胰腺癌新辅助方面的研究进展,为胰腺癌患者个体化精准治疗带来曙光。
利益冲突所有作者声明无利益冲突
