基于微卫星标记的鼋亲子鉴定技术
2022-12-21谢敏敏王亚坤魏成清刘晓莉洪孝友朱新平
谢敏敏 王亚坤 魏成清 陈 辰 刘晓莉 李 伟 洪孝友 朱新平
(中国水产科学研究院珠江水产研究所, 农业农村部热带亚热带水产资源利用与养殖重点实验室, 广州 510380)
微卫星DNA也称为简单串联重复序列 (Simple Sequence Repeats, 简称SSRs), 是由1—6个核苷酸为重复单位而多次串联的 DNA 序列, 它在水产动物的研究领域利用最为普遍、并且十分有效, 可以将它应用于各类经济物种、濒危物种的遗传多样性检测、遗传图谱构建、基因定位、群体遗传结构分析及种群的亲缘鉴定、种质资源保护等方面的研究[1—9]。
鼋(Pelochelys cantorii)属于龟鳖目(Testudines)、鳖科(Trionychidae)、鼋属(Pelochelys), 是我国地区体型最大的水生龟鳖动物之一, 也是整个珠江流域,乃至我国南部地区水系生态系统健康的重要指示物种[10]。并且, 由于鼋的种族延续历史源远流长[11],因此它在对历史环境变化的研究以及生物进化方面的研究都具有十分重要的科学价值。但是, 由于不正当的贸易、人类的滥捕滥杀及水利工程等, 鼋的生存环境不断恶化, 其群数量大幅减少。如今,鼋已成为极端濒危物种, 2020年9月, 据我国农业农村部发布的数据显示, 我国目前仅人工保圈养条件下保有13只性成熟的鼋[12,13]。国外鼋种群数量也在20世纪迅速减少[14—16], 鼋在全球范围内的物种延续都面临着严酷的挑战。因此, 为了加强对鼋的保护, 我国在早在1989年就将鼋定为国家一级重点水生野生保护动物[17,18]。2014年7月至2021年6月, 中国水产科学研究院珠江水产研究所人工驯养保护的4只亲鼋(2雌2雄)已产下孵育了800多只不同规格的子一代鼋[19,20], 但其遗传信息还未知。为了保证圈养群体的遗传多样性处于适于中高度的水平、避免近交危害鼋人工保种群体的健康, 并在未来实现对自然群体的增殖, 本论文拟探究人工驯养条件下子一代鼋的遗传信息并建立亲子鉴定技术, 意在为濒危动物鼋人工保种工作提供科学理论基础和方法。
1 材料与方法
1.1 实验对象
实验用子一代鼋包含2021年生产的56个个体。56只子一代鼋均来自高明鼋繁育保护基地人工驯养的4只亲本(2♀, 2♂)。收集同年但不同窝次的受精卵在人工控温控湿条件下孵化, 待稚鼋孵出后收集其脱落的脐带, 浸泡于无水乙醇中并做好标记, −20℃保存。其每窝包含的个体数量如表1, 按所属窝次编号, 若为第1窝则编号为“1-x”, 属第2窝则编号为“2-x”。
表1 孵出子代鼋脐带采样数量Tab.1 Number of hatching progenitor turtles umbilical cord samples
1.2 基因组DNA提取
剪脐带约10 μL, 按照说明书的方法, 使用MicroElute Genomic DNA Kit试剂盒(OMEGA)提取基因组DNA, 使用NanoQTM微型分光光度计(博奥)检测所提取DNA的OD值及浓度, 并使用1%琼脂糖凝胶电泳测试其完整性, 随后转入–20℃备用。
1.3 微卫星引物设计与筛选
利用本实验室测得的鼋的转录组数据(未公布), 采用MISA软件挖掘鼋转录组序列中的微卫星标记(http://pgrc.ipk-gatersleben.de/misa/), 再通过引物设计软件PrimerPremier5.0进行三、四核苷酸重复及核苷酸重复微卫星序列的筛选。进行PCR扩增前, 将所有引物稀释至10 μmol/L, 再将每对引物按照上下游1﹕40的比例进行混合, 3种荧光接头均稀释至20 μmol/L。建立10 μL多重PCR反应体系:AB Multiplex PCR Master Mix 5 μL, 混合引物(含上下游)2 μL, 荧光接头0.2 μL, 去离子水1.8 μL。30—150 ng/L的DNA 1 μL。扩增程序为: 94℃预变性5min; 94℃变性30s, 60℃退火45s, 72℃延伸70s(24个循环); 94℃变性30s, 53℃退火40s, 72℃延30s(8个循环); 72℃再延伸10min。在 ABI3730 自动测序仪上进行荧光信号的收集, 利用毛细管电泳方法进行基因型检测(测序过程由广州天一辉远基因科技有限公司完成)。
1.4 数据分析
利用Popgene软件[21]计算各微卫星位点的等位基因数(Na)、有效等位基因数(Ne)、Shannon指数。用CERVUS3.0软件[22]计算微卫星位点的多态性信息含量(PIC)、观测杂合度(Ho)、期望杂合度(He)。
本实验以孟德尔遗传定律为判定亲子关系的理论依据。由于进行实验的所有子代个体均知晓其属于当年产出的第几窝, 因此母本均为确定母本,父本为疑似父本, 可以采用排除法进行父权鉴定。根据SSR扩增产物建立0、1数据矩阵, 即记录每个个体在相同的迁移位置上的条带状况, 有条带的记为1, 反之则记为0。再利用 NTSYS软件[23], 基于Nei’s 遗传相似系数对遗传数据的 UPGMA(非加权类平均)进行聚类分析。
2 结果
2.1 DNA的提取与质检
本实验用1%琼脂糖凝胶电泳来检测DNA的完整性, 根据结果可知DNA完整性较好、条带明亮;接着使用NanoQTM微型分光光度计(博奥)测定A260/A280, 结果显示每个个体的DNA值分布于1.82—1.92, 表明其纯度较高。即DNA质量可满足后续实验的要求。
2.2 微卫星引物设计及多态性筛选
搜索转录组序列中的SSR, 并进行引物设计, 成功设计出3万余对三核苷酸及四核苷酸重复的微卫星引物序列, 其中三核苷酸重复微卫星引物序列67.73%, 其中(AAT)n数目最多, 占6.00%; 四核苷酸重复微卫星引物序列32.27%, 其中(AAAG)n数目最多, 占6.67%。随机挑选其中230对引物, 经第一次筛选出153对能扩增出稳定条带的引物, 再挑选子代个体DNA进行二次筛选, 发现仅有10对引物具多态性,占比为6.53%。10对微卫星标记引物相关信息见表2,引物在个体中PCR扩增产物的毛细管电泳图谱效果如图1及图2所示。在使用ABI3130多功能基因遗传分析仪进行遗传分型时, 为降低基因型测序的成本,将带有不同荧光基团的PCR产物分组, 进行混合测序。本试验将10个微卫星标记分为2组(表3)。

表3 卫星标记分组情况Tab.3 The grouping of microsatellite markers
图1 引物Xm86在随机个体中的PCR扩增产物的毛细管电泳图谱Fig.1 Capillary electrophoresis of PCR amplification products of primer Xm86 in random individuals

图2 引物Xm86在随机个体中的PCR扩增产物的毛细管电泳图谱Fig.2 Capillary electrophoresis of PCR amplification products of primer Xm86 in random individuals

表2 鼋微卫星引物序列及扩增信息Tab.2 Primers and amplification information of Pelochelys cantorii microsatellite
2.3 群体遗传多样性分析
2个PCR组合所包含的10个微卫星标记均能够在鼋的56个个体中扩增出稳定、清晰的DNA条带,每个位点检测到的等位基因数为2—4; PIC为0.306—0.684; 群体内近交系数(Fis)为–0.6970—0.1418。有效等位基因数(Ne)为1.2800—3.0521, 观测杂合度(Ho)为0.250—0.929, 平均为0.6305; 期望杂合度(He)为0.221—0.678, 平均为0.4767; 香农多样性指数(I)为0.3768—1.0290, 平均为0.7182。每个微卫星位点双亲基因型均未知时单个微卫星位点的非排除概率(NE-1P), 已知单亲基因型时单个微卫星位点的非排除概率(NE-2P), 两个亲本基因型已知时的非排除概率(NE-PP)如表4所示。并且, 排除概率会随着微卫星位点数的增多而增大。10个微卫星位点的累积排除概率分别为73.14%(NE-1P)、90.98%(NE-2P)和98%(NE-3P)。
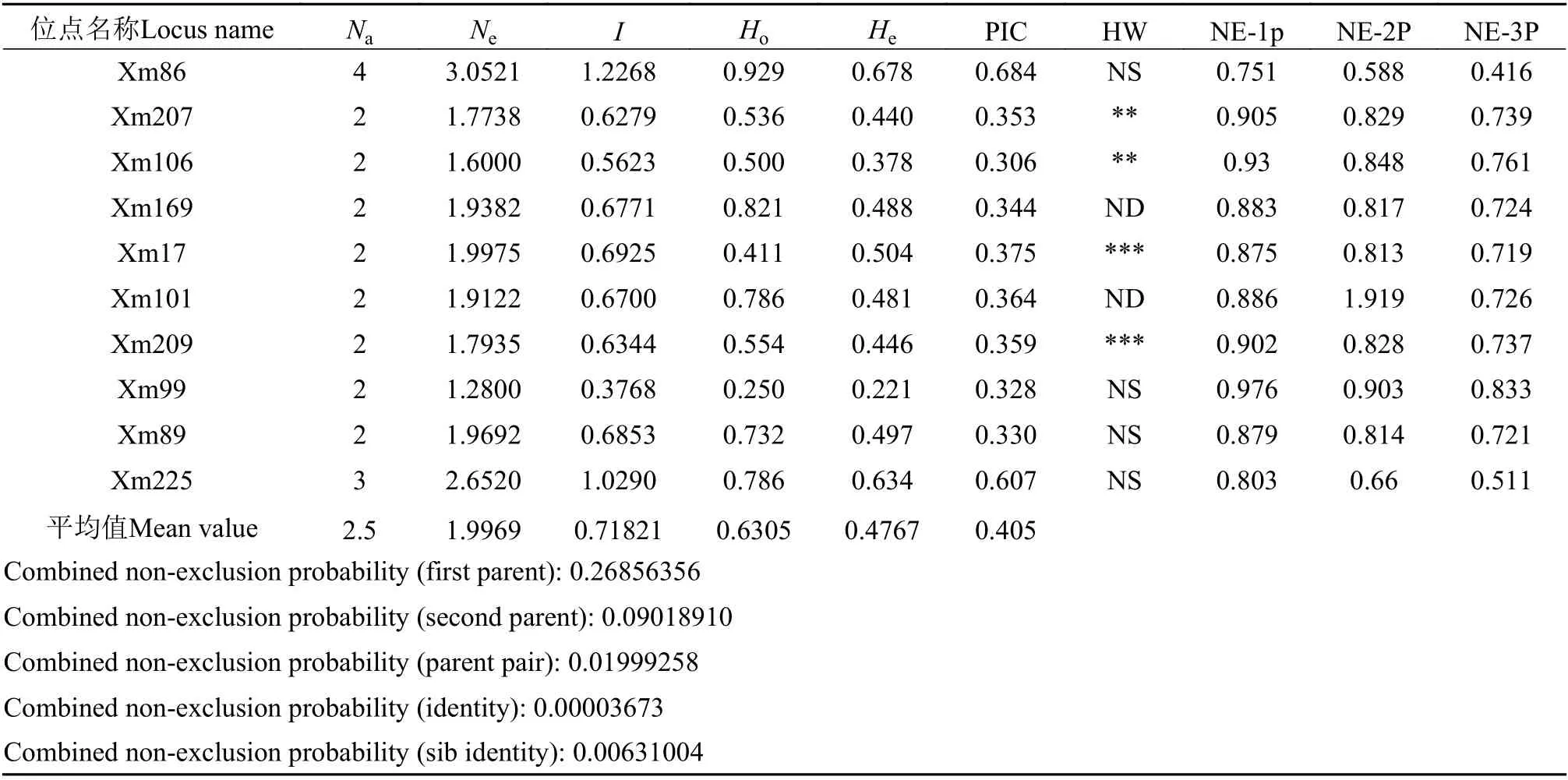
表4 子一代鼋在10对微卫星位点的多样性指数Tab.4 Diversity index of subgeneration Soft-shelled turtles at 10 pairs of microsatellite loci
2.4 聚类分析比较
NTSYS聚类结果如图3所示, 根据每个个体实际所属的窝次推断软件分析所得亲本的亲本是否正确。经过计算, 若只考虑母本, 推演正确率为89.29%; 若同时考虑父母本, 则正确率为80.36%。
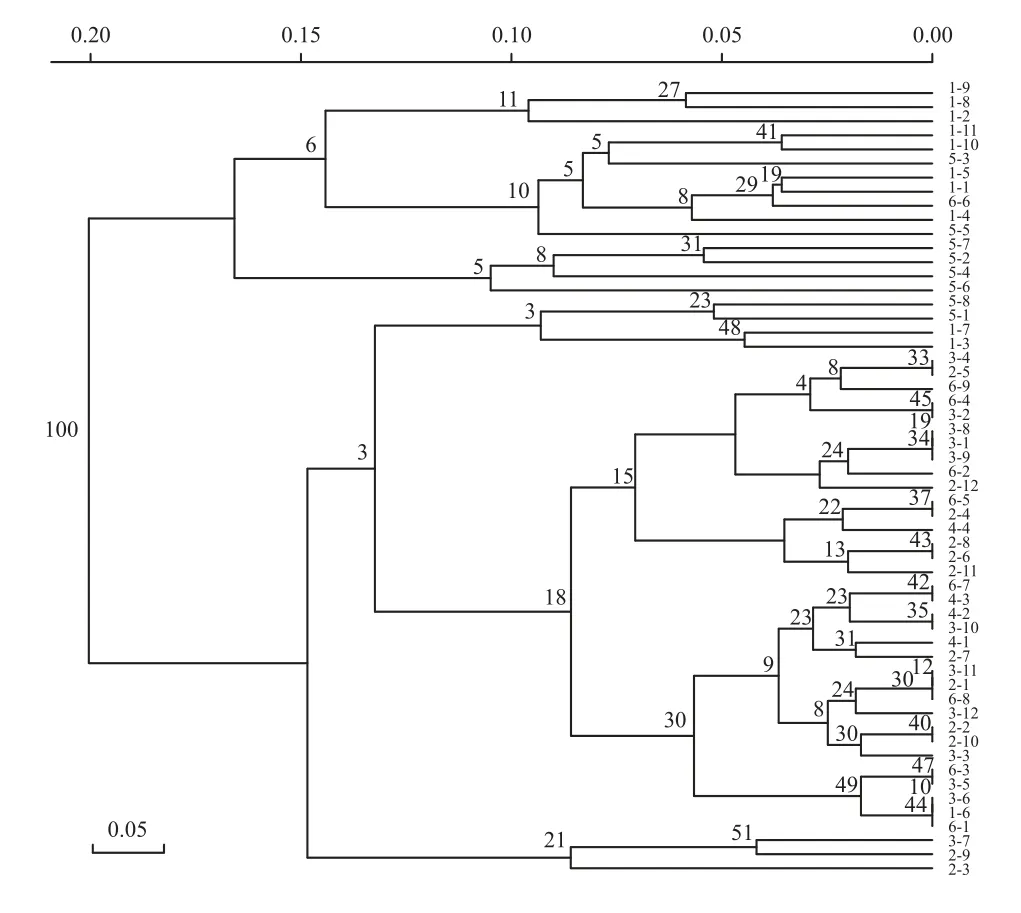
图3 NTSYS 软件聚类分析Fig.3 Cluster analysis of NTSYS software
2.5 亲本后代数的比较
统计结果显示实验群体中每个雌鼋与雄鼋都育有后代, 但每个亲本的后代数都不同。结合当年繁殖季节的观察记录, 可知两只母本分别诞下共2窝(第1与第5窝)与4窝(第2、3、4及第6窝)子代(表5),母本的后代数在群体总后代中贡献率分别为33.93%和66.07%。
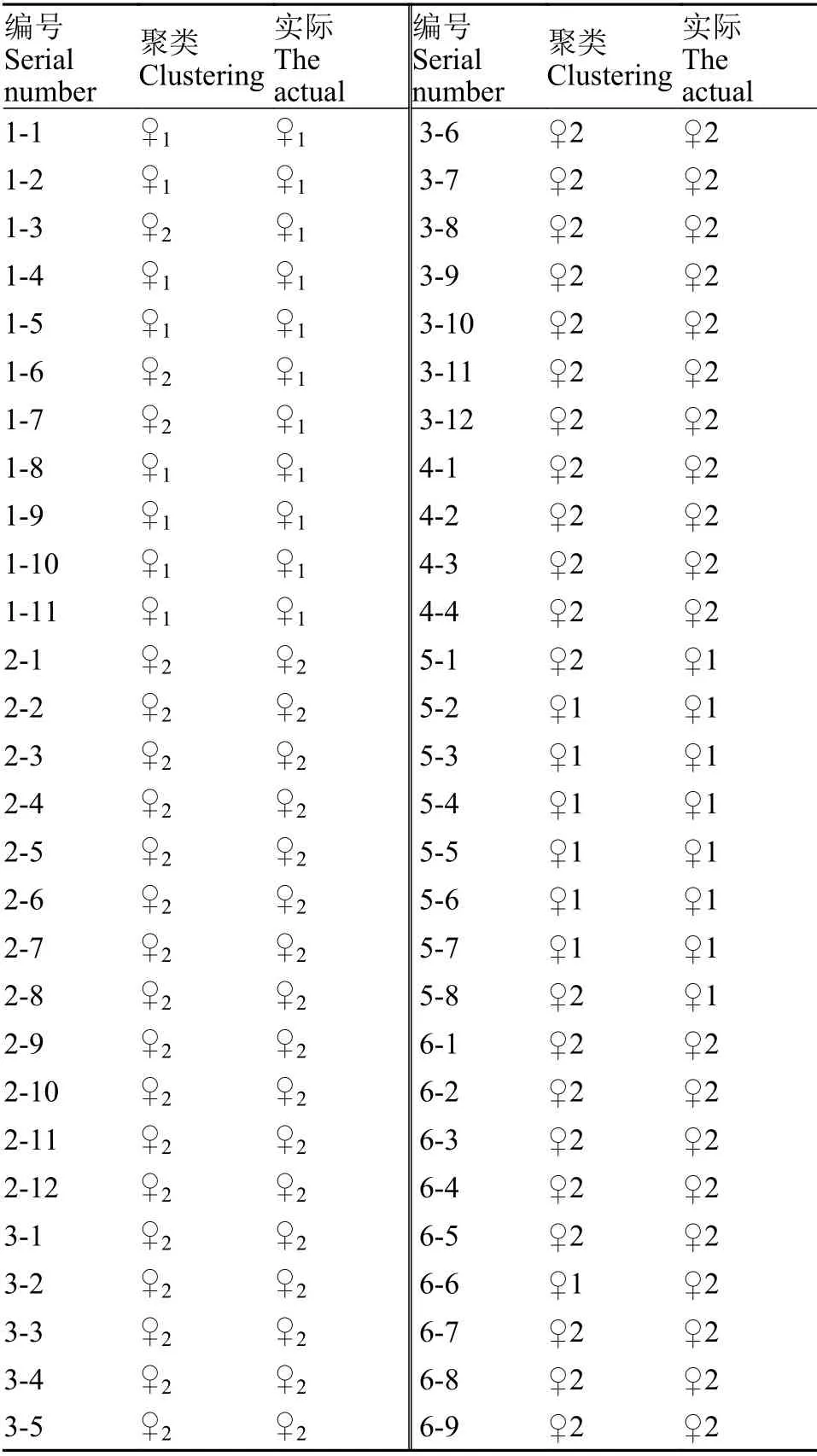
表5 每个子代个体的亲缘关系Tab.5 Genetic relationship of each progeny
3 讨论
3.1 子一代鼋的遗传信息
本研究使用10个微卫星位点进行遗传参数分析, 位点多态信息含量为0.306—0.6840, 其均值为0.3829。Schultz等[24]认为PIC>0.5为高多态性信息含量, 0.5>PIC>0.25的信息含量为中等适度, 而PIC<0.25为低信息含量, 本实验所选用的标记位点,包含高度多态标记2个(PIC≥0.5), 中度多态标记8个, 无低信息含量位点。由10个位点分析可得, 鼋2021年子一代群体的观测杂合度(Ho)为0.250—0.929, 平均为0.6305; 期望杂合度(He)为0.221—0.678, 平均为0.4767。金铃等[25]同样利用10个微卫星位点对两个红螯螯虾(Cherax quadricarinatus)群体进行遗传多样性参数分析, 其平均Ho为0.464, 平均He为0.557。相比之下, 可见2021年的鼋子一代群体的遗传多样性处于中度水平。同时与濒危龟鳖类比较, 荆胜利等[26]用18对引物对黄缘盒龟(Cuora flavomarginata)的4个群体进行观测杂合度测定, 其He为0.032—0.936, 平均值为0.329; 人工圈养条件下黄喉拟水龟(Mauremys mutica)的观测杂合度(Ho)介于0.364—0.921, 平均值为 0.687[27]。相比之下, 可见鼋子一代群体遗传多样性处于较丰富的水平。
3.2 亲子鉴定
通过上述微卫星位点进行亲子鉴定, 得出累积排除概率分别为73.14% (NE-1P)、90.98%(NE-2P)和98%(NE-3P)。与同样以少数亲本进行圈养繁殖的扬子鳄(Alligator sinensis)[28]比较: 当双亲的基因型均在未知的情况下, 扬子鳄13个位点累积排除概率为 0.7763; 已知单亲基因型时的累积排除概率为0.9414。这说明本实验中所选用的微卫星位点可满足鼋亲子鉴定的要求。
本实验还通过NTSYS软件对整个子代群体进行聚类, 结果基本均显示其可分为2个亚群, 符合实际圈养观察为两个母本参与生产的真实情况。并且, 结果表明其可进一步分为4个亚群, 也与实际养殖中4只亲鼋均参与生殖活动的理论子代群体构成相映照(♀1×♂1、♀1×♂2、♀2×♂1和♀2×♂2)。由此可见, 基于微卫星所建立的亲子分析技术的结果较为可靠。
3.3 亲本繁殖力分析
经统计, 母本的后代数在群体总后代中贡献率分别为33.93%和66.07%。后代数在亲本中表现差异的现象十分常见, 如文萍等[26]利用 89 只雌龟进行子代统计, 经亲子鉴定可明确分配 258 只子代到60 个母本中, 有29个母本没有被分配子代, 这表明不同母本具有不同的繁殖力。可在未来子代繁育中, 以个体繁殖力作为选择母本的重要参考条件。
经过遗传聚类分析, 还可发现每对亲本组合对子代的贡献率存在显著差异。对于雌性爬行动物来说, 一妻多夫制可减小近交衰退和遗传不相容性[29],还可以为同一种群中的所有成熟雄性提供交配的机会, 以此增加种群的遗传多样性[30,31]。例如, 多父性在胎生岩鱼(Sebastesspp.)[32]的多重父权的繁殖策略, 可以作为一种基因上的缓冲方式来扩大该种的适应幅度, 以应对自然选择的压力, 更利于种群的延续和散布。
而鼋子一代的4个子代亚群所拥有子代个体数不同, 其原因可能是雄性在交配活动中竞争力的优劣, 诸如雌性选择偏好, 即能够提供更多更好物质利益的雄性会被雌性优先选择, 以便将这些优势直接转化为产卵的适宜效应; 精子浓度与活力差异对受精结果的影响; 雌性个体与雄性个体之间的固定搭配; 时间上最后进行交配的个体由于在雌性生殖器中贡献的精子损失量少、能够去除前任雄性的精子占比、精子在雌性生殖器中的存放位置等使其更占优势。诸如此类因素, 都可能造成父权分配不均的结果。
然而, 优势个体的出现可能会造成子代群体内遗传多样性的偏移和减少。在将来F2的育种中, 可利用分子遗传手段挑选种鼋, 保护稀有等位基因,通过两两个体之间的亲缘分析, 隔离或迁出亲缘关系对较多的繁殖雌雄个体, 进而提高鼋种群遗传多样性的维持能力, 进一步改进濒危物种的人工饲养繁殖管理和保护策略。
