转录组分析揭示溶藻弧菌感染早期大黄鱼的免疫应答特征
2022-12-21程安怡王永阳翁华松陈新华张伟妮
程安怡 王永阳 翁华松 陈新华 张伟妮,
(1.福建农林大学海洋研究院, 福建省海洋生物技术重点实验室, 福州 350002; 2.福建农林大学, 中西兽医结合与动物保健福建省高校重点实验室, 福州 350002; 3.宁德富发水产有限公司, 宁德 352100)
大黄鱼(Larimichthys crocea)又称黄花鱼、黄鱼, 属鲈形目(Perciformes)、石首鱼科(Sciaenidae)、黄鱼属(Larimichthys), 是我国特有的海水经济鱼类。2020年我国大黄鱼产量为25.4×107kg, 较2019年上涨了12.6%, 稳居海水养殖鱼类榜首[1]。然而, 随着人工养殖规模的快速发展, 疾病问题日益突出, 已成为制约大黄鱼养殖产业可持续发展的瓶颈[2—4]。
溶藻弧菌(Vibrio alginolyticus)属于弧菌科(Vibrionaceae)、弧菌属(Vibrio), 是一种嗜盐嗜温的兼性厌氧菌, 在海洋弧菌中占比最多[5,6], 还可导致人类细菌性食物中毒和腹泻[7]。溶藻弧菌对多种水生动物都具有致病性, 可以引起石珊瑚(Acroporasp.)的白化[8]、斑节对虾(Penaeus monodon)的白便综合征[9]、罗氏沼虾(Macrobrachium rosenbergii)的幼体坏死[10]和翡翠贻贝(Perna viridis)免疫器官功能障碍[11]等。该菌还能通过损伤的皮肤感染大黄鱼[12]、金头鲷(Sparus aurata)[13]和点带石斑鱼(Epi-nephelus malabaricus)[14]等多种海水养殖经济鱼类,给养殖业造成了严重的经济损失。溶藻弧菌病是大黄鱼养殖过程中的易发病害, 在我国大黄鱼网箱养殖区广泛流行。感染初期, 患病大黄鱼游动缓慢,嘴部等体表充血并伴有炎症, 肌肉松散, 鳞片易脱落; 感染后期出现体表溃疡、嘴部烂穿和肝肾红肿等症状, 最终死亡[12,15]。然而目前, 关于大黄鱼抗溶藻弧菌感染的免疫应答机制尚不清楚。鉴于大黄鱼溶藻弧菌病的频发及严重危害, 开展大黄鱼抗该菌感染的机制探究十分必要。
转录组测序(RNA-Seq)是借助高通量测序手段快速获得某一物种的特定组织或细胞在特定状态下的转录本信息, 已成为研究水产动物免疫防御、胁迫应激和生长发育等分子机制的有效手段[16,17]。RNA-Seq已广泛应用于揭示鱼类应对病原感染的反应机制, 如罗非鱼抗海豚链球菌感染机制[18], 草鱼抗嗜水气单胞菌[19]和草鱼呼肠孤病毒感染机制[20],大黄鱼抗刺激隐核虫[21]、嗜水气单胞菌[22]和变形假单胞菌感染机制[23]等研究。
头肾是大黄鱼发育过程中最先出现的免疫器官, 是大黄鱼巨噬细胞、粒细胞和B淋巴细胞等主要免疫细胞发生、分化和增殖的场所, 兼具中枢免疫器官和外周免疫器官的双重功能[24]。本研究通过腹腔注射溶藻弧菌, 借助RNA-Seq和生物信息学分析的手段, 探究溶藻弧菌感染24h后大黄鱼头肾组织中基因表达水平的变化, 研究结果可为解析大黄鱼抗溶藻弧菌感染的应答机制及溶藻弧菌病的防治提供科学依据。
1 材料与方法
1.1 试验菌株
溶藻弧菌为实验室前期从患病大黄鱼上分离所得的菌株。用2216E液体培养基, 28℃, 200 r/min摇床震荡培养12h, 调整菌液浓度至1×108cfu/mL备用。
1.2 试验鱼处理及样品采集
试验用大黄鱼购自宁德市富发水产有限公司,挑选大小均一、状态健康的30尾大黄鱼[全长(15±4)cm, 体质量(52±10)g], 随机分为对照组和实验组, 饲养于1 m×1 m的小网箱中。试验期间水温(28.56±0.90)℃, 盐度34.51±0.71, 溶氧(6.52±0.40)mg/L, pH 7.84±0.62。
在1周暂养结束后, 实验组大黄鱼腹腔注射200 μL浓度为1×108cfu/mL(半数致死量)的溶藻弧菌。注射后24h, 分别从对照组和实验组中随机捞取9尾鱼,丁香酚(阿拉丁公司)麻醉后剖取头肾, 每3尾鱼的头肾组织合并为一个混合样, 无酶冻存管液氮速冻保存。对照(Control, C)组样本命名为C1、C2和C3,注射溶藻弧菌(V.alginolyticus, V)的实验组样本命名为V1、V2和V3, 共获得6个样本(2个组×3个生物学重复)用于RNA提取和转录组测序。
1.3 RNA 的提取与转录组测序
组织总RNA的提取采用TRIzol(Invitrogen, 美国)法, mRNA通过带有Oligo(dT)的磁珠从总RNA中分离出来, 片段化后将mRNA逆转录成cDNA,经纯化、末端修复、连接接头后进行PCR扩增, 得到cDNA文库, 最后用Illumina HiSeq 2000进行测序。文库构建和测序工作由上海美吉生物医药科技有限公司完成。
1.4 测序数据分析及转录本组装
经Illumina平台测序, 获得6个样本的原始数据(Raw reads), 对原始数据进行质控和过滤, 去除低质量片段后, 获得清洁数据(Clean reads), 将Clean reads与参考基因组比对, 得到匹配数据(Mapped reads), 再用StringTie软件(版本1.3.3b)[25]进行转录本组装。参考基因来源:Larimichthys crocea(Gen-Bank登录号: JRPU02000000[26,27])。
1.5 差异表达基因的鉴定
基因和转录本的表达量借助RNA Seq by Expectation Maximization(RSEM)软件(版本1.3.1)进行计算, 以Transcripts Per Million reads(TPM)作为定量指标[28]。使用DESeq2(版本1.24.0)分析鉴定样本间差异表达的基因, 当一个基因同时满足false discovery rate(FDR)<0.05和|log2Fold Change|≥1时,则认为该基因是差异表达基因(Differentially Expressed Genes, DEGs)[29]。
1.6 DEGs功能注释和信号通路分析
借助Goatools软件、用Fisher精确检验方法将所有的DEGs比对到Gene Ontology(GO)数据库(http://www.geneontology.org/)。同时使用KOBAS软件、用Fisher精确检验方法将DEGs比对到Kyoto encyclopedia of genes and genomes(KEGG)数据库(http://www.genome.jp/kegg/)。GO和KEGG富集分析多重检验采用Benjamini and Hochberg(BH)方法[30]。当校正的P<0.05时, 认为该GO功能分类/KEGG通路存在显著富集;P<0.01时存在极显著富集。
1.7 实时荧光定量PCR(Quantitative real-time PCR, qPCR)验证
测序后选取7个差异表达基因(C7、Hepcidin-1、IL-8、JUN、ZAP-70、GATA3和TCRβ)进行qPCR验证(引物序列见表1)。使用与测序同批次的总RNA通过反转录试剂盒(Promega, 美国)合成cDNA。PCR反应总体系为20 μL, 包括10 μL SYBR Mix(Promega, 美国), 0.1 μL上下游引物(10 μmol/L), 0.5 μL cDNA和9.3 μL双蒸水。反应程序: 95℃预变性150s; 95℃ 15s, 58℃ 20s, 72℃ 20s, 40个循环; 熔解曲线分析产物特异性。以β-actin为内参基因, 采用2–ΔΔCt方法[31]分析, 使用SPSS软件进行统计学分析。

表1 荧光定量PCR引物序列Tab.1 Primer sequences for qPCR
2 结果
2.1 RNA-Seq数据质量评估、序列比对分析
本研究构建了对照和溶藻弧菌注射24h后大黄鱼头肾共6个样本的转录组文库, 经Illumina平台测序, 在移除adaptor和低质量序列后, 各样本的clean reads均在4847万条以上, 质控数据的测序碱基平均错误率均小于0.026%, Q20碱基百分比在97.75%以上, Q30碱基百分比在93.69%以上, 说明测序结果质量较好; 对照组(C1、C2和C3)和实验组(V1、V2和V3)的clean reads成功比对到大黄鱼基因组的比例分别为87.43%、86.26%、85.96%、88.93%、90.07%和88.10%, 说明参考基因组的选择合理; 成功比对到CDS的比例为70.15%、67.33%、61.64%、70.94%、74.40%和71.31%, 说明测序深度足以覆盖转录组(表2)。
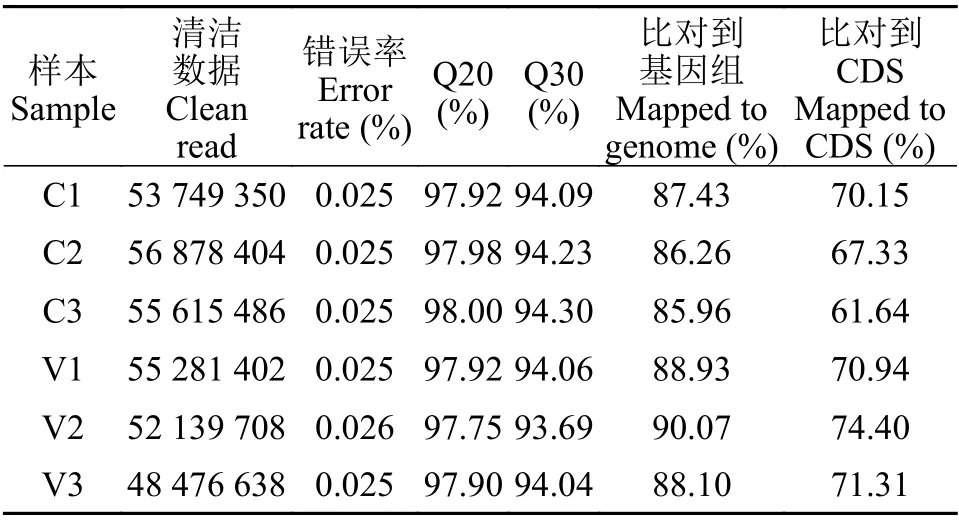
表2 测序数据统计Tab.2 Summary of sequencing data
2.2 DEGs聚类分析
在注射溶藻弧菌24h后, 实验组大黄鱼头肾转录组与对照组相比, 有1903个差异表达基因, 其中641个上调基因, 1262个下调基因。进一步对差异表达基因进行聚类热图分析(图1), 溶藻弧菌感染对大黄鱼头肾基因表达水平的影响显著, 同一样本的不同重复基因表达相近。

图1 差异表达基因聚类热图Fig.1 Clustering heatmap of DEGs
2.3 DEGs的GO功能分类
对1903个DEGs进行GO富集分析, 发现在47个GO terms存在显著富集(P<0.05), 包括32个生物学进程(Biological process, BP)类、10个分子功能(Molecular function, MF)类和5个细胞组分(Cellular component, CC)类。存在极显著富集(P<0.01)的26个GO terms如图2所示, 其中免疫系统进程(Immune system process)、免疫应答(Immune response)、细胞因子活性(Cytokine activity)、趋化因子活性(Chemokine activity)和趋化因子受体结合(Chemokine receptor binding)等免疫相关的GO terms在大黄鱼头肾中都极显著富集。此外, 血红蛋白复合物(Hemoglobin complex)、氧结合(Oxygen binding)和氧载体活性(Oxygen carrier activity)也发生了极显著富集, 且这3个GO terms中的12个DEGs在感染组中均显著下调。

图2 差异表达基因的GO功能富集(P<0.01)Fig.2 Enrichment of gene ontology classifications for the DEGs(P<0.01)
2.4 DEGs的KEGG功能分类
对DEGs进行KEGG功能注释, 发现45个信号通路存在显著富集(P<0.05), 其中极显著富集的有31个(P<0.01; 图3), 且28个都与疾病和免疫相关,包括金黄色葡萄球菌感染(Staphylococcus aureusinfection)、致病性大肠杆菌感染(PathogenicEscherichia coliinfection)等与疾病相关的通路; 造血细胞谱系(Hematopoietic cell lineage)、Th1和Th2细胞分化(Th1 and Th2 cell differentiation)、T细胞受体信号通路(T cell receptor signaling pathway)等与免疫系统相关的通路; 如细胞因子受体互作(Cytokine-cytokine receptor interaction)、NF-κB信号通路(NF-kappa B signaling pathway)等与信号分子和传导相关的通路。而且, 富集到T细胞受体信号通路(图4)中的26个DEGs在感染组中的表达水平均显著低于对照组。
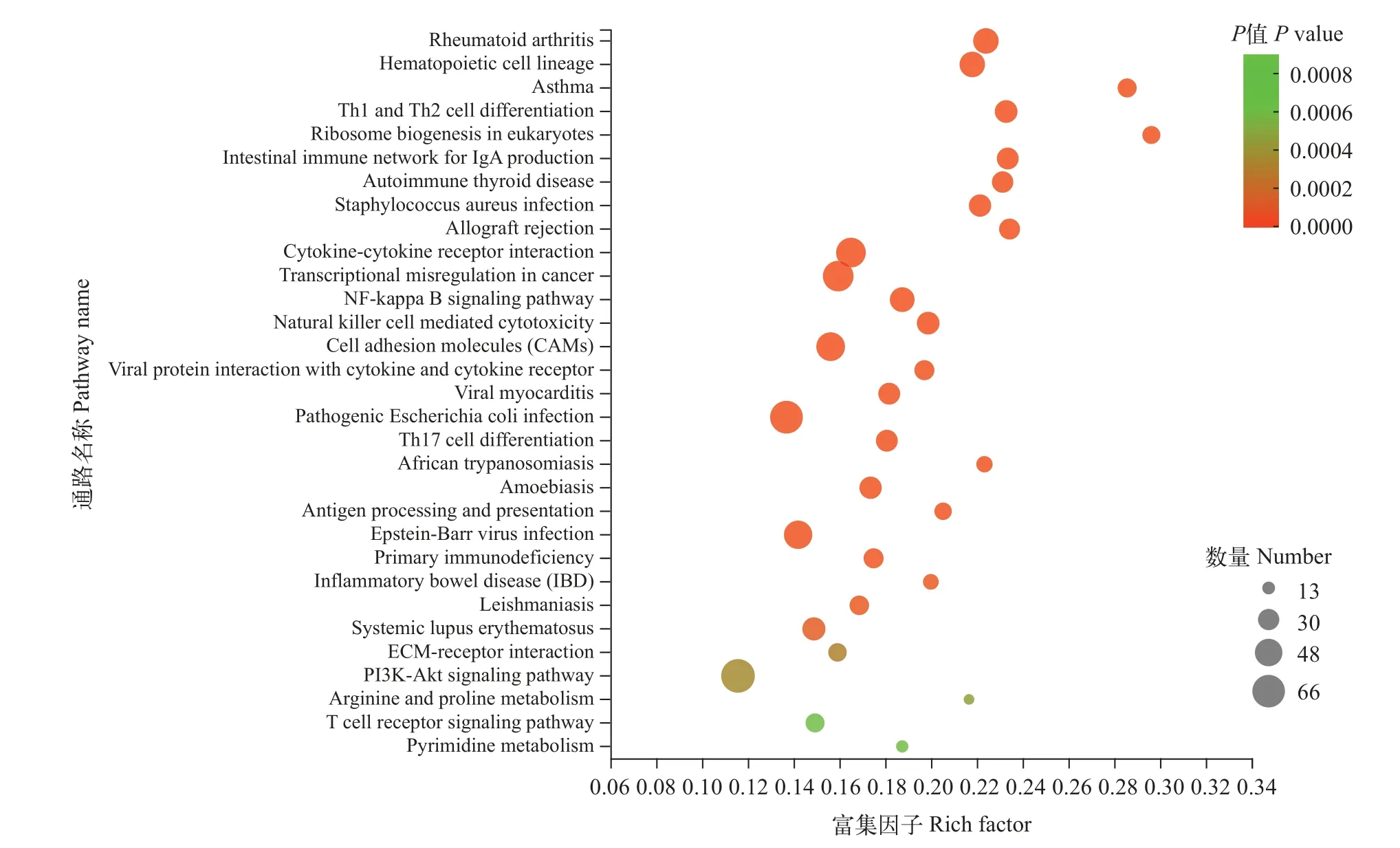
图3 差异表达基因的KEGG富集分析(P<0.01)Fig.3 KEGG highly significant enrichment pathways of DEGs (P<0.01)
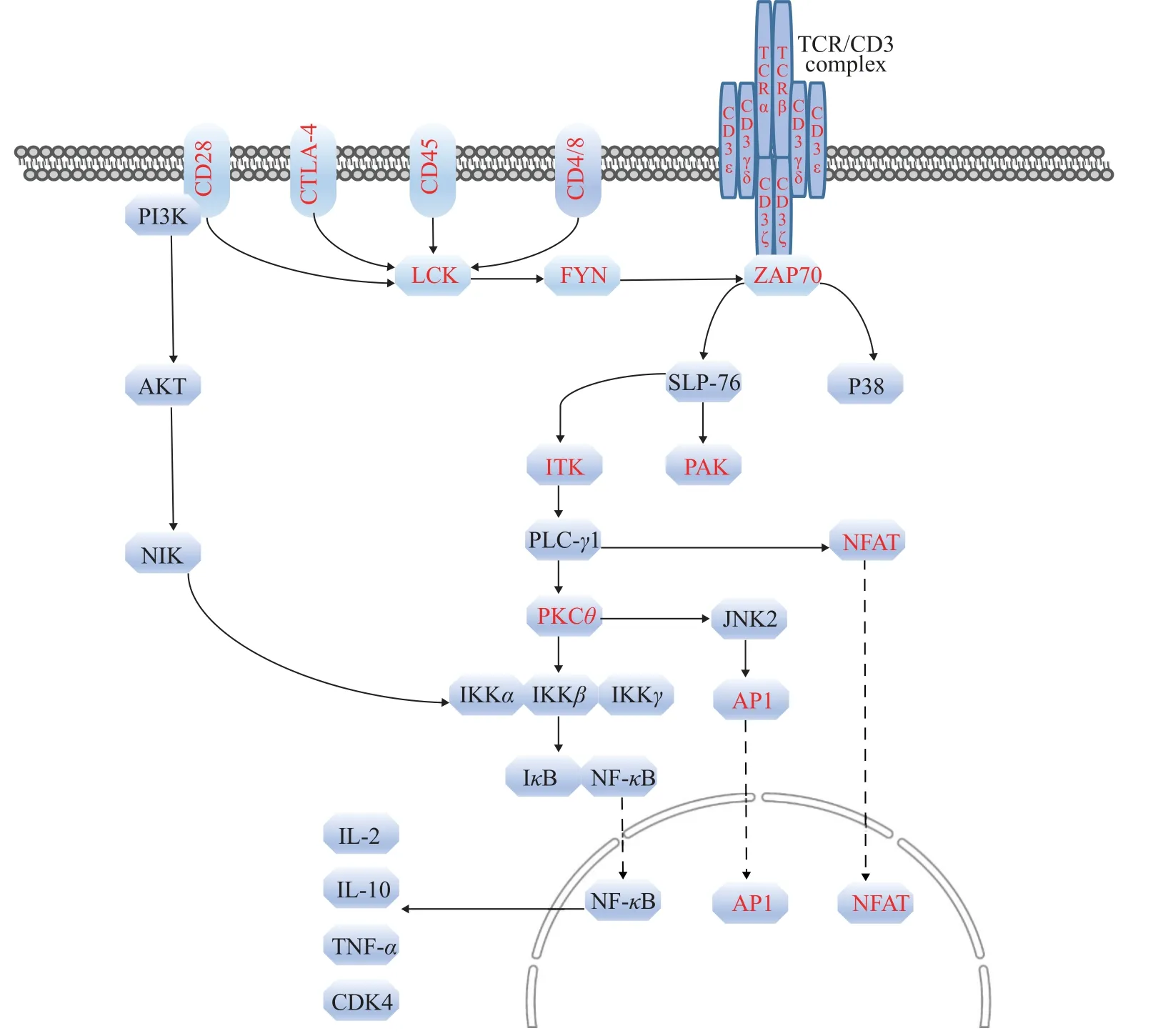
图4 T细胞受体信号通路Fig.4 T cell receptor signal pathway
2.5 免疫应答相关的主要DEGs
基于GO和KEGG分析的结果, 统计了与免疫相关的代表性DEGs(表3)。与先天性免疫相关的如补体家族(C1qbp、C1QL2和C7)、热休克蛋白家族(hspd1、hspa4、hspa5和hspa9)、抗菌肽(Hepcidin-1)、C型凝集素受体(Clec4e和MR1)、己糖激酶(hex1)、精氨酸酶(Arg-II)和线粒体翻译延伸因子(TUFM)等均显著上调。而与T、B细胞增殖分化(FcR5和CCL17)、T细胞调控(TCRα、TCRβ、CD3ε、CD3γδ、CD3ζ、LCK、FYN、ZAP-70、ITK、JUN和NFATC2)及免疫球蛋白(Immunoglobulin,Ig)参与抗原识别(Ighv 5A、Ighv 914和Ighv XIG14)等获得性免疫相关基因表达水平均显著下调。此外, 血红蛋白亚基基因(HBA1、HBAA、HBAD和HBB2)等需氧代谢相关DEGs均显著下调。

表3 免疫应答相关的主要DEGsTab.3 Main DEGs related to immune response
2.6 荧光定量PCR验证部分DEGs
qPCR实验结果显示, 在溶藻弧菌感染后, 大黄鱼头肾组织中C7和Hepcidin-1的表达水平显著上调,IL-8、JUN、ZAP-70、GATA3和TCRβ基因的表达水平显著下调, 这些基因的变化趋势与测序数据基本一致(图5)。
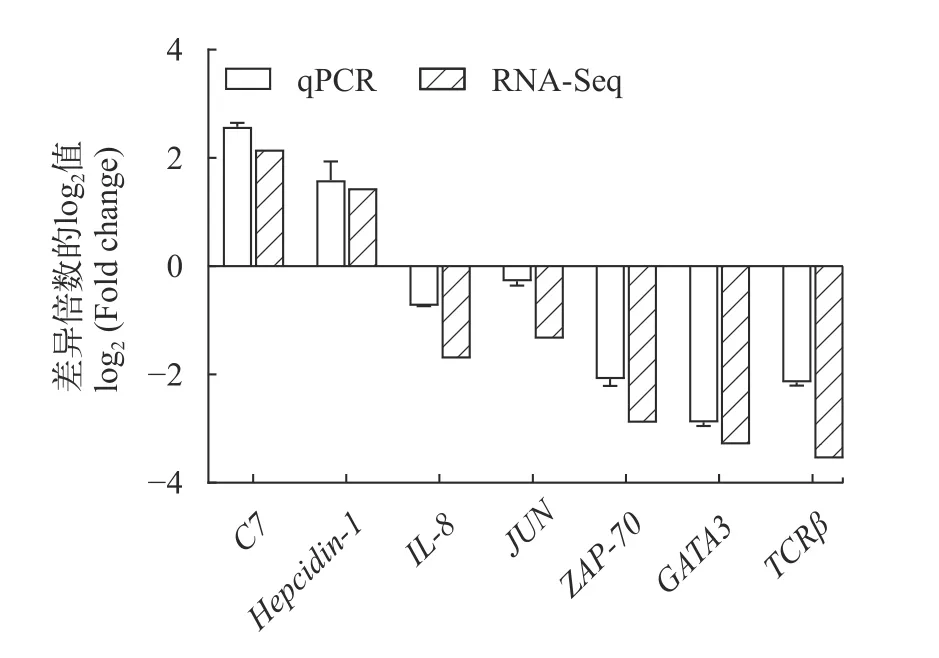
图5 荧光定量PCR验证部分DEGsFig.5 qPCR validation of partial DEGs
3 讨论
作为我国海水养殖产量最高的鱼类, 大黄鱼的健康养殖受到学者的普遍关注。溶藻弧菌是大黄鱼养殖过程中的常见病原菌, 然而其抗溶藻弧菌感染的免疫应答机制尚不明确。因此, 本文以溶藻弧菌为试验菌, 比较了该菌感染后大黄鱼头肾组织转录水平的变化, 共筛选到1903个DEGs, 占大黄鱼26000多个基因总数[27]的约7.3%, 说明溶藻弧菌感染可以有效刺激大黄鱼产生免疫应答。经质控分析和qPCR验证, 转录组数据质量良好、结果可信。
3.1 溶藻弧菌感染对大黄鱼先天性免疫的影响
先天性免疫是鱼类抵抗病原感染的第一道防线, 也是适应性免疫的启动者[32]。先天性免疫分子主要包括补体、抗菌肽、溶菌酶和凝集素等[33]。本研究发现, 在注射溶藻弧菌24h后, 大黄鱼头肾中一些先天性免疫相关基因, 包括补体(C1qbp、C1QL2和C7)、抗菌肽(hepcidin-1)、C型凝集素受体(Clec4e和MR1)、己糖激酶(hex1)和精氨酸酶(Arg-II)等表达量均显著高于对照组。补体(Complement, C)系统是鱼类先天免疫的重要组分之一,激活后具有细胞溶解、调理吞噬等生物学效应,C1和C7均为补体固有成分, C7已被证明参与了溶藻弧菌刺激大黄鱼产生的免疫应答[34]。hepcidin抗菌肽具有广泛的抗细菌、病毒、真菌和原生动物活性[27,35], 大黄鱼hepcidin已被证实能抑制嗜水气单胞菌和副溶血弧菌的生长[36]。C型凝集素结构域家族4成员E(C-type lectin domain family 4 member E, Clec4e)又称巨噬细胞诱导的C型凝集素(the macrophage-inducible C-type lectin, Mincle), 主要分布在单核/巨噬细胞表面, 哺乳类Clec4e已被证实能够识别细菌、真菌等病原[37], 本团队前期研究发现大黄鱼Clec4e通过结合病原菌表面的糖类病原体相关分子模式来识别病原, 参与大黄鱼抗细菌感染的免疫防御。甘露糖受体(Mannose receptor, MR)也属于C型凝集素超家族, 参与先天性和适应性免疫反应。巨噬细胞甘露糖受体MR1可以结合致病菌、病毒和真菌表面的甘露糖结构, 通过吞噬作用实现对病原的清除[38]。作为经典的代谢酶, 己糖激酶hexokinase-1不仅能催化各种己糖的磷酸化, 还能通过充当细菌肽聚糖的模式识别受体参与先天免疫和炎症[39]。精氨酸酶(Arginase)是巨噬细胞极化的主要标志, 牙鲆肾、鳃等免疫组织及离体巨噬细胞Arg-Ⅱ基因已被证实响应迟缓爱德华氏菌感染[40]。线粒体翻译延伸因子(Tu translation elongation factor, TUFM), 是一种线粒体蛋白, 主要参与机体抗病毒信号通路的调控, 青鱼TUFM基因在LPS刺激后出现显著上调[41]。在细菌感染后, 补体[23,42]、抗菌肽[23,43]和模式识别受体[18,19,22,42,44]等先天性免疫基因的表达上调已在多种鱼类中被证实, 说明先天性免疫是鱼类抗细菌感染的普遍应答反应。
细菌感染早期往往会引起鱼类IL-1β和IL-8等炎性因子的表达上调[18,19,22], 然而张恒泽等[45]研究发现大黄鱼脾脏IL-1β在假单胞菌活疫苗免疫后的早期出现下调, 在7d后上调。本研究也发现头肾组织中IL-8的表达水平在溶藻弧菌感染24h后显著下调。热休克蛋白(Heat shock protein, HSP)是典型的应激蛋白, 然而鱼类HSP70已被证实可以增强机体的抗氧化能力, 抑制氧自由基的生成, 发挥对炎症损伤机体的保护作用[46]。在本实验中,HSP70基因(hspa4、hspa5和hspa9)在溶藻弧菌感染后的高表达可能是导致炎性因子IL-8表达下调的原因之一。这与高温胁迫下大黄鱼肝脏蛋白组学中的研究结果是吻合的[47]。
3.2 溶藻弧菌感染对大黄鱼获得性免疫的影响
获得性免疫系统通过特异性受体(如TCR)识别来自病原体的特定抗原[48]。TCR位于T细胞表面,多由α和β两条链组成, 直接参与T细胞对抗原的识别[49]。CD3是TCR的辅助受体, 哺乳动物CD3包括γ、δ、ε和ζ四个亚基, 而硬骨鱼类CD3包括ε、ζ和γδ(哺乳动物CD3γ和CD3δ的前身)三个亚基[50]。ZAP-70参与T细胞免疫应答, 被活化的TCR招募后激活下游信号转导途径[51]。ITK属于Tec家族非受体酪氨酸激酶, 是TCR下游的关键信号介质[52], 参与调节T细胞以及CD4+T细胞的分化[53]。本文结果显示, 在注射溶藻弧菌24h后, 大黄鱼TCR信号通路上的许多基因, 如TCRα、TCRβ、CD3ε、CD3γδ、CD3ζ、ZAP-70和ITK等均显著下调, 说明该通路被抑制。这与本团队前期用嗜水气单胞菌(Aeromonas hydrophila)[22]和变形假单胞菌(Pseudomonas plecoglossicida)[23]感染大黄鱼后脾脏中TCR信号通路受到抑制的结果是一致的。
FcR5是一种B细胞应答抗原的调节蛋白, 可以促进B细胞增殖[54]。趋化因子CCL17能够促进T细胞的发育, 并参与成熟T细胞的转运和激活[55]。在本试验中, 溶藻弧菌感染组大黄鱼FcR5和CCL17的表达量都显著下调。同时, KEGG富集分析结果显示, 造血细胞谱系(Hematopoietic cell lineage)中大部分DEGs显著下调, 也验证了T、B细胞的增殖分化受到抑制。可见, 注射溶藻弧菌24h后大黄鱼特异性免疫细胞的增殖受到抑制。由于机体适应性免疫的激活较晚, 在感染早期阻断TCR途径、抑制特异性免疫细胞的增殖发育, 可能为先天免疫节省足够的能量, 有利于鱼类抗病原感染的免疫应答。
此外, 溶藻弧菌感染后大黄鱼头肾血红蛋白亚基基因(HBA1、HBAA、HBAD和HBB2)表达水平均显著下调。血红蛋白是红细胞内运输氧气的特殊蛋白质, 是一个由两个α链(HBA)和两个β链(HBB)组成的四聚体[56]。血红蛋白亚基表达水平的下降会直接影响血红蛋白。含量从而影响红细胞的携氧能力。同时, GO富集分析显示, 与需氧代谢有关的氧结合(Oxygen binding)和氧载体活性(Oxygen carrier activity)也发生极显著富集, 且其中的DEGs在感染组中均显著下调。该结果显示, 在溶藻弧菌感染后, 大黄鱼血液的氧传输能力下降, 可能跟该菌的溶血活性有关[57], 但具体机制有待进一步阐明。
综上所述, 本研究分析了溶藻弧菌感染后24h大黄鱼头肾转录组的变化, 结果显示, 大黄鱼补体、热激蛋白、抗菌肽和甘露糖受体等一些先天性免疫相关基因的表达水平均显著上调, 而TCR信号通路、特异性免疫细胞增殖发育等相关基因表达水平出现下调。可见在溶藻弧菌感染早期, 大黄鱼的先天性免疫被激活、获得性免疫被抑制。本文结果表明, 先天性免疫在大黄鱼抗溶藻弧菌早期感染中发挥重要作用。
