清燥救肺汤含药血清对非小细胞肺癌细胞恶性行为的影响
2022-12-21张美英侯炜高坤
张美英, 侯炜, 高坤
(1.中国中医科学院广安门医院,北京 100053;2.中国中医科学院望京医院,北京 100053)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是指源于支气管黏膜上皮或者肺泡上皮的恶性肿瘤,是肺癌最常见的类型。随着中医药学的发展,中医在治疗肺癌方面取得了显著的成果。肺癌归属于中医学“肺痿”的范畴,燥热伤肺是肺癌的重要病机[1]。清燥救肺汤具有清燥润肺、益气养阴的功效,既往临床和实验研究表明,清燥救肺汤对肺癌有显著的疗效[2-5],但关于其具体作用机制仍不明确,因此,本研究以NSCLC细胞株H1299为研究对象,进一步观察清燥救肺汤抗肺癌机制,以期为临床治疗提供实验依据,现将研究结果报道如下。
1 材料与方法
1.1实验细胞与动物人非小细胞肺癌(NSCLC)细胞株H1299,购自北京科瑞思搏生物科技有限公司。24只SPF级8周龄雄性SD大鼠,体质量180~200 g,购自北京华阜康生物科技股份有限公司,生产许可证号:SCXK(京)2019-0008。动物实验于中国中医科学院广安门医院实验室[动物使用许可证号:SYXK(京)2014-0041]完成。实验方案经中国中医科学院广安门医院伦理委员会批准(批准号:2016-052-KY)。按照《实验动物管理条例》规定进行实验。
1.2试剂与仪器干扰素γ(IFN-γ)抗体、白细胞介素4(IL-4)抗体、胰岛素样生长因子1受体(IGF-1R)抗体、信号传导与转录激活因子3(STAT3)抗体,购自沈阳万类生物科技公司;RPMI 1640培养基,购自上海善然生物科技公司;Transwell小室,购自上海生博生物医药公司。蛋白电泳仪,购自北京科普尔科技公司;PCR仪,购自苏州雅睿生物公司;高速离心机,购自武汉益普生物科技公司。
1.3药物及制备清燥救肺汤组成:桑叶(霜)9 g,炙甘草3 g,麦冬10 g,枇杷叶9 g,生石膏12 g,党参12 g,阿胶9 g,苦杏仁9 g。所有中药材购自中国中医科学院广安门医院中药局。常规煎煮后,浓缩生药含量1 g/mL,冷却后4℃保存备用。
1.4含药血清制备适应性喂养2周后,将24只大鼠随机分为空白血清组和含药血清组,每组12只,含药血清组大鼠给予清燥救肺汤5.5 g/kg灌胃,空白血清组大鼠给予等体积生理盐水灌胃,每日1次,干预2周[3]。末次灌胃后经大鼠尾部采血,离心,保留血清,56℃水浴灭活,除菌过滤后,-20℃密封冷藏备用。
1.5含药血清干预及分组取第3代NSCLC细胞株H1299,用2.5 g/L胰蛋白酶消化后以1×106个/孔接种于6孔板,37℃、CO2培养箱中培养,细胞贴壁后更换新鲜的无血清RPMI 1640培养基继续培养。培养1 d后,弃上清。实验分为空白血清组及清燥救肺汤低、中、高浓度含药血清组(简称清燥救肺汤低、中、高浓度组)。空白血清组:NSCLC细胞+10%空白血清培养;清燥救肺汤低浓度组:NSCLC细胞+2.5%清燥救肺汤含药血清+7.5%空白血清;清燥救肺汤中浓度组:NSCLC细胞+5%清燥救肺汤含药血清+5%空白血清;清燥救肺汤高浓度组:NSCLC细胞+10%清燥救肺汤含药血清。给药后继续培养24 h后进行后续实验。
1.6观察指标与方法
1.6.1 平板克隆形成实验观察NSCLC细胞增殖能力 给药24 h后,取各组细胞制备细胞悬液接种于6孔板中常规培养7 d,结晶紫染色,显微镜下观察,计算克隆形成率。克隆形成率(%)=形成的细胞克隆数/接种细胞数×100%。
1.6.2 Transwell细胞侵袭及迁移实验Transwell小室包被基底膜(细胞侵袭实验所需)。制备细胞悬液5×104个/mL,接种到Transwell小室中,继续培养12~24 h。4%多聚甲醛固定,0.1%结晶紫染色,显微镜下随机选取5个视野,计算侵袭、迁移细胞数,取平均值。
1.6.3 PCR法检测NSCLC细胞Th1细胞表型因子IFN-γ及Th2细胞表型因子IL-4及IGF-1R/STAT3通路相关蛋白IGF-1R、STAT3的基因水平PCR反应条件:95℃预变性3 min;95℃变性5 s,58℃退火30 s,40个循环。以β-actin作为内参照,采用2-ΔΔCt法计算目的基因相对表达量。引物序列见表1。

表1 PCR引物序列Table 1 PCR primer sequences
1.6.4 蛋白免疫印迹(Western Blot)法检测NSCLC细胞IFN-γ、IL-4、IGF-1R、STAT3蛋白表达 将H1299细胞裂解离心取上清液,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白。IFN-γ(1∶1 000)、IL-4(1∶1 000)、IGF-1R(1∶1 500)、STAT3(1∶1 000)等一抗稀释液4℃孵育过夜。辣根过氧化物酶标记的二抗(1∶2 000)稀释液37℃反应1 h。电化学发光法(ECL)显色,曝光,凝胶成像系统(JY-Clear)分析目标条带的光密度值,结果以目的蛋白灰度值与内参蛋白(GAPDH)灰度值比值表示目的蛋白相对表达量。
1.7统计方法采用SPSS 21.0统计软件进行数据的统计分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析或重复测量方差分析,两组之间比较采用t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1各组NSCLC细胞克隆率比较空白血清组及清燥救肺汤低、中、高浓度组NSCLC细胞克隆率分别为(92.15±6.15)%、(83.11±4.16)%、(71.36±4.37)%、(52.31±5.02)%。4组组间比较,差异均有统计学意义(F=71.430,P<0.05)。与空白血清组比较,清燥救肺汤低、中、高浓度组NSCLC细胞克隆率减小(P<0.05),呈浓度依赖性。各组细胞克隆情况见图1。

图1 各组NSCLC细胞平板克隆形成实验结果Figure 1 Results of NSCLC cell plate clone formation assay
2.2各组NSCLC细胞侵袭能力比较空白血清组,清燥救肺汤低、中、高浓度组NSCLC细胞侵袭数分别为(148±17)、(111±15)、(84±13)、(62±10)个。4组组间比较,差异有统计学意义(F=42.080,P<0.05)。与空白血清组比较,清燥救肺汤低、中、高浓度组NSCLC细胞侵袭数量减少(P<0.05),且呈浓度依赖性。见图2。

图2 各组NSCLC细胞Transwell小室侵袭实验结果(×400)Figure 2 Results of Transwell invasion assay of NSCLC cells(×400)
2.3各组NSCLC细胞迁移能力比较空白血清组,清燥救肺汤低、中、高浓度组NSCLC细胞迁移数量分别为(108.01±11.34)、(85.73±5.14)、(67.33±6.44)、(44.52±6.79)个。4组组间比较,差异有统计学意义(F=72.050,P<0.05)。与空白血清组比较,清燥救肺汤低、中、高浓度组NSCLC细胞迁移数量减少(P<0.05),且呈浓度依赖性。见图3。

图3 各组NSCLC细胞Transwell小室迁移实验结果(×400)Figure 3 Results of Transwell migration assay of NSCLC cells(×400)
2.4各组NSCLC细胞中IFN-γ、IL-4、IGF-1R、STAT3的mRNA表达比较与空白血清组比较,清燥救肺汤低、中、高浓度组NSCLC细胞中IFN-γ mRNA表达水平升高,IL-4、IGF-1R、STAT3 mRNA表达水平降低(P<0.05),呈浓度依赖性。见表2。
表2 各组NSCLC细胞中IFN-γ、IL-4、IGF-1R、STAT3 mRNA表达比较Table 2 Comparison of mRNA expressions of IFN-γ,IL-4,IGF-1R,STAT3 in NSCLC cells of among various groups (±s,n=6)
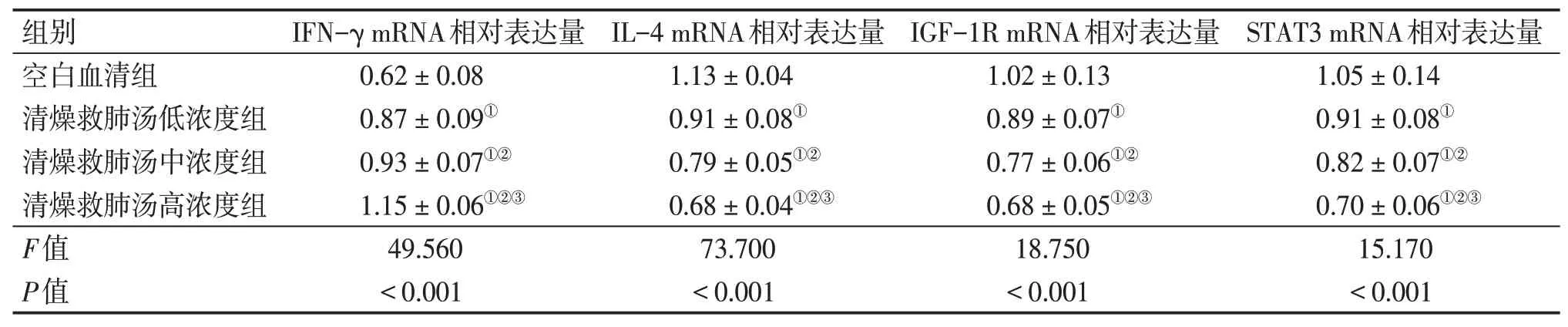
表2 各组NSCLC细胞中IFN-γ、IL-4、IGF-1R、STAT3 mRNA表达比较Table 2 Comparison of mRNA expressions of IFN-γ,IL-4,IGF-1R,STAT3 in NSCLC cells of among various groups (±s,n=6)
注:①P<0.05,与空白血清组比较;②P<0.05,与清燥救肺汤低浓度组比较;③P<0.05,与清燥救肺汤中浓度组比较
?
2.5各组NSCLC细胞中IFN-γ、IL-4、IGF-1R、STAT3蛋白表达比较与空白血清组比较,清燥救肺汤低、中、高浓度组NSCLC细胞中IFN-γ蛋白表达水平升高,IGF-1R、STAT3、IL-4蛋白表达水平降低(P<0.05),呈浓度依赖性。见表3、图4。

图4 各组NSCLC细胞中IFN-γ、IL-4、IGF-1R、STAT3的Western Blot电泳图Figure 4 Western Blot electrophoretogram of IFN-γ,IL-4,IGF-1R,STAT3 in NSCLC cells
表3 各组NSCLC细胞中IFN-γ、IL-4、IGF-1R、STAT3蛋白表达比较Table 3 Comparison of protein expressions of IFN-γ,IL-4,IGF-1R and STAT3 in NSCLC cells among various groups (±s,n=6)
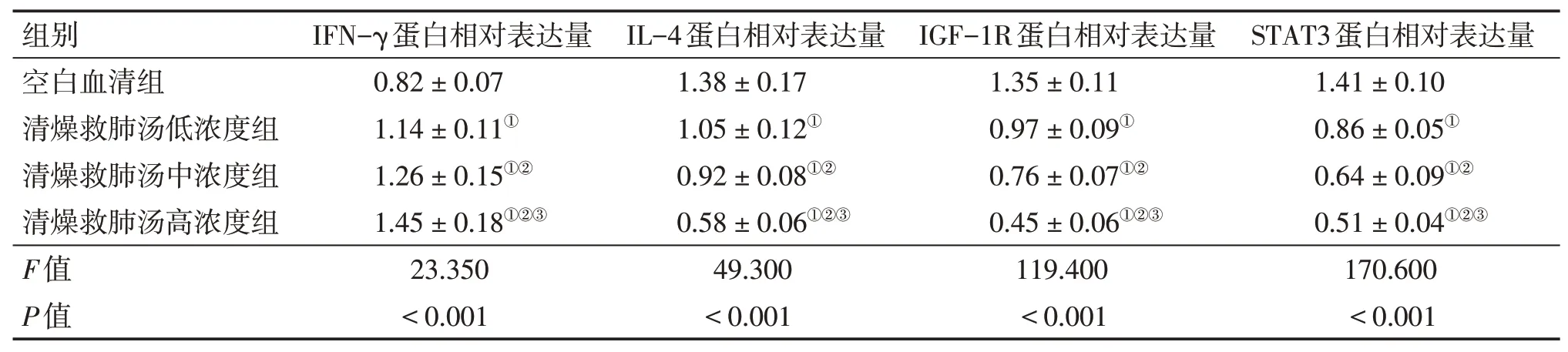
表3 各组NSCLC细胞中IFN-γ、IL-4、IGF-1R、STAT3蛋白表达比较Table 3 Comparison of protein expressions of IFN-γ,IL-4,IGF-1R and STAT3 in NSCLC cells among various groups (±s,n=6)
注:①P<0.05,与空白血清组比较;②P<0.05,与清燥救肺汤低浓度组比较;③P<0.05,与清燥救肺汤中浓度组比较
?
3 讨论
肿瘤的发生是由于多种因素作用导致的,易发生侵袭和转移,而肺癌在所有肿瘤类型中,发生侵袭和转移的概率最高[6]。本研究结果显示,经过清燥救肺汤干预后,NSCLC细胞克隆、侵袭及迁移能力降低,提示清燥救肺汤可抑制肺癌细胞的生长及转移。
肿瘤的发生发展与机体免疫密切相关,机体的抗肿瘤免疫功能主要体现在细胞免疫。T细胞介导的细胞免疫在抗肿瘤免疫中至关重要。Th1细胞表型因子IFN-γ参与细胞毒性T细胞介导的细胞免疫,具有重要的抗肿瘤作用,可诱导NK细胞增强抗肿瘤活性;Th2细胞表型因子IL-4参与速发型超敏反应,通过抑制IFN-γ的产生,防止NK细胞活化,抑制细胞免疫的抗肿瘤效应,促进肿瘤细胞的生长[7-9]。本研究结果显示,经过清燥救肺汤干预后,NSCLC细胞IFN-γ表达升高、IL-4表达降低,提示清燥救肺汤可上调NSCLC细胞IFN-γ表达并抑制IL-4表达,促进Th细胞向Th1型细胞分化,发挥抗肿瘤作用。
IGF-1R/STAT3通路参与多种肿瘤的产生及发展。IGF-1R是一种广泛表达于多种类型细胞表面的酪氨酸激酶跨膜蛋白,主要介导IGF-1和IGF-2的生物学作用,参与机体物质代谢调节及胚胎发育等生物学过程,同时还能刺激肿瘤细胞增殖[10]。已有研究证实,IGF-1R信号通路影响肿瘤细胞的发生、发展、凋亡、各种途径的转移[11-12]。STAT3是IGF-1R/STAT3通路的成员,属于STAT家族成员。有研究[13]表明,STAT3的激活可以促进肺癌发生和肿瘤血管形成,与肺癌的进展和预后密切相关。在相关细胞的作用下,炎症因子通过激活STAT3的表达使其磷酸化后,可特异性地结合在相关因子的基因启动子区,通过启动相关基因的表达促进Th1细胞的分化[14-15]。本研究结果显示,给予清燥救肺汤干预后,NSCLC细胞STAT3、IGF-1R表达随着浓度的增加而降低,提示清燥救肺汤可抑制NSCLC细胞IGF-1R/STAT3通路的活化,发挥抗肿瘤的作用。
综上所述,清燥救肺汤可能通过促进IFN-γ表达,抑制IL-4表达,介导T细胞分化以调节免疫功能,同时抑制IGF-1R/STAT3通路活化,从而抑制NSCLC细胞的恶性行为。
