复合陶粒对水中氨氮和磷的吸附研究
2022-12-21赵明星戚艳侠
蒋 楠,李 彬,赵明星,戚艳侠
(湖州师范学院化学系,浙江湖州 313000)
水产品需求的逐渐增加带来各种方式水产养殖规模的扩大,促进了水产养殖业迅猛发展。由于投喂频率增加、高频率换水、消毒剂和药物的使用以及不适当的管理方法等,使养殖水体的污染程度不断加剧,也给周边的水环境带来了潜在的威胁[1]。同时,不断富集的氨氮和磷使藻类和浮游生物的增多,加快了水中现有溶解氧的下降,引起水中鱼虾等生物的大量死亡,水体质量变差,水中生态平衡被打破,导致病害滋生和养殖效益下降,阻碍了水产养殖业的健康发展和影响食品安全[2]。因此,对水中氨氮和磷的处理已经显得越来越重要,也引起养殖业和环境保护领域的高度重视。目前,水体中氨氮和磷的去除方法有很多[3],如吹脱法[4]、沸石脱氮法[5]、膜分离技术[6]、MAP沉淀法[7]和化学氧化法[8],静电吸附法[9]、化学沉淀法[10]、结晶法[11]和吸附法[12]等。近年来,吸附法的操作简单、成本低廉、高效低耗和吸附容量大且环境友好等特点,使其在处理水中氨氮和磷具有较大潜力[13]。因此,进一步研究吸附能力强、成本低和二次污染小的吸附剂是更好地解决氨氮和磷处理的一个重要途径。
利用矿物和农业废弃物等作为吸附剂处理废水取得了一定进展,如新型镧改性膨润土[14],用于废水除磷有较好效果;稻草和沸石的新型混合物对磷去除率可达到99%,是一种很有前途的低成本废水处理吸附剂[15];石榴皮作为低成本的氨氮吸附剂[16]在一定条件下可以到达97%的去除率。
通过不同吸附剂对镍离子和镉离子的吸附表明[17-18],由磷矿粉为主成分的吸附剂对重金属镍和镉都有较好的吸附效果,说明磷矿粉具有较强的选择性吸附能力。本研究以磷矿粉为主原料,结合废弃物的利用,采用膨润土尾矿和竹粉为辅助原料,制备复合陶粒,研究低成本、高效率和可再利用的吸附剂,探究吸附剂对水中氨氮和磷的吸附性能及影响因素,并通过动力学分析吸附过程的变化。
1 材料与方法
1.1 试剂与材料
试剂:氯化铵(中国医药集团上海化学试剂公司)、磷酸二氢钾(湖州湖试化学试剂有限公司)、氢氧化钠、碘化钾(杭州萧山化学试剂厂)、碘化汞(汕头市光华化学厂)、酒石酸钾钠(上海美兴化工股份有限公司)、抗坏血酸(广东省化学试剂工程技术研究开发中心)、钼酸铵(汕头市西陇化工厂)、酒石酸锑钾(上海试剂四厂)、硫酸和硝酸等均为分析纯(浙江中星化工试剂有限公司)。所有溶液均用去离子水配制。
材料:磷矿粉购自济南荣冠化工有限公司,膨润土、膨润土尾矿(湿法提纯后用于砂浆稠化剂产生的尾矿)购自安吉中瑞膨润土化工有限公司;竹粉由浙江森达竹木制品有限公司提供。
1.2 复合陶粒吸附剂的制备
制备6种复合陶粒的组分比例如下(重量比)。
陶粒A—磷矿粉∶膨润土∶竹粉=6.5∶2.5∶1
陶粒B—磷矿粉∶膨润土尾矿∶竹粉=6.5∶2.5∶1
陶粒C—攀枝花尾矿∶膨润土尾矿∶竹粉=4∶3∶3
陶粒D—攀枝花尾矿∶磷矿粉∶膨润土尾矿∶竹粉=4∶3∶2∶1
陶粒E—膨润土∶竹粉=4∶6
陶粒F—膨润土尾∶竹粉=4∶6
将各组分原料过通过100目筛后,按比例将混合均匀,加入一定比例的粘合剂和去离子水搅拌均匀,陈化12h,通过制丸机制作成4mm球坯,置通风处自然干燥后,将球坯装入坩埚中,表面铺上一层石英砂,放置于马弗炉高温煅烧,以200℃·h-1的速率升温至1000℃,保持1h,冷却至室温,制得复合陶粒。
1.3 样品的表征
采用自动比表面积与孔隙度分析仪(BET,Nova 4200e,美国康塔)在77K条件下测定陶粒的比表面积;晶型的分析采用X射线衍射仪(XRD,XD-6,北京普析)在36kV,20mA,Cu靶Kα 0.15406nm条件下进行,测试范围为10°<2θ<80°;采用傅里叶红外光谱仪(FT-IR Nicolet is20,美国赛默飞世尔)KBr压片,扫描范围为400~4000cm-1,分析陶粒表面官能团;采用拉曼光谱(BWS415-532S,美国必达泰克)在激发波长532nm下,100~4000cm-1范围内扫描,分析陶粒的组成和结构。
1.4 方法
1.4.1 吸附试验
1.4.1.1 不同陶粒吸附能力试验分别取A、B、C、D、E、F组分的陶粒2g放入含100mL、10mg·L-1铵标准溶液和2mg·L-1磷标准溶液锥形瓶中,调节pH=7,在25℃,以90r·min-1速度振荡吸附6h,吸附液过滤,取25mL滤液,在722E型可见分光光度计上,根据HJ535-2009《纳氏试剂分光光度法》[19]和GB11893-89《钼酸铵分光光度法》[20]对滤液中的氨氮和磷浓度进行分析,并按式(1)和式(2)计算吸附率η和吸附量q。式中:η为吸附率(%);q为氨氮或磷的吸附量(mg·g-1);C0为吸附前氨氮或磷的初始浓度(mg·g-1);C为吸附时间t时氨氮或磷的浓度(mg·g-1);m为陶粒添加量(g);V为氨氮或磷溶液体积(L)。

1.4.1.2 吸附影响因素试验pH值影响试验:在25℃条件下,将100mL、10mg·L-1铵标准溶液和2mg·L-1磷标准溶液分别调节pH值为1~11,分别加入2g陶粒B吸附6h,吸附液过滤,测定氨氮和磷浓度,后续步骤同上,研究pH值对水中氨氮和磷吸附效果的影响。
投加量影响试验:将100mL、10mg·L-1铵标准溶液和2mg·L-1磷标准溶液调节pH值为7,分别加入1~5g陶粒B进行吸附,氨氮吸附4h,磷吸附2h,吸附液过滤,测定氨氮和磷浓度,后续步骤同上,研究陶粒投加量对水中氨氮和磷吸附效果的影响。
氨氮共存离子吸附试验:将水体中常见的阳离子Na+、K+、Mg2+、Ca2+、Fe3+和PO43-阴离子作为共存离子,研究其对氨氮吸附的影响。溶液中的氨氮的初始浓度和每种共存离子的浓度均是20mg·L-1。将20mg·L-1NH4+-N溶液与20mg·L-1共存离子溶液等体积混合,溶液的体积是100mL,初始pH值为7,投加量为3g。
磷共存离子吸附试验:将SO42-、NO3-、NO2-、Cl-、NH4+-N作为共存离子,PO43--P初始浓度和共存离子初始浓度均是2mg·L-1,溶液的体积是100mL,初始pH值为7,投加量为1g。
1.4.1.3 吸附动力学试验在25℃条件下,将3g陶粒B分别加至100mL浓度为10mg·L-1铵标准溶液中,初始pH值为7,振荡吸附1~14h,吸附液过滤,取25mL滤液,测定氨氮浓度,用准一级动力学和准二级动力学模型拟合。
在25℃条件下,将1g陶粒B分别加至100mL浓度为2mg·L-1磷标准溶液中,初始pH值为7,振荡吸附10~180min,吸附液过滤,取25mL滤液,测定磷浓度,用准一级动力学和准二级动力学模型拟合。
准一级动力学模型数学式为:

准二级动力学模型数学式为:

式中:qt为各个时间的吸附量(mg·g-1);qe为平衡吸附量(mg·g-1);k1为准一级动力学常数(min-1)和k2准二级动力学常数[g·(mg·min)-1];t为吸附时间(min)。
1.4.1.4 吸附等温线在25℃条件下,将3g陶粒B分别加至100mL浓度为5,10,15,20,30,40和50mg·L-1铵标准溶液中,初始pH值为7,振荡吸附后测定氨氮浓度,用Langmuir和Freundlich等温吸附模型拟合。
在25℃条件下,将1g陶粒B分别加至100mL浓度为1.0,1.5,2.0,2.5,3.0,3.5和4mg·L-1磷标准溶液中,初始pH值为7,振荡吸附后测定磷吸附率,用Langmuir和Freundlich等温吸附模型拟合。

式中:Ce为吸附平衡时的氨氮或磷的浓度(mg·L-1);Qe为平衡吸附量(mg·g-1);K为平衡吸附系数;n为经验常数。

式中:ce为吸附平衡时的浓度(mg·L-1);qe为氨氮或磷的平衡吸附量(mg·g-1);qm为氨氮或磷的单层饱和吸附量(mg·g-1);b为平衡吸附系数。
1.4.2 解吸附与再利用试验
1.4.2.1 解吸附剂浓度对氨氮和磷二次吸附的影响在25℃条件下,选取氨氮解吸附剂KCl,分别配制50mL 0.2,0.4,0.6,0.8和1.0mol·L-1的KCl解吸附液,加入3g已吸附氨氮至饱和的复合陶粒B,以90r·min-1速度振荡,解吸附时间4h,取滤液测定解吸附率。选取磷解吸附剂KCl,分别配制50mL 0.01,0.02,0.03,0.04和0.05mol·L-1的KCl解吸附液,加入1g已吸附磷至饱和的复合陶粒B,以90r·min-1速度振荡,解吸附时间4h,取滤液测定解吸附率。将已经完成解吸附的陶粒B取出,干燥后置于锥形瓶中,重复吸附操作,分别对氨氮和磷进行二次吸附,探究陶粒的解吸附及再生性能。
1.4.2.2 解吸附时间对氨氮和磷二次吸附的影响在25℃条件下,将3g已吸附氨氮至饱和的复合陶粒B取出,干燥并加入到碘量瓶中,加入50mL 1.0mol·L-1的KCl,以90r·min-1速度振荡,进行解吸附,时间1~12h,取滤液测定解吸附率。将1g已吸附磷至饱和的复合陶粒B取出,干燥并加入到碘量瓶中,加入50mL 0.02mol·L-1的KCl,以90r·min-1速度振荡,进行解吸附,时间1~12h,取滤液测定解吸附率。将已经完成解吸附的陶粒B取出,干燥后置于锥形瓶中,重复吸附操作,对磷进行二次吸附,探究陶粒的解吸附及再生性能。
所有试验均做3次平行试验,结果取平均值,如果3次结果的误差大于10%,则需要再进行平行试验。
2 结果与分析
2.1 吸附试验结果
2.1.1 不同陶粒的吸附性能制备原料采用矿物和农业废弃物,这些原料有不同的特性,其中,膨润土和膨润土尾矿具有一定黏结性,攀枝花选钛尾矿含有多种氧化物组分,竹粉具有造孔作用和炭化后具有一定补充吸附作用,磷矿粉具有吸附选择性,其中除了磷矿粉和膨润土为普通矿物外,其他组分均为废弃物。磷矿粉为主成分的陶粒(A、B和D)对氨氮和磷的吸附率较高(图1),说明磷矿粉为主原料的陶粒适宜在处理氨氮和磷时使用。由表1可知,含磷矿粉陶粒比表面积都不大,含竹粉多的陶粒E和陶粒F表面积大,并对六价铬离子有较好吸附[21],但对氨氮和磷的吸附弱,根据吸附效果,选择陶粒B做进一步吸附研究。

表1 不同组分陶粒表面性质Table 1 Surface properties of ceramsite with different components
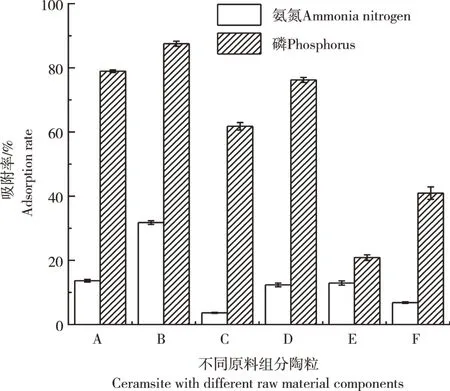
图1 不同陶粒对氨氮和磷的吸附性能图Figure 1 Adsorption properties of different ceramsite for ammonia nitrogen and phosphorus
2.1.2 pH值的影响pH值是影响表面电荷的一个重要因素,溶液中的H+和OH-对吸附剂的特性和化学特性有一定影响[22],复合陶粒对氨氮和磷的较高吸附效果集中在pH=5~8之间,适合在水产养殖水中处理氨氮和磷(图2)。在pH值较大区域时,氨氮和磷的吸附率均下降,主要原因是溶液中OH-含量增多,对于氨氮的吸附来说,OH-易于与NH4+结合生成NH3·H2O,阻碍NH4+在陶粒上的被吸附行为;对磷的吸附来说,pH>7时,磷主要以H2PO4-和HPO42-的形式存在,溶液中OH-增多与磷之间形成竞争吸附,不利于吸附的进行,导致陶粒对磷的吸附量下降。

图2 溶液初始pH值对氨氮和磷吸附效果的影响Figure 2 Effect of initial pH of solution on adsorption of ammonia nitrogen and phosphorus
2.1.3 陶粒添加量的影响随着陶粒投加量的增加,陶粒对水中氨氮和磷的吸附率都有所提高,当陶粒的投加量达到3g时,对氨氮的吸附率达52.7%,继续增大陶粒B的投加量,氨氮的吸附率仍有增加,综合考虑效能,选取3g作为吸附氨氮的最佳投加量。当陶粒的投加量达到1g时,对磷的吸附率达93.2%,继续增大陶粒的投加量,磷的去除率趋于平缓,因此选择1g作为吸附磷的最佳投加量(图3)。

图3 陶粒投加量对氨氮和磷吸附效果的影响Figure 3 Effect of ceramsite B dosage on the adsorption of ammonia nitrogen and phosphorus
2.1.4 共存离子的影响当溶液中不含有共存离子时,陶粒B对氨氮的吸附率为89.23%,磷酸盐阴离子的存在基本对氨氮吸附无影响(图4);与金属阳离子的共存时对氨氮吸附的影响顺序是Fe3+>Mg2+>Ca2+>Na+>K+,其中K+和Na+对氨氮吸附的影响较小,Mg2+、Ca2+和Fe3+与氨氮共存时陶粒B对氨氮的吸附率分别为86.53%、84.43%、81.73%。导致这一结果的原因可能是金属阳离子与铵根离子一同参与竞争吸附剂表面的吸附位点,且三价和二价金属阳离子相对于单价金属阳离子能占据更多的吸附位点,具有更强的竞争能力[23-25]。

图4 共存离子对陶粒B吸附氨氮(a)和磷(b)的影响Figure 4 Effect of coexisting ions on adsorption of ammonia nitrogen(a)and phosphorus(b)by ceramsite B
当溶液中不含有共存离子时,陶粒B对磷的吸附率为93.18%,当SO42-、NO3-、NO2-、Cl-、NH4+-N存在时,陶粒B对磷的吸附率基本无影响,说明陶粒B对磷酸盐的吸附过程具有很强的离子选择性,几乎不受其他离子的干扰。
2.1.5 吸附动力学陶粒对初始浓度为10mg·L-1的氨氮溶液和初始浓度为2mg·L-1的磷溶液的吸附量随时间变化的关系如图5,吸附分别在12h和2h达到平衡。采用准一级动力学方程和准二级动力学方程对吸附结果进行拟合。
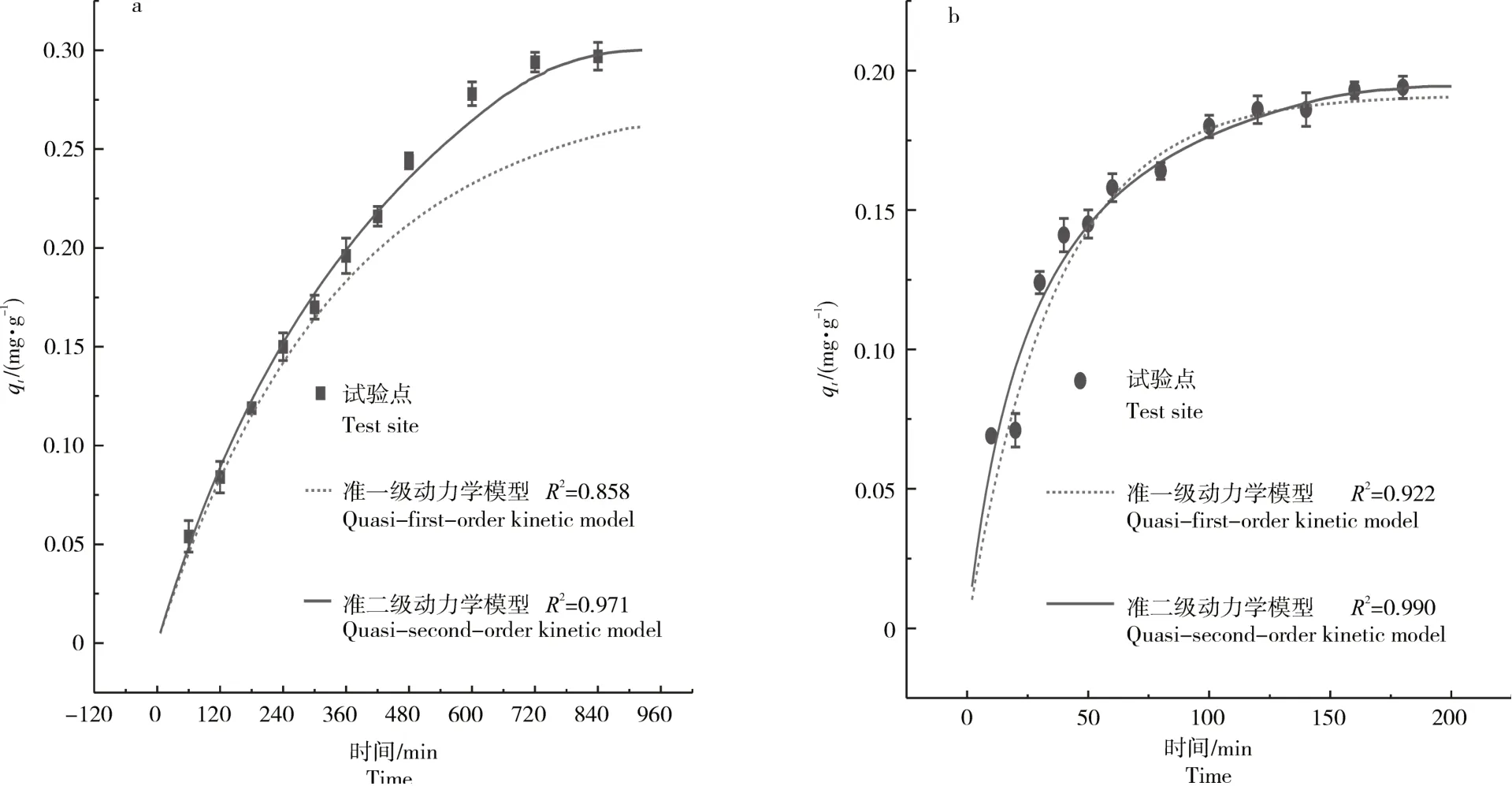
图5 陶粒吸附氨氮(a)和磷(b)的动力学Figure 5 Kinetic diagram of adsorption of ammonia nitrogen(a)and phosphorus(b)by ceramsite
拟合结果表明,陶粒吸附氨氮和磷的准二级动力学方程相关系数分别为R2=0.971和R2=0.990,准二级动力学模型可以更准确地描述陶粒对水中氨氮和磷的吸附过程。准二级动力学方程假定了化学吸附是吸附过程的限速步骤,可以初步判断陶粒对氨氮和磷的吸附过程以化学作用为主[26]。其中,陶粒吸附磷的准一级动力学方程R2=0.922,说明可能含有一定的物理吸附过程。
2.1.6 吸附等温线陶粒对氨氮和磷在25℃的等温吸附曲线分别采用Ferundlich(式5)和Langmuir(式6)进行拟合。
陶粒对氨氮和磷的吸附量均随着平衡浓度的增加而增加(图6)。由拟合模型的R2可以看出,陶粒吸附氨氮的吸附数据和吸附磷的吸附数据均与Langmuir模型的相关系数更大一些,Freundlich模型所得到的1/n小于1(表2),表明吸附过程很容易实现[27]。Langmuir模型定义的无量纲分离因子RL值(式7)反应吸附的难易程度,如果R在0~1.0之间,说明为有利吸附[28]。由表2可知,陶粒吸附磷的RL=0.00025,磷在陶粒上的吸附容易进行。

表2 陶粒吸附氨氮、磷的等温拟合参数Table 2 Isothermal fitting parameters of adsorption of ammonia nitrogen and phosphorus by ceramsite

图6 陶粒吸附氨氮(a)和磷(b)的吸附等温线Figure 6 Adsorption isotherm of ammonia nitrogen(a)and phosphorus(b)on ceramsite

式中:C0为溶液初始浓度(mg·L-1)。
2.2 解吸附与再利用试验结果
2.2.1 解吸附剂浓度对二次吸附率的影响使用不同浓度的KCl解吸附剂时,陶粒B对氨氮的二次吸附率在吸附剂浓度为1.0mol·L-1时达到最高,随后基本不变;陶粒B对氨氮的二次吸附率在吸附剂浓度为0.8mol·L-1时达到最高,随后基本不变;陶粒B对磷的二次吸附率随吸附剂浓度升高先上升,在浓度为0.02mol·L-1时达到最高,随后降低(图7)。说明陶粒B仍显示出良好的再吸附性能,陶粒可在一定范围内重复使用。
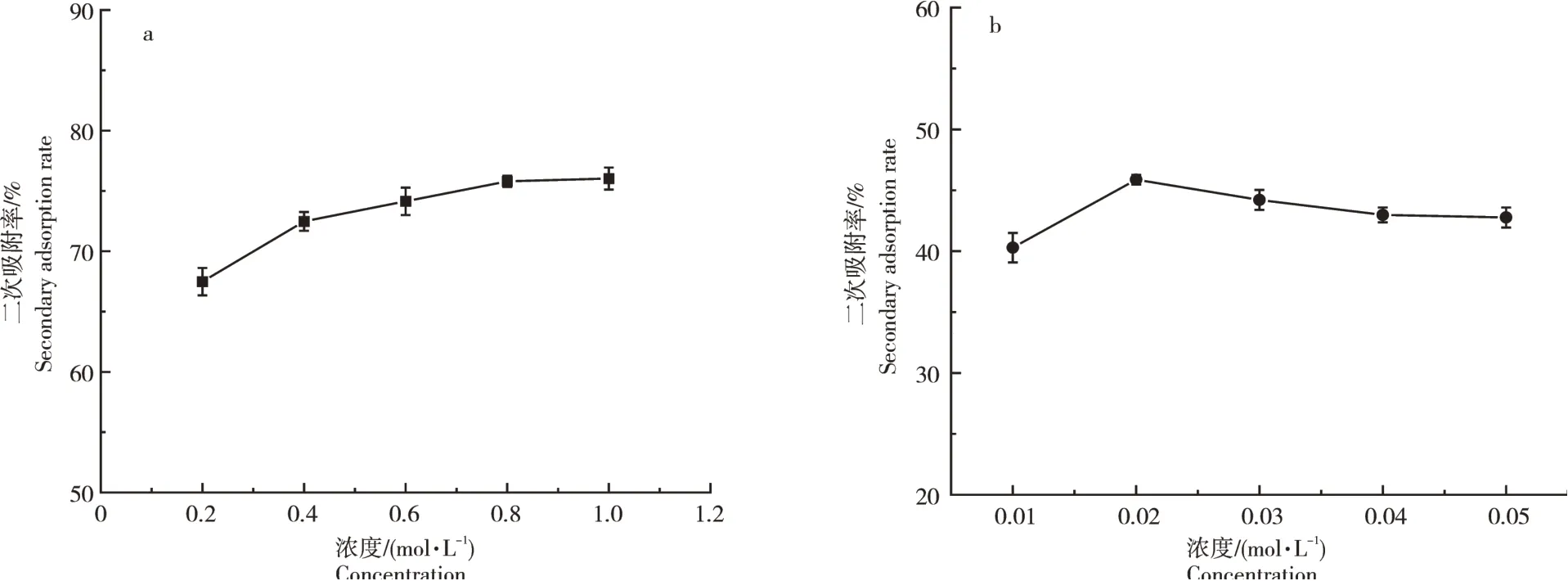
图7 陶粒对氨氮(a)和磷(b)的二次吸附率随解吸附剂浓度的变化曲线Figure 7 The variation curve of the secondary adsorption rate of ceramsite to ammonia nitrogen(a)and phosphorus(b)with the concentration of adsorbent
2.2.2 解吸附时间对二次去除率的影响陶粒B对氨氮和磷的二次吸附率均随解吸附时间增大先升高,在6h时达到最高,随后基本不变(图8),氨氮的二次吸附率能达65%以上,磷的二次吸附率能达50%以上,故可选择6h进行解吸附。
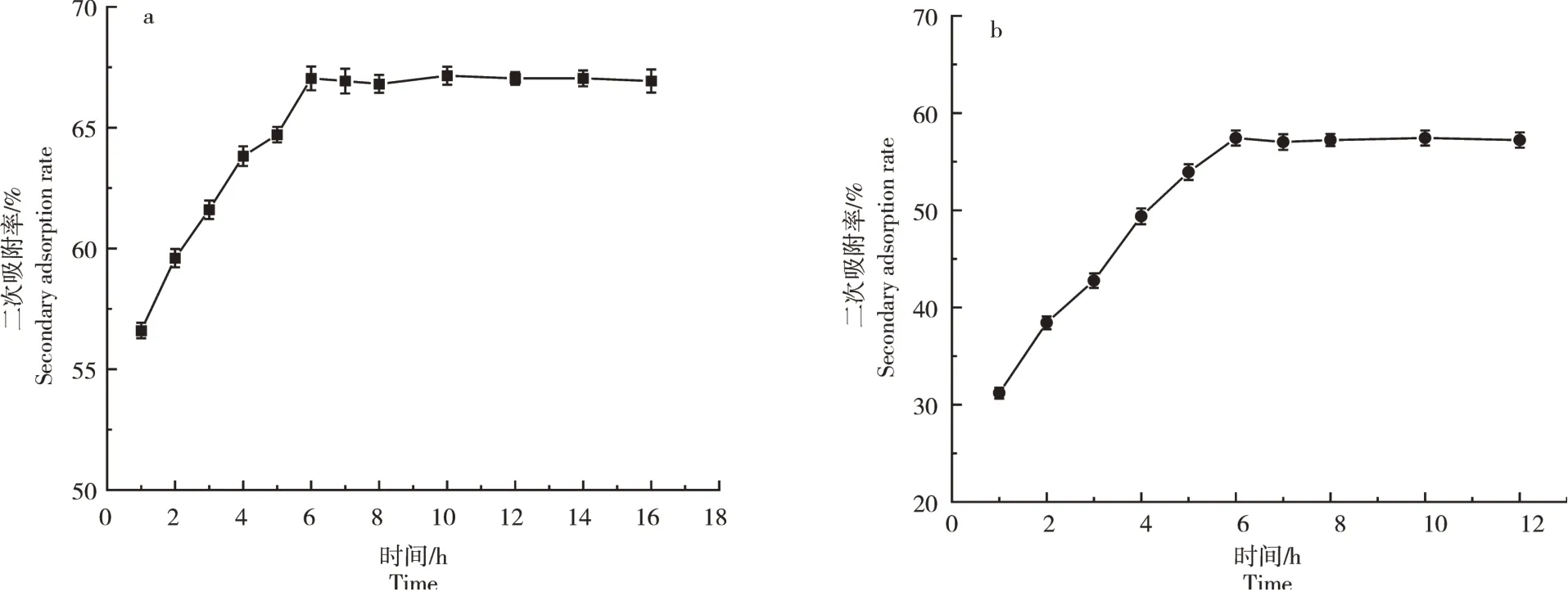
图8 陶粒对氨氮(a)和磷(b)的二次吸附率随解吸附时间的变化曲线Figure 8 Variation curve of secondary adsorption rate of ceramsite to ammonia nitrogen(a)and phosphorus(b)with desorption time
2.3 陶粒的结构表征及吸附机理
2.3.1 陶粒的表面积和表观形貌图9为陶粒B吸附前后的氮气吸附脱附曲线,等温线中均存在一个回滞环,属于典型的介孔材料等温吸脱附曲线,说明介孔分布状态、孔径不均匀和孔结构不完整。吸附前后表面积有一定变化(表3),吸附前比表面积为2.422m2·g-1,吸附氨氮后为6.047m2·g-1,吸附磷后11.607m2·g-1。

表3 陶粒对氨氮和磷吸附前后的物理性质参数Table 3 Physical property parameters of ceramsite before and after adsorption of ammonia nitrogen and phosphorus

图9 陶粒对氨氮和磷吸附前后吸附解吸附曲线Figure 9 Adsorption and desorption curve of ceramsite before and after adsorption of ammonia nitrogen and phosphorus
2.3.2 陶粒的晶相通过XRD分析对陶粒吸附氨氮和磷前后的晶体变化(图10),由图可知,吸附氨氮和磷后陶粒表面的晶体组分有新的变化。吸附前的陶粒主晶相为SiO2,CaCO3和Ca5(PO4)3F,吸附氨氮和磷后,从微弱的峰发现,可能有少量的NH4NO3和K2HPO4存在。

图10 陶粒对氨氮和磷吸附前后的XRD图Figure 10 X-ray diffraction pattern of ceramsite before and after adsorption of ammonia nitrogen and phosphorus
2.3.3 陶粒的红外光谱和拉曼光谱图谱陶粒吸附氨氮和磷前后的红外谱图如图11所示,样品在3676,3441和3437cm-1处对应–OH伸缩振动峰,其中,3441cm-1附近峰可能是N-H键引起的,被-OH伸缩振动峰覆盖[29],在1090~1030cm-1处对应P-O伸缩振动峰或H2PO42-特征峰[30],777cm-1为Si-O-Si弯曲振动峰[31],1400cm-1和1520cm-1附近的峰是P=O振动峰和CO32-键的伸缩振动峰[32],吸附氨氮和磷后,陶粒的两个峰在1400cm-1处变成一个峰,强度降低,峰形变宽,说明官能团参与了吸附作用。
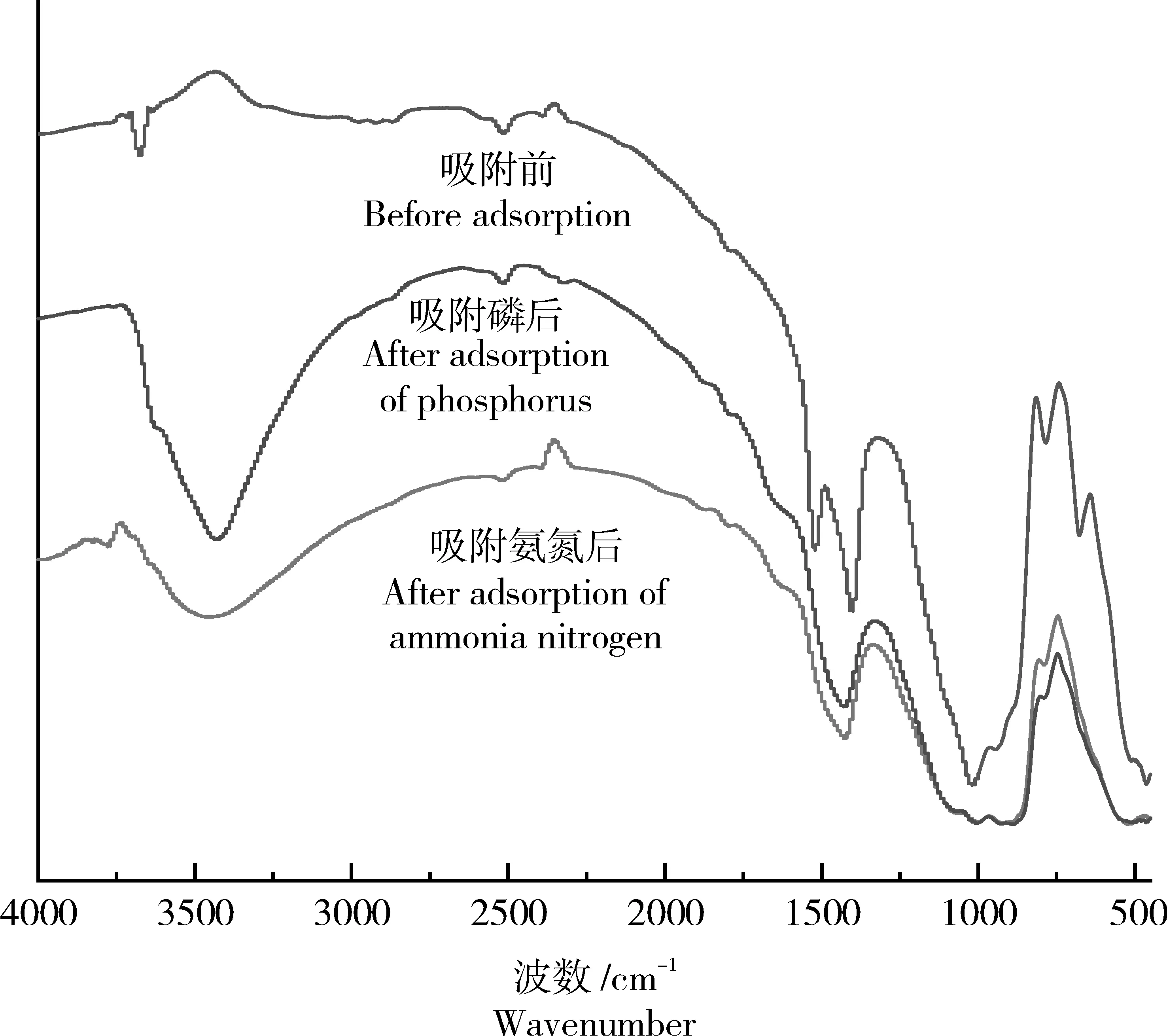
图11 陶粒对氨氮和磷吸附前后的红外光谱图Figure 11 FTIR spectra of ceramsite before and after adsorption of ammonia nitrogen and phosphorus
陶粒吸附氨氮和磷前后拉曼光谱见图12。由图12可知,1593cm-1和1348cm-1处出P-O特征峰[33],吸附后在1233cm-1附近出现N-H峰,1085cm-1处的P-O反对称角振动峰[34],与红外光谱和XRD一起验证了氨氮和磷已被吸附到陶粒表面。

图12 陶粒对氨氮和磷吸附前后的拉曼光谱图Figure 12 Raman spectra of ceramsite before and after adsorption of ammonia nitrogen and phosphorus
3 讨论与结论
从动力学和结构分析发现,复合陶粒含有多种组分,对氨氮和磷的吸附是个复杂的过程,吸附是多个因素综合作用的过程。矿物表面的负电荷、吸水过程和表面形态可能是选择性吸附的一个原因[35]。XRD证据表明,吸附氨氮后表面有NH4+的晶体存在,说明含有少量物理吸附的吸附位点吸附作用。溶液中游离的OH-和官能团在吸附中也起重要作用[36],红外光谱的峰形变化和拉曼光谱数据说明了这个变化。磷酸根与丰富的OH-,C=O和Si-O等官能团作用,吸附体系带正电荷,磷的存在形态为H2PO4-和HPO42-,同时,HPO42-及CaHPO4更易被吸附[37]。XRD出现了HPO42-晶体相,进一步说明了吸附的形式。同时,根据配体交换释放OH-和静电吸附理论[38],一部分以HPO42-形式在陶粒表面产生吸附;另一部分以其他形式被吸附,动力学结果也验证了这一结果。因此,综合分析后发现,氨氮和磷的吸附是通过吸附位点吸附,官能团间吸附和静电吸附等综合作用使氨氮和磷富集在陶粒表面,其中,不同作用发生的程度不同。
(1)通过不同陶粒的吸附性能比较发现,磷矿粉基复合陶粒对氨氮和磷均具有选择性吸附,吸附效果较好。
(2)当模拟水pH值7、投加磷矿粉基复合陶粒3g时,在室温下对初始浓度为10mg·L-1的氨氮溶液吸附12h,吸附率达89.23%;当复合陶粒用量1g,在室温下对初始浓度为2mg·L-1的磷溶液振荡吸附2h,吸附率达93.18%。根据《污水综合排放标准》GB8978-1996[39],氨氮一级排放标准≤15mg·L-1,磷酸盐一级排放标准≤0.5mg·L-1,故本研究中的复合陶粒B吸附氨氮和磷后能够满足规定的出水浓度。
(3)准二级动力学模型可以更准确地描述陶粒对水中氨氮和磷的吸附过程,化学吸附为主控步,准一级动力学方程在一定程度上可描述陶粒吸附磷的过程,说明可能含有一定的物理吸附过程。陶粒吸附氨氮和磷的吸附数据均与Langmuir模型有较好的符合性。
(4)BET、XRD、FTIR和Raman光谱表征结果表明,对氨氮和磷的吸附是个复杂的过程,是吸附位点吸附,官能团间吸附和静电吸附等综合作用的结果。
