参蛤散对H9c2 心肌细胞增殖的影响
2022-12-20邱伯雍魏易洪苑素云毛美娇
邱伯雍,魏易洪,苑素云,毛美娇,曹 敏,周 端,邓 兵,沈 琳
参蛤散是中医经典方剂,本课题组在前期研究中发现该方可以改善心功能[1]、舒张主动脉[2]、减轻心肌氧化应激[3],并能保护心脏线粒体功能[4]。在临床试验和动物实验等方面均证实了参蛤散具有很好的抗心力衰竭作用[5]。但在细胞研究水平,目前尚未见参蛤散相关的较多报道。H9c2 心肌细胞是常用的心肌细胞株,多用于药理及信号通路机制等研究。本实验拟采用H9c2 心肌细胞为研究对象,同时制备参蛤散冻干粉进行干预,使用细胞计数试剂盒-8(CCK-8)法检测细胞吸光度值(OD 值),细胞划痕实验检测细胞迁移率,探讨参蛤散对H9c2 心肌细胞增殖的作用,为后续进一步研究参蛤散的药效及药理机制作铺垫。
1 材料与方法
1.1 细胞 大鼠心肌细胞(H9c2)购自中国科学院上海生命科学研究院细胞资源中心。
1.2 药物与试剂 人参购自上海上药神象健康药业公司(批号:180702);蛤蚧购自上海雷允上药业西区有限公司(批号:190812)。参蛤散冻干粉制备:蛤蚧去头足,加入3 倍蛤蚧质量的人参,再加入5 倍干药质量的一级纯水,煎煮2 遍,过滤药液后浓缩。浓缩液装入冻干机中制备冻干粉,加入等重DMEM 配成参蛤散冻干粉溶液,用0.22μm 微孔滤膜(MILLEXGP)过滤,配成1 g/mL的母液,置于-20 ℃冰箱保存。CCK-8 购自上海碧云天生物技术有限公司。
1.3 实验仪器 LGJ-10D 冷冻干燥机(北京四环科学仪器厂有限公司);多功能酶标仪(美国Thermo 公司);ECLIPSE Ti2 TI-E 倒置式荧光显微镜(日本尼康公司);37 ℃培养箱(德国Heraues 公司)。
1.4 实验方法
1.4.1 细胞培养及分组 将H9c2 心肌细胞培养于37 ℃、5%CO2培养箱中,待细胞生长到约80%融合时使用0.25%胰蛋白酶消化进行传代,平均约3 d 传1 代。细胞传代后,设立对照组(未作处理),参蛤散不同浓度组(0.5%DMEM 将参蛤散冻干粉母液稀释成0.01 mg/mL、0.03 mg/mL、0.10 mg/mL、0.30 mg/mL、1.00 mg/mL)。
1.4.2 OD 值检测 将对数生长期H9c2 细胞接种于96 孔板,每孔1×104个细胞,于10%DMEM 培养液、37 ℃、5% CO2培养箱培养24 h 后,更换成0.5%DMEM 培养液以及不同浓度参蛤散溶液,于24 h、48 h、72 h 各时间点(每24 h 更换新培养液及药液)抽掉细胞培养液,每孔加入100 μL 的CCK-8 溶液,于培养箱培养1 h 后,用酶标仪检测细胞OD 值。
1.4.3 细胞划痕实验 将对数生长期H9c2 细胞接种于6 孔板,每孔5×105个细胞,于10%DMEM 培养液、37 ℃、5%CO2培养箱中培养24 h 后,用200μL 移液枪枪头垂直孔板划痕,磷酸盐缓冲液(PBS)冲洗2次或3 次后,更换成0.5%DMEM 培养液以及不同浓度参蛤散溶液,于24 h、48 h、72 h 各时间点(每24 h 更换新培养液及药液)进行显微镜拍照。采用Image J软件分析划痕面积以计算细胞迁移率,细胞迁移率(%)=(0 h 划痕面积―各时间点划痕面积)/0 h 划痕面积×100%。
1.5 统计学处理 采用SPSS 22.0 软件对数据进行统计学处理。定量资料符合正态分布时以均数±标准差(±s)表示,组间数据比较采用单因素方差分析(One Way ANOVA)及最小显著差异法(LSD )检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各时间点H9c2 心肌细胞OD 值 24 h 参蛤散0.03 mg/mL、0.10 mg/mL、0.30 mg/mL、1.00 mg/mL 组OD值高于对照组(P<0.05);48 h 参蛤散各浓度组OD值均高于对照组(P<0.05);72 h 参蛤散0.01 mg/mL组OD 值高于对照组(P<0.05)。详见表1、图1。

图1 各组H9c2 心肌细胞OD 值
表1 各组H9c2 心肌细胞OD 值(±s)

表1 各组H9c2 心肌细胞OD 值(±s)
与对照组比较,①P <0.05。
组别 24 h 48 h 72 h对照组 0.72±0.03 0.81±0.02 0.89±0.03参蛤散0.01 mg/mL 组 0.70±0.03 0.93±0.03① 0.94±0.03①参蛤散0.03 mg/mL 组 0.78±0.03① 1.02±0.02① 0.92±0.03参蛤散0.10 mg/mL 组 0.78±0.03① 1.02±0.05① 0.90±0.02参蛤散0.30 mg/mL 组 0.80±0.02① 0.97±0.06① 0.86±0.02参蛤散1.00 mg/mL 组 0.81±0.02① 1.00±0.05① 0.89±0.04
2.2 各时间点H9c2 心肌细胞迁移情况 24 h 参蛤散0.10 mg/mL、0.30 mg/mL、1.00 mg/mL 组细胞迁移率大于对照组(P<0.05);48 h 参蛤散0.01 mg/mL、0.10 mg/mL、0.30 mg/mL 组细胞迁移率大于对照组(P<0.05);72 h 参蛤散0.01 mg/mL、0.30 mg/mL 组细胞迁移率大于对照组(P<0.05)。详见表2、图2、图3。
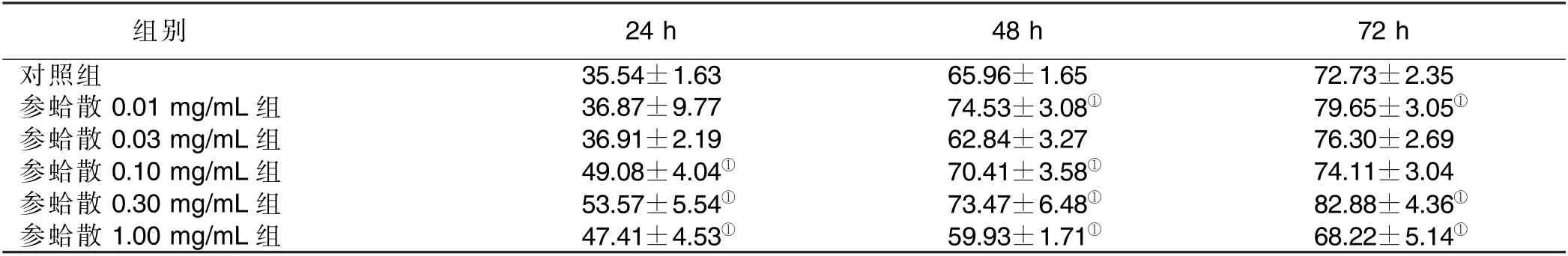
表2 各组H9c2 细胞迁移率 单位:%
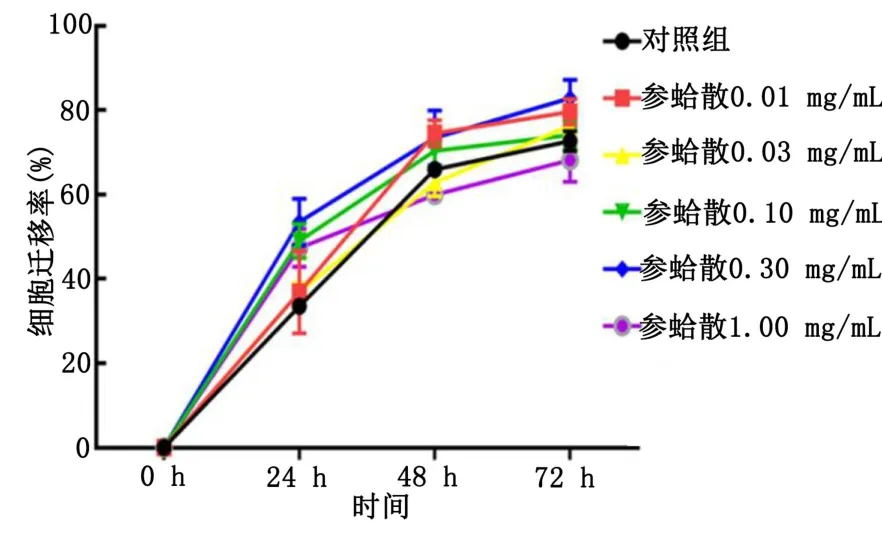
图2 各组H9c2 细胞迁移率情况

图3 各组H9c2 细胞迁移情况
3 讨 论
据估算,我国目前心血管病患病人数约2.9 亿例,其死亡率占居民疾病死亡构成40%以上,高于其他疾病,居于首位,是重大的公共卫生问题,而心力衰竭病人约450 万例,且患病率随年龄增加显著上升[6]。心力衰竭是各种心血管疾病的终末阶段,最主要病因是原发性心肌损害和异常[7]。因此,保护心肌细胞、改善心脏功能是重要的研究方向。中医学中没有“心力衰竭”这个名词,根据临床症状通常纳入“喘证”“心悸”“胸痹”等范畴。在中医理论“异病同治”“心肺同治”理论指导下,本课题组周端教授提倡使用参蛤散进行心力衰竭的治疗,并且进行了各项临床及基础研究,得到了较好的结果。
通常来说,中药由于其成分的多样性和制剂的复杂性,进行体外的细胞实验较为麻烦,常用的方法有使用药物血清制备中药冻干粉、中药提取物等方法。本次实验中,使用参蛤散冻干粉进行心肌细胞的体外实验,发现各浓度参蛤散对H9c2 细胞并无毒性,而在干预后24 h、48 h 和72 h 等各时间点很多药物组的存活率高于对照组,说明参蛤散有一定的促进H9c2 细胞生存的作用。另外,细胞划痕实验又称为“细胞损伤修复实验”,不仅可以观察细胞迁移功能,亦可观察细胞的增殖情况。在此次划痕实验中,发现一些参蛤散药物组的细胞迁移率明显高于对照组,并在24 h 和48 h尤为明显,这说明参蛤散在一定浓度下可以促进H9c2细胞的增殖。因此,可以认为参蛤散具有促进H9c2细胞增殖的作用。当然,CCK-8 检测和细胞划痕实验的结果在时间点和药物浓度等方面略微有差异,这可能与不同的实验和统计方法有关。
参蛤散由人参和蛤蚧组成,其促进H9c2 细胞增殖作用的具体机制还需后续研究进一步探讨。现已有诸多研究表明人参可以促进血管内皮生长因子(VEGF)表达,如人参皂苷F1 可以通过激活胰岛素样生长因子-1(IGF-1)/IGF-1 受体(IGF1R)通路促进VEGF 表达[8],人参皂苷Rg1 亦可通过miR-214/内皮型一氧化氮合酶(eNOS)通路促进血管内皮生长因子受体-2(VEGFR-2)表达以提高VEGF 功能[9]。魏英等[10]亦发现,人参总皂苷可明显促进急性心肌梗死大鼠心脏功能恢复,机制与上调心肌组织VEGF 有关;张庆勇等[11]在冠状动脉结扎的急性心肌缺血大鼠模型中,发现人参皂苷Rg1 可促进大鼠急性缺血心肌血管再生,亦与VEGF 有关。而在本课题组前期研究中,发现人参水煎液和蛤蚧水煎液都能不同程度地促进斑马鱼血管生长,且可能与VEGF 通路有关[12-13]。因此,参蛤散可能上调VEGF 通路。当然,其是否通过VEGF通路促进H9c2 细胞的增殖最终还需要后续的实验进一步加以探索。
