加味温胆汤抑制NLRP3介导的内皮细胞焦亡防治冠心病痰瘀互结证机制研究
2022-12-19常艳宾张丽丽徐永福靳艳江林腾龙谢博欢李琳琳
常艳宾,李 雁,张丽丽,李 龙,徐永福,靳艳江,林腾龙,谢博欢,李琳琳
(黑龙江省中医药科学院,黑龙江 哈尔滨 150036)
冠状动脉粥样硬化性心脏病指冠状动脉发生粥样硬化引起管腔狭窄或闭塞,导致心肌缺血缺氧或坏死而引起的心血管疾病,简称冠心病。据估计,我国现有约2.9亿心血管病患者,其中冠心病患者约有1 100万人,并且冠心病及其引起的并发症已经成为居民致死的首因[1]。中医学认为冠心病属于“胸痹”范畴,为多种因素引起痰浊、瘀血、气滞、寒凝闭阻心脉所致。加味温胆汤具有祛痰化饮、活血化瘀的功效,是治疗冠心病痰瘀互结证的有效方。既往研究发现,加味温胆汤能够改善冠心病痰浊血瘀证家兔血液流变学变化,降低血清白细胞介素-6(IL-6)水平,稳定冠状动脉粥样硬化斑块[2-3];可减轻冠心病心肌细胞的病理损伤,抑制心肌细胞凋亡,促进急性心肌梗死后心力衰竭大鼠的心肌能量代谢,保护心肌超微结构的完整性[4-5]。本研究基于NLRP3/Caspase-1通路,观察了加味温胆汤对人冠状内皮细胞焦亡相关因子的影响,探讨其防治冠心病的新机制。
1 实验材料与方法
1.1细胞系及实验动物 人冠状动脉内皮细胞(HCAEC)购自上海中科院细胞中心。健康SD雄性大鼠20只,体重200~250 g,由哈尔滨医科大学实验动物学部提供,动物合格证号: SCXK(黑)2020-0001,饲养于黑龙江省中医药科学院清洁级动物实验室。本实验通过黑龙江省中医药科学院医学伦理委员会批准。
1.2药品与试剂 加味温胆汤,组方:半夏9 g、陈皮9 g、茯苓12 g、甘草3 g、胆南星3 g、竹茹6 g、苍术6 g、延胡索6 g、丹参6 g、川芎6 g、赤芍6 g、牛膝12 g、黄芪6 g、节菖蒲6 g,由黑龙江省中医药科学院制剂室加工而成,制作工艺为标准制干浸膏,每克干浸膏相当于生药8.62 g。MCC950Sodium(货号:IM1340)、脂多糖(LPS,货号:L8880)、三磷酸腺苷(ATP,货号:1119L022)、TRIzol(货号:15996-026)、二甲基亚砜(DMSO,货号:D8371)、MTT试剂盒(货号:M1020),购买于北京索莱宝科技有限公司。DMEM培养基(货号:SH30243.01)、胎牛血清(货号:SH30070.02)购自美国Hyclone;1-Step RT-qPCR试剂盒(货号:A6020)购自美国Promega公司;NLRP3、Caspase-1、白细胞介素-1β(IL-1β)、β-actin(货号分别为bs-10021R,bs-0169R,bs-0812R, bs-0061R)购自美国Bioss公司,兔二步法检测试剂盒(货号:PV900-1)购自北京中杉金桥生物技术有限公司,引物合成自上海生物工程技术有限公司。
1.3主要仪器与设备 奥地利TECANM200多功能酶标仪,中国博日LineGene9600Real-TimePCR仪,日本Olympus显微镜DP72,美国Thermo CO2培养箱。
1.4实验方法
1.4.1含药血清的制备 采用随机数字表法将20只大鼠分为空白血清组和加味温胆汤血清组,每组10只。适应性喂养1周后,加味温胆汤血清组给予加味温胆汤8.64 g/kg灌胃(按70 kg成人与大鼠的等效剂量换算系数[6]换算给药剂量),空白血清组给予等体积蒸馏水灌胃,均1次/d,连续7 d。 末次灌胃3 h后,无菌条件下大鼠腹主动脉穿刺取血,室温静置2 h,3 000 r/min离心10 min,取上清,同组混匀,56 ℃水浴灭活,0.22 μm过滤器过滤除菌,置于-20 ℃冰箱下保存备用。
1.4.2细胞分组及培养 将HCAEC细胞培养于含10%胎牛血清和1%青霉素-链霉素溶液的DMEM完全培养基中,置于含5%CO2、温度为37 ℃的恒温培养箱,隔天换液,取对数生长期的细胞分为4组进行实验。空白组:将细胞接种到含10%FBS的DMEM培养基中,24 h后吸出培养基,然后加入含10%空白血清的培养基常规培养;模型组:将细胞接种到含10%FBS的DMEM培养基中,24 h后吸出培养基,给予100 ng/mL LPS刺激4 h,然后加入含10%空白血清的培养基,24 h后给予5 mmol/L ATP刺激30 min;MCC950组:将细胞接种到含10%FBS的DMEM培养基中,24 h后吸出培养基,给予100 ng/mL LPS刺激4 h,然后加入含50 μmol/L MCC950的10%空白血清培养基,24h后给予5 mmol/L ATP刺激30 min;加味温胆汤组:将细胞接种到含10%FBS的DMEM培养基中,24 h后吸出培养基,给予100 ng/mL LPS刺激4 h,然后加入含10%加味温胆汤含药血清培养基,24 h后给予5 mmol/L ATP刺激30 min。
1.5检测指标及方法
1.5.1细胞活性 采用MTT法检测:取对数生长期的细胞悬液,以1×105个/mL的密度(每孔100 μL)接种于96孔板中,分组及干预同1.4.2,每组设3个复孔。在各组ATP处理30min后,用PBS清洗1次,每孔加入50 μL MTT溶液(5 mg/mL),培养4 h后吸去孔内培养液,每孔再加入200 μL DMSO,置摇床上低速振荡10 min,在酶标仪OD 490 nm处测量各孔的吸光值。细胞活力(%)=[(加药组-空白组) /(不加药组-空白组)]×100%。
1.5.2NLRP3、Caspase-1、IL-1β阳性表达情况采用免疫组织化学法检测:取对数生长期的细胞,按每孔2×104个接种到6孔板中,分组及干预同1.4.2,去除培养基后,甲醇固定10 min, PBS清洗,3% H2O2去离子水孵育10 min,以阻断内源性过氧化物酶,分别滴加抗体NLRP3(1∶1 000)、Caspase-1(1∶1 000)、IL-1β(1∶1 000),4 ℃湿盒过夜。PBS冲洗后滴加反应增强液室温孵育15 min,PBS冲洗后滴加二抗室温孵育15 min。应用DAB染色,脱水、透明、封片,显微镜下观察细胞并评分。每张细胞爬片随机选择3个视野,以着色深浅程度及面积计分。细胞核出现黄色颗粒为蛋白表达阳性,浅色为弱阳性计 1 分,棕黄色为中等阳性计 2 分,褐色为强阳性计 3 分;着色细胞面积数<25%计1分,25%~49%计2分,>50%计3分;以二者相乘的综合积分计量,<3分为阴性,>4分为阳性,>6分为强阳性。
1.5.3NLRP3、Caspase-1、IL-1β mRNA表达情况 采用RT-qPCR法检测:取对数生长期的细胞,按每孔2×104个接种到6孔板中,分组及干预同1.4.2,收集各组细胞,加入TRIzol试剂提取RNA,经酶标仪检测浓度后,将纯度在1.9~2.0的RNA稀释至100 ng/μL。反应体系:组织RNA 1 μL,上下游引物各1 μL,反应液(根据PCR试剂盒说明书配制)17 μL。扩增条件:95 ℃ 10 min、95 ℃ 10 s、60 ℃ 30 s、72 ℃ 30 s,40个循环;溶解曲线分析:95 ℃ 10 s,台阶采样,台阶温度0.5 ℃。引物基因序列(人):NLRP3上游为5’-AAGGAAGTGGACTGCGAGAA-3’,下游为5’-AACGTTCGTCCTTCCTTCCT-3’;Caspase-1上游为5’-GGCATGACAATGCTGCTACA-3’,下游为5’-TCTGGGACTTGCTCAGAGTG-3’;IL-1β上游为5’-CTCTCTCCTTTCAGGGCCAA-3’,下游为5’-GCGGTTGCTCATCAGAATGT-3’。按2- ΔΔCt法进行定量分析。
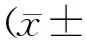
2 结 果
2.1各组细胞活力比较 空白组、模型组、MCC950组、加味温胆汤组细胞相对活力分别为(100.00±0.00)%、(78.69±7.07)%、(92.33±3.47)%、(94.07±2.14)%,模型组细胞活力明显低于空白组(P<0.05),MCC950组、加味温胆汤组细胞活力均明显高于模型组(P均<0.05),MCC950组与加味温胆汤组比较差异无统计学意义(P>0.05)。
2.2各组细胞中NLRP3、Caspase-1、IL-1β阳性表达情况 各组细胞中NLRP3、Caspase-1和IL-1β阳性表达染色情况见图1。模型组NLRP3、Caspase-1、IL-1β阳性表达积分均明显高于空白组(P均<0.05),MCC950组和加味温胆汤组均明显低于模型组(P均<0.05),MCC950组和加味温胆汤组比较差异均无统计学意义(P均>0.05),见图2。
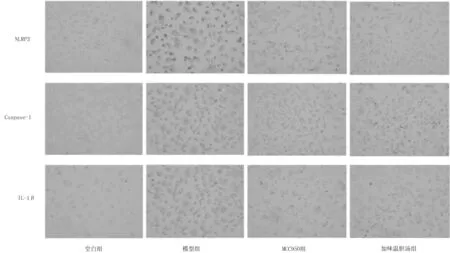
图1 各组人冠状动脉内皮细胞中NLRP3、Caspase-1、IL-1β阳性表达情况(免疫组化染色,×200)
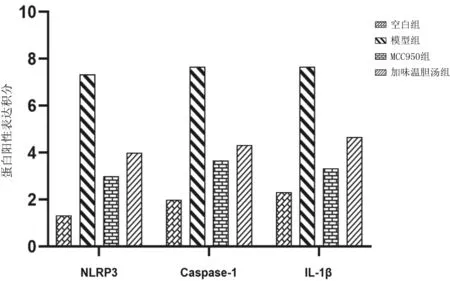
图2 各组人冠状动脉内皮细胞中NLRP3、Caspase-1、IL-1β阳性表达积分比较
2.3各组细胞中NLRP3、Caspase-1与IL-1β mRNA表达的影响 模型组细胞中NLRP3、Caspase-1、IL-1β mRNA相对表达量均明显高于空白组(P均<0.05),MCC950组和加味温胆汤组均明显低于模型组(P均<0.05),MCC950组和加味温胆汤组比较差异均无统计学意义(P均>0.05)。见表1。
表1 各组人冠状动脉内皮细胞中NLRP3、Caspase-1、IL-1β mRNA相对表达量比较
3 讨 论
细胞焦亡是一种促炎性的细胞程序性死亡方式,并且依赖于属于半胱氨酸依赖性天冬氨酸特异性蛋白酶(Caspase)家族的炎性蛋白酶的酶活性激活,其特征在于孔道的形成、质膜破裂、细胞内容物和促炎症介质进入细胞间质,导致炎症和细胞死亡[7]。近年来研究发现细胞焦亡在冠心病的发生发展中起着重要的作用。动脉粥样硬化是冠心病发生的最主要原因,而动脉粥样硬化早期,内皮细胞焦亡可以促进P-选择素、细胞间黏附分子-1(ICAM-1)和血管细胞黏附分子-1(VCAM-1)等大量分泌,可吸引单核细胞和其他炎性细胞的募集[8-9]。单核细胞与炎性内皮细胞的黏附、结合及向内膜的迁移,导致血管壁炎性反应的增强和血管内膜完整性的破坏,进而加快动脉粥样硬化病变进程。排列在血管壁内表面的内皮细胞是第一个接触循环系统中与代谢相关的内源性危险信号的细胞[10],能识别出血液中脂质和炎性介质增加,并触发内皮细胞焦亡[11-12],促进ICAM-1和VCAM-1分泌,促使内皮细胞与单核细胞黏附[13]。同时内皮细胞焦亡可导致促炎因子IL-1β和IL-18分泌并释放到细胞外,从而募集更多的炎症细胞,导致血管炎症反应。此外,血管内皮细胞的数量减少和完整性破坏可增加内皮单层的通透性,可以促进脂质、单核细胞迁移和沉积到内膜中,并进一步损害脉管系统[14]。当冠脉血流量不能满足心肌代谢的需要,就会引起心肌缺血缺氧,持续的、严重的心肌缺血可引起心肌梗死,心肌梗死中缺血导致的心肌细胞死亡和再灌注引起的活性氧增多会诱导产生心脏炎症反应[15]。Lei等[16]发现氧化应激通过激活NF-κB-GSDMD信号轴诱导产生NLRP3介导的心肌细胞焦亡。有研究在心肌梗死模型中发现梗死区域心肌细胞中焦亡相关因子表达增加,而抑制细胞焦亡能减少梗死面积,改善心脏功能,提高生存率[17-18]。
在古代,认为胸痹心痛以阴寒凝滞为基本病机,治宜宣痹通阳散结。然而随着时代的变迁,冠心病的病机也发生了演变,多认为痰瘀阻碍气血正常运行,从而影响心脏供血,最终导致冠心病的发生,如果以同时满足痰湿证和血瘀证诊断作为痰瘀互结证判断标准,目前50%以上冠心病患者辨证属于痰瘀互结证[19]。中医的“痰”多被认为是体内病理性产物堆积形成,“瘀”则被认为是生物理化功能的改变。从微观辨证及中医学理论角度分析,细胞焦亡的过度激活导致炎症因子在体内大量聚集(痰),致使炎症的不断反复,对组织器官造成损伤而发病(瘀)[20]。加味温胆汤组方中半夏、陈皮、竹茹、胆南星、苍术、节菖蒲燥湿化痰;陈皮理气行滞;茯苓渗湿健脾,以杜生痰之源;延胡索、丹参、川芎、赤芍、牛膝、黄芪活血化瘀;甘草调和诸药。全方燥湿化痰健脾、行气活血化瘀,切中冠心病痰瘀互结证病机。
本实验结果显示,模型组经LPS/ATP干预后,HCAEC细胞活力明显降低,NLRP3、Caspase-1、IL-1β蛋白阳性表达与mRNA相对表达量明显升高,表明LPS和ATP能够诱导HCAEC细胞发生焦亡;与模型组比较, MCC950组和加味温胆汤组细胞活力明显升高, NLRP3、Caspase-1、IL-1β蛋白阳性表达与mRNA相对表达量明显降低。加味温胆汤表现出了与NLRP3炎症小体抑制剂MCC950 相似的细胞焦亡抑制作用,表明加味温胆汤可能通过调节NLRP3/Caspase-1信号通路,降低内皮细胞中焦亡相关因子NLRP3、Caspase-1、IL-1β的表达水平,从而减轻细胞炎症反应,抑制内皮细胞焦亡。但本实验仅从细胞层面证实加味温胆汤可抑制冠状动脉内皮细胞焦亡,至于能否在人体内复杂的整体环境中发挥同等的作用有待进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
