驴食草酚调控ERK1/2和p38 MAPK信号通路防治溃疡性结肠炎的研究
2022-12-19马沛广李秋逸刘佳静董瑞娟葛东宇彭桂英
马沛广,李秋逸,刘佳静,李 娜,董瑞娟,葛东宇,彭桂英
(1. 北京中医药大学生命科学学院,北京 100029;2. 北京中医药大学中医学院,北京 100029)
溃疡性结肠炎是一种特发性、慢性结肠黏膜炎症性疾病,其主要临床表现为反复发生的肠道溃疡,同时伴有腹痛、腹泻、黏液脓血便等,常反复发作[1]。该病的发病机制尚不明确,可能与遗传因素、环境因素、自身免疫和肠道微生物有关[2]。中医学认为该病多由脾胃运化功能失调、湿热内蕴,为气血搏结、化为脓血所致,与中医的“痢疾”“肠癖”相近[3]。相关研究表明,含甘草的药物如复方甘草酸、甘草泻心汤联合西药治疗溃疡性结肠炎可起到标本兼治的作用[4-5]。驴食草酚是从甘草中提取出的一种天然的异黄酮类化合物,其可以减少脂多糖或甲基化牛血清白蛋白诱导的中性粒细胞迁移以及巨噬细胞释放CXCL1/KC和CXCL2/MIP-2,可减少小鼠肠系膜微循环中白细胞滚动和黏附[3,6]。相关研究发现驴食草酚在低浓度就显示出良好的抗炎和抗菌活性,其抗炎作用和地塞米松相当,是一种有前途的新型抗炎剂[6-7]。驴食草酚对溃疡性结肠炎是否有保护作用,以及其作用机制尚不明确,因此本研究观察了驴食草酚对溃疡性结肠炎的干预作用,并从ERK1/2和p38 MAPK信号通路角度探讨了其可能作用机制。
1 实验材料与方法
1.1实验动物 SPF级雄性C57BL/6小鼠32只,6~8周龄,体重20~22 g,购自北京斯贝福生物有限公司,生产许可证号:SCXK(京)2011-0004。本实验经过北京中医药大学试验动物伦理委员会批准,实验过程严格按照动物伦理相关指导原则进行。小鼠在清洁级动物房饲养,统一光照时间为6:00—18:00,恒温,恒湿,自由饮水,饲喂固体饲料。适应性喂养7 d后用于正式实验。
1.2药物与试剂 驴食草酚(中国成都乐美天,CAS:35878-41-2);葡聚糖硫酸钠(美国MP Biomedicals公司,批号:S0433);柳氮磺吡啶肠溶片(上海信宜天平药业公司,国药准字H31020557);便隐血试剂(中国BASO公司,批号:BA-2020B);PBS、D-Hank’s、红细胞裂解液(中国Solarbio公司,批号:R1010);胎牛血清(FBS,Hyclone);胶原酶Ⅲ(Worthington);Percoll分离液(GE Healthcare);BCA蛋白测定试剂盒(美国Thermo公司,批号:A53225);小鼠流式荧光抗体CD45-PB、CD11b-PE-Cy5、Ly6c-APC(美国,BioLegend);磷酸化p38 MAPK(p-p38 MAPK)单克隆抗体、磷酸化ERK1/2(p-ERK1/2)单克隆抗体、p38 MAPK单克隆抗体、ERK1/2单克隆抗体、GAPDH单克隆抗体(美国CST公司,批号分别为9377S,4511T,8460T,9145T,4967S);辣根过氧化物酶二抗(美国CST公司,批号:7076S)。
1.3仪器 高压灭菌锅;精密天平(中国,ACS-3C型);摇床(中国,SHIPING);5415型高速离心机(德国,Eppendorf);Aperio VERSA超分辨显微组织成像系统、自动组织脱水机、全自动轮转式切片机(德国,Leica Biosystems);流式细胞仪(美国,Beckman Coulter);电泳仪、电转仪、GelDoc Go凝胶成像系统(美国,Bio-Rad);SpectraMax i3x(美国,MD)。
1.4实验方法 将32只雄性C57BL/6小鼠随机分为正常组、模型组、驴食草酚组、柳氮磺胺吡啶组,每组8只。除正常组外,其余组小鼠参考文献[7]方法给予加入3% DSS溶液的饮用水(自由饮用)饲养7 d建立溃疡性结肠炎模型。从实验第1天起,每天同一时间点,驴食草酚组按10 mg/kg的剂量给予驴食草酚灌胃,柳氮磺吡啶组按0.5 g/kg的剂量给予柳氮磺胺吡啶灌胃,正常组和模型组给予等量的生理盐水灌胃,均连续7 d。
1.5标本采集 末次灌胃后,禁食不禁水12 h,小鼠经2%戊巴比妥钠深度麻醉后眼球取血,然后处死小鼠,分离结肠组织,测量结肠长度,距肛门4 cm处截取1~2 cm的结肠组织放入4%多聚甲醛溶液中固定,剩余结肠组织冻存管分装,液氮速冻后放置于-80 ℃冰箱保存。
1.6观察指标
1.6.1体重及疾病活动指数(DAI) 每日同一时间测量小鼠体重,观察粪便性状、便血情况,按粪便隐血试剂盒说明书进行检测。记录实验结束后各组小鼠体重,计算各组小鼠的DAI。DAI=(体重评分+粪便性状评分+粪便隐血评分)/3。
1.6.2结肠组织病理学形态 结肠组织经4%多聚甲醛固定后放入包埋盒中,酒精梯度脱水,二甲苯透明,石蜡包埋,切成厚度为4 μm的切片,二甲苯脱蜡、梯度水化后进行HE染色,中性树胶封片,晾干后使用光学显微镜观察。
1.6.3血清白细胞介素(IL)-17A含量 眼球取血常温静置2 h,待血液凝固血块收缩后,4 000 r/min离心10 min,取上清于干净的离心管中,放置冰上备用。根据ELISA试剂盒说明书检测血清中IL-17A含量。
1.6.4结肠组织中中性粒细胞比例 取小鼠结肠组织,将组织剪成小块,用含5 mmol/L EDTA的D-Hank’s洗涤2次,每次20 min,置于1 mg/mL胶原酶Ⅲ的RPMI1640溶液中消化60 min后,经70 μm的细胞筛过滤,离心收集细胞沉淀,经冷PBS洗涤2次后,重悬于40%Percoll分离液中进行梯度离心,沉淀细胞用红细胞裂解液裂解,冷PBS洗涤2次,重悬于含0.5%BSA的PBS溶液中计数。调整细胞浓度为1×106个/mL,加入anti-mouse CD45、anti-mouse CD11b、anti-mouse Ly6C荧光抗体冰上避光孵育30 min,最后用含0.5%BSA的PBS洗涤2次后重悬,上流式细胞仪检测。框门策略:CD45+CD11b+Ly6C+。
1.6.5结肠组织中p-ERK1/2、p-p38 MAPK、ERK1/2、p38 MAPK表达情况 采用Western blot法检测:取已加入RIPA裂解液、COCKTAIL、PMSF 蛋白酶抑制剂的结肠组织匀浆液,13 000 r/min离心40 min,取20 μL上清液用于检测蛋白浓度,剩余量加入相应体积的蛋白上清缓冲液(Loading buffer)振荡混匀。加热使蛋白变性后待其自然冷却,分装。取24 μg蛋白上样,电泳、转膜、封闭后,分别用5%BSA 按1∶1 000的比例稀释p-ERK1/2、p-p38 MAPK、ERK1/2、p38 MAPK抗体,4 ℃摇床孵育过夜,用5% BSA 按1∶5 000 的比例稀释IgG二抗,摇床室温孵育1.5 h,TBST清洗后,滴入显影液在凝胶成像系统成像,采用Image J 1.52v 软件进行定量分析,用内参GAPDH计算蛋白相对表达量。
1.7统计学方法 采用SPSS 20.0软件进行统计分析。计量数据如果符合正态分布,多组间比较采用单因素方差分析(one-way ANOVA),利用LSD检验进行多重比较。若数据不符合正态分布,则采用非参数检验中的Kruskal-wallis分析。P<0.05为差异有统计学意义。
2 结 果
2.1各组小鼠体重、结肠长度及DAI比较 模型组小鼠体重明显低于正常组(P<0.05),结肠长度明显短于正常组(P<0.05),DAI明显高于正常组(P<0.05);驴食草酚组和柳氮磺吡啶组小鼠体重均明显高于模型组(P均<0.05),结肠长度明显长于模型组(P<0.05),DAI明显低于模型组(P<0.05),且驴食草酚组小鼠DAI明显低于柳氮磺吡啶组(P<0.05),但2组小鼠体重和结肠长度比较差异均无统计学意义(P均>0.05)。见表1。
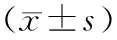
表1 正常组和溃疡性结肠炎各组小鼠体重、结肠长度及DAI比较
2.2各组小鼠结肠组织HE染色病理形态 正常组小鼠结肠黏膜组织结构完整,无充血水肿,腺体和杯状细胞排列规则,无炎性细胞浸润及溃疡形成;模型组小鼠结肠黏膜组织结构破损,腺体排列紊乱,部分坏死、消失,隐窝肿胀,杯状细胞破坏减少,同时有大量炎性细胞浸润;驴食草酚组及柳氮磺胺吡啶组小鼠结肠黏膜上皮组织增生修复,腺体及杯状细胞数目增多,排列较为整齐,炎细胞浸润明显减少。见图1。
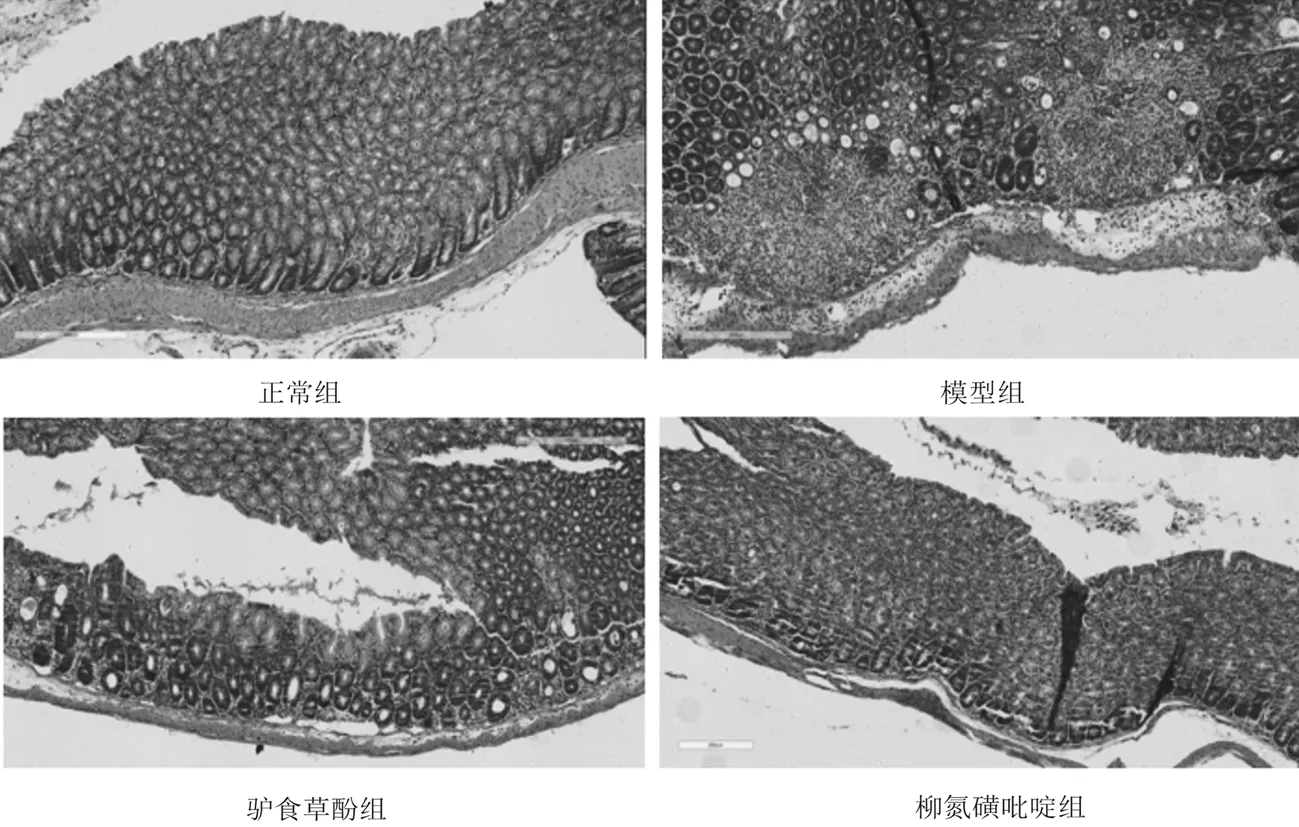
图1 正常组和溃疡性结肠炎各组小鼠结肠组织HE染色病理形态(×100)
2.3各组小鼠血清IL-17A含量和结肠组织中中性粒细胞比例比较 模型组小鼠血清IL-17A含量和结肠组织中中性粒细胞比例均明显高于正常组(P均<0.05);驴食草酚组和柳氮磺吡啶组小鼠血清IL-17A含量和结肠组织中中性粒细胞比例均明显低于模型组(P均<0.05),驴食草酚组和柳氮磺吡啶组比较差异均无统计学意义(P均>0.05)。见表2。

表2 正常组和溃疡性结肠炎各组小鼠血清IL-17A含量和结肠组织中中性粒细胞比例比较
2.4各组小鼠结肠组织中p38 MAPK和ERK1/2信号通路因子表达情况 模型组小鼠结肠组织中p-ERK1/2/ERK1/2和p-p38 MAPK/p38 MAPK比值均明显高于正常组(P均<0.05),驴食草酚组和柳氮磺吡啶组均明显低于模型组(P均<0.05),驴食草酚组和柳氮磺胺吡啶组比较差异均无统计学意义(P均>0.05)。见图2及表3。
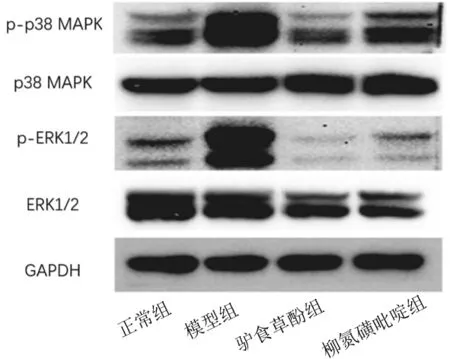
图2 正常组和溃疡性结肠炎各组小鼠结肠组织中p-p38 MAPK、p38 MAPK、p-ERK1/2、ERK1/2、GAPDH蛋白表达情况
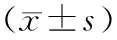
表3 正常组和溃疡性结肠炎各组小鼠结肠组织中p-p38 MAPK、p-ERK1/2蛋白相对表达量比较
3 讨 论
溃疡性结肠炎是一种发病率较高的结直肠慢性非特异性炎症性疾病,其病变部位主要局限在大肠黏膜及黏膜下层。世界卫生组织根据该病病程长、迁延难愈、易癌变的特点,将其列为消化内科的难治病之一[1]。在过去几年中,溃疡性结肠炎在全球范围内的发生率不断增高,但不同地区的患病率存在明显差异,如在亚洲人群中,患病率为5.3~63.6/10万,而北美的患病率为37.5~238/万[8]。溃疡性结肠炎已然成为一个重要的社会公共问题,因此迫切需要开展对该病的疗效和机制研究。
目前临床上治疗溃疡性结肠炎仍然以氨基水杨酸类、糖皮质激素、免疫抑制剂和生物制剂等西药治疗为主,短期效果较好,但是长期使用会出现明显不良反应、耐药、易复发等问题。中医药治疗溃疡性结肠炎显示出明显优势,其中甘草泻心汤应用较多,相关研究证实其具有抗溃疡、调节黏膜分泌和机体免疫功能的作用,被称为黏膜修复剂[5,9]。甘草为甘草泻心汤的主药,而驴食草酚是从甘草中提取的有效成分,故本研究探讨了其对溃疡性结肠炎的潜在作用。
p38 MAPK是MAPK家族的重要成员[10],广泛存在于各种组织中。在生理条件下,p38 MAPK主要位于细胞质中,且活性很低;病理条件下,它可以被各种细胞因子[肿瘤坏死因子-α(TNF-α)、IL-1]、脂多糖、应激刺激(如热休克、高渗性损伤、缺血再灌注)激活,促进TNF-α、IL-1、IL-6、IL-8等促炎细胞因子的产生,进而增强炎症反应;且p38 MAPK可以介导中性粒细胞的激活,显著增强中性粒细胞呼吸爆发效应,从而导致持续的炎症反应和损伤[11]。p38 MAPK还可以促进细胞内诱导型一氧化氮合酶(iNOS)的产生,上调细胞内一氧化氮(NO)的表达,引起炎症和组织损伤[12]。Ren等[13]报道,p38 MAPK可通过磷酸化NF-κB上游组蛋白H3和IKK或NF-κB p65活性,促进炎症细胞因子的释放。ERK1/2是最经典的MAPK之一[14],激活ERK1/2通路可引起多种促炎细胞因子如TNF-α、IL-6、IL-8等表达,参与炎症反应的调节[15]。许多研究发现ERK1/2在溃疡性结肠炎结肠组织中高表达,ERK1/2通路与溃疡性结肠炎发病密切相关[16]。
IL-17A和IL-17F是IL-17家族的主要成员,活动期炎症性肠病患者的血浆和肠黏膜均高表达IL-17A[17]。IL-17A和IL-17F与细胞表面受体IL-17RA、IL-17RC结合,通过Act1、TRAF6进而激活NF-κB、MAPK、C/EBP等信号通路,刺激内皮细胞产生IL-6、IL-8、TNF-α、粒细胞-巨噬细胞刺激因子等,介导炎症反应[18]。中性粒细胞在溃疡性结肠炎的发病中起着重要作用,中性粒细胞在IL-17A的作用下向结肠病变位置迁移,引起一系列肠道疾病[19]。在炎症反应中,IL-17A对中性粒细胞的招募至关重要,同时中性粒细胞也可以分泌产生IL-17A[20-21]。近年研究认为中性粒细胞浸润是溃疡性结肠炎活动期的重要标志[22],因此抑制中性粒细胞浸润可能成为治疗溃疡性结肠炎的重要靶点。
本实验结果显示,驴食草酚组小鼠体重明显高于模型组,结肠长度明显长于模型组,DAI明显低于模型组,结肠组织损伤程度明显减轻,血清IL-17A含量、结肠组织中中性粒细胞比例、结肠组织中p-ERK1/2/ERK1/2和p-p38 MAPK/p38 MAPK比值均较模型组低。由此推测驴食草酚可能通过下调p38 MAPK和ERK1/2的磷酸化表达,抑制IL-17A分泌与中性粒细胞迁移,从而减轻炎症反应和结肠组织损伤。驴食草酚的抗炎特性具有潜在的临床应用价值,值得进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
