重视反应条件 把握原理细节
——例析如何解答选考化学实验大题
2022-12-19廖旭杲
廖旭杲
(浙江省宁波市鄞州中学 315104)
1 温度不同,反应不同
例1(2020年1月·浙江选考·第30题·10分)碘化锂(LiI)在能源、医药等领域有重要应用,某兴趣小组制备LiI·3H2O和LiI,流程如图1所示.
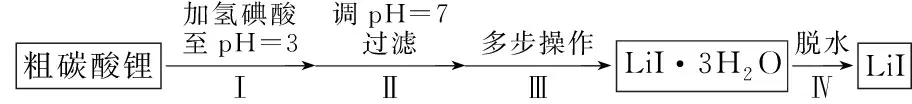
图1
已知:
a.LiI·3H2O在75~80℃转变成LiI·2H2O,80~120℃转变成LiI·H2O,300℃以上转变成无水LiI.
b.LiI易溶于水,溶解度随温度升高而增大.
c.LiI在空气中受热易被氧化.
请回答:
(1) 步骤Ⅱ,调pH=7,为避免引入新的杂质,适宜加入的试剂为____.
(2) 步骤Ⅲ,包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作.
下列说法正确的是____.
A.为得到较大的LiI·3H2O晶体颗粒,宜用冰水浴快速冷却结晶
B.为加快过滤速度,得到较干燥的晶体,可进行抽滤
C.宜用热水洗涤
D.可在80℃鼓风干燥
(3) 步骤Ⅳ,脱水方案为:将所得LiI·3H2O置入坩埚中,300℃加热,得LiI样品.用沉淀滴定法分别测定所得LiI·3H2O、LiI样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调pH=6,用滴定管中的AgNO3标准溶液滴定至终点,根据消耗的AgNO3标准溶液体积计算,得LiI·3H2O、LiI的纯度分别为99.96%、95.38%.LiI纯度偏低.
①上述测定过程提及的下列仪器,在使用前一定不能润洗的是____.
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②测定过程中使用到移液管,选出其正确操作并按序列出字母:蒸馏水洗涤→待转移溶液润洗→(____)→(____)→(____)→(____)→洗净,放回管架.
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口
③LiI纯度偏低,可能的主要杂质是____.
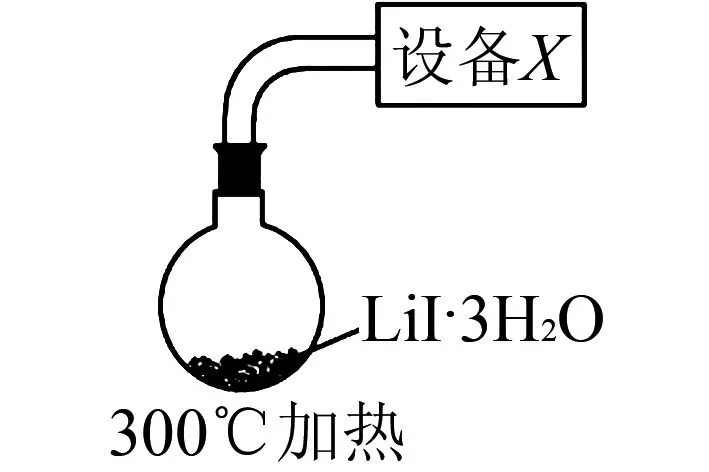
图2
(4) 步骤Ⅳ,采用改进的实验方案(装置如图2所示),可以提高LiI纯度.
①设备X的名称是____.
②请说明采用该方案可以提高LiI纯度的理由____.

(2) 根据提供的LiI·3H2O的性质进行分析;
A.用冰水浴快速冷却结晶得到的是较小颗粒的晶体,故A错误;为得到较大的LiI·3H2O晶体颗粒,宜将热溶液在常温条件下静置,使之缓慢冷却,方可得到均匀而较大的晶体.
B.抽滤可以加快过滤速度,得到较干燥的晶体,故B正确;
C. LiI易溶于水,溶解度随温度升高而增大,故C错误;
D. LiI·3H2O在75~80℃转变成LiI·2H2O,80~120℃转变成LiI·H2O,故D错误
(3)①润洗容量瓶会使浓度偏大;润洗锥形瓶消耗更多的待测液,测定的待测液浓度偏大;②移液管的正确使用步骤为:蒸馏水洗涤→待转移溶液润洗→洗耳球吸溶液至移液管标线以上,食指堵住管口→放液至凹液面最低处与移液管标线相切,按紧管口→移液管尖与锥形瓶内壁接触,松开食指放液设备→放液完毕,停留数秒,取出移液管→洗净,放回管架;③LiI在空气中受热易被氧化生成Li2O;
(4)①因LiI在空气中加热易被氧化,故需要将空气抽出;设备X的作用是将仪器内的空气抽出,其名称为抽气泵;②该方案抽出空气且瓶内压强较低,一者抽除空气,避免LiI被氧化;二者减压,水的沸点降低,有利脱水.
参考答案:(1)LiOH (2)B (3)①AC ②d f c b ③Li2O (4)①抽气泵 ②抽除空气,避免LiI被氧化;减压,有利脱水
2 酸度不同,反应不同
例2(2021年1月·浙江选考·第30题·10分) 某兴趣小组用铬铁矿[Fe(CrO2)2制备K2Cr2O7晶体,流程如图3所示.
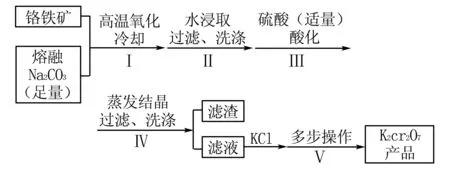
图3

相关物质的溶解度随温度变化如图4所示.
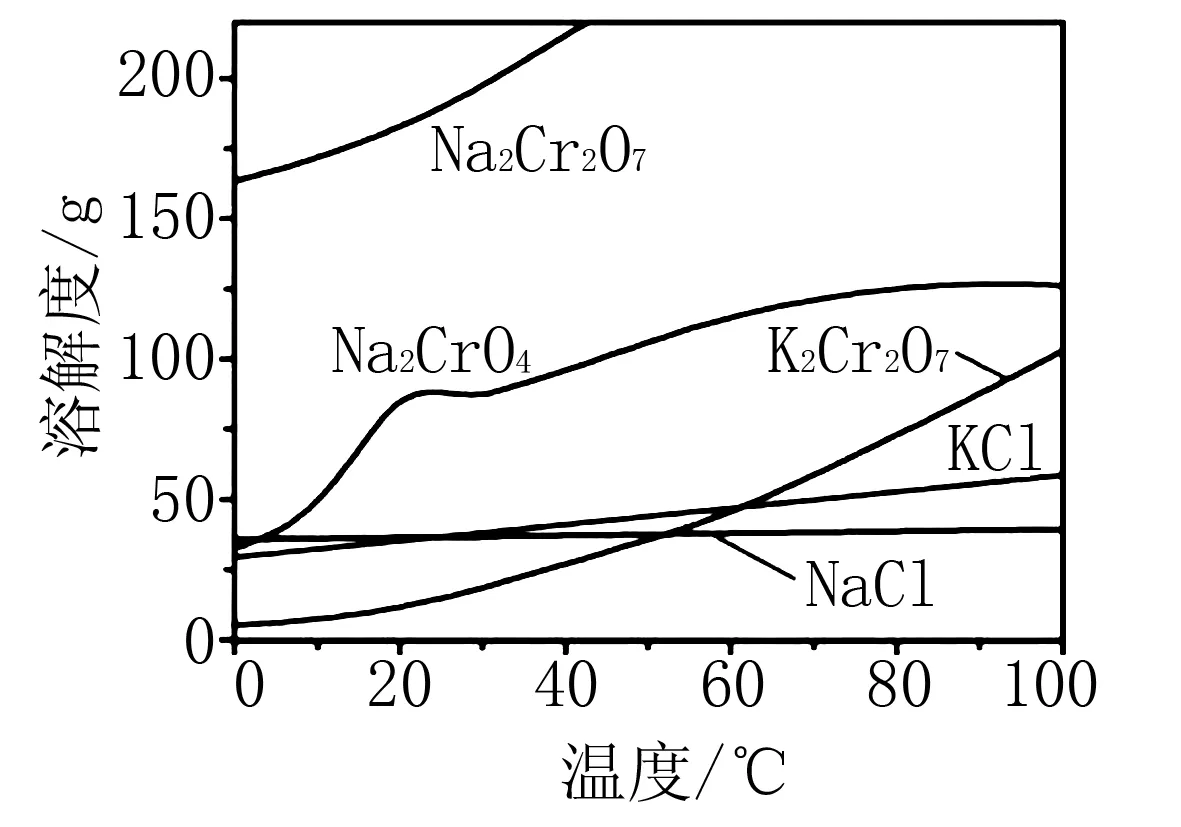
图4
请回答:
(1)步骤Ⅰ,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是____.
(2)下列说法正确的是( ).
A.步骤Ⅱ,低温可提高浸取率
B.步骤Ⅱ,过滤可除去NaFeO2水解产生的Fe(OH)3
C.步骤Ⅲ,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7
D.步骤Ⅳ,所得滤渣的主要成分是Na2SO4和Na2CO3
(3)步骤Ⅴ,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl→( )→( )→( )→( )→重结晶
a.50℃蒸发溶剂;b.100℃蒸发溶剂;
c.抽滤;d.冷却至室温;
e.蒸发至溶液岀现晶膜,停止加热;
f.蒸发至溶液中岀现大量晶体,停止加热.
(4)为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法.
①下列关于滴定分析的操作,不正确的是( ).
A.用量筒量取25.00 mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度.其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,____,继续摇动锥形瓶,观察颜色变化.(请在横线上补全操作)
(5)该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%.某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低.分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂.该试剂是,添加该试剂的理由是____.

(1)步骤Ⅰ中将铬铁矿粉碎,可增大反应物的接触面积,加快高温氧化的速率.
(2)A.步骤Ⅱ的主要目的有二:一是让NaFeO2水解,产生的Fe(OH)3可以通过过滤除去,水解反应是一吸热反应,所以高温有利于生成Fe(OH)3;二是溶解Na2CrO4,根据题中曲线图可知室温以上,Na2CrO4的溶解度总体随着温度的升高而略微增大,无疑步骤Ⅱ中应用高温可提高浸取率,A错误;

D.根据分析,步骤IV中过滤所得滤渣主要成分为Na2SO4,同时,步骤Ⅲ中已用硫酸酸化过了,不可能还有Na2CO3存在,所以D错误.
综上,本小问答案选BC.

故答案为:aedc.
(4)①A.量筒属于粗量器,不能用量筒量取25.00 mL溶液,由于K2Cr2O7具有强氧化性,量取25.00 mL待测液应用酸式滴定管或移液管,A错误;
B.滴定时要适当控制滴定的速率,确保反应物之间充分反应,同时防止滴加过快使得滴加试剂过量,B正确;
C.滴定时眼睛应一直观察锥形瓶中溶液颜色的变化,以便准确判断滴定的终点,C错误;
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,在重力作用下使滴定管保持垂直,平视读取读数,D正确.
E.为了确保每次滴定时滴定管中的溶液充足,平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下,并记录初始读数,E正确.
综上,本小问答案选AC.
②在接近终点时,使用“半滴操作”的方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁,继续摇动锥形瓶,观察颜色变化.

参考答案:(1)增大反应物的接触面积
(2) BC (3) a e d c
(4)①AC ②再用洗瓶以少量蒸馏水吹洗锥形瓶内壁
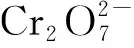
3 量比不同,反应不同
例3(2019年4月·浙江选考【加试题】·第31题·10分)某兴趣小组在定量分析了镁渣[含有MgCO3、Mg(OH)2、CaCO3、Al2O3、Fe2O3和SiO2]中Mg含量的基础上,按如图5所示流程制备六水合氯化镁(MgCl2·6H2O).
图5
相关信息如下:①700℃只发生MgCO3和Mg(OH)2的分解反应.②NH4Cl溶液仅与体系中的MgO反应,且反应程度不大.③“蒸氨”是将氨从固液混合物中蒸出来,且须控制合适的蒸出量.
请回答:
(1) 下列说法正确的是____.
A.步骤Ⅰ,煅烧样品的容器可以用坩埚,不能用烧杯和锥形瓶
B.步骤Ⅲ,蒸氨促进平衡正向移动,提高MgO的溶解量
C.步骤Ⅲ,可以将固液混合物C先过滤,再蒸氨
D.步骤Ⅳ,固液分离操作可采用常压过滤,也可采用减压过滤
(2) 步骤Ⅲ,需要搭建合适的装置,实现蒸氨、吸收和指示于一体(用硫酸溶液吸收氨气).
①选择必须的仪器(如图6所示),并按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):热源→____.
图6
②为了指示蒸氨操作完成,在一定量硫酸溶液中加指示剂.请给出指示剂并说明蒸氨可以停止时的现象____.
(3) 溶液F经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品.取少量产品溶于水后发现溶液呈碱性.
①含有的杂质是____.
②从操作上分析引入杂质的原因是____.
(4) 有同学采用盐酸代替步骤Ⅱ中的NH4Cl溶液处理固体B,然后除杂,制备MgCl2溶液.已知金属离子形成氢氧化物沉淀的pH范围见表1所示.
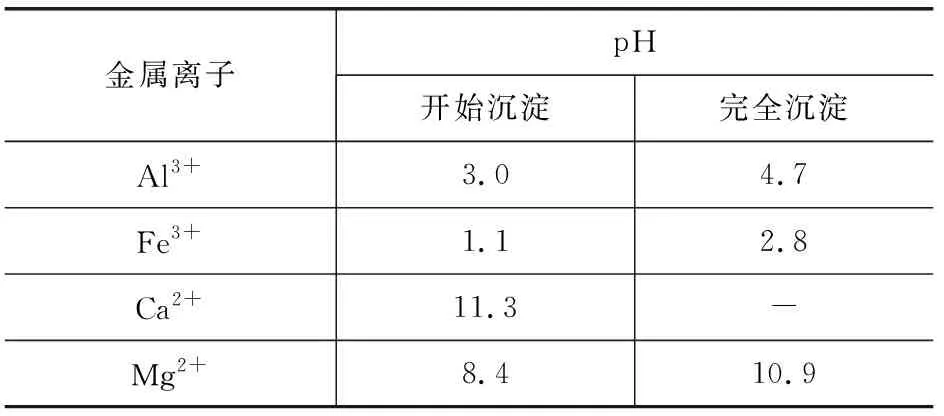
表1
请给出合理的操作排序(从下列操作中选取,按先后次序列出字母,操作可重复使用):固体B→a→( )→( )→( )→( )→( )→( )→MgCl2溶液→产品.
a.用盐酸溶解 b.调pH=3.0
c.调pH=5.0 d.调pH=8.5
e.调pH=11.0 f.过滤g.洗涤
解析题中流程“翻译”如图7所示.
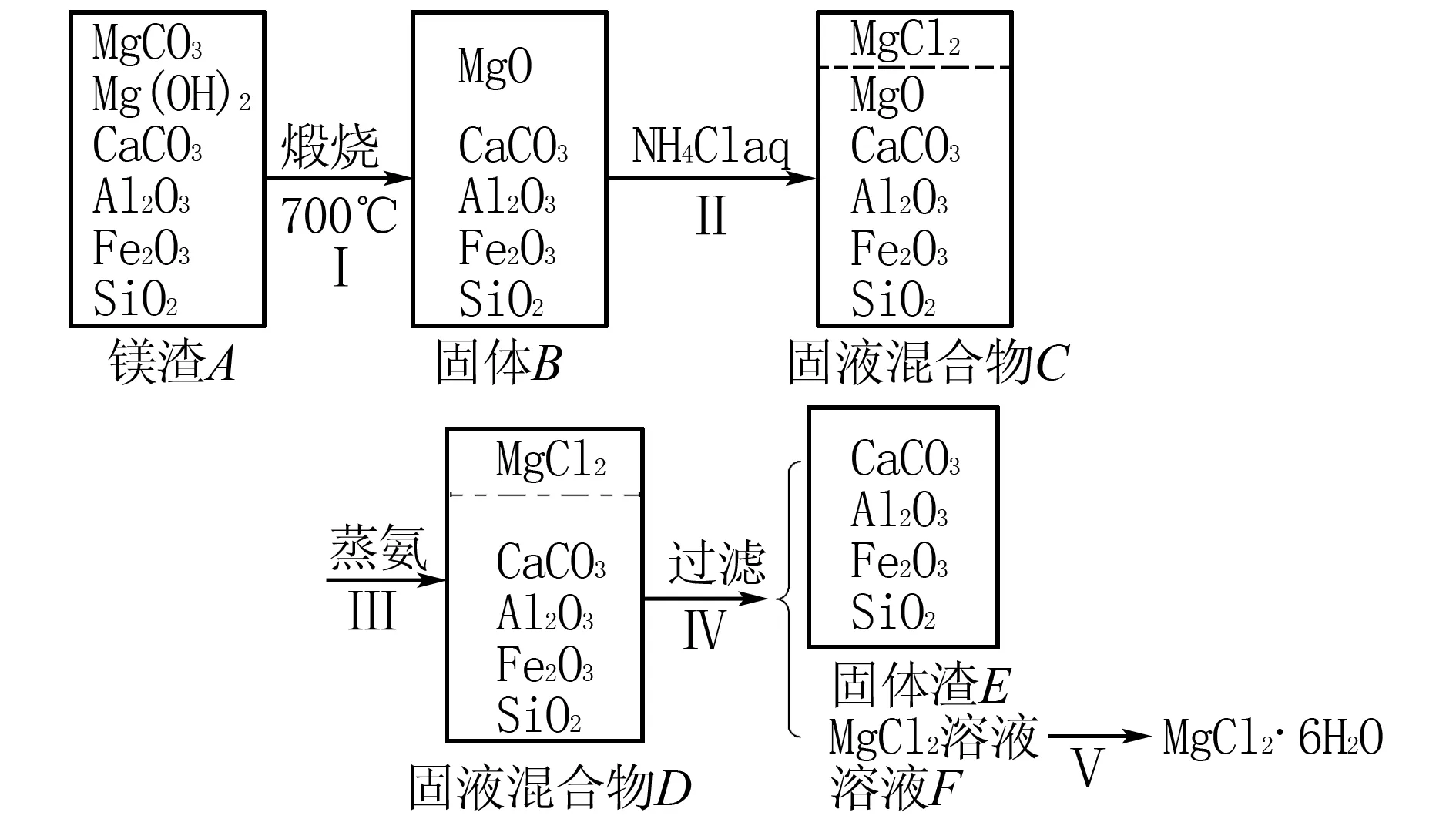
图7

(1)A项,步骤Ⅰ,煅烧时温度控制在700℃,盛装样品的容器可以用坩埚,不能用烧杯和锥形瓶,正确;

D项,步骤Ⅳ,固液分离操作可采用常压过滤,也可采用减压过滤,正确.
所以该小题正确的选项是ABD.
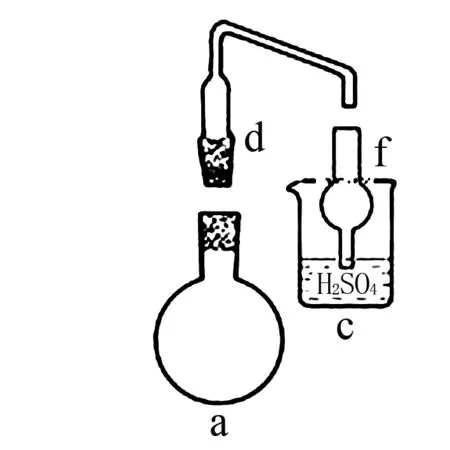
图8
(2)选择的仪器为a、d、f、c,如图8所示(未考虑夹持和橡皮管连接):其中球形干燥器可防止倒吸,吸收过程中可加入甲基橙作指示剂,起初硫酸溶液呈红色,等吸收较多氨气后,溶液中c(H+)下降,呈橙色时,说明蒸氨可以停止,不宜继续吸收NH3至溶液呈黄色,因为题示信息③:“蒸氨”须控制合适的蒸出量,需留一定量的NH3在体系内.疑问:选用甲基橙作指示剂,甲基红可以吗?
(3)溶液F经盐酸酸化、蒸发浓缩、冷却结晶过程中容易因过度蒸发导致发生水解反应:
所以MgCl2·6H2O中含有的杂质是碱式氯化镁或氢氧化镁.
(4)固体B(MgO、CaCO3、Al2O3、Fe2O3和SiO2)用盐酸溶解后溶液中成分有:MgCl2、CaCl2、AlCl3、FeCl3,还有不溶物SiO2.合理的操作排序见表2.
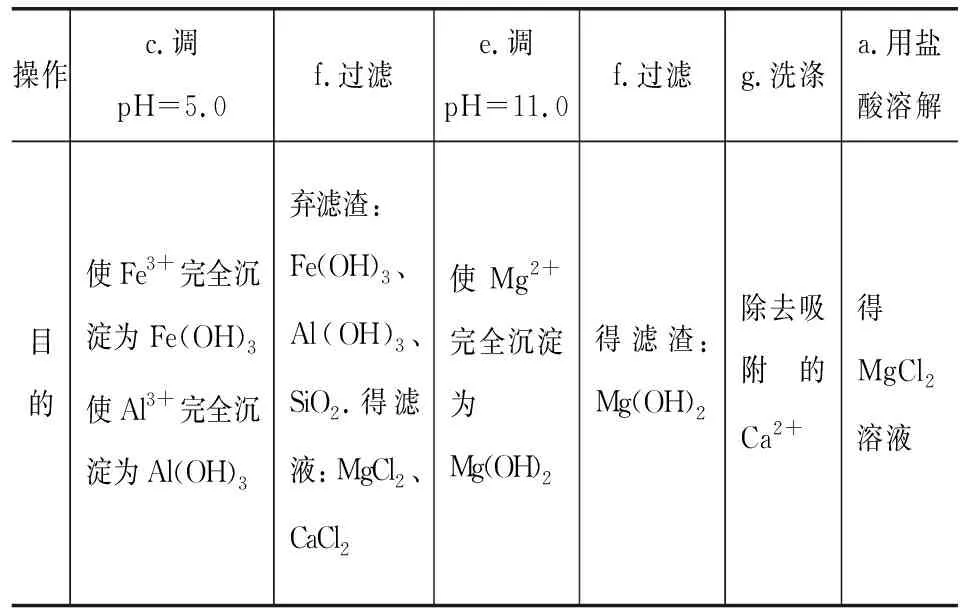
表2
因题给操作仅5步,所以在过滤除去Fe(OH)3、Al(OH)3、SiO2时没有洗涤,这里避免了MgCl2、CaCl2混合溶液中又引入了少量Fe3+、Al3+,当然表面看似乎有些Mg2+因吸附而损失,殊不知,微调pH=5.0时使用的往往是难溶性的含镁化合物,如MgO、Mg(OH)2等,所以洗涤一步不需要.至于得到Mg(OH)2后的洗涤则必不可少,因为刚刚生成的沉淀往往呈絮状,具有大的比表面积,吸附性极强,需将其上吸附的Ca2+洗去,当然洗涤过程中会有少量的Mg(OH)2因溶解而损耗,但两害相权取其轻.
参考答案:
(1)ABD
(2)①a→d→f→c
②甲基橙,颜色由红色变橙色
(3)①碱式氯化镁(氢氧化镁)
②过度蒸发导致氯化镁水解
(4)c→f→e→f→g→a
综观近年浙江省的化学选考实验大题,背景以无机物制备及分析居多,考察化学反应原理的理解,考量实验操作(装置)细节的把握,其风格一以贯之.只不过近年的试题均渗透了条件不同,反应不同,引导高中教学强调反应总是在一定的条件下发生的,除了以上例举的温度的改变、酸度(介质)的不同、量比(浓度)的变化均导致不同的反应外,还有催化剂、压力、物态、溶剂等因素均可影响反应的进行.化学学习,必须重视反应条件,方能体悟化学之理,习得操作之妙,长此以往,终身受益.
