新型冠状病毒疫苗佐剂的研究现状与展望
2022-12-19李海波
李海波,程 浩
400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系微生物与生化药学教研室,国家免疫生物制品工程技术研究中心
新型冠状病毒(SARS-CoV-2)是一种具有包膜的正链单股RNA病毒,其引发的新冠病毒肺炎(COVID-19)正在全球蔓延,对人类健康以及全球经济构成了巨大威胁[1]。截至2022年6月24日,全球已报告超过5.39亿确诊病例和632万例死亡。由于当前治疗手段有限,疫苗的研制和使用仍然是控制新冠病毒肺炎疫情的最重要手段[2]。
佐剂是添加到疫苗中以增强抗原特异性免疫应答的物质,其可以减少免疫接种的次数,重塑适应性免疫反应、减少抗原剂量和提高保护效果。佐剂广泛应用于新冠病毒灭活疫苗、重组病毒疫苗和病毒样颗粒疫苗。进入临床试验的新冠病毒疫苗所用佐剂包括无机物类佐剂铝盐、TLRs激动剂、水包油类佐剂、油包水类佐剂、复合佐剂等。本文主要从新冠病毒疫苗佐剂种类、优缺点及面临的挑战等方面进行评述(表1),并对未来新冠病毒疫苗佐剂的研究方向进行展望。
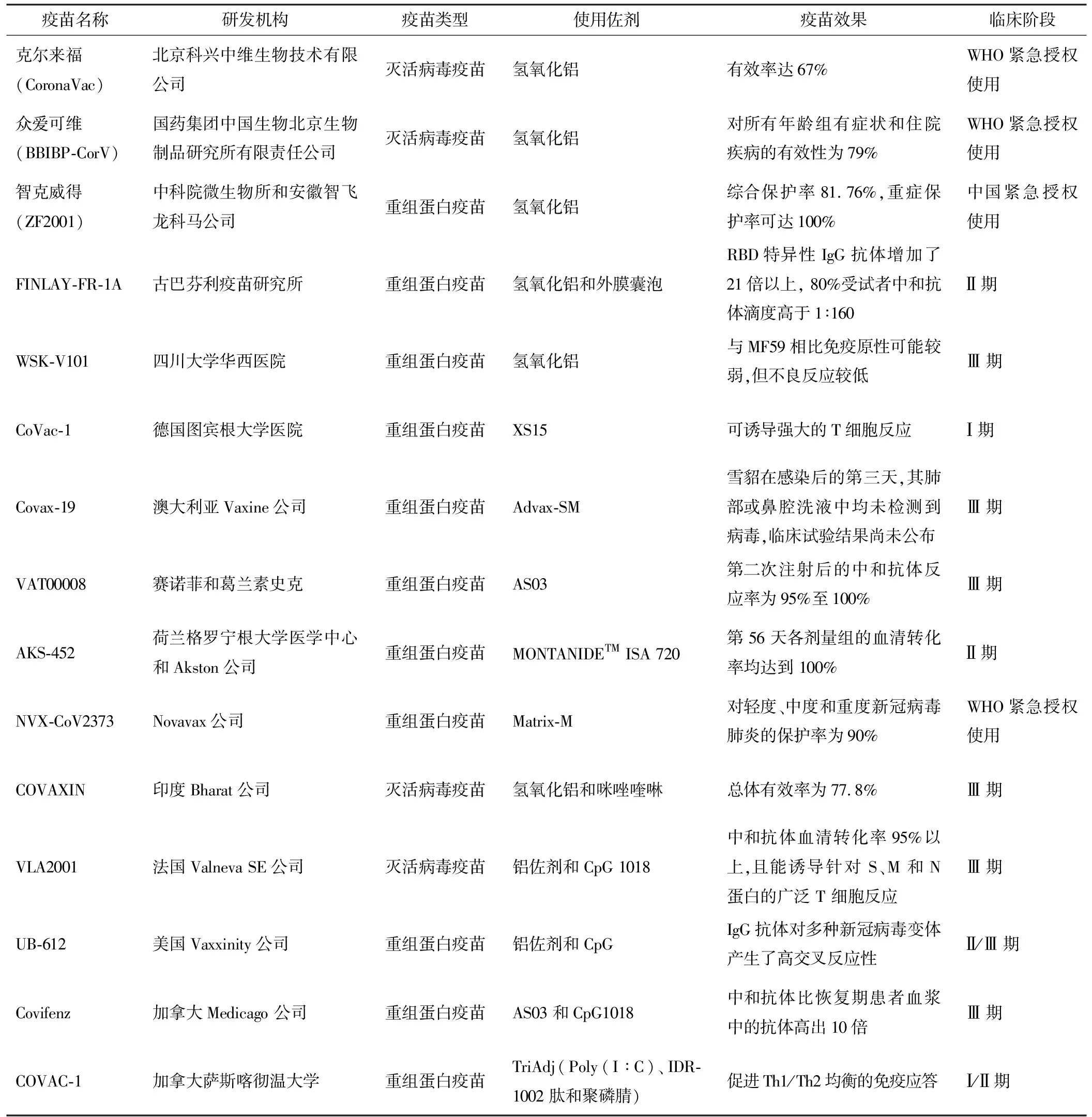
表1 紧急授权使用或进入临床试验的新冠病毒疫苗及其使用佐剂
1 新冠病毒疫苗佐剂的研究现状
1.1 铝佐剂
铝佐剂是我国唯一批准用于人体的佐剂,已经有九十多年的历史,也是目前应用最广泛的疫苗佐剂。铝佐剂发挥作用的机制尚不完全清楚,可能的机制包括延长抗原的吸附时间,诱导抗原递呈细胞的活化和成熟,激活炎症小体[3-4]等。铝佐剂主要促进体液免疫应答,诱导细胞免疫应答的能力弱。我国批准上市的两款灭活疫苗均选用铝佐剂,其中科兴的克尔来福(CoronaVac)的有效率达67%,能降低85%的住院率,降低89%的重症监护就诊率以及降低80%的死亡率[5]。国药的众爱可维(BBIBP-CorV)对所有年龄组有症状和住院疾病的有效性估计为79%[6]。智飞生物的重组亚单位疫苗智克威得(ZF2001)也选用氢氧化铝佐剂,综合保护率81.76%,重症保护率可达100%[4,7]。古巴疫苗FINLAY-FR-1A在铝佐剂的基础上添加了B群脑膜炎奈瑟氏球菌的外膜囊泡,在已进行的Ⅰ期临床试验中,疫苗接种后28d,RBD特异性IgG抗体增加了21倍以上,24名(80%)受试者中和抗体滴度高于1∶160[8-9]。四川大学研制的重组新冠病毒疫苗(Sf9细胞),采用氢氧化铝佐剂制成,与水包油类佐剂MF59相比免疫原性可能较弱,但是不良反应较低[10]。
1.2 Toll样受体(TLRs)激动剂
Toll样受体(TLRs)激动剂多为合成小分子佐剂,具有分子设计灵活和容易量产的优点[11]。此外,TLRs激动剂可以同时增强抗原特异性体液和细胞免疫应答,克服了铝佐剂诱导细胞免疫应答能力弱的缺点。XS15是一种TLR2激动剂,最初被设计用作肿瘤疫苗的佐剂。CoVac-1以XS15作为佐剂的,抗原由新冠病毒结构蛋白的多个T细胞表位组成。在Ⅰ期临床试验中,CoVac-1显示了可接受的安全性,并诱导了强大的T细胞反应,下一步将开展B细胞或抗体缺乏患者的Ⅱ期临床试验[12-13]。PIKA佐剂是一种合成的双链RNA(dsRNA),能被TLR3识别并激活免疫反应。以PIKA为佐剂的新冠病毒三聚体S蛋白可诱导快速、高效和长效的中和抗体,产生强有力的细胞免疫应答,对感染小鼠表现出完全的保护作用。此外,在非人灵长类动物中的研究表明,PIKA佐剂辅助三聚体S蛋白诱导了高中和效价的抗体,并在病毒攻击后阻断了病毒在肺部复制和感染[4,14]。CpG是一类模拟细菌和病毒遗传物质的合成DNA,可以靶向激活TLR9,已被开发为乙型肝炎疫苗HEPLISAV-B的佐剂。Covax-19疫苗采用Advax-SM佐剂,该佐剂由delta菊粉多糖颗粒组成,其中含有TLR9激动剂CpG55.2。接种了两剂高剂量的Covax-19疫苗的雪貂,在感染后的第3天,其肺部或鼻腔洗液中均未检测到病毒,显示其可能降低病毒传播[15-16]。
1.3 水包油类佐剂
乳剂在很长时间内已被用作疫苗佐剂,但直至上世纪末,解决代谢问题后才被批准用于人类。水包油型乳剂免疫刺激效果比铝佐剂更强,其分子作用机制尚不完全清楚[17]。虽然相对于其它类型的佐剂,水包油佐剂制备工艺复杂,但可以显著增强疫苗在老年人群体的免疫保护效果。MF59由角鲨烯、吐温80、司盘85组成,油相成分角鲨烯可降解且生物相容性好,能显著刺激抗体产生,增强Th1型和Th2型免疫应答,已用于季节性和大流行性流感疫苗。临床前研究表明,昆士兰大学研制的新冠病毒候选疫苗与MF59 佐剂相结合可以产生高水平的中和抗体,但进入Ⅰ期临床试验后由于可能干扰HIV病毒检测而被叫停[18]。与MF59成分和粒径相近,AS03也包含角鲨烯和吐温80,不同的是含有α-生育酚。研究表明,AS03可诱导肌肉和引流淋巴结产生细胞因子和趋化因子,促使单核细胞、树突状细胞和粒细胞向引流淋巴结迁移。此外,AS03能够刺激CD4+T细胞特异性免疫反应,可能与持续产生的中和抗体和记忆B细胞有关[19]。赛诺菲和葛兰素史克联合开发的新冠病毒蛋白亚单位疫苗VAT00008,其采用AS03作为佐剂,在Ⅱ期临床试验中,各剂量各年龄组(18~95岁)中,第2次注射后的中和抗体反应率为95%~100%。目前进行的Ⅲ期临床试验将进一步评价疫苗的效果、免疫原性和安全性[20]。
1.4 油包水类佐剂
MONTANIDE ISA 720是一种含有甘露醇单油酸脂乳化剂的以角鲨烯为基础的佐剂,可以形成油包水体系,在注射部位抗原缓慢释放,已在超过50个人体临床试验中使用[21-22]。由Akston研制的新冠病毒疫苗AKS-452,研究发现在添加油包水佐剂MONTANIDETMISA 720后,接受一针剂和两针剂注射的小鼠其中和抗体滴度提高了约7倍。此外,添加该佐剂的AKS-452疫苗在兔和非人灵长类动物中具有免疫原性,对活病毒攻毒的非人灵长类动物(USA-WA1/2020病毒株)和K18-人ACE2转基因小鼠(南非B.1.351病毒变体)具有完全保护作用[23]。
1.5 Matrix-M佐剂
Novavax的专利佐剂Matrix-M由两个单独40 nm大小的颗粒组成,每个颗粒都含有不同且结构明确的皂苷部分(A组分和C组分)。Matrix-M可增强Th1和Th2反应,诱导多个亚类的抗体,增强免疫细胞迁移,并节省抗原剂量。以Matrix-M为佐剂的新冠病毒疫苗NVX-CoV2373(约3万名受试者)和针对其他病原体的疫苗(约4200名受试者),已在美国、英国等共29个Ⅱ、Ⅲ期临床试验中使用[24-25]。在两项Ⅲ期临床试验中,NVX-CoV2373对轻度、中度和重度新冠病毒肺炎的保护率为90%。
1.6 复合佐剂
复合佐剂是将两种及以上佐剂进行组合,发挥佐剂的协同作用。为了弥补传统铝佐剂诱导细胞应答能力弱的不足,常用的策略是将可以诱导细胞免疫应答的佐剂与铝佐剂进行组合构建复合佐剂。印度的新冠病毒疫苗COVAXIN将TLR7/8激动剂咪唑喹啉吸附到氢氧化铝颗粒作为佐剂,Ⅲ期临床试验疫苗的总体有效性为77.8%[26]。法国Valneva SE公司开发的新冠病毒疫苗VLA2001则将铝佐剂和CpG 1018进行组合,在临床前实验中能诱导比铝佐剂更高的抗体水平,并促进细胞免疫应答向Th1方向偏移,其Ⅲ期临床试验结果显示中和抗体血清转化率95%以上,且能诱导针对S、M和N蛋白的广泛T细胞反应[27]。美国Vaxxinity公司的新冠病毒疫苗UB-612将CpG和与另外一种形式的铝佐剂磷酸铝进行复配,以诱导Th1反应[28]。用UB-612加强免疫后,受体结合域(RBD)和刺突(S)蛋白结合IgG抗体对多种新冠病毒变体产生了高交叉反应性[29]。加拿大疫苗Covifenz将AS03与CpG 1018进行组合,对18至64岁的试验参与者有效保护率71%,Ⅱ期临床试验中期结果显示该疫苗的高安全性和有效性,与恢复期患者血浆中的抗体反应相比,中和抗体反应高出10倍[30]。加拿大的另一款新冠病毒疫苗COVAC-1则采用TriAdj佐剂,由Poly(I∶C)、IDR-1002肽和聚磷腈按照1∶2∶1比例配制而成,之前的研究表明TriAdj佐剂可以促进Th1/Th2均衡的免疫应答[31]。
2 新冠病毒疫苗研发中应用佐剂须考虑的问题
新冠病毒仍然在全球广泛传播,且不断有新的变异株出现,新冠病毒疫苗研发仍然面临诸多挑战,其佐剂应用须考虑以下几个问题。
2.1 佐剂的起效速度
在新冠病毒持续流行的背景下,接种疫苗的个体越早产生有效浓度的中和抗体,不仅可以保护接种个体免受病毒的侵染,在一定程度上还会阻断病毒的传播链,因此新冠病毒疫苗的研发中应考虑选用可以辅助抗原快速诱导特异性免疫应答的佐剂。
2.2 佐剂的持久性
随着时间推移,疫苗接种者的抗体水平通常会逐渐下降。为了维持有效的抗体水平,必要时需要进行加强免疫。持久强效佐剂可以辅助抗原维持长期高水平的特异性免疫应答,将会减少加强针的接种次数,从而提高新冠病毒疫苗接种的依从性。
2.3 佐剂的普适性
多数新冠病毒疫苗在青壮年人群中接种可以诱导保护性免疫应答,然而对于老年人或有基础疾病等免疫功能不全人群,通常需要创新的疫苗佐剂策略。水包油佐剂以及部分复合佐剂已经在提高免疫功能不全人群的疫苗免疫应答方面表现出了一定的潜力,未来可能作为普适性佐剂用于新冠病毒疫苗的研发。
3 新冠病毒疫苗佐剂的研究展望
目前已有多种新型佐剂用于新冠病毒疫苗开发,由于铝佐剂的应用较成熟,其安全性在广泛使用中得到验证,被用于多种类型的新冠病毒疫苗开发。在所有进入临床试验或已上市的疫苗类型中,包括灭活疫苗、蛋白亚单位疫苗、病毒样颗粒疫苗等,使用铝佐剂的新冠病毒疫苗占比约为37.5%。但新型佐剂的优势也逐渐体现出来,有望弥补传统铝佐剂的不足,因此有必要进一步开展创新佐剂的研究与开发,我们认为未来新冠病毒疫苗佐剂可以围绕以下几个方面开展研究。
3.1 针对免疫功能低下人群的佐剂
由于各年龄段人群均对新冠病毒易感,实现全人群接种是形成群体免疫屏障、阻断传播的关键,但目前老年人以及有基础疾病人群的新冠病毒疫苗接种的研究还非常少[32]。免疫功能低下导致该类人群感染新冠病毒的严重程度增加,并且当前大多数新冠病毒疫苗的免疫原性和临床疗效在该人群中要显著低于免疫功能正常人群。开发新型佐剂是增强疫苗对免疫功能低下人群免疫原性的主要策略。虽然已经有研究表明氢氧化铝佐剂和CpG组成的复合佐剂可以提高新冠病毒疫苗对老年鼠的保护[33],但至今还未有相关的临床研究[34]。因此,后续还须重视对以上免疫功能低下人群新冠病毒疫苗佐剂的研究。
3.2 增强T细胞应答的佐剂
新冠病毒为单股正链RNA病毒,可在疫情发生发展中不断变异,且其感染与免疫机制还有很多盲点,因此当前研制的疫苗保护效力和免疫持久性仍然存在不确定因素。抗体一直被认为在阻止新冠病毒感染中发挥重要作用,但随着新冠病毒的变异,现有疫苗诱导的抗体对变异株的中和能力大幅下降[35]。然而,有研究者发现新冠康复者以及接种疫苗人群产生的T细胞应答仍然能够识别新冠病毒变异株[36-37],提示诱导特异性T细胞应答,尤其是CD8+T细胞应答,可能是应对变异株感染的有效策略。铝佐剂作为我国唯一获批用于人体的佐剂,其增强T细胞免疫应答能力弱。研发可辅助抗原诱导强效、持久特异性T细胞应答的佐剂是未来新冠病毒疫苗研究的重点。
3.3 新型黏膜免疫佐剂
由于新冠病毒主要通过呼吸道入侵人体,呼吸道黏膜免疫应答对阻断新冠病毒对宿主的感染至关重要[38]。现有新冠病毒疫苗主要通过皮下或肌肉注射接种,所能激发的黏膜免疫应答通常非常有限,导致当前的新冠病毒疫苗“只能预防病症,不能预防感染”[39]。缺乏安全有效的黏膜佐剂是限制黏膜递送新冠病毒疫苗研发的主要障碍。我们的前期研究中,通过合理设计新型脂肽分子,发现优选的脂肽与新冠病毒重组RBD联用滴鼻免疫小鼠,可以显著提升血清、肺泡灌洗液和鼻腔灌洗液中新冠病毒中和抗体的水平,提示新型脂肽可能是新冠病毒疫苗的候选佐剂[40]。尽管有部分黏膜佐剂处于临床前或临床研究阶段,但其安全性和有效性还有待进一步评估[41]。因此,迫切需要发展安全、高效的粘膜免疫佐剂来促进机体产生保护性黏膜免疫应答,以应对新冠病毒带来的感染威胁。
3.4 复合佐剂的理性设计
由于不同佐剂的作用特点各不相同,为尽可能将各种佐剂的优势相结合,促进疫苗激发更强的免疫应答,发挥更好的免疫保护效果,佐剂的组合通常是必要的[42]。复合佐剂策略在新冠病毒疫苗研发中也备受重视,但多数是将传统铝佐剂和PAMPs进行组合,在保留铝佐剂良好的蛋白抗原存储库效应的基础上,弥补铝佐剂不能有效诱导细胞免疫应答的不足。然而,将PAMPs与铝佐剂简单混合,无法靶向胞内免疫活化位点,难以最优发挥佐剂的免疫增强效用。因此,科学、合理的佐剂组合以及时空耦合的共递送是复合佐剂形成优势互补,发挥协同作用的基础[43],该领域的研究有待进一步深入。为了寻找到更为有效的新冠病毒疫苗复合佐剂,建议针对传统佐剂的机制和结构,采取高通量筛选以及理性设计等策略,开展新冠病毒疫苗复合佐剂的研究。
随着新冠病毒的不断变异,其疫苗研发仍然在路上。佐剂作为提升疫苗保护效果的重要组成部分,也是当前新冠病毒疫苗研究的热点。虽然多种佐剂已经应用于新冠病毒疫苗,但现在佐剂的应用仍然以经验性为主,根据新冠病毒的感染特点进行佐剂的合理化设计以及递送可能是未来重要的研究方向。
