骨髓增生异常综合征贫血患者铁代谢、炎症指标与铁调素的关系及对病情转归的影响
2022-12-19刘建会
谢 杨,汪 丹,刘建会
骨髓增生异常综合征(MDS)为一种造血干细胞恶性克隆性疾病,临床特征主要表现为病态造血、无效造血及凋亡增强,最终可发展为造血功能衰竭及急性髓系白血病[1-2]。相关资料表明,每年新增MDS患者可达30万例,且由于骨髓造血功能中红细胞受损、丢失,大多数患者伴有贫血症状[3],对生活质量、生命安全造成严重影响。国内研究发现,MDS贫血患者可累及粒细胞系、红细胞系、巨核细胞系造血细胞,需进行长期输血治疗,而多次输血必然导致铁代谢紊乱,且骨髓中免疫因子介导的炎症反应可负面影响骨髓造血微环境[4-5]。因此,尽早对MDS贫血患者铁代谢、炎症状态进行评估干预至关重要。铁调素为肝脏合成分泌的多肽物质,其异常为铁代谢紊乱性疾病的发病机制之一,故推测其与MDS贫血患者铁代谢具有一定联系,但鲜有相关研究。基于此,本研究分析MDS贫血患者铁代谢、炎症指标与铁调素的关系及对病情转归的影响。
1 资料与方法
1.1一般资料 选取2016年5月—2020年12月收治的MDS 48例,男26例,女22例;年龄1~67(45.83±5.84)岁;体质量指数(BMI)15.3~26.5(21.15±2.35)kg/m2。根据是否贫血分为贫血组28例、无贫血组20例。另选取同期45例健康体检者作为对照组,男27例,女18例;年龄1~65(45.21±5.76)岁;BMI 15.1~26.2(21.32±2.26)kg/m2。2组性别、年龄等方面比较差异无统计学意义(P>0.05),具有可比性。本研究经我院医学伦理委员会审核批准。
1.2纳入及排除标准 纳入标准:确诊患者均符合《血液病诊断及疗效标准》[6]中MDS及贫血相关诊断标准;可接受本研究检查、治疗方案;原发性MDS;患者及家属知晓本研究,并签署知情同意书。排除标准:合并慢性阻塞性肺疾病、高血压病、糖尿病等慢性疾病者;心肺肝肾功能障碍者;全身性感染、自身免疫性疾病者;预计生存期<3个月者;合并精神异常无法配合本研究检查者;临床资料缺失者;恶性肿瘤者。
1.3剔除病例标准 不符合纳入标准者;临床资料不全,影响疾病判断者;治疗过程中未按本研究治疗方案治疗者;研究过程中发生意外情况退出研究者;患者或家属自愿退出本研究。剔除后按1∶1重新选取符合纳入标准者。
1.4方法
1.4.1血清学指标检测:采集所有患者入院后次日晨起空腹外周静脉血5 ml,对照组取体检当天静脉血5 ml,经离心半径8 cm、5000 r/min离心15 min后,收集血清于-80 ℃冰箱保存备用。采用酶联免疫吸附试验测定血浆铁调素水平,试剂盒购于美国TSZ公司;采用日本KX-21N型全自动血球计数仪测定红细胞系指标[红细胞计数(RBC)、血红蛋白(Hb)、红细胞平均体积(MCV)、红细胞平均血红蛋白浓度(MCHC)];采用亚铁嗪比色法测定血清铁(SI)水平,仪器选用贝克曼DXC800型分析仪;采用电化学发光法测定血清铁蛋白(FERR)水平,仪器选用罗氏E60型分析仪;采用络合铁比色法测定总铁结合力(TIBC)水平,仪器选用贝克曼DXC800型分析仪;采用酶联免疫吸附试验测定炎症指标[白细胞介素-1(IL-1)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)]水平。所有操作均严格按照试剂盒及仪器操作说明书进行。
1.4.2病情转归评估:采用国际预后评分系统(IPSS)进行病情转归评估。危险度根据血细胞减少系别数、原始细胞百分比、骨髓细胞遗传学特征确定。低危:0分;中危-1:0.5~1.0分;中危-2:1.5~2.0分;高危:≥2.5分。
1.4.3治疗方案:根据IPSS评分结合患者年龄、体能状况制订治疗方案。低危MDS主要包括造血因子治疗、成分血输注、免疫调节剂、表观遗传学药物治疗;中危、高危MDS给予输血、去铁治疗、血小板输注、促中性粒细胞治疗、促红细胞生成治疗。
1.5观察指标 比较3组入院时红细胞系指标(RBC、Hb、MCV、MCHC)、铁代谢指标(SI、FERR、TIBC、铁调素)及炎症指标(IL-1、IL-6、TNF-α)。分析红细胞系、铁代谢、炎症指标与铁调素的关系。分析红细胞系、铁代谢及炎症指标对病情转归的影响。
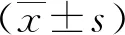
2 结果
2.1红细胞系指标比较 3组RBC、Hb、MCV、MCHC比较差异有统计学意义(P<0.01);贫血组、无贫血组RBC、Hb、MCHC低于对照组,MCV高于对照组(P<0.05);贫血组RBC、Hb、MCHC低于无贫血组,MCV高于无贫血组(P<0.05)。见表1。

表1 3组红细胞系指标比较
2.2铁代谢指标比较 3组SI、FERR、TIBC、铁调素比较差异有统计学意义(P<0.01);贫血组、无贫血组SI、FERR、TIBC、铁调素高于对照组,且贫血组高于无贫血组(P<0.05)。见表2。

表2 3组铁代谢指标比较
2.3炎症指标比较 3组IL-1、IL-6、TNF-α比较差异有统计学意义(P<0.01);贫血组、无贫血组IL-1、IL-6、TNF-α高于对照组,且贫血组高于无贫血组(P<0.05)。见表3。

表3 3组炎症指标比较
2.4红细胞系、铁代谢、炎症指标与铁调素关系 相关性分析显示,贫血组RBC、Hb与铁调素呈负相关(r=-0.773、-0.762,P<0.05),MCV、SI、FERR、TIBC、IL-1、IL-6、TNF-α与铁调素呈正相关(r=0.819、0.673、0.797、0.736、0.800、0.732、0.785,P<0.05),见图1。贫血组MCHC与铁调素无相关性(P>0.05)。无贫血组红细胞系、铁代谢、炎症指标与铁调素均无相关性(P>0.05)。

图1 骨髓增生异常综合征患者贫血组红细胞系、铁代谢、炎症指标与铁调素相关性分析
2.5红细胞系、铁代谢及炎症指标对病情转归影响 48例MDS低危19例,中危-1 16例,中危-2 8例,高危5例。相关性分析显示,MDS贫血患者RBC、Hb与病情转归呈正相关(r=0.859、0.871,P<0.05);MCV、SI、FERR、TIBC、IL-1、IL-6、TNF-α、铁调素与病情转归呈负相关(r=-0.813、-0.765、-0.744、-0.796、-0.826、-0.709、-0.737、-0.926,P<0.05)。
3 讨论
MDS为一种以无效造血为主要特征的多相干细胞克隆性疾病,与免疫失调、骨髓微环境异常密切相关[7]。MDS患者由于需长期频繁输血以维持血细胞功能,易导致铁代谢发生紊乱[8]。国内学者认为,对于无输血依赖MDS患者,无效造血及骨髓中免疫因子介导的炎症反应为引起贫血及铁代谢紊乱的主要原因,且机体红细胞系指标随之变化[9]。因此,及时对MDS贫血患者炎症及铁代谢状态进行评估,针对性制订个体化治疗方案具有重要意义。
RBC为红细胞计数,Hb为血红蛋白,MCV为红细胞平均体积,SI为血清铁,FERR为铁蛋白,TIBC为总铁结合力,IL-1为白细胞介素-1,IL-6为白细胞介素-6,TNF-α为肿瘤坏死因子-α
本研究发现,贫血组SI、FERR、TIBC高于无贫血组,且与铁调素呈正相关,提示机体铁代谢状态与MDS贫血的发生密切相关。铁调素为机体铁稳态调节中重要激素之一,具有抑制巨噬细胞储存铁及肠道吸收铁作用[10]。研究表明,铁调素主要由肝脏细胞合成分泌,可由细胞因子、铁负荷及缺氧等因素调节,其水平异常可导致机体铁负荷过重并对肝脏等多个器官造成损伤[11]。李姣等[12]研究发现,机体正常生理状态下缺乏铁排出途径,需依赖铁调素对铁进行负性调节,以维持铁平衡,而铁调素可通过与膜铁转运蛋白1相结合,促进对铁的内吞作用,同时减少巨噬细胞、肝细胞生成铁。据此可推测铁调素与MDS贫血患者铁代谢密切相关。笔者认为,MDS贫血主要由红细胞系无效造血引起,而凋亡小体被巨噬细胞吞噬,细胞内铁可被重复利用,致巨噬细胞功能亢进,摄取铁明显增多,为预防铁负荷过重,铁调素水平随之升高,以减少机体对铁的吸收[13-15]。国外学者发现,铁负荷增多症、炎性贫血患者铁调素水平高于健康体检者及缺铁性贫血患者,且铁调素水平升高与铁负荷增加具有相关性[16]。本研究结果与该报道一致。
本研究还发现,MDS贫血患者炎症指标及红细胞系指标与铁调素具有相关性,可推测MDS贫血与骨髓中免疫因子介导的炎症反应及红细胞发育情况密切相关。研究表明,MDS患者存在病态造血,外周血可出现形态不规则红细胞,且巨核细胞发生病态造血,骨髓涂片中可见巨大血小板及小巨核细胞[17]。国内学者探讨MDS患者红细胞系指标变化规律,发现MCV、红细胞分布宽度均升高,该参数变化对于早期MDS诊断具有一定价值,且MCHC可反映红细胞发育不良程度[18-19]。临床研究表明,IL-1、IL-6等炎性因子可由患者骨髓中突变的恶性血液肿瘤细胞大量分泌,可调节肿瘤细胞所处微环境,推测其与骨髓血液疾病的发生存在联系,且表达量随患者炎症状态变化而变化[20]。宗晓燕和寇剑成[21]指出,骨髓间质细胞可分泌TNF-α,MDS患者骨髓凋亡现象与TNF-α水平密切相关,TNF-α可反映机体系统性炎症活动。本研究结果与上述文献报道一致。一项研究表明,机体炎症指标及铁代谢指标可能与MDS预后具有一定关系,且与原始RBC及Hb浓度相关[22]。本研究通过相关性分析发现,MDS贫血患者红细胞系、铁代谢及炎症指标与病情转归显著相关,与上述研究结果基本一致,提示临床可通过上述指标早期评估MDS贫血患者病情及预后,以制订相应干预方案。
综上所述,MDS贫血患者红细胞系、铁代谢、炎症指标与铁调素变化密切相关,且与病情转归具有较高相关性,可为临床早期制订个体化治疗方案提供参考。
