咖啡连作根际土壤水提液对其幼苗根系发育的影响
2022-12-16林兴军施忠海董云萍
谭 军,王 蕊,林兴军,施忠海,董云萍,张 昂*
咖啡连作根际土壤水提液对其幼苗根系发育的影响
谭 军1,王 蕊2,林兴军1,施忠海2,董云萍1,张 昂1*
1. 中国热带农业科学院香料饮料研究所/农业农村部香辛饮料作物遗传资源利用重点实验室/海南省热带香辛饮料作物遗传改良与品质调控重点实验室,海南万宁 571533;2. 云南农业大学热带作物学院,云南普洱 665099
咖啡是世界三大饮料之一,营养丰富,经济价值高,深受消费者欢迎。咖啡是热区重要的多年生经济作物,长期的连作产生了严重的连作障碍,已成为影响咖农增收、制约产业可持续发展的严重问题,亟待解决。本研究采集咖啡园病株根际土壤,开展室内盆栽试验,研究其4个浓度的水提液(0、0.50、1.00和2.00 g/mL,分别表示为CK、T1、T2和T3)对咖啡幼苗根系生长发育的影响,以期明晰咖啡连作障碍产生的机理,为克服咖啡连作障碍提供科学和试验依据。结果表明:发病植株根际土壤水提液导致其幼苗根系表皮细胞变小、排列更加紧密,并且随着浓度的升高,根系细胞壁及内膜系统逐渐被破坏,形成空腔;初生木质部细胞的木质化程度逐渐增加。根系鲜重、干重、总根长、根体积、根尖数、总根表面积以及根系活力均随根际土壤水提液浓度的升高而下降,T2处理与CK相比差异显著(<0.05),T3处理差异极显著(<0.01)。随着根际土壤水提液浓度的升高,根系木质素含量和相对电导率逐渐升高,T1处理与CK相比,木质素含量增加29.53%,差异显著,T2、T3处理木质素含量分别增加42.38%、66.52%,差异均达极显著;T2、T3根系相对电导率分别增加34.40%、58.30%,差异均达极显著。根系可溶性蛋白含量随着土壤水提液浓度的升高呈现先升高后下降的变化趋势,T2处理与CK相比,可溶性蛋白含量增加61.75%,差异显著。MDA含量、SOD、POD和CAT活性均随着土壤水提液浓度升高而升高,T3处理与CK相比,SOD活性增长56.77%,差异显著;POD活性增加96.28%,差异极显著。综上可知,发病咖啡植株根际土水提液中存在自毒物质,破坏咖啡幼苗根系结构、抑制根系生长发育。
咖啡;根系;连作;根际土壤;自毒作用
咖啡是世界三大饮料之一,每年全球消费量超过9´109kg,具有广泛的营养价值、经济价值和药用价值。咖啡是我国乃至全球热区重要的经济作物。据统计,2020年我国咖啡种植面积已达9.94万hm2,年产咖啡豆11.41万t,是云南、海南等热区农民重要的经济来源[1]。咖啡是多年生经济作物,长期连作导致树体衰弱、产质量下降、经济效益降低。但再植或者咖啡老园更新时出现大量死株,严重影响了咖农种植的积极性和产业的可持续发展,现已成为产业亟待解决的问题。笔者田间调查发现再植的咖啡植株普遍存在黄化、长势弱、不发新根、甚至部分根系腐烂的问题。大量研究表明,自毒作用是连作障碍发生的重要诱因。自毒作用是发生在同种植物间的抑制生长发育的一种化感作用[2-3]。长期的连作导致自毒物质在土壤中积累,尤其是在根际土壤中形成高浓度的微环境。自毒作用已给农业生产造成诸多负面影响。如白茹[4]研究表明苹果根系水提液破坏其幼苗根系膜的结构和功能,降低膜的流动性、增加膜的相对透性、降低叶片光合色素和光合速率,进而影响苹果树生长发育;陆茜[5]研究表明杨树根际土壤水提液抑制其幼苗根系的生长;李敏等[2]证实酚酸类物质是枸杞自毒物质,对其种子萌发具有较强抑制作用;袁婷婷等[6]研究表明蚕豆自毒物质阿魏酸导致其根系木质素含量升高、细胞形变、胞内物质外泄,显著加剧了连作障碍的发生。
根是植物吸收养分的主要器官,也是最先感知土壤环境改变的器官。健康的根系对植物生长发育至关重要[7]。但迄今为止,有关咖啡化感物质对其根系生长发育影响的研究还鲜见报道。因此,本研究采集大田再植发病咖啡植株根际土壤,并通过室内盆栽试验探讨其水提液对咖啡根系发育的影响,以期明晰咖啡连作障碍产生的机理,为克服咖啡连作障碍提供科学和试验依据。
1 材料与方法
1.1 材料
供试土壤取自海南省琼海市大路镇咖啡园(19°44¢N,110°47¢E)。该园咖啡种植时间超过15年,连作障碍严重,再植咖啡植株长势弱、成活率低。采用抖落法采集发病咖啡植株根际土,混匀过10 mm筛,置于灭菌自封袋中带回实验室自然风干。参照陈艳芳[8]的方法提取咖啡根际土水提液,并浓缩至2 g/mL后用0.22 μm的滤膜过滤除菌,冷藏保存备用。开展试验时用无菌水分别稀释成浓度为0.5、1.0 g/mL的溶液。在咖啡园毗邻区域采集从未种植过咖啡的耕层土壤,过筛、风干后按照耕层土壤有机肥=7∶3配制营养土,备用[9]。营养土理化特征为pH 6.50±2.12,有机质(28.91±3.85)g/kg、碱解氮(151.71±6.01)mg/kg、速效磷(20.13±1.92)mg/kg、速效钾(170.63± 5.91)mg/kg。供试咖啡品种为中粒种主栽品种‘热研1号’(Pierre ex Froehner cv. Reyan No.1)。
1.2 方法
1.2.1 试验设计 盆栽试验于2019年12月至2021年4月在中国热带农业科学院香料饮料研究所日光温室内进行。咖啡种子经沙床催芽,子叶完全展开后于2020年3月10日选择健壮、无病害的苗移栽至高12 cm、直径10 cm装有1.50 kg营养土的营养钵中培养,于2020年4月15日选取健壮的长势一致的植株开始试验处理。即分别用无菌水、0.5、1.0和2.0 g/mL的根际土壤水提液分别浇灌咖啡植株,依次标记为CK、T1、T2和T3,每3 d灌根一次,每次100 mL。各处理15株、3次重复。全程置于荫蔽度50%的日光温室中培育。于2021年3月29日取植株根系分析、测定。
1.2.2 项目测定 采用石蜡切片,番红-固绿染色观察根尖结构[10];TTC方法测定根系活力,WinRhizo根系分析系统扫描分析根系形态[11];巯基乙酸法测定根系木质素含量[12];电导率测定仪(雷磁,DZS-708)测定根系相对电导率;BCA法测定根系可溶性蛋白含量;氮蓝四唑(NBT)还原法测定超氧化物歧化酶(SOD)活性;愈创木酚法测定过氧化物酶(POD)活性;过氧化氢法测定过氧化氢酶(CAT)活性;硫代巴比妥酸比色法测定丙二醛(MDA)含量[11]。
1.3 数据处理
采用SPSS 20.0软件进行统计分析,运用Duncan’s新复极差法进行差异显著性分析,采用Microsoft Excel 2013软件进行数据处理和图表绘制。
2 结果与分析
2.1 咖啡根际土水提液对其幼苗根系解剖结构的影响
由图1可知,根际土壤水提液处理与CK相比,根系表皮细胞变小、排列更紧密。随着根际土壤水提液浓度的升高,皮层薄壁细胞变小,细胞壁发生破裂、形成空腔;内皮层细胞变小,在T3浓度处理下,内皮层细胞形成的紧密环状结构消失,形成空隙;初生木质部细胞的木质化程度逐渐增加。可知,咖啡根际土壤水提液破坏了其幼苗根系的细胞结构。

图1 不同浓度咖啡根际土水提液处理的咖啡幼苗根尖切片
2.2 咖啡根际土水提液对其幼苗根系生长的影响
由表1可知,根系鲜重、干重、总根长、根体积、根尖数和总根表面积均随土壤水提液浓度的升高而下降。T1处理各指标与CK相比虽有降低,但差异不显著,T2处理各指标均达显著,T3处理各指标均达极显著。因此,咖啡根际土壤水提液对其幼苗根系生长发育有显著影响。
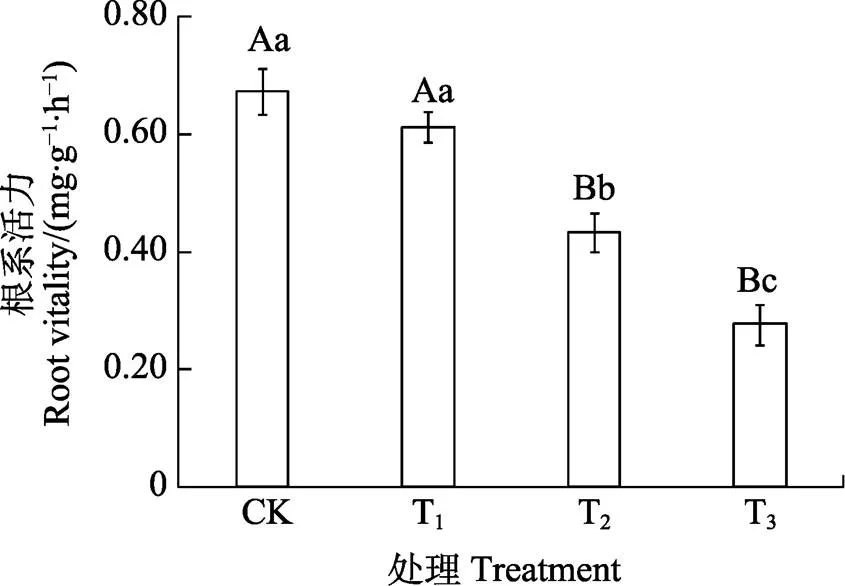
2.3 咖啡根际土水提液对其幼苗根系活力的影响
由图2可知,T1处理根系活力比CK降低8.91%,二者差异不显著;T2和T3处理根系活力均极显著低于CK,分别降低35.64%、58.91%;T3处理根系活力显著低于T2处理,降低36.15%。可知,咖啡根际土壤水提液降低了咖啡幼苗的根系活力。
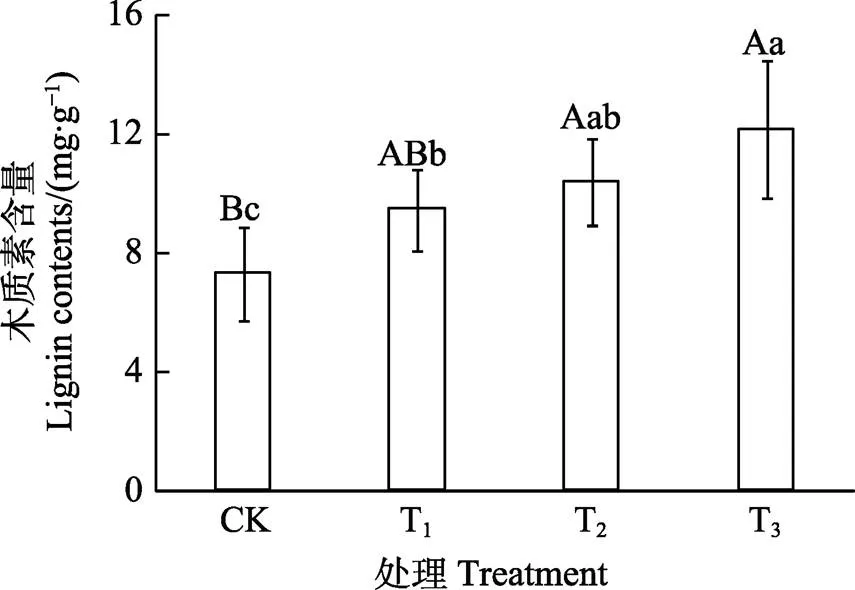
2.4 咖啡根际土水提液对其根系木质素含量的影响
由图3可知,咖啡苗根系木质素含量随着连作土壤水提液浓度增加而升高。T1处理木质素含量与CK相比增加29.53%,差异显著,T2、T3分别增加42.38%、66.52%,差异均达极显著。T3处理木质素含量也显著高于T1处理。可知,咖啡根际土壤水提液增加了咖啡苗根系木质素的含量。

表1 不同浓度咖啡根际土水提液处理的幼苗根系形态
注:同列数据后不同小写字母表示处理间差异显著(<0.05),不同大写字母表示处理间差异极显著(<0.01)。
Note: Different lowercase letters after the same column of data indicate significant difference (<0.05), different capital letters indicate extremely significant difference among treatments (<0.01).
不同小写字母表示处理间差异显著(P<0.05),不同大写字母表示处理间差异极显著(P<0.01)。
不同小写字母表示处理间差异显著(P<0.05),不同大写字母表示处理间差异极显著(P<0.01)。
2.5 咖啡根际土水提液对其幼苗根系相对电导率的影响
由图4可知,T1处理的根系相对电导率与CK相比略有增加,但二者差异不显著;T2、T3根系相对电导率分别增加34.40%、58.30%,均达极显著差异;T3根系相对电导率比T2增加47.54%,差异显著。可知,咖啡根际土壤水提液增加了咖啡幼苗根系相对电导率。

不同小写字母表示处理间差异显著(P<0.05),不同大写字母表示处理间差异极显著(P<0.01)。
2.6 咖啡根际土水提液对其幼苗根系可溶性蛋白含量的影响
由图5可知,随着土壤水提液浓度的升高,根系可溶性蛋白含量呈现先升高后下降的变化趋势。T2处理可溶性蛋白含量与CK相比增加61.75%,差异显著;T1处理增加33.01%;差异不显著。T3根系可溶性蛋白比T2处理下降88.73%,差异显著。可知,咖啡根际土壤水提液对其幼苗根系可溶性蛋白含量有显著影响。

不同小写字母表示处理间差异显著(P<0.05)。
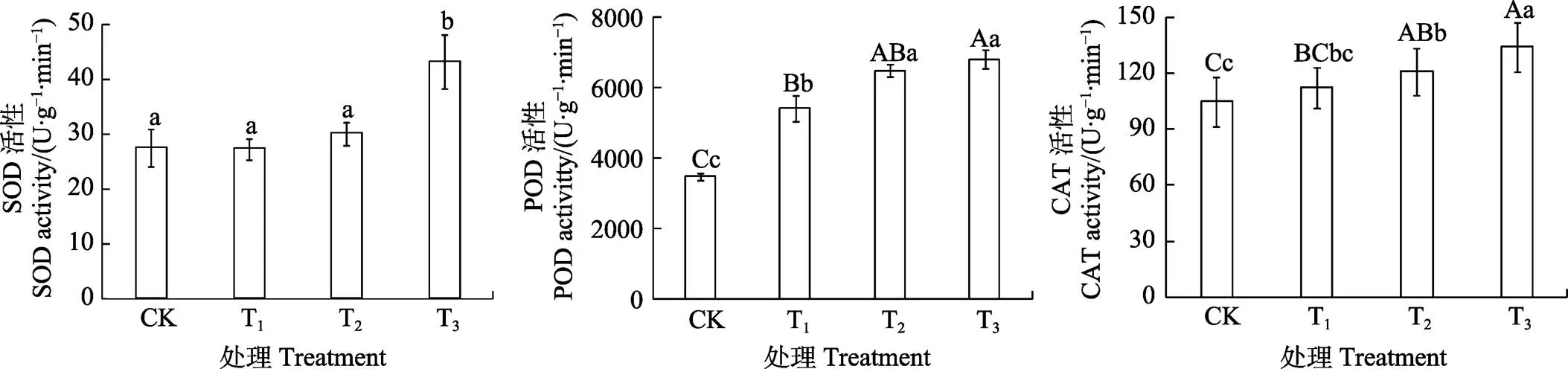
2.7 咖啡根际土水提液对根系抗氧化酶活性的影响
由图6可知,SOD、POD和CAT活性均随着土壤水提液浓度升高而升高。T3处理SOD活性与CK相比增长56.77%,差异显著;T1、T2、T3处理的POD活性分别增加55.90%、87.22%、96.28%,差异极显著;T2和T3处理的CAT活性增加15.31%、27.82%,差异极显著水平。
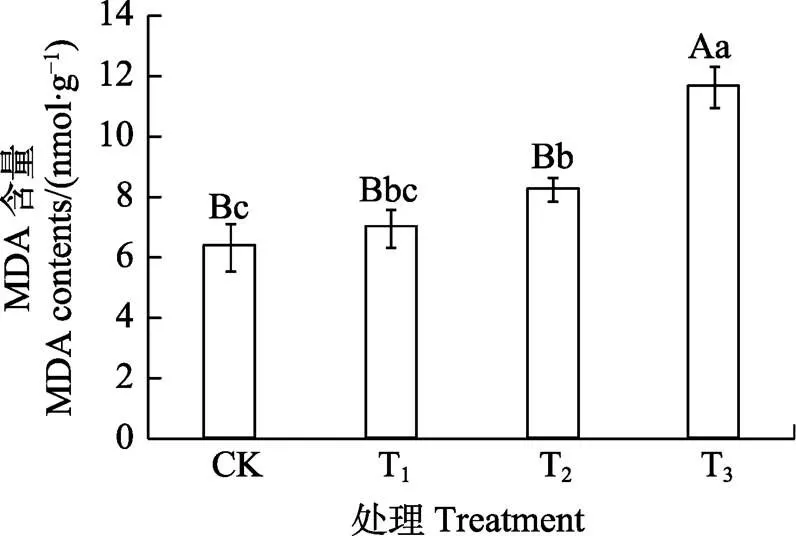
2.8 咖啡根际土水提液对其根系MDA含量的影响
由图7可知,根系MDA含量随着土壤水提液浓度升高而升高。T1处理MDA含量与CK相比略有增加,差异不显著;T2处理增加30.03%,差异显著;T3处理增加83.55%,差异极显著。可知,咖啡根际土壤水提液对咖啡苗膜系统造成了损伤。
不同小写字母表示处理间差异显著(P<0.05),不同大写字母表示处理间差异极显著(P<0.01)。
3 讨论
根系是植物重要的代谢器官和养分吸收器官,也是植株唯一与土壤接触的器官,最先感知土壤环境的改变并做出响应[13-14]。当遭遇逆境胁迫时,根系通过信号传导系统启动相关抗逆基因的转录、表达、合成抗逆代谢物质,改变能量流方向、调节生理状态,最终影响根系的生长发育和形态结构[14-16]。本研究表明即使是低浓度的发病咖啡根际土壤水提液也会导致咖啡幼苗根系表皮细胞变小、排列更加紧密;并且随着水提液浓度的升高,皮层薄壁细胞变小,逐渐破裂形成空腔;根系相对电导率升高。这说明发病咖啡根际土壤水提液中的化感自毒物质扰乱了代谢途径,改变了细胞形态,破坏了细胞膜系统导致胞内物质外泄。本研究结果与前人研究的结果基本一致。如向维[17]在研究三七皂苷类自毒物质对其根系的影响时也出现质壁分离、胞结构被破坏的现象;李勇等[18]研究表明,人参根系在其自毒物质苯甲酸胁迫下出现细胞壁异常增厚、核膜溶解消失、细胞内产生空腔。由此可知化感物质对根系的自毒机理有一定的共性。
可溶性蛋白是重要的渗透调节物质和功能性蛋白,在维持细胞渗透压和正常代谢活动方面起着重要作用,其含量高低是植物代谢能力强弱的一个重要指标[19-20]。植物遭遇胁迫时,可溶性蛋白合成受阻、含量降低。本研究中随着根际土水提液浓度的升高,咖啡幼苗根系可溶性蛋白含量呈现先升高后下降的变化趋势。这表明发病咖啡根际土水提液浓度低于1.0 g/mL时,根系可以通过合成可溶性蛋白,提高细胞渗透压、增强代谢能力,降低毒害作用;当浓度高于1.0 g/mL时,自毒作用增强,抑制了可溶性蛋白的合成。
不同小写字母表示处理间差异显著(P<0.05),不同大写字母表示处理间差异极显著(P<0.01)。
本研究中咖啡幼苗根系活力,根系鲜重、干重,总根长,根体积和总根表面积均随着发病植株根际土水提液浓度升高而显著下降。根系活力的强弱在一定程度上反映根系代谢的旺盛程度和养分吸收能力的强弱[4]。本研究表明发病咖啡根际土壤水提液影响根系的代谢和吸收功能,影响干物质积累,进而导致根系发育受阻,根系鲜重、干重下降。根尖的发育以及侧根的形成受外界环境因子和内部信号的调控[21]。细胞表面的信号感受器感知到外界环境信号的刺激,启动转录因子调控相关基因的表达,进而调控根尖顶端分生组织、侧根的发育。大量研究表明,如bZIP、MYB、AP2/ERF等转录因子家族,生长素、细胞分裂素等激素广泛参与根系发育调控、逆境应答等多个生物学过程[22-24]。本研究中咖啡幼苗根尖数量随着发病植株根际土水提液浓度升高而显著下降,与大田调研的发病咖啡植株根系生长发育受阻、不发新根的结论基本一致。据此推测发病植株根际土中存在抑制咖啡根系发育物质,但具体是何种物质及其抑制机理还有待更进一步研究。
活性氧在植物体内参与多种生命过程,兼具有利和毒害的双重功能[25-26]。大量研究表明正常情况下细胞内的活性氧含量和抗氧化酶系的活性处于动态平衡。但遭遇逆境胁迫时,活性氧含量大量积累,打破与抗氧化酶系的平衡,导致细胞膜系统受损,表现出MDA含量增加、相对电导率升高[27-29]。本研究表明发病咖啡植株根际土壤中存在某种或者某些化学物质对咖啡幼苗根系造成了氧化胁迫,导致细胞膜系统受损。该研究结果与根系解剖观察到的结果一致,也与其他学者研究的胁迫导致细胞抗氧化酶活性增加,膜系统受损的结论一致。
4 结论
发病咖啡植株根际土壤水提液存在自毒物质,破坏咖啡幼苗根系结构、影响根系生长发育。随着水提液浓度的升高,咖啡幼苗根系受损逐渐加重,木质化程度、MDA含量和抗氧化酶活性逐渐增加,根系鲜重、干重,总根长,根体积和总根表面积显著下降。本研究结果为揭示咖啡连作障碍的形成提供了科学和试验依据。
[1] 付兴飞, 李贵平, 黄家雄, 程金焕, 吕玉兰, 李亚男, 武瑞瑞, 胡发广. 云南省3个咖啡产区小粒咖啡病虫害危害调查分析[J]. 热带农业科学, 2020, 40(3): 71-79.
FU X F, LI G P, HUANG J X, CHENG J H, LV Y L, LI Y N, WU R R, HU F G. Investigation and analysis on the diseases and insect pest of coffea arabica in three coffee producing areas of Yunnan province[J]. Chinese Journal of Tropical Crops, 2020, 40(3): 71-79. (in Chinese)
[2] 李 敏, 闫兴富, 马 丽, 马 璐, 时 榕. 酚酸类化感自毒物质对枸杞种子萌发的抑制作用[J]. 生态学报, 2020, 40(6): 2072-2079.
LI M, YAN X F, MA L, MA L, SHI R. Allelopathic inhibition of phenolic acids on germination of Wolfberry (Lycium barbarum Linn.) [J]. Acta Ecologica Sinica, 2020, 40(6): 2072-2079. (in Chinese)
[3] 卢 红, 李 明, 李龙明. 广藿香植株水提液的化感自毒作用[J]. 北方园艺, 2021(16): 108-115.
LU H, LI M, LI L M. Allelotoxic effect of aqueous extract solution from[J]. Northern Horticulture, 2021(16): 108-115. (in Chinese)
[4] 白 茹. 苹果连作障碍中自毒作用的研究[D]. 杨凌: 西北农林科技大学, 2009.
BAI R. Autointoxication in apple replant disease[D]. Yangling: Northwest A&F University, 2009. (in Chinese)
[5] 陆 茜. 杨树连栽对根际土壤环境演变的影响及其自毒效应研究[D]. 南京: 南京林业大学, 2016,
LU X. The study for autotoxicity of rhizosphere soil under successive monoculture poplar plantations[D]. Nanjing: Nanjing Forestry University. (in Chinese)
[6] 袁婷婷, 赵 骞, 董 艳. 阿魏酸胁迫下间作对蚕豆枯萎病发生和根系组织结构的影响[J]. 土壤学报, 2021, 58(4): 1060-1071.
YUAN T T, ZHAO Q, DONG Y. Effects of intercropping on fusarium wilt infection and root tissue structure under ferulic acid stress[J]. Acta Pedologica Sinica, 2021, 58(4): 1060-1071. (in Chinese)
[7] 车永梅, 孙艳君, 卢松冲, 侯丽霞, 范欣欣, 刘 新. AtMYB77促进NO合成参与调控干旱胁迫下拟南芥侧根发育[J]. 植物学报, 2021, 56(4): 404-413.
CHE Y G, SUN YJ, LU S C, HOU L X, FAN X X, LIU X. AtMYB77 involves in lateral root development via regulating nitric oxide biosynthesis under drought stress in[J]. Chinese Bulletin of Botany, 2021, 56(4): 404-413. (in Chinese)
[8] 陈艳芳. AM真菌与生物炭对连作梨园化感作用的效应研究[D]. 重庆: 西南大学, 2017.
CHEN Y F. Study on regulation of arbuscular mycorrhizal fungi and biochar on allelopathy in continuous cropping pear orchard[D]. Chongqing: Southwest University, 2017. (in Chinese)
[9] 董云萍, 林兴军, 黄丽芳, 孙 燕, 王晓阳, 闫 林. 咖啡种间嫁接苗生长特性研究[J]. 热带作物学报, 2013, 34(8): 1421-1425.
DONG Y P, LIN X J, HUANG L F, SUN Y, WANG X Y, YAN L. Coffee interspecific grafting seedling growt[J]. Chinese Journal of Tropical Crops, 2013, 34(8): 1421-1425. (in Chinese)
[10] 叶宝兴. 植物细胞与组织研究方法[M]. 北京: 化学工业出版社, 2011.
YE B X. Research methods of plant cells and tissues[M]. Beijing: Chemical Industry Press, 2011. (in Chinese)
[11] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
LI H S. Principles and techniques of plant physiological and biochemical experiments[M]. Beijing: Higher Education Press. 2000. (in Chinese)
[12] 叶素芬. 黄瓜根系自毒物质对其根系病害的助长作用及其缓解机制研究[D]. 杭州: 浙江大学, 2004.
YE S F. Research on promoting effect ofwilt inby cinnamic acid, an autotoxin in root exudates ofL., and mitigation mechanism by grafting and cinnamic acid-degrading microbial strains[D]. Hangzhou: Zhejiang University, 2004. (in Chinese)
[13] CABAL C, MARTÍNEZ-GARCÍA R, AGUILAR ABC, VALLADARES F, PACALA S W. The exploitative segregation of plant roots[J]. Science, 2020, 370(6521): 1197-1199. (in Chinese)
[14] 路旭平, 李芳兰, 马晓娟, 景盼盼, 罗成科, 田 蕾, 李培富. 不同碱敏感水稻品种根系对碱胁迫的生理响应策略[J]. 中国生态农业学报(中英文), 2021, 29(7): 1171-1184.
LU X P, LI F L, MA X J, JIN P P, LUO C K, TIAN L, LI P F. Physiological response strategies of roots of different alka-li-tolerant rice varieties to alkali stres[J]. Chinese Journal of Eco-Agriculture, 2021, 29(7): 1171-1184. (in Chinese)
[15] 张翠梅, 师尚礼, 吴 芳. 干旱胁迫对不同抗旱性苜蓿品种根系生长及生理特性影响[J]. 中国农业科学, 2018, 51(5): 868-882.
ZHANG C M, SHI S L, WU F. Effects of drought stress on root and physiological responses of different drought-tolerant alfalfa varieties[J]. Scientia Agricultura Sinica, 2018, 51(5): 868-882. (in Chinese)
[16] NIU K, MA X, LIANG G L. MA H L, JIA Z F, LIU W H, YU Q Q. 5-Aminolevulinic acid modulates antioxidant defense systems and mitigates drought-induced damage in Kentucky bluegrass seedlings[J]. Protoplasma, 2017, 254(6): 2083-2094. (in Chinese)
[17] 向 维. 三七根系分泌物的自毒作用及自毒物质研究[D]. 南宁: 广西大学, 2016.
XIANG W. Autotoxic inof root exudates and their allelochemicals[D]. Nanning: Guangxi University, 2016. (in Chinese)
[18] 李 勇, 王 梓, 龙期良, 高 原, 丁万隆. 人参幼根对苯甲酸胁迫的形态学响应及基因差异表达[J]. 中国现代中药, 2017, 19(7): 995-1000.
LI Y, WANG Z, LONG Q L, GAO Y, DING W L. Morphological response of Ginseng root to benzoic acid and differential genes expression analysis[J]. Modern Chinese Medicine, 2017, 19(7): 995-1000. (in Chinese)
[19] 王 丰, 王馨悦, 朱强龙, 杨有新, 王 强, 吴才君. 肉桂酸对豇豆根系毒害作用的研究[J]. 核农学报, 2020, 34(5): 1113-1118.
WANG F, WANG X Y, ZHU Q L, YANG Y X, WANG Q, WU C J. Effect of cinnamic acid of roots of cowpea (L.)[J]. Journal of Nuclear Agricultural Sciences, 2020, 34(5): 1113-1118. (in Chinese)
[20] 范林林, 高丽朴, 王 清, 左进华, 史君彦. 外源NO处理对豇豆采后生理特性的影响[J]. 食品与发酵工业, 2015, 41(10): 191-196.
FAN L L, GAO L P, WANG Q, ZUO J H. Research on the NO treatment on physiological characteristics of postharvest cowpe[J]. Food and Fermentation Industry, 2015, 41(10): 191-196. (in Chinese)
[21] 祁伟洋. 拟南芥类受体激酶TMKs对根尖发育的调控[D]. 兰州: 兰州大学, 2021.
QI W Y. Receptor-like kinase TMKs regulate the development of root tip in[D]. Lanzhou: Lanzhou University, 2021. (in Chinese)
[22] 车永梅, 孙艳君, 卢松冲, 赵方贵, 侯丽霞, 刘 新. AtWRKY40参与拟南芥干旱胁迫响应过程[J]. 植物生理学报, 2018, 54(3): 456-464.
CHE Y M, SUN Y J, LU S C , ZHAO F G, HOU L X, LIU X. AtWRKY40 functions in drought stress response in[J]. Acta Phytophysiologica Sinica, 2018, 54(3): 456-464. (in Chinese)
[23] 张 雨, 赵明洁, 张 蔚. 植物次生细胞壁生物合成的转录调控网络[J]. 植物学报, 2020, 55(3): 351-368.
ZHANG Y, ZHAO M J, ZHANG W. Transcriptional regulatory network of secondary cell wall biosynthesis in plants[J]. Chinese Bulletin of Botany, 2020, 55(3): 351-368. (in Chinese)
[24] AN J P, WANG X F, ZHANG X W, XU H F, HAO Y J. An apple MYB transcription factor regulates cold tolerance and anthocyanin accumulation and undergoes MIEL1-mediated degradation[J]. Plant Biotechnology Journal, 2019, 18: 337-353.
[25] 祁伟亮, 孙万仓, 马 骊. 活性氧参与调控植物生长发育和胁迫应激响应机理的研究进展[J]. 干旱地区农业研究, 2021, 39(3): 69-81, 193.
QI W L, SUN W C, MA L. Research progress of reactive oxygen species involved in regulating plant growth and development and the mechanisms of stress response[J]. Agricultural Research in the Arid Areas, 2021, 39(3): 69-81, 193. (in Chinese)
[26] 林植芳, 刘 楠. 活性氧调控植物生长发育的研究进展[J]. 植物学报, 2012, 47(1): 74-86.
LIN Z F, LIU N. Research progress on the regulation of plant growth and development by reactive oxygen species[J]. Chinese Bulletin of Botany, 2012, 47(1): 74-86. (in Chinese)
[27] 罗 宁, 魏 湜, 李 晶, 顾万荣, 贺 丹, 曲天明, 乔天长, 杨振芳. 低温胁迫对玉米苗期根系特征及电导率的影响[J]. 生态学杂志, 2014, 33(10): 2694-2699.
LUO N, WEI S, LI J, GU W R, HE D, QU T M, QIAO T C, YANG Z F. Effects of low-temperature stress on root system characteristics and electric conductivity of maize seedlings[J]. Chinese Journal of Ecology, 2014, 33(10): 2694-2699. (in Chinese)
[28] 刘建新, 刘瑞瑞, 刘秀丽, 贾海燕, 卜 婷, 李 娜. 不同时期喷施NaHS对盐碱胁迫下裸燕麦叶片渗透调节物质和抗氧化活性的影响[J]. 生态学杂志, 2021, 40(11): 3620-3632.
LIU J X, LIU R R, LIU X L, JIA H Y, PU T, LI N. Effects of spraying NaHS at different growth stages on osmotic adjustment substance and antioxidant activity in leaves of naked oat under saline-alkali stress[J]. Chinese Journal of Ecology, 2021, 40(11): 3620-3632. (in Chinese)
[29] 陈晓晶, 徐忠山, 赵宝平, 米俊珍, 严威凯, 刘景辉. 盐胁迫对燕麦根系呼吸代谢、抗氧化酶活性及产量的影响[J]. 生态学杂志, 2021, 40(9): 2773-2782.
CHEN X J, XU Z S, ZHAO B P, MI J Z, YAN W K, LIU J H. 2021. Effects of salt stress on root respiratory metabolism, antioxidant enzyme activities, and yield of oats[J]. Chinese Journal of Ecology, 2021, 40(9): 2773-2782. (in Chinese)
Effects of Aqueous Extracts from Continuous Cropping Rhizosphere Soil of Coffee on Development of Seedling Roots
TAN Jun1, WANG Rui2, LIN Xingjun1, SHI Zhonghai2, DONG Yunping1, ZHANG Ang1*
1. Spice and Beverage Research Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Genetic Resources Utilization of Spice and Beverage Crops, Ministry of Agriculture and Rural Affairs / Hainan Provincial Key Laboratory of Genetic Improvement and Quality Regulation for Tropical Spice and Beverage Crops, Wanning, Hainan 571533, China; 2. Tropical Crops College, Yunnan Agricultural University, Pu’er, Yunnan 665099, China
Coffee with rich nutritional value and high economic value is one of the three major beverages in the world, and is deeply welcome by consumers all over the world. Coffee is an important perennial cash crop in hot areas, and the long-term continuous cropping of which has produced serious continuous cropping obstacles, which has become a serious problem affecting the income of coffee farmers and restricting the sustainable development of the industry. Therefore, it needs to be solved urgently. In order to clarify the mechanism of coffee continuous cropping obstacle and provide scientific and experimental basis for overcoming it, the rhizosphere soil of diseased coffee plants was collected, and the indoor pot experiment was carried out to study the response of root growth and development of coffee seedlings to four concentrations of which water extracts (0, 0.50, 1.00 and 2.00 g/mL, recorded as CK, T1, T2and T3, respectively) in this study.The rhizosphere soil aqueous extracts of diseased coffee plants caused the epidermal cells of coffee seedlings to become smaller and arranged more closely. With the increase of its concentration, the root cell wall and intimal system were gradually destroyed and formed a cavity. The lignification degree of primary xylem cells increased gradually as well. Root fresh weight, dry weight, total root length, root volume, root tip number, total root surface area and root activity decreased with the rhizosphere soil aqueous extracts of diseased coffee plants. Compared with CK, those from T2decreased to a significant different level (0.05), and those from T3decreased to a very significant different level (0.01). The lignin content and relative conductivity of roots increased gradually with the rhizosphere soil aqueous extracts. Compared with CK, the lignin content of T1increased by 29.53%, reaching a significant different level, and the lignin of T2and T3increased by 42.38% and 66.52% respectively, reaching a very significant different level. The root relative conductivity of T2and T3increased by 34.40% and 58.30%, respectively. With the aqueous extracts concentration rising up, the soluble protein content of roots increased, 61.75% higher of T2than that of CK. Although subsequently the amount decreased, but which was significantly different according to the data recorded before. MDA content, and the activities of SOD, POD and CAT increased with the increase of the aqueous extracts concentration. Compared with CK, the activity of SOD in T3increased by 56.77%, reaching a significant different level, POD activity increased by 96.28%, reaching a very significant different level. In conclusion, there are autotoxic substances in the aqueous extract of rhizosphere soil of diseased coffee plants, which destroy the root structure of coffee seedlings and affect the growth and development of roots.
coffee; root; monocropping; rhizosphere soil; autotoxicity
S571.3;S-3
A
10.3969/j.issn.1000-2561.2022.11.013
2022-02-16;
2022-03-31
国家自然科学基金项目(No. 31901469);海南省自然科学基金项目(No. 320QN345);中央级公益性科研院所基本科研业务费专项(No. 1630142020006)。
谭 军(1985—),男,博士,助理研究员,研究方向:作物栽培。*通信作者(Corresponding author):张 昂(ZHANG Ang),E-mail: angzhang_henu@163.com。
