荔枝P型ATP酶基因家族鉴定及其在采后贮藏过程中响应拮抗菌N-1的表达模式分析
2022-12-16邵远志
王 鑫,邵远志,汤 月,李 雯*
荔枝P型ATP酶基因家族鉴定及其在采后贮藏过程中响应拮抗菌N-1的表达模式分析
王 鑫1,邵远志2,汤 月2,李 雯1*
1. 海南大学园艺学院海南省热带园艺作物品质调控重点实验室,海南海口 570228;2. 海南大学生命科学学院,海南海口 570228
P型ATP酶是植物体内一种重要的膜转运蛋白,在果实能量代谢和酸代谢中发挥重要作用,并广泛参与植物离子运输、抗逆、细胞信号转导等各项生命活动,然而在荔枝或其他无患子科植物中尚未对P型ATP酶基因家族进行全面分析,本研究基于‘妃子笑’荔枝转录组数据,通过对这些基因进行生理生化分析、生物信息学分析和表达分析,共鉴定了28个P型ATP酶基因家族成员基因,探讨P型ATP酶在荔枝采后贮藏过程中的潜在功能。结构和系统发育分析表明该基因可以分为5个亚家族,同一亚族的基因在基因结构和motif基序方面具有很大的相似性,其蛋白二级结构主要以α-螺旋为主,亚细胞定位预测分析发现LcPAs多定位于线粒体(21/28)。通过转录组分析,在采后贮藏期间,荔枝P型ATP酶家族基因中上调表达的基因明显高于下调表达基因,暗示其可能在荔枝采后品质劣变过程中发挥着积极的抵御作用。使用拮抗菌N-1处理荔枝可以有效抑制其果实采后褐变和病害的发生,结合RT-qPCR结果,发现拮抗菌N-1处理能诱导和在整个贮藏过程中的上调表达,并维持了较高的ATP酶活性,进一步说明P型ATP酶家族基因在抑制荔枝病变过程中发挥着重要作用。本研究为了解荔枝P型ATP酶基因家族基因的进化和功能分析提供了参考,为深入了解拮抗菌N-1保鲜机理的分子调控机理提供新的证据。
荔枝;P型ATP酶基因家族;转录组;拮抗菌N-1
P型ATP酶是在植物整个生命过程中都发挥重要作用的膜转运蛋白,参与广泛的细胞基本代谢过程。迄今为止,在阐明P型ATP酶的结构、功能和调控特性方面都取得了极大的进展。植物P型ATP酶在结构上有一个亚基,8~12个跨膜(TM)片段,N端和C端暴露于细胞质,以及一个大型的中央细胞质的结构域,其上包含磷酸化和ATP结合位点,P型ATP酶最重要的一个特征是形成一个磷酸化的中间产物,因此被命名为P型,P型泵的复杂性也反映了P型ATP酶的多样性和这些转运体具有离子特异性[1]。目前已经从拟南芥全基因组序列中鉴定出45个编码P型ATP酶的基因[2],从向日葵基因组中鉴定出13个P型H+-ATP酶基因家族成员[3],从陆地棉中鉴定出98个P型ATP酶家族基因[4],从大豆基因组中鉴定了105个P型ATP酶基因[5],从水稻中鉴定出43个P型ATP酶基因家族成员等,通过蛋白序列和系统发育比较,一个共同的被子植物祖先拥有至少23个P型ATP酶基因家族成员的集合[6],说明它普遍存在于各种生物中,并广泛参与植物离子运输、抗逆性、细胞信号转导等各项生命活动。近年来大量研究表明P型ATP酶和植物的酸代谢密切相关,从矮牵牛的遗传分析中发现2种P型ATP酶PH1和PH5,这2种酶通过改变花瓣细胞液泡酸度从而改变花的颜色[7],通过进一步研究发现,这2个基因在柑橘类水果的酸调控中发挥重要作用[8]。此外,P型ATP酶还参与细胞内PH稳态的调控,为植物多胺(plant polyamines)PA前体向液泡运输提供动力[9],并在大豆盐、干旱、寒冷、磷酸盐饥饿等胁迫下被显著诱导或抑制[5],在水稻和拟南芥的非生物胁迫中发挥重要作用[10]。
生防治作为一种安全健康的应对果蔬保鲜问题的新途径,是最有希望替代传统化学保鲜剂的一种保鲜方法,其中拮抗菌生物防治具有安全、绿色和环保的优点,成为荔枝采后保鲜技术研究的热点[11-12]。然而拮抗菌作为保鲜剂的作用机理十分复杂,目前可以确定的是果实能量代谢在其中起到了十分重要的作用。提高果实的能荷水平可以减缓桃[13]、梨[14]和枇杷[15]等果实病害的发生,陈梦茵[16]研究发现外源ATP处理能提高Ca2+-ATPase和H+-ATPase酶活性,维持果实较高的ATP含量,保护细胞膜结构,维持细胞的抗氧化系统,使龙眼果实免受病菌带来的伤害。因此,研究P型ATP酶基因家族,筛选出该家族中可能响应拮抗菌作用信号的关键基因,可能有助于探明拮抗菌保鲜剂的作用机理,提高采后荔枝的果实品质。
1 材料与方法
1.1 材料
供试荔枝品种为‘妃子笑’,采摘于海南省澄迈县荔枝种植园。剔除病果、机械损伤果,留0.5 cm左右果柄、大小均一的荔枝果实为材料。将挑选后的荔枝均匀分为2组,一组于108CFU/mL拮抗菌N-1悬液中浸泡20 min,另一组用清水浸泡相同时间用作对照,随后晾干。每30个果实装一框,用80 cm×120 cm的保鲜膜轻裹,放置于25℃的智能人工气候(RH:85%~90%)中贮藏,每2 d取样一次。取30个果实用于观察,并测定好果率和荔枝果皮的ATP酶活性[16],果皮使用液氮研磨,并使用天根RNA提取试剂盒(多糖多酚植物总RNA提取试剂盒DP441)提取荔枝果实总RNA,使用逆转录试剂盒(MonScriptTM RTIII All-in-One Mix With dsDNase)将RNA逆转录成cDNA保存备用。
暹罗拮抗菌N-1从自然感病的热带水果中分离,随后保存在–80℃环境中,该拮抗菌在之前的实验中已经得到鉴定[17]。在使用之前,N-1拮抗菌在28℃条件下于PDA培养基中培养2 d,随后转移到NA培养基中培养36 h,最后稀释拮抗菌悬浮液浓度为108CFU/mL,备用。
1.2 方法
1.2.1 荔枝P型ATP酶家族基因的收集与鉴定 利用Pfam数据库(http://pfam.xfam.org/)获取P型ATP酶家族基因的结构域(PF00690、PF00122、PF13246)的比对文件构建隐马尔可夫模型(HMM)文件。然后,利用TB-tools软件对荔枝蛋白数据库进行HMM搜索。此外,所有P型ATP酶蛋白序列均通过SMART(http://smart.emblhe- idelberg.de/)和NCBI(http://www.ncbi.nlm.n-ih. gov/cdd/)手动筛选结构域,并去除缺乏P型ATP酶结构域的蛋白序列[18]。
1.2.2 系统进化树分析 利用MEGA-X软件对荔枝、苹果、猕猴桃、拟南芥、巴旦木、辣椒和蒺藜苜蓿共7个不同种属物种的P型ATP酶基因家族全长蛋白序列进行比对,对比结果在Jalview软件中进行美化分析,再使用MEGA-X软件绘制进化树,并通过FigTree软件进行美化[19]。
1.2.3 保守基序和理化性质分析 利用MEME (http://memesuite.org/t-ools/-meme)网站对荔枝P型ATP酶家族基因进行motif分析,共设置15个motif,其他参数为默认设置,随后利用ExPAsy(http://web.expasy.org/com-pute_pi/)在线软件预测P型ATP酶基因家族成员蛋白理化性质信息,包括氨基酸数、分子量、等电点、总平均疏水指数;通过Plant-mPLoc(http://www.csbio.sjtu.edu. cn/bioinf/-plant-multi/)在线软件预测该基因家族蛋白的亚细胞定位,并利用GOV IV(http://npsa prabi.-ibcp.fr)在线软件预测蛋白二级结构[20]。
1.2.4 基于转录组的荔枝P型ATP酶家族基因表达分析 使用荔枝转录组(FPKM)值表示在各P型ATP酶家族基因的表达量,并用TBtools软件绘制热图和维恩图显示该家族基因在荔枝贮藏过程中的表达水平。其中热图依据转录组数据FPKM值作图,以分析荔枝贮藏前期(0、2d)和后期(6、8d)基因表达差异;维恩图中差异基因筛选均以0 d为作为参照,以转录组数据-value和log2(FC)值为依据筛选差异基因。
1.2.5 实时荧光定量PCR分析 根据荔枝P型ATP酶家族基因的ORF序列,在网站(https:// primer3.ut.ee/)上设计引物序列,并在DNAMAN软件上验证引物的可靠性,设计好的引物交由中美泰和生物技术有限公司合成。使用Mona公司试剂盒(MonAmpTM ChemoHS qPCR Mix)进行RT-qPCR扩增,荔枝P型ATP酶家族基因的相对表达水平采用2–DDCT法进行标准化分析[21],并用GraphPad Prism 8软件构建基因表达柱状图。
1.3 数据处理
数据采用SAS软件进行统计分析。
2 结果与分析
2.1 对荔枝P型ATP酶基因家族的鉴定
通过对荔枝转录组数据进行筛选,并结合在线工具SMART(http://smart.emb-lheidelberg.de/)和NCBI(http://www.ncb-i.nlm.nih.gov/cdd/)的结构域分析,共鉴定出28个P型ATP酶基因家族成员,并对所有的家族成员进行系统编号,将其命名为~。
荔枝28个P型ATP酶基因家族成员的氨基酸长度范围在203(LcPA28)~1061(LcPA25)之间不等,相对分子质量范围为50 926.22~ 259 788.49 Da,等电点范围为4.75~5.14,所有蛋白均为疏水性蛋白,脂肪系数范围为17.29~ 29.66,α-螺旋占比最大。亚细胞定位预测发现荔枝大多数P型ATP酶家族基因定位于线粒体(21/28),其次定位于细胞膜(5/28)、叶绿体(LcPA15)和细胞质(LcPA22)中(表1)。
2.2 系统进化树分析
通过聚类分析,将荔枝中28个LcPA蛋白分成5个亚组,Group Ⅱ、Group Ⅲ和Group Ⅴ均有3个成员,分别为、和,、和,、和,Group Ⅳ仅有1个成员,其余18个成员均属于Group I(图1)。
2.3 荔枝P型ATP酶基因家族结构分析
利用MEME分析了荔枝P型ATP酶基因家族蛋白序列的15个保守motifs(图2),这些基序的氨基酸组成如表2所示。本研究发现,所有LcPA蛋白均含有motif 2,表明其在荔枝P型ATP酶基因家族中高度保守,此外,高度保守的motif 4同样存在于除外的所有LcPA蛋白中。在所有15个motif基序中,值从高到低排在前6的依次是motif 1、motif 4、motif 5、motif 7、motif 6、motif 2,均位于N末端结构域。
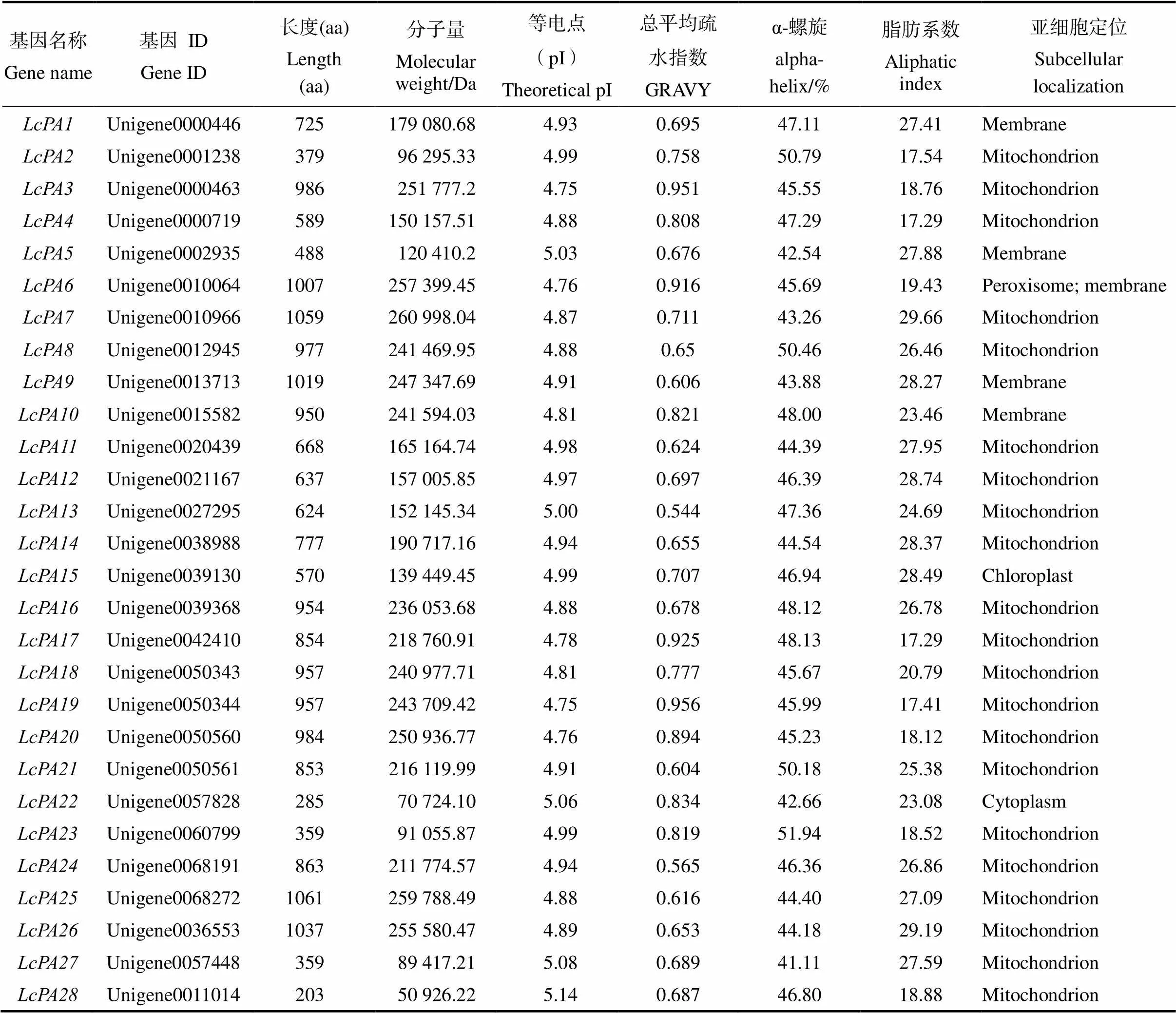
表1 荔枝P型ATP酶基因家族成员信息

图1 P型ATP酶基因家族系统进化树分析
2.4 荔枝P型ATP酶家族基因采后贮藏过程中的表达分析
根据荔枝P型ATP酶家族基因在荔枝采后贮藏过程中的表达水平绘制成热图(图3A)和维恩图(图3B)。结果表明,在整个贮藏过程中出现明显上调或下调表达的基因占到64.3%,且贮藏后期差异表达的基因数量明显高于前期,上调表达基因的数量显著高于下调表达基因。上调表达基因的大量富集暗示着该基因家族基因可能在‘妃子笑’荔枝品质劣变过程中起到积极的抵御作用。
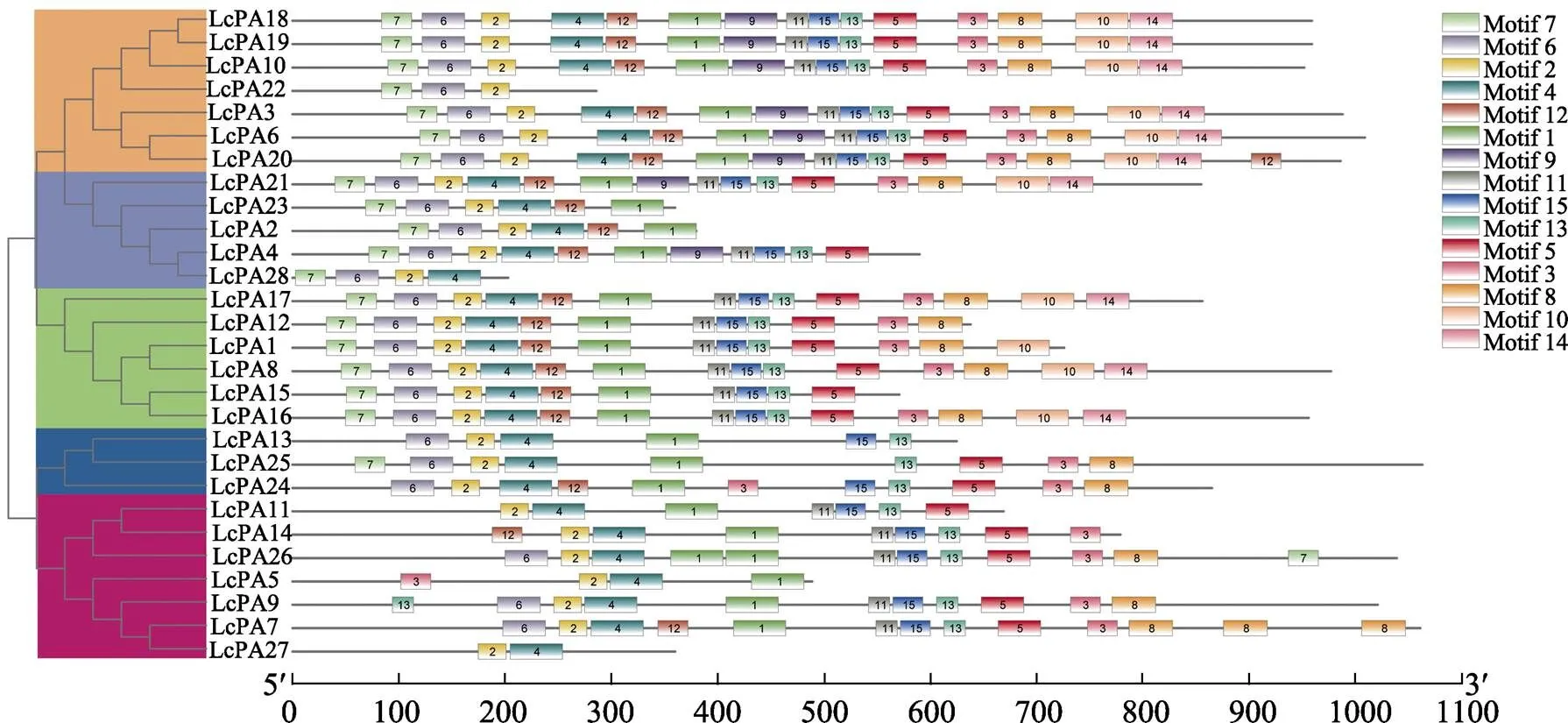
图2 荔枝P型ATP酶基因家族motif分布

表2 荔枝P型ATP酶基因家族结构域序列标识

图3 荔枝P型ATP酶基因家族的表达分析
2.5 拮抗菌N-1处理下果实外观,好果率和ATP酶活性变化
随着贮藏时间的增加,果实的好果率呈现明显的下降趋势,但在整个贮藏过程中,拮抗菌处理后的荔枝果实的好果率始终高于对照果实(图4A,图4B),从图4A中可以看出,处理组荔枝果实的外观,褐变及病变情况均好于对照组,说明拮抗菌N-1处理可以有效的抑制荔枝果实的褐变和病变。结合图4C可知,拮抗菌处理的荔枝果实ATP酶活性在整个贮藏过程中显著高于对照果实,说明拮抗菌可能通过提高ATP酶活性维持荔枝的高能荷状态,增强荔枝的抗病性,减少荔枝营养物质的损失,最终达到延缓荔枝果实衰老腐败的目的。
2.6 部分LcPA家族基因在拮抗菌N-1处理下的表达
从LcPA基因家族在采后贮藏过程中的表达分析中初步筛选出在‘妃子笑’荔枝贮藏过程中可能起到关键作用的家族基因,并对这些基因在拮抗菌N-1处理后的表达情况进行实时荧光定量PCR分析(图5)。结果表明,拮抗菌N-1显著诱导了基因和在整个贮藏过程中的上调表达,诱导基因、在荔枝贮藏第2天上调表达,并诱导基因、和在贮藏后期的上调表达,总体而言,拮抗菌N-1处理能诱导荔枝P型ATP酶基因家族基因的上调表达,这与ATP酶活性的变化一致。以上结果说明,荔枝LcPA家族基因在拮抗菌N-1抑制荔枝病变的过程中发挥着积极的作用,且响应外源刺激信号的时期和作用也有所不同。

图4 拮抗菌N-1处理下果实好果率和ATP酶活性变化

图5 荔枝P型ATP酶基因家族成员在拮抗菌处理下的表达
3 讨论
3.1 荔枝P型ATP酶家族基因的鉴定与结构分析
采后果实是一个鲜活的有机体,时刻进行着各种代谢活动,P型ATP酶基因家族在果实的能量代谢、酸代谢、胁迫信号转导、逆境响应等过程中发挥着重要的作用,目前已在苹果[22]、柑橘[23-24]和梨[25]等多个物种中得到鉴定和研究。在本研究中,基于‘妃子笑’荔枝的转录组数据,共鉴定出28个荔枝P型ATP酶家族家族基因,并划分为5个亚族,说明该家族在进化上可能存在5个分支,这在拟南芥P型ATP酶基因家族的鉴定上也得到了验证[1],这28个家族基因对应蛋白的等电点、总平均疏水指数、α-螺旋和脂肪系数在荔枝中高度一致,表明该家族成员在进化上比较保守,在motif的分布模式中,值高的motif基序基本分布于N-末端结构域,说明N-末端结构域比C-末端结构域更加保守。荔枝P型ATP酶基因家族的亚细胞定位预测大多位于线粒体,而线粒体能够参与植物细胞内的诸多过程,如呼吸作用、产热、抗逆机制、程序性细胞死亡和基因组进化等[26],另外还有少量基因定位于叶绿体、细胞膜和细胞质中,说明该基因家族不仅在能量代谢过程中发挥重要作用,还在植物的各种生理活动中发挥作用,也说明了该基因家族功能的多样性。
3.2 P型ATP酶家族基因在采后荔枝贮藏保鲜过程中发挥重要作用
ATP酶作为能量代谢的关键酶,贯穿于细胞的整个生命过程。采后果实由于脱离了母体,切断了能量供应,其贮藏的能量又被不断消耗,已有诸多研究证实,果实的能量亏损越严重,品质劣变程度越严重,其衰老和死亡的速度和进程越快[27]。高兆银等[28]研究发现外源ATP处理可提高荔枝贮藏前期ATP合成酶基因表达量,保持荔枝果实的能量供应,显著延缓荔枝果实的成熟衰老,这与本研究中拮抗菌处理诱导基因、和在荔枝贮藏第2天上调表达的结果相似,说明这些基因可能是最先响应拮抗菌处理触发的信号。基因和则在整个贮藏过程中均被拮抗菌显著诱导高表达,这些基因均定位于线粒体,研究表明,线粒体ATP合成酶是细胞功能的关键枢纽,控制着ATP的产生和细胞信号传导,它受ATP酶抑制因子1(IF1)的调节,从而控制线粒体功能和线粒体活性氧的产生[29],这在生理水平上也得到了验证,解偶连剂DNP可加剧活性氧的积累,降低能荷水平从而加速草莓衰老[30]。在拮抗菌的诱导下,荔枝线粒体ATP酶基因上调表达,荔枝ATP酶活性升高,其保护机制可能也是通过抑制线粒体活性氧的产生,进而保护细胞膜结构,最终抑制了荔枝果实品质劣变,而基因基因和可能是维持荔枝高能荷状态、抑制荔枝果实品质劣变的关键基因。ATP除了作为能量货币的功能外,还起着胞外信号分子的作用,当果实ATP含量过低时,会产生反馈调节[31],基因、和在荔枝贮藏后期的上调表达说明其可能是ATP反馈调节的响应基因。本研究表明以上几个基因在荔枝采后贮藏保鲜过程中发挥着重要作用,可作为后续的研究重点,进行基因功能的验证。
[1] KUHLBRANDT W. Biology, structure and mechanism of P-type ATPases[J]. Nature Reviews Molecular Cell Biology, 2004, 5(4): 282-295.
[2] XKRISTIAN B. A, MICHAEL G. P. Inventory of the superfamily of P-type ion pumps in[J]. Plant Physiology, 2001, 126(2): 696-706.
[3] XU Z C, MAROWA P, LIU H, DU H N, ZHANG C S, LI Y Q. Genome-wide identification and analysis of P-type plasma membrane H+-ATPase sub-gene family in sunflower and the role ofandin the development of salt stress resistance[J]. Genes, 2020, 11(4): 361.
[4] CHEN W, SI G Y, ZHAO G, ABDULLA H M, GUO N, LI D H, SUN X, CAI Y P, LIN Y, GAO J S. Genomic comparison of the P-ATPase gene family in four cotton species and their expression patterns in[J]. Molecules, 2018, 23(5): 1092.
[5] ZHAO B Q, WU H C, XU W J, ZHANG W, CHEN X, ZHU Y Y, CHEN H T, ZENG H. Q. Genome-wide identification, characterization, and expression analyses of P-Type ATPase superfamily genes in soybean[J]. Agronomy, 2020, 11(1): 543.
[6] IVAN B, JASON T, MICHAEL R, MARC B, MICHAEL G. P, MICHAEL G, JEFFREY F. H, N KRISTIAN B. Genomic comparison of P-type ATPase ion pumps in arabidopsis and rice[J]. Plant Physiology, 2003, 132(2): 618-628.
[7] LI Y B, PROVENZANO S, BLIEK M, SPELT C, APPE- LHAGEN I, MACHADOL, VERWEIJ W, SCHUBERT A, SAGASSER M, SEIDEL T, WEISSHAAR B, KOES R, QUATTROCCHIO F. Evolution of tonoplast P‐ATP are transporters involved in vacuolar acidification[J]. New Phytologist, 2016, 211(3): 761-764.
[8] STRAZZER P, CORNELIS E. S, LI S J, BLIEK M, CLAIRE T. F, MIKEAL L. R, KOES R, FRANCESCA M. Q. Hyperacidification of citrus fruits by a vacuolar proton-pumping P-ATPase complex[J]. Nature Communications, 2019, 10(1): 744.
[9] APPELHAGEN I, NORDHOLT N, SEIDEL T, SPELT K, KOES R, QUATTROCHIO F, SAGASSER M, WEISSHAAR B. TRANSPARENT TESTA 13 is a tonoplast P3A-ATP ase required for vacuolar deposition of proantho cyanidins inseeds[J]. The Plant Journal, 2015, 82(5): 840-849.
[10] HUDA K M K , YADAV S , BANU M S A , TUTEJA T N. Genome wide analysis of P-Type-II Ca2+ATPases gene family from rice and arabid-opsis: potential role in abiotic stresses[J]. Plant Physiology and Biochemistry, 2013, 65: 32-47.
[11] TianZ h,Li Y Y, Qian L P,D Y j,ChenC w,Chao a L. Antifungal activities and the mechanisms of biocontrol agent WE-3 against postharvest sour rot in citrus[J]. European Journal of Plant Pathology,2021,161(3): 723-733.
[12] SIVAKUMAR D, ZEEMAN K, KORSTEN L. Effect of a biocontrol agent () and modified atmosphere packaging on postharvest decay control and quality retention of litchi during storage[J]. Phytoparasitica, 2007, 35(5): 507-518.
[13] 张正敏, 杨艺琳, 李美琳, 王 静, 季娜娜, 郑永华. 2,4-表油菜素内酯处理对桃果实软腐病及能量代谢的影响[J]. 食品科学, 2019, 40(5): 207-213.
ZHANG Z M, YANG Y L, LI M L, WANG J, JI N N, ZHENG Y H. Effect of 2,4-epibrass-inolide treatment on rhizopus rot and energy metabolism in postharvest peach fruit[J]. Food Science, 2019, 40(5): 207-213. (in Chinese)
[14] CAO G, Y H, WEI M L, LI C Y, CHEN Y R, LV J Y, LI J R. Effect of acibenzolar-S-methyl on energy metabolism and blue mould of Nanguo pear fruit[J]. Scientia Horticulturae, 2017, 225: 221-225.
[15] CAO S F, CAI Y T, YANG Z F, JOYCE D C, ZHENG Y H. Effect of MeJA treatment on polyamine, energy status and anthracnose rot of loquat fruit[J]. Food Chemistry, 2014, 145: 86-89.
[16] 陈梦茵. DNP和ATP调控Chi侵染所致龙眼果实采后病害发生的机理研究[D]. 福州: 福建农林大学, 2015: 16-20.
CHEN M Y. Study on the mechanism of DNP and ATP regulation the disease development of harvested longan fruit infected byChi[D]. Fuzhou: Fujian Agriculture and Forestry University, 2015: 16-20. (in Chinese)
[17] YOU W, GE C, JIANG Z, CHEN M, SHAO Y. Screening of a broad-spectrum antagonist-, and its possible mechanisms to control postharvest disease in tropical fruits[J]. Biological Control, 2021, 157(11): 104584.
[18] 刘志鑫, 孙 宇, 叶 子, 罗睿雄, 李 忠, 蒲金基, 张 贺. 芒果VOZ转录因子基因家族成员鉴定及生物信息学分析[J]. 南方农业学报, 2021, 52(7): 1762-1770.
LIU Z X, SUN Y, YE Z, LUO R X, LI Z, PU J J, ZHANG H. Identification and bioinformatics analysis of VOZ transcription factor gene family members in[J]. Journal of Southern Agriculture, 2021, 52(7): 1762-1770. (in Chinese)
[19] 林 欢, 段伟科, 周 怡, 祝梦全, 王云鹏, 孙 敏, 黄志楠. 辣椒CDPK基因家族的鉴定、进化与表达分析[J]. 核农学报, 2021, 35(1): 7-17.
LIN H, DUAN W K, ZHOU Y, ZHU M Q, WANG Y P, SUN M, HUANG Z N. Identification, evolution and expression analysis of the CDPK gene family in pepper[J]. Journal of Nuclear Agricultural Sciences, 2021, 35(1): 7-17. (in Chinese)
[20] 邵正伟, 曾志鹏, 陈彦竹, 何敏红, 张 毅, 陈善兰, 朱宏波.甘薯全基因组SBP-box基因家族鉴定及表达分析[J]. 分子植物育种, 2021, 5: 1-20.
SHAO Z W, ZENG Z P, CHEN Y Z, HE M H, ZHANG Y, CHEN S L, ZHU H B. Genome-wide identification and expression analysis of S-BP-box gene family in sweet potato[J]. Molecular Plant Breeding, 2021, 5: 1-20. (in Chinese)
[21] 黄金凤, 吕天星, 王 寻, 王颖达, 王冬梅, 闫忠业, 刘 志. 苹果LRR-RLK基因家族鉴定和表达分析[J]. 中国农业科学, 2021, 54(14): 3097-3112.
HUANG J F, LV T X, WANG X, WANG Y D, WANG D M, YAN Z Y, LIU Z. Genome-wide identification and expression analysis of LRR-RLK gene family in apple[J]. Agricultural Sciences in China, 2021, 54(14): 3097-3112. (in Chinese)
[22] 陈厚彬, 苏钻贤. 2021年全国荔枝生产形势分析[J]. 中国热带农业, 2021(2): 5-18.
CHEN H B, SU Z X. Analysis of national litchi production situation in 2021[J]. Chinese Tropical Agriculture, 2021(2): 5-18. (in Chinese)
[23] SHI C Y, SONG R Q, HU X M, LIU X, JIN L F. LIU Y Z. Citrus PH5-like H+-ATPase genes: identification and transcript analysis to investigate their possible relationship with citrate accumulation in fruits[J]. Frontiers in Plant Science, 2015, 6: 135.
[24] SHI C Y, HU S B, HAN H, SM ALAM, LIU D, LIU Y Z. Reduced expression of, a P-type ATPase gene, is the major factor leading to the low citrate accumulation in citrus leaves-science direct[J]. Plant Physiology and Biochemistry, 2021, 160: 211-217.
[25] ZHANG Y X, LI Q H, XU L L, QIAO X, LIU C X, ZHANG S L. Comparative analysis of the P-type ATPase gene family in seven Rosaceae species and an expression analysis in pear (Rehd.)[J]. Genomics, 2020, 112(3): 2550-2563.
[26] IANM M, ALLAN G R, OLIVIER V A. Plant mitochondria -past, present and future[J]. The Plant journal, 2021, 108(4): 912-959.
[27] 王 鑫, 李 雯. 果实能量代谢与采后品质关系的研究进展[J]. 分子植物育种, 2021, 11: 1-13
WANG X, LI W. Research progress on the relationship between fruit energy metabolism and quality deterioration on fruit[J]. Molecular Plant Breeding, 2021, 11: 1-13. (in Chinese)
[28] 高兆银, 胡美姣, 赵 超, 张正科, 李 敏, 李焕苓, 王 果, 孙进华, 文 婕, 王家保. 荔枝能荷水平及能量相关基因表达与采后褐变关系的研究[J]. 园艺学报, 2018, 45(1): 51-60.
GAO Z Y, HU M J, ZHAO C, ZHANG Z K, LI M, LI H L, WANG G, SUN J H, WEN J, WANG J B. Effects of energy charge levels and ex-pression of energy charge genes on browning of post-harvest litchi fruit[J]. Acta Horticulturae Sinica, 2018, 45(1): 51-60. (in Chinese)
[29] 梁 爽, 刘 欢, 李巧玲, 白 杨, 闫宇彤, 郭金丽. 能量调控对草莓果实采后衰老过程中活性氧及保护酶的影响[J].安徽农业大学学报, 2016, 43(5): 810-814.
LIANG S, LIU H, LI Q L, BAI Y, YAN Y T, GUO J L. Effects of energy regulating on reactive oxygen and protective enzyme activity in ageing process of strawberry fruit[J]. Journal of Anhui Agricultural Sciences, 2016, 43(5): 810-814. (in Chinese)
[30] ESPARZA M P B, ROMERO C I, NÚÑEZ D A C, PEREIRA M P, BLANCO N, PARDO B, BATES G, SÁNCHEZ C C, ARTUCH R, MURPHY M, ESTEBAN J, CUEZVA J. Generation of mitochondrial reactive oxygen species is controlled by ATPase inhibitory factor 1 and regulates cognition[J]. PLoS biology, 2021, 19(5): e3001252.
[31] MORTEZA S A, ABBASALI J, ZISHENG L, GOPINADHAN P. Ensuring sufficient intracellular ATP supplying and friendly extracellular ATP signaling attenuates stresses, delays senescence and maintains quality in horticultural crops during postharvest life[J]. Trends in Food Science & Technology, 2018, 76: 67-81.
Identification of P-type ATPase Gene Family and Analysis of Expression Pattern in Response to Antagonistic N-1 During Postharvest Storage in Litchi
WANG Xin1, SHAO Yuanzhi2, TANG Yue2, LI Wen1*
1. Key Laboratory for Quality Regulation of Tropical Horticultural Crops of Hainan Province, School of Horticulture, Hainan University, Haikou, Hainan 570228, China; 2. School of Life Sciences, Hainan University, Haikou, Hainan 570228, China
P-type ATPase is an important membrane transporter in plants. It plays a significant role in plant energy metabolism and acid metabolism. In addition, the enzyme is widely involved in plant ion transport, stress resistance, cell signal transduction and other life activities. However, p-type ATPase gene family has not been comprehensively analyzed in litchi or other sapindaceae plants. In this study, based on the transcriptome data of ‘Feizixiao’ litchi, 28 p-type ATPase genes were identified through physiological and biochemical analysis, bioinformatics analysis and expression analysis, to explore the potential function of P-type ATPase during postharvest storage of litchi. The structure and phylogenetic analysis showed that the gene could be divided into 5 subfamilies, the genes in the same subfamily had similar gene structure and motifs. The secondary structure of protein was mainly consisted of α -helix, and the N-terminal domain of LcPAs was more conserved than the C-terminal domain. Subcellular localization prediction analysis showed that LcPAs were mostly located in mitochondria (21/28). According to transcriptome analysis, the up-regulated genes of P type ATPase family genes in litchi were significantly higher than the down-regulated genes during postharst storage, which suggesting that they may play a positive role in the resistance of quality deterioration of litchi after harvest. As a safe and healthy preservation technology, the mechanism of antagonistic biological control is very complex. Results showed that the antagonistic N-1 treatment could effectively inhibit the browning and disease occurrence of litchi fruits after harvest. Combined with RT-qPCR results, it was found that antagonistic N-1 treatment could induce up-regulated expression of,,andduring the whole storage process, which further indicating that P-type ATPase family genes would play an important role in the antagonistic N-1 inhibition of litchi lesions. This study would provide a reference for understanding the evolution and biological function analysis of p-type ATPase gene family in litchi, it also provide new evidence for further understanding the molecular regulation mechanism of antagonistic N-1 preservation mechanism.
litchi; p-type ATPase gene family; transcriptome; antagonist N-1
S667.1
A
10.3969/j.issn.1000-2561.2022.11.021
2022-02-25;
2022-04-04
海南省自然科学基金创新研究团队项目(No. 320CXTD430);海南省研究生创新科研课题(No. Qhys2021-244)。
王 鑫(1994—),男,硕士研究生,研究方向:荔枝采后贮藏保鲜。*通信作者(Corresponding author):李 雯(LI Wen),E-mail:liwen9-210@163.com。
