广西百色市芒果树根际土壤丛枝菌根真菌资源初探
2022-12-16江尚焘彭海英高日芳张金莲李冬萍董彩霞陈廷速
栗 晗,江尚焘,彭海英,高日芳,张金莲*,李冬萍,姜 柔,董彩霞,陈廷速*
广西百色市芒果树根际土壤丛枝菌根真菌资源初探
栗 晗1,江尚焘1,彭海英1,高日芳2,张金莲2*,李冬萍2,姜 柔1,董彩霞1,陈廷速2*
1. 南京农业大学资源与环境科学学院/江苏省固体有机废弃物资源化高技术研究重点实验室/江苏省有机固体废弃物协同创新中心/教育部资源节约型肥料工程技术研究中心,江苏南京 210095;2. 广西农业科学院微生物研究所,广西南宁 530007
为探明广西百色市芒果根际土壤丛枝菌根(arbuscular mycorrhizal, AM)真菌的分布情况,本研究对广西芒果主产区的芒果根际土壤及根系样本进行AM真菌分离,并比较不同施肥制度下芒果根际土壤的AM真菌种类和根系菌根侵染情况。采集5个主施有机肥的芒果园(OT)和5个主施化肥的芒果园(CT)根际土壤,采用湿筛倾析法分离土壤中的AM真菌孢子,通过富集和诱导培养纯化其中的AM真菌,进行分子和形态鉴定。采用墨水醋染色法对根系样本进行染色及内生真菌侵染率的测定。共分离出6种AM真菌,OT处理分离出无梗囊霉属(sp)1种,近明球囊霉属(sp)1种,类球囊霉属(sp.)1种;CT处理分离出无梗囊霉属2种,近明球囊霉属1种。2种施肥制度分离出的AM真菌种类较少,且分离出的AM真菌种类均较常见,并无特有种。根系染色发现,OT处理菌丝分布较多,AM真菌结构丰富,可明显观察到丛枝和泡囊结构,还发现有少量的深色有隔真菌(dark septate endophytes, DSE);CT处理的菌丝相对较少,泡囊结构和丛枝也较少,DSE相对较多。方差分析结果显示,施肥类型、芒果品种和树龄对AM真菌的根外菌丝、泡囊结构以及孢子密度均有不同程度的影响,其中施用有机肥较化肥对AM真菌的根外菌丝和泡囊结构均有显著的促进作用。综上,本研究筛选所得菌种丰富了我国AM真菌菌种库,并为筛选果树高效AM真菌菌剂奠定物质基础,也为果园管理提供了新方向。
芒果;根际;土壤;丛枝菌根真菌
芒果是一种常绿大乔木,为我国主要的热带水果之一。广西壮族自治区作为我国最大的芒果生产基地,具有悠久的种植历史,尤其是被命名为“中国芒果之乡”的百色地区。随着芒果产业的快速发展,问题也伴随而来。大多数果农为追求效益滥施和偏施化肥,普遍存在有机肥施用不足、钾肥投入不足的问题[1],导致土壤质量下降、树体营养不足、病虫害易侵入等问题。丛枝菌根(arbuscular mycorrhizal, AM)真菌是一种具有广泛宿主范围的共生真菌,它能与大约80%的植物建立共生关系[2]。AM真菌依赖于宿主植物提供的碳源,而其菌丝网络的强大吸收能力促进植物养分的吸收[3],还能够提高宿主植物对各种生物和非生物胁迫的耐受性,例如干旱胁迫和细菌、真菌、线虫等病原体入侵[4-5]。前人已有研究表明,AM真菌可提高果树矿质元素吸收、增加抗旱耐盐等抗胁迫能力,还可直接或间接改善果实品质。李娇娇[6]研究表明,AM真菌促进了叶片和根系中渗透物质的积累,通过调节激素和相关酶活性提高梨树幼苗的抗旱性。张敏瑜等[7]研究表明,AM真菌的定殖促进了植物的生长,改变了柑橘类水果中次生代谢产物的积累。因此,对于果树生态系统,如何利用AM真菌资源提高土壤肥力、改善树体营养和果实品质具有很大研究价值。
AM真菌资源分布广泛,种类多样。我国已发现并报道的AM真菌有147种[8],但果树中发现的AM真菌相对较少。目前芒果根际土壤AM真菌的分离鲜有报道。AM真菌多样性受宿主植物、土壤、气候、地理等影响。张贵云[9]研究分析了不同耕作条件下土壤环境因子与AM真菌孢子密度及侵染率的相关性,结果表明土壤有机质与其呈正相关;还有许多研究均表明果园有机管理对保持AM真菌多样性和丰富度具有积极作用[10-11]。本研究从芒果主产区之一的广西百色地区采集2种不同施肥制度的芒果根际土壤,对其进行检测及土著AM真菌的纯化分离,通过分离芒果根际土壤土著AM真菌,为后续研究和开发适宜芒果的菌根菌剂提供理论依据,并对果园管理提供方向。
1 材料与方法
1.1 材料
1.1.1 样品采集 2020年7月在广西百色市芒果主产区选取5个主施有机肥的芒果园(OT-1、OT-2、OT-4、OT-7、OT-10)和5个以化肥为主,不施(或少施)有机肥的芒果园(CT-3、CT-5、CT-6、CT-8、CT-9),果园气候和土壤类型尽可能保持一致。采用五点取样法采集土壤样品,即在同一地块选取5个点,先去掉表层大块碎石和枯枝落叶,将根系及土壤挖出,深度30~40 cm,然后将与根系紧密结合的土壤敲出。将5个点的土壤混合,用4分法保留样品,装入无菌纸袋。每个果园采集土样1 kg,同一果园根系样品放入同一密封袋,4℃保存带回实验室。带回实验室后分为2份,分别置于4℃和室温条件下。
1.1.2 采样地概况 采样地概况见表1。土样在室内风干,过20目筛,水土比为2.5∶1,采用PB-10标准型pH计测定pH。

表1 采样信息表
1.2 方法
1.2.1 芒果根系内生真菌侵染率测定 从10个根系样品中分别选择各级根系各5~10条,放入50 mL离心管。清水浸泡30 min,自来水清洗后,超声波处理30~60 s,用50%酒精室温保存。芒果根系染色处理参考廖楠等[12]的方法,侵染率的测定参考汪茜等[13]的方法。
1.2.2 AM真菌的分离扩繁 将采集的土壤样品过20目筛,装入封口袋。分别称取10个土样各20 g,采用湿筛倾析法筛取AM孢子并记录孢子数量,将从5个OT处理和5个CT处理中筛取的孢子分别混合,最后将孢子按形态分开,分别接种于玉米苗根部,在广西农业科学院微生物研究所玻璃温室进行单孢子分离培养8个月后,将检测有孢子的样品进行孢子鉴定。
1.2.3 AM真菌孢子的形态鉴定 形态鉴定参考汪茜等[14]的方法,根据孢子分类特征如颜色、形状大小、表面纹饰、孢子内含物、孢壁结构、连孢菌丝的数目、宽度及形状和附属结构产孢子囊等对孢子进行分类及种属鉴定。对照《VA菌根真菌鉴定手册》和http://invam.wvu.edu/home,http:// mycorrhizae.org.in/cmcc/index,http://www.i-beg.eu/网站提供的图片及菌种描述,并查阅相关种的原始发表资料和近几年发表的有关AM真菌的分类资料进行种属的检索和鉴定。
1.2.4 AM真菌的分子鉴定 参考骆礼华等[15]的方法分别提取AM真菌单个孢子的DNA进行巢式PCR扩增。第一次PCR扩增:采用引物GeoA2-Geo11[16](表2)。反应体系(20 μL):PCRmix 10 μL,ddH2O 7 μL,引物GeoA2 0.5 μL,引物Geo11 0.5 μL,DNA模板2 μL。反应条件:94℃预变性3 min,94℃变性30 s,54℃退火30 s,72℃延伸2 min,循环35次,最后72℃延伸5 min。
第二次PCR扩增:采用AM真菌特异性通用引物对AML1-AML2[17](表2),模板以第一次PCR产物稀释100倍,取2 μL,反应体系与第一次PCR相同,反应程序退火温度改为58℃,延长时间为1 min,其余反应程序与第一次相同。取扩增产物2 μL,用1.0%琼脂凝胶电泳检测。
PCR产物由擎科基因公司测序,测序结果在NCBI数据库中比对后下载相似性达97%的序列,用MAGA 7软件通过邻位加入法(N-J),运行1000次bootstrap验证,构建系统发育树。

表2 Nested PCR引物
1.3 数据处理
采用Excel 2016软件进行试验数据的整理,用SPSS 22.0软件进行方差分析,利用LSD法多重比较平均数间的差异显著性(<0.05)。
2 结果与分析
2.1 芒果根系内生真菌检测
不同施肥处理的芒果根系丛枝菌根(AM)真菌和深色有隔内生真菌(dark septate endophytes, DSE)侵染有差异。主施有机肥的芒果园(OT)(图1A~图1F)菌丝分布较多,AM真菌结构丰富,可以明显观察到丛枝和泡囊结构,还发现有少量的DSE。主施化肥的芒果园(CT)(图1G~图1L)菌丝相对较少,与OT处理相比菌丝较细,CT处理的泡囊结构和丛枝也较少,而DSE相对较多。

A~F:主施有机肥的芒果园;G~L:主施化肥的芒果园。
2.2 AM真菌和深色有隔真菌侵染情况
不同样点芒果根系的内生真菌定殖情况不同(表3,表4)。AM真菌总定殖率依次为:OT-10>OT-4>CT-3>OT-1>OT-2>CT-9>CT-5>CT-6> CT-8>OT-7。除OT-2没有DSE定殖外,其余样点均有定殖,DSE总定殖率依次为CT-8>CT-9> OT-1>OT-10>CT-3>CT-5>OT-4>CT-6>OT-7。OT处理和CT处理的AM真菌侵染率的平均值分别为40.21%和32.56%,其DSE侵染率的平均值分别为0.65%和5.54%,CT处理的根系AM真菌侵染率有低于OT处理的趋势,DSE侵染率与之相反。此外,OT处理的根外菌丝、根内菌丝、泡囊和丛枝的平均丰度均高于CT处理,而OT处理的微菌核和有隔菌丝平均丰度低于CT处理。

表3 不同采样点根系AM真菌的定殖情况
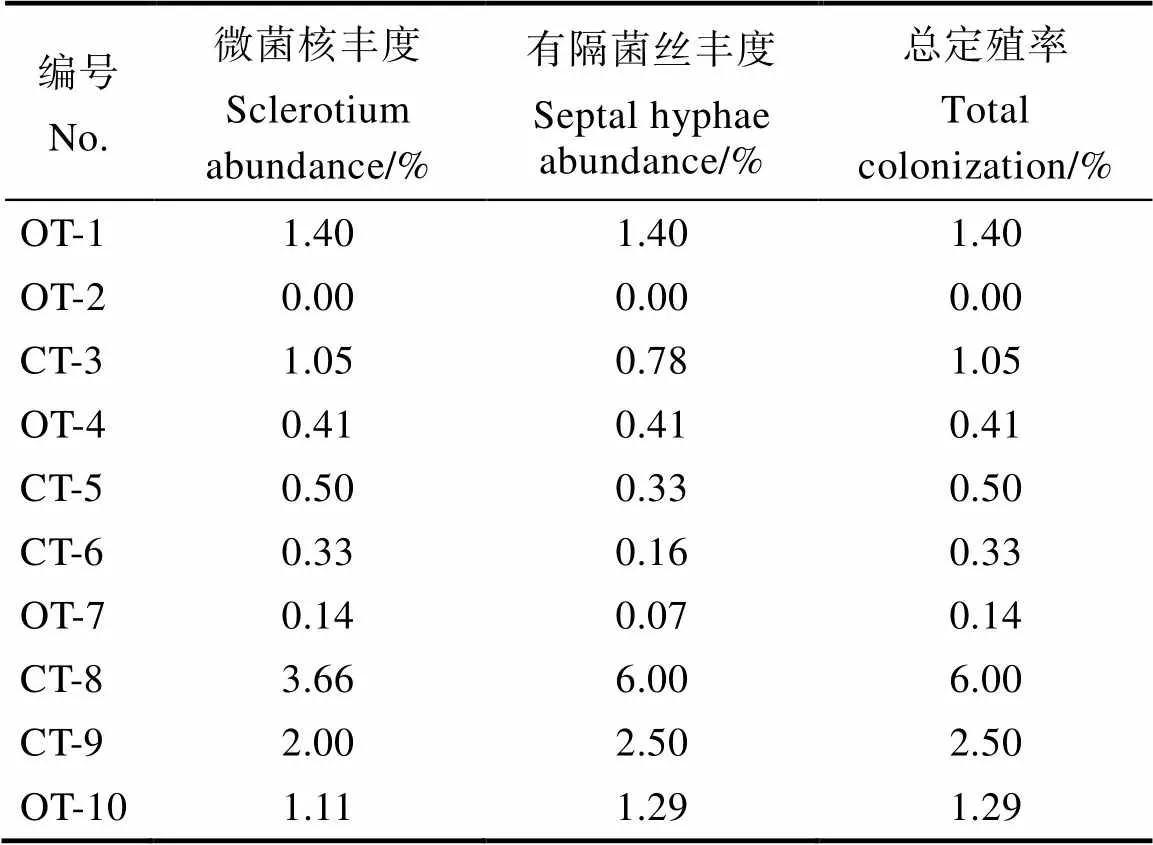
表4 不同采样点的根系有隔内生真菌(DSE)定殖情况
经方差分析可以得出,2种施肥处理的孢子数无显著差异,但不同芒果树龄及品种间的孢子数有显著差异。施肥对AM真菌定殖的根外菌丝、泡囊结构有显著影响,其中OT处理的根外菌丝和泡囊侵染率均显著高于CT处理,品种对AMF的根外菌丝也有显著影响(表5)。
2.3 AM真菌孢子形态特征
如图2所示,芒果根际土壤中共分离出6种AM真菌孢子,OT处理和CT处理各3种,分别是CT-1-4、CT-2-7、CT-3-10、OT-2-13、OT-4-3、OT-4-15,具体描述如下:
2.3.1 层状近明球囊霉()编号CT-1-4(图2A1~图2A3),孢子黄棕色,球形或近球形,大小为77.88~148.56 μm,平均为104.50 μm。孢子壁3层。L1透明至淡黄色层状壁,厚1.00~4.00 μm,在乳酸酚棉蓝试剂中被染成浅蓝色,这一层往往易被降解。L2层状壁,淡黄色至黄色,厚4.60~8.07 μm,由多亚层组成,无染色反应。L3膜状壁,厚<1.00 μm,在Melzer’s试剂中呈淡粉色,在乳酸酚棉蓝试剂中被染成浅蓝色至蓝色。连孢菌丝透明至淡黄,圆筒形至漏斗形,偶尔略下弯,其壁与孢子壁L1和L2相连,菌丝有隔。
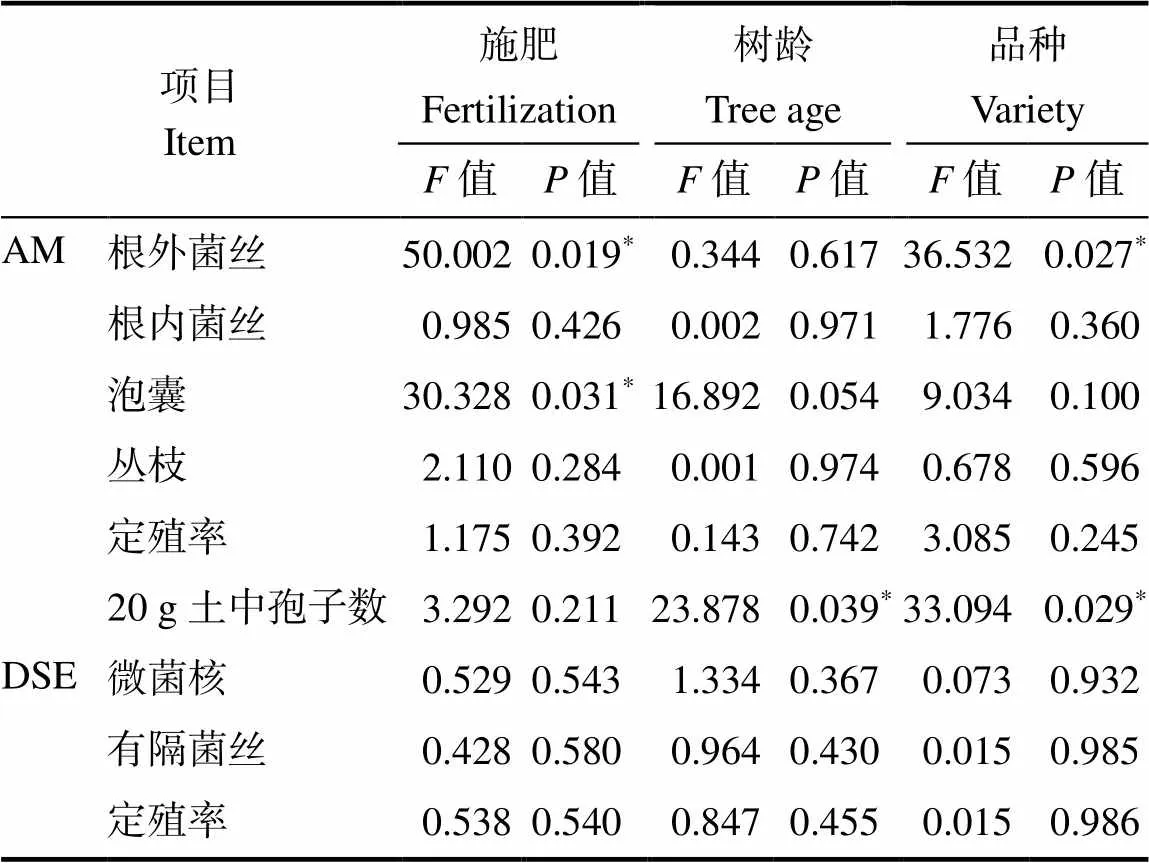
表5 施肥、树龄和品种对AM和DSE真菌定殖结构的方差分析
注:*表示显著差异(<0.05)。
Note:*indicate significant difference (<0.05).
2.3.2 近明球囊霉属(sp.) 编号OT-2-13(图2B1~图2B3),孢子透明至淡黄色,球形或近球形,大小为31.54~61.86 μm,平均为47.49 μm。孢子壁3层。L1层无色透明易脱落,厚度0.43~1.10 μm。L2透明至淡黄色,厚3.21~5.06 μm,由多亚层组成,在Melzer’s试剂中被染成黄色,在乳酸酚棉蓝试剂中被染成蓝色。L3为膜状壁,透明至淡黄色,厚<1.00 μm,在Melzer’s试剂中被染成黄色,在乳酸酚棉蓝试剂中被染成蓝色。内含物呈光滑透明无杂质的油滴状,在Melzer’s中会有絮状的内含物染上黄色。连点宽度3.25~ 4.03 μm,连孢菌丝呈圆柱形,菌丝壁透明,在乳酸酚棉蓝试剂中被染成蓝色。
2.3.3 空洞无梗囊霉() 编号CT-2-7(图2C1~图2C3),孢子球形至近球形,偶有椭圆形,大小为88.61~141.42 μm,平均108.51 μm,淡黄至黄棕色。孢子壁3层,L1易逝壁,无色透明,紧贴L2,乳酸酚棉蓝试剂中有反应。L2层状壁,黄色至黄棕色,厚3.40~5.28 μm,有圆形或卵形凹坑纹饰,宽0.70~2.81 μm,深3.50 μm,坑与坑之间由脊分开,脊宽0.48~ 1.58 μm。乳酸酚棉蓝试剂中有反应。L3膜状壁,无色透明,厚<1.00 μm,乳酸酚棉蓝试剂中有反应。发芽壁2层(GW1、GW2)。GW1膜状,无色透明,乳酸酚棉蓝试剂中有反应。GW2膜状,无色透明,双层(GW2-L1、GW2-L2),GW2-L1膜状,无色透明,厚<1.00 μm,有珠状颗粒,Melzer’s试剂中无反应,乳酸酚棉蓝试剂中有反应。GW2-L2膜状,无色透明,厚<1.00 μm,Melzer’s试剂中染成紫红色,乳酸酚棉蓝试剂中有反应。
2.3.4 蜜色无梗囊霉() 编号CT-3-10(图2D1~图2D3),孢子形状多为球形或近球形,大小为50.07~106.25 μm,平均80.00 μm,颜色为蜂蜜色至淡黄棕色。孢子壁2层,L1层状壁,黄色,厚1.74~3.70 μm,外表光滑。L2膜状壁,无色透明,厚度<1.00 μm,附着在L1上。发芽壁2层(GW1、GW2)。GW1膜状壁,无色透明,半韧性,厚度<1.00 μm,孢子破裂后易皱。GW2两层紧贴(GW2-L1、GW2-L2),GW2-L1无色透明,厚度<1.00 μm,有时表面有细小颗粒附着,GW2-L2具可塑性,无色透明,在Melzer’s试剂中染成紫红色,在乳酸酚棉蓝试剂中显蓝色。脱落痕直径7.53 μm。
2.3.5 无梗囊霉属(sp) 编号OT-4-3(图2E1~图2E4),孢子形状多为球形或近球形,大小为53.92~101.72 μm,平均79.08 μm,颜色为淡黄色至淡棕色。孢子壁3层。L1外层,透明,厚1.00 μm,易吸附杂质,有时脱落。L2层状壁,淡黄色,厚2.47~3.18 μm。L3膜状壁,无色透明,厚度<1.00 μm,很少与孢子壁完全分离。发芽壁2层(GW1、GW2)。GW1一层双层膜状壁,无色透明,两层厚度基本相似,厚度<1.00 μm,通常两层粘着似单层。GW2两层,在Melzer’s中对比明显。GW2-L1透明状,厚度<1.00 μm,表面有细小颗粒附着,GW2-L2无色透明,无定形,在Melzer’s试剂中染成红紫色,在乳酸酚棉蓝试剂中显蓝色。
2.3.6 类球囊霉属(sp) 编号OT-4-15(图2F1~图2F4),孢子球形至近球形,大小为40.39~75.88 μm,平均为53.23 μm,无色透明至浅黄色。孢子壁4层。L1(W1)易逝层,厚0.78~ 1.08 μm,无色透明,易黏附杂质,紧贴L2,在Melzer’s试剂中染成浅黄色,在乳酸酚棉蓝试剂中染成浅蓝色。L2(W2)和L3(W3)层状壁,由多个亚层组成,二者紧密相连,有时分开,厚3.10~5.22 μm,在Melzer’s试剂中变成橙黄色,在乳酸酚棉蓝试剂中变成蓝色,着色快。L4膜状壁,厚<1.00 μm,在Melzer’s试剂中变成橙黄色,在乳酸酚棉蓝试剂中变成蓝色,着色快。连点呈圆筒状,<10.00 μm。
2.4 AM真菌分子鉴定
对已纯化的6种AM真菌进行分子鉴定,所得序列在GenBank上进行blast序列比对,并与相关菌种构建系统发育树(图3)。经比对,编号OT-2-13和OT-4-15未鉴定出;CT-3-10与无梗囊霉属(sp, MH424517.1)聚成一支,序列同源性为97%;而OT-4-3、CT-2-7与无梗囊霉属(sp)聚在较大分支,三者间亲缘关系稍远。CT-1-4与近明球囊霉属(sp, MT378291.1)聚成一支,序列同源性为97%。将CT-3-10、OT-4-3、CT-2-7和CT-1-4的序列提交至NCBI GenkBank数据库,获得登录号分别为OL966069、OL966070、OL966067、OL966068。从鉴定结果可看出,近明球囊霉属(sp)1种、无梗囊霉属(sp)3种。相对于属的分子鉴定,种的的分子鉴定可信度并不太高,因此最终要结合形态鉴定确定种类。

A为层状近明球囊霉(CT-1-4),A1:水;A2:Melzer+PVLG试剂;A3:乳酸酚棉蓝试剂。B为近明球囊霉属(OT-2-13),B1:水;B2:Melzer试剂;B3:乳酸酚棉蓝试剂。C为空洞无梗囊霉(CT-2-7),C1:水;C2:Melzer试剂;C3:乳酸酚棉蓝试剂。D为蜜色无梗囊霉(CT-3-10),D1:水;D2:Melzer试剂;D3:乳酸酚棉蓝试剂。E为无梗囊霉属(OT-4-3),E1:水;E2:Melzer试剂;E3:乳酸酚棉蓝试剂;E4:PVLG+Melzer试剂浸。F为类球囊霉属(OT-4-15),F1:水;F2:Melzer试剂;F3:乳酸酚棉蓝试剂;F4:PVLG+Melzer试剂。

图3 基于18S rRNA序列构建的系统发育树
3 讨论
3.1 芒果根际AM真菌种类
通过对芒果根际土壤进行AM真菌的纯化分离,从主要施用有机肥和主要施用化肥的2种肥料处理土壤中各分离得到3种AM真菌,在2种处理土壤中分离获得的AM真菌孢子形态相似,但种类不同。目前尚未将AM真菌的分类类群与其功能属性联系起来[18],即使同一个属的AM真菌,其功能可能也会存在差异。纯化得到的AM真菌属数量较少,其原因可能有:(1)AM真菌对外界非生物因素响应不同,如不同季节AM真菌群落组成不同;(2)一些孢子萌发侵染到根系后,土壤中孢子量减少,未能纯化得到真菌孢子[19];(3)部分AM真菌无法产孢;(4)孢子在不同阶段或发生病变等原因导致形态鉴定困难[20]。AM真菌多样性往往受宿主植物影响,二者间相互选择,这与宿主植物基因型、根系形态及对AM真菌光合产物的分配密不可分。从芒果根际土壤中分离出来的优势种为无梗囊霉属(sp),并未观测到、等常见的AM真菌,这说明与该地区芒果形成自然共生的AM真菌可能有别于其他常规作物。本研究中的采样点以酸性土壤为主,VERESOGLOU等[21]研究表明无梗囊霉科(Acaulosporaceae)和巨孢囊霉科(Gigasporaceae)对酸性土壤环境的耐受性较强,与本研究中分离出的无梗囊霉属一致。王军晓[22]通过湿筛倾析法从枣树根际土壤中分离获得AM真菌孢子,通过形态鉴定发现也有近明球囊霉属()、无梗囊霉属()和类球囊霉属()3种,而通过高通量测序结果表明,球囊霉属()的相对丰度较高,其次为盾巨孢囊霉属()。其原因可能是有些AM真菌产孢较少。JIANG等[23]对芒果根际土壤的AM真菌进行高通量测序,得到其优势种为球囊霉属(),其次为类球囊霉属(),同时包括近明球囊霉属()和无梗囊霉属(),但丰度较低。此外,前人在桑树[24]、葡萄[25]、香蕉[26]、核桃[27]、橘[28]、树莓和黑莓[29]等果树根际土壤中也分离得到无梗囊霉属()、近明球囊霉属()、类球囊霉属()等AM真菌。由此可见从芒果根际土壤中分离出的AM真菌在属水平上具有普遍性。本研究分离出的芒果土著AM真菌为筛选果树高效AM真菌菌剂提供了一定基础,对将来开发生物菌剂具有重要的实践意义。
3.2 施肥种类对芒果AM真菌侵染的影响
在果园生态系统中,微生物调控许多过程,包括养分循环、有机质分解、土壤团聚体稳定等。其中AM真菌在土壤团聚体形成和碳固存中起着重要作用[30]。AM真菌还可促进果树树体养分吸收及抗胁迫能力。因此,强化生态系统中关键微生物——AM真菌的作用对果园具有重要意义,果园管理应该向促进果树与AM真菌共生的方向发展。当AM真菌在肥力良好环境中,会形成较多丛枝和泡囊吸收养分;而肥力较低时,AM真菌会形成较少泡囊和菌丝圈吸收和储存能量[31]。前人研究表明,果园集约化管理降低了土壤微生物多样性,有机肥的适度施用可以提高果园生态多样性,也有利于提高AM真菌多样性和丰富度[2]。本研究通过根系染色发现OT处理菌丝分布较多,AM真菌结构丰富,可明显观察到丛枝和泡囊结构,方差分析显示OT处理的AM真菌根外菌丝和泡囊结构显著高于CT处理,进一步印证了前人的结论[31]。但对于AM真菌总定殖率,2种施肥处理间并无显著差异,这可能与不同芒果品种和树龄有关。已有报道桑[32]和枸杞[33]根系的AM真菌群落α-多样性受品种影响,蔡邦平等[34]研究表明根围土壤AM真菌种类或孢子密度与宿主植物的生长状况密切相关。温苗等[35]的研究结果也表明随着树龄的增加,根系AM真菌菌丝侵染率先上升后下降,而丛枝侵染率逐渐下降,泡囊侵染率无明显变化。DSE是一类生长在植物根部且可以在体外培养的共生真菌,它与AM真菌功能相似,在植物根系与AM真菌共享生态位。本研究中DSE侵染强度与AM真菌侵染强度在OT和CT处理中的表现恰恰相反,这与欧阳瑞培等[36]的结果一致。其原因可能是土壤条件与气候的限制,或者是定殖的优先性。另已有研究表明DSE可以改变植物的菌根状态,调节根际的不同共生状态[37]。以上结果说明施用有机肥对AM真菌的定殖可能具有促进作用,但AM真菌与有机质的相互影响机制目前尚未完全解析,有机肥对AM真菌的调控机理还有待进一步研究。
综上,芒果根际土壤中共分离出3属6种AM真菌孢子,但未来仍需深入研究不同种/属的AM真菌改善果树养分吸收及抗逆功能大小。通过调查不同施肥处理的芒果根系AM真菌侵染状况发现,施用有机肥较化肥显著促进AM真菌根外菌丝和泡囊结构的形成,这对AM真菌促进植物养分吸收有重要意义,芒果树龄和品种对根外菌丝、孢子密度也有显著影响。本研究中芒果土著AM真菌的分离对开发生物菌剂具有重要的实践意义,并为筛选果树高效AM真菌菌剂提供基础,也为果园管理提供了新方向。
[1] 胡小璇. 芒果有机无机肥配施效果及有机肥氮素有效性初探[D]. 南京: 南京农业大学, 2020.
HU X X. Study on the effect of combined application of organic and inorganic fertilizers on mango and nitrogen availability of organic fertilizer[D]. Nanjing: Nanjing Agricultural University, 2020. (in Chinese)
[2] BERRUTI A, LUMINI E, BALESTRINI R, BIANCIOTTO V. Arbuscular mycorrhizal fungi as natural biofertilizers: let’s benefit from past successes[J]. Frontiers in Microbiology, 2016, 6: 1559.
[3] 刘洪章, 迟丽华, 图力古尔, 李 玉. 丛枝菌根真菌资源及其在果树上的应用[J]. 吉林农业大学学报, 2002(2): 50-55.
LIU H Z, CHI L H, TOLGOR, LI Y. AM (arbuscular-mycorrhizas) fungi resources and their applcation in fruit trees[J]. Journal of Jilin Agricultural University, 2002(2): 50-55. (in Chinese)
[4] DOWARAH B, GILL S S, AGARWALA N. Arbuscular mycorrhizal fungi in conferring tolerance to biotic stresses in plants[J]. Journal of Plant Growth Regulation, 2021(2): 1-16.
[5] WIPF D, KRAJINSKI F, VAN TUINEN D, RECORBET G, COURTY P E. Trading on the arbuscular mycorrhiza market: from arbuscules to common mycorrhizal networks[J]. New Phytologist, 2019, 223(3): 1127-1142.
[6] 李娇娇. 丛枝菌根真菌对干旱胁迫下梨树幼苗生长以及抗旱性的影响[D]. 重庆: 西南大学, 2021.
LI J J. Effect of arbuscular mycorrhizal fungi on growth and drought resistance of pear seedlings under water stress[D]. Chongqing: Southwest University, 2021. (in Chinese)
[7] 张敏瑜, 王明元, 侯式贞, 刘建福, 林 萍, 李雨晴. 接种丛枝菌根真菌对柑橘生长与次生代谢的影响[J]. 热带亚热带植物学报, 2020, 28(1): 78-83.
ZHANG M Y, WANG M Y, HOU S Z, LIU J F, LIN P, LI Y Q. Effects of arbuscular mycorrhizal fungi on plant growth and secondary metabolism in[J]. Journal of Tropical and Subtropical Botany, 2020, 28(1): 78-83. (in Chinese)
[8] 王幼珊, 刘润进. 球囊菌门丛枝菌根真菌最新分类系统菌种名录[J]. 菌物学报, 2017, 36(7): 820-850.
WANG Y S, LIU R J. A checklist of arbuscular mycorrhizal fungi in the recent taxonomic system of Glomeromycota[J]. Mycosystema, 2017, 36(7): 820-850. (in Chinese)
[9] 张贵云. 不同农业措施对丛枝菌根真菌群落结构和侵染效应的影响[D]. 南京: 南京农业大学, 2013.
ZHANG G Y. Effects of different agricultural practices on community structure and colonization rate of arbuscular mycorrhizal fungi[D]. Nanjing: Nanjing Agricultural University, 2013. (in Chinese)
[10] BANERJEE S, WALDER F, BUCHI L, MEYER M, HELD A Y, GATTINGER A, KELLER T, CHARLES R, VAN DER HEIJDEN M G A. Agricultural intensification reduces microbial network complexity and the abundance of keystone taxa in roots[J]. The ISME Journal, 2019, 13(7): 1722-1736.
[11] WINDISCH S, SOMMERMANN L, BABIN D, CHOWDHURY S P, GROSCH R, MORADTALAB N, WALKER F, HOGLINGER B, EL-HASAN A, ARMBRUSTER W, NESME J, SORENSE S J, SCHELLENBERG I, GEISTLINGER J, SMALLA K, ROTHBALLER M, LUDEWIG U, NEUMANN G. Impact of long-term organic and mineral fertilization on rhizosphere metabolites, root-microbial interactions and plant health of lettuce[J]. Frontiers in Microbiology, 2021(11): 3157.
[12] 廖 楠, 张金莲, 李冬萍, 汪 茜, 龙艳艳, 谭裕模, 李 松, 陆祖军, 陈廷速. 甘蔗根系内生真菌染色方法探讨[J]. 西南农业学报, 2016, 29(4): 814-819.
LIAO N, ZHANG J L, LI D P, WANG Q, LONG Y Y, TAN Y M, LI S, LU Z J, CHEN T S. Method to stain endophytic fungi in sugarcane roots[J]. Southwest China Journal of Agricultural Sciences, 2016, 29(4): 814-819. (in Chinese)
[13] 汪 茜, 龙艳艳, 李冬萍, 张金莲, 宋 娟, 周生茂, 车江旅, 陈廷速. 5种染色剂对生姜根系丛枝菌根(AM)真菌的染色效果比较[J]. 南方农业学报, 2015, 46(8): 1425-1429.
WANG Q, LONG Y Y, LI D P, ZHANG J L, SONG J, ZHOU S M, CHE J L, CHEN T S. Staining effects of five stains on arbuscular mycorrhizal (AM) fungi in ginger roots[J]. Journal of Southern Agriculture, 2015, 46(8): 1425-1429. (in Chinese)
[14] 汪 茜, 张金莲, 龙艳艳, 李冬萍, 陈廷速, 车江旅. 广西柳江生姜根际土壤丛枝菌根真菌资源研究[J]. 西南农业学报, 2016, 29(1): 115-119.
WANG Q, ZHANG J L, LONG Y Y, LI D P, CHEN T S, CHE J L. Resources of arbuscular mycorrhizal fungi in ginger fields of Liujiang, Guangxi[J]. Southwest China Journal of Agricultural Sciences, 2016, 29(1): 115-119. (in Chinese)
[15] 骆礼华, 姚刘斌, 江 龙. 双重培养体系中AM真菌孢子的种类鉴定[J]. 贵州大学学报(自然科学版), 2017, 34(5): 38-42.
LUO L H, YAO L B, JIANG L. Species identification of AM fungal spores from dual culture system[J]. Journal of Guizhou University (Natural Sciences), 2017, 34(5): 38-42. (in Chinese)
[16] SCHWARZOTT D, SCHUSSLER A. A simple and reliable method for SSU rRNA gene DNA extraction, amplification, and cloning from single AM fungal spores[J]. Mycorrhiza, 2001, 10(4): 203-207.
[17] LEE J, LEE S, YOUNG J P W. Improved PCR primers for the detection and identification of arbuscular mycorrhizal fungi[J]. FEMS Microbiology Ecology, 2008, 65(2): 339-349.
[18] MUNKVOLD L, KJOLLER R, VESTBERG M, ROSENDAHL S, JAKOBSEN I. High functional diversity within species of arbuscular mycorrhizal fungi[J]. New Phytologist, 2004, 164(2): 357-364.
[19] KLAMER M, ROBERTS M S, LEVINE L H, DRAKE B G, GARLAND J L. Influence of elevated CO2on the fungal community in a coastal scrub oak forest soil investigated with terminal-restriction fragment length polymorphism analysis[J]. Applied and Environmental Microbiology, 2002, 68(9): 4370-4376.
[20] 王化秋, 程 巍, 郝 俊, 毛圆圆, 卢 绮, 古天岳, 李栋恒. 贵州煤矸石山香根草根系及根际土丛枝菌根真菌(AMF)群落的季节动态研究[J]. 菌物学报, 2021, 40(3): 514-530.
WANG H Q, CHENG W, HAO J, MAO Y Y, LU Q, GU T Y, LI D H. Seasonal dynamic changes of community of arbuscular mycorrhizal fungi (AMF) in root system and rhizosphere soil ofin coal gangue in Guizhou of Southwest China[J]. Mycosystema, 2021, 40(3): 514-530. (in Chinese)
[21] VERESOGLOU S D, CARUSO T, RILLIG M C. Modelling the environmental and soil factors that shape the niches of two common arbuscular mycorrhizal fungal families[J]. Plant and Soil, 2013, 368(1/2): 507-518.
[22] 王军晓. 设施栽培条件下枣园丛枝菌根真菌多样性研究[D]. 杨凌: 西北农林科技大学, 2021.
WANG J X. Arbuscular mycorrhizal fungal diversity in jujube orchard under facility cultivation[D]. Yangling: Northwest A & F University, 2021. (in Chinese)
[23] JIANG S T, HU X X, KANG Y L, XIE C Y, AN X R, DONG C X, XU Y C, SHEN Q R. Arbuscular mycorrhizal fungal communities in the rhizospheric soil of litchi and mango orchards as affected by geographic distance, soil properties and manure input[J]. Applied Soil Ecology, 2020, 152: 103593.
[24] 郑亚茹. 桑树根际丛枝菌根真菌(AMF)多样性及对宿主耐盐性的影响[D]. 杨凌: 西北农林科技大学, 2021.
ZHENG Y R. Diversity of arbuscular mycorrhizal fungi (AMF) in mulberry rhizosphere and its effect on salt tolerance of hosts[D]. Yangling: Northwest A & F University, 2021. (in Chinese)
[25] 屈雁朋. 西北地区葡萄园AM真菌的筛选、鉴定和接种效应[D]. 杨凌: 西北农林科技大学, 2009.
QU Y P. The screening, identification of arbuscular mycorrhizal fungi from the vineyards in Northwestern China and the effects of promotion[D]. Yangling: Northwest A & F University, 2009. (in Chinese)
[26] 李岚岚. 海南香大蕉根际丛枝菌根真菌及菌根化蕉苗对枯萎病的防效研究[D]. 海口: 海南大学, 2015.
LI L L. Researches on arbuscualr mycorrhiza fungi at the rhizosphere ofspp. on Hainan island and efficacy of mycorrhiza of banana seedlings towilt disease of banana[D]. Haikou: Hainan University, 2015. (in Chinese)
[27] 李荣波, 景跃波, 卯吉华, 宁德鲁. 云南核桃不同套种模式根际丛枝菌根真菌多样性[J]. 北方园艺, 2021(5): 84-93.
LI R B, JING Y B, MAO J H, NING D L. Arbuscular mycorrhizal fungi diversity of walnut orchards in Yunnan under different intercropping systems[J]. Northern Horticulture, 2021(5): 84-93. (in Chinese)
[28] 张锦娟. 黄棕壤橘园丛枝菌根真菌多样性的研究[D]. 武汉: 华中农业大学, 2010.
ZHANG J J. The diversity of arbuscular mycorrhizal fungi in yellow-brown soil citrus orchards[D]. Wuhan: Huazhong Agricultural University, 2010. (in Chinese)
[29] 王少峰. 树莓和黑莓根际AM真菌生态学研究[D]. 杨凌: 西北农林科技大学, 2006.
WANG S F. Study on the ecology of arbuscular mycorrhizal fungi from the rhizospere of raspberry and blackberry[D]. Yangling: Northwest A & F University, 2006. (in Chinese)
[30] MORRIS E K, MORRIS D J P, VOGT S, GLEBER S C, BIGALKE M, WILCKE W, RILLIG M C. Visualizing the dynamics of soil aggregation as affected by arbuscular mycorrhizal fungi[J]. The ISME Journal, 2019, 13(7): 1639-1646.
[31] 张淑容, 贺学礼, 徐浩博, 刘春卯, 牛 凯. 蒙古沙冬青根围AM和DSE真菌与土壤因子的相关性研究[J]. 西北植物学报, 2013, 33(9): 1891-1897.
ZHANG S R, HE X L, XU H B, LIU C M, NIU K. Correlation study of AM and DSE fungi and soil factors in the rhizosphere of[J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(9): 1891-1897. (in Chinese)
[32] 温 苗. 四川主栽桑树品种和土壤因子对桑园AMF群落的影响[D]. 重庆: 西南大学, 2020.
WEN M. Effects of major mulberry cultivars and soil factors on arbuscular mycorrhizal fungal community in Sichuan[D]. Chongqing: Southwest University, 2020. (in Chinese)
[33] 吕 燕, 刘建利, 李靖宇, 候琳琳, 孙 敏, 苟 琪. 不同品种和产区宁夏枸杞根系AMF多样性[J]. 生物技术通报, 2021, 37(6): 36-48.
LV Y, LIU J L, LI J Y, HOU L L, SUN M, GOU Q. Diversity of arbuscular mycorrhizal fungi inhabiting the roots ofin different varieties and cultivation regions[J]. Biotechnology Bulletin, 2021, 37(6): 36-48. (in Chinese)
[34] 蔡邦平, 陈俊愉, 张启翔, 郭良栋. 云南昆明梅花品种根围丛枝菌根真菌多样性研究[J]. 北京林业大学学报, 2013, 35(S1): 38-41.
CAI B P, CHEN J Y, ZHANG Q X, GUO L D. Diversity of arbuscular mycorrhizal fungi associated within Kunming, Yunnan, China[J]. Journal of Beijing Forestry University, 2013, 35(S1): 38-41. (in Chinese)
[35] 温 苗, 施松梅, 罗 协, 何新华, 徐云飞, 胥 晓. 不同树龄桑园丛枝菌根侵染、球囊霉素土层分布及与土壤因子的关系[J]. 应用与环境生物学报, 2020, 26(5): 1138-1146.
WEN M, SHI S M, LUO X, HE X H, XU Y F, XU X. Relationships between spatial distribution of arbuscular mycorrhizal colonization, glomalin-related soil protein, and rhizhospheric soil chemical properties under different aged mulberry orchards[J]. Chin Journal of Applied and Environment Biology, 2020, 26(5): 1138-1146. (in Chinese)
[36] 欧阳瑞培, 姚庆智, 石俊庭, 梁秀雪. 艾蒿根系共生真菌与土壤理化因子的相关性分析[J]. 北方农业学报, 2021, 49(2): 49-55.
OUYANG R P, YAO Q Z, SHI J T, LIANG X X. Correlation analysis of root symbiotic fungi ofand soil physical and chemical factors[J]. Journal of Northern Agriculture, 2021, 49(2): 49-55. (in Chinese)
[37] SCERVINO J M, GOTTLIEB A, SILVANI V A, PERGOLA M, FERNANDEZ L, GODEAS A M. Exudates of dark septate endophyte (DSE) modulate the development of the arbuscular mycorrhizal fungus (AMF)[J]. Soil Biology and Biochemistry, 2009, 41(8): 1753-1756.
Resources of Arbuscular Mycorrhizal Fungi in the Rhizosphere Soil of Mango Trees in Baise, Guangxi, China
LI Han1, JIANG Shangtao1, PENG Haiying1, GAO Rifang2, ZHANG Jinlian2*, LI Dongping2, JIANG Rou1, DONG Caixia1, CHEN Tingsu2*
1. College of Resources and Environmental Sciences, Nanjing Agricutural University / Jiangsu Provincial Key Lab of Solid Organic Waste Utilization / Jiangsu Collaborative Innovation Center of Solid Organic Wastes / Educational Ministry Engineering Center of Resource-Saving Fertilizers, Nanjing, Jiangsu 210095, China; 2. Microbiology Research Institute, Guangxi Academy of Agricultural Sciences, Nanning, Guangxi 530007, China
In order to find out the distribution of AM fungi in the mango rhizosphere soil in Baise City, Guangxi, AM fungi were isolated from the rhizosphere soil and root samples from the main mango producing areas with both main application of organic fertilizers and main application of chemical fertilizer in Baise, Guangxi, and the species and infection of AM fungi under different fertilization regimes were compared. The rhizosphere soils of 5 mango orchards with the main application of organic fertilizer (OT) and 5 mango orchards with the main application of chemical fertilizer (CT) were collected. The AM fungi spores in the soil were isolated by the wet sieve decantation method, and the AM fungi in them were purified by enrichment and induction culture. The spores were identified molecularly and morphologically. The root samples were stained by the ink-vinegar solution staining method and the infection rate of endophytic fungi was determined. Six spore species of AM fungi were identified in the soil samples. Three AM fungal spores including one, oneand onewere identified in OT-treated soil samples. Three AM fungal spores including two, onewere identified in CT-treated soil samples. Few species of AM fungi were isolated from the two fertilization systems, and the isolated species of AM fungi were relatively common, with no endemic species. Root staining showed that OT treatment had more hyphae, AM fungal structures were abundant, arbuscular and vesicle structures could be clearly observed, and a small amount of dark septate endophytes (DSE) were also found. CT treatment had relatively few hyphae, with less vesicular structures and arbuscules, and relatively more DSE. Analysis of variance (ANOVA) revealed that the colonization rate of extraradical hyphae, vesicle structure and spore density were affected by fertilization regime, mango variety and tree ages to a different extent. OT treatment had higher rates of extraradical hyphae and vesicle structure than those of CT treatment. In summary, the AM fungi isolated in this study enriched the AM fungal strain library in China, which would provide a basis for selecting high-efficiency AM fungal inoculants for fruit trees and a new direction for orchard management.
mango; rhizosphere; soil; arbuscular mycorrhizal fungi
S667.7;S154.3
A
10.3969/j.issn.1000-2561.2022.11.018
2022-03-09;
2022-05-10
广西科技基地和人才专项(桂科AD20159001);国家重点研发计划项目(No. 2017YFD0202101)。
栗 晗(1998—),女,硕士研究生,研究方向:果树营养与根际调控。*通信作者(Corresponding author):张金莲(ZHANG Jinlian),E-mail:zhangjinlian1@126.com;陈廷速(CHEN Tingsu),E-mail:2831404955@qq.com。
