甘蔗镰孢菌FsANT基因的克隆及表达模式分析
2022-12-16王彩霞李慧雪周宇明段真珍暴怡雪张木清
王彩霞,黄 振,李慧雪,周宇明,段真珍,暴怡雪,张木清*,姚 伟,3**
甘蔗镰孢菌基因的克隆及表达模式分析
王彩霞1,2,黄 振1,3*,李慧雪1,2,周宇明1,2,段真珍1,3,暴怡雪1,3,张木清1,3**,姚 伟1,2,3**
1. 亚热带农业生物资源保护与利用国家重点实验室,广西南宁 530004;2. 广西甘蔗生物学重点实验室,广西南宁 530004;3. 广西大学农学院,广西南宁 530004
甘蔗是我国主要的糖料作物,是生产蔗糖最主要的原料,甘蔗生产过程中受到的病虫害威胁给蔗糖产业造成了严重的损失。甘蔗镰孢菌()引起的梢腐病是一种真菌性病害,严重影响甘蔗作物生产。镰孢菌致病基因的研究对于梢腐病的防治具有重要意义。腺苷酸转移酶(adenine nucleotide translocase, ANT)介导线粒体与细胞质基质之间ADP/ATP的交换,在真核细胞能量代谢中发挥重要作用,与细胞的生长、发育和凋亡密切相关。本研究克隆获得了长936 bp具有完整开放阅读框(open reading frame, ORF)的甘蔗镰孢菌ANT基因序列,命名为,其编码311个氨基酸,并且与小麦条锈菌病原菌ANT蛋白和小麦白粉病病原菌ANT序列相似性较高。蛋白软件分析显示,该基因编码的蛋白为稳定的疏水蛋白,含有5个跨膜结构,一个ADP/ATP transporter结构域,有3个同源重复的MCF基序,与粒体转运蛋白家族(mitochondrial carrier family,MCF)的基本结构特点相吻合。软件预测分析发现基因可能定位在线粒体。qRT-PCR结果显示,基因在菌丝生长时期的表达相对稳定无显著差异;在与甘蔗互作过程的表达模式表现为:接种后12 h该基因开始上调表达,24 h表达量显著升高,72 h达到表达高峰。推测基因的表达不仅与甘蔗镰孢菌细胞的生长相关,同时可能参与与甘蔗的互作过程,且主要在侵染后期发挥功能。研究病原菌生长保守基因为甘蔗抗梢腐病育种提供新思路。
甘蔗梢腐病;甘蔗镰孢菌;腺苷酸转移酶;基因克隆;表达分析
甘蔗(spp.)不仅是我国最重要的糖料作物,还是关系国计民生的重要战略物资,保障食糖安全已上升成为国家战略[1-2]。广西地区的亚热带气候,适合甘蔗生长的同时也利于各种病害的发生与传播,其中,梢腐病(pokkah boeng disease)是由真菌引起的主要威胁甘蔗梢部幼嫩叶片的病害,轻者使甘蔗梢部叶片褪绿,扭曲变形,严重时会使梢部整个畸形坏死,引起顶腐,甚至造成甘蔗整株死亡[3-4]。近年来甘蔗梢腐病的发病趋势逐年加重,广西作为我国最主要的甘蔗种植地区,其蔗区的梢腐病由以前的零星发生到现在已发展成为甘蔗生长前中期的主要病害。梢腐病的发生不仅出现在广西蔗区,在云南蔗区也有发生,一些高感品种因梢腐病爆发致使甘蔗产量下降30.2%~48.5%,其发生逐渐表现出无规律性、无区域性的特点[5-7]。甘蔗梢腐病的发生导致甘蔗产量下降,影响甘蔗品质(如会引起甘蔗糖分、蔗汁锤度、蔗汁重力纯度等降低)[4, 8],对甘蔗生产以及蔗糖产业的可持续发展构成了严重威胁。甘蔗梢腐病病原菌为半知菌亚门镰刀菌属,我国甘蔗梢腐病病发的主要病原菌有等[9]。研究甘蔗镰孢菌的能量代谢机制是甘蔗梢腐病防治的基础性工作,对甘蔗梢腐病的防治具有重要意义。
线粒体转运蛋白(mitochondrial carrier family, MCF)是位于线粒体膜上的跨膜蛋白,介导细胞质与线粒体之间的能量交换,将在线粒体中产生的多余的能量传递至细胞质中[10]。腺苷酸转移酶(adenine nucleotide translocase, ANT),又称ADP /ATP载体蛋白(ADP/ATP carrier protein, AAC)或ADP/ATP转位酶(ADP/ATP translocase, AAT),是MCF家族的成员并且是含量最丰富的线粒体内膜蛋白[11, 10-13]。MCF motif中的RRRMMM氨基酸序列位于ANT转运的重要位置,负责吸引ADP结合到ANT蛋白上,进而激发转运的发生[10, 14-17]。ANT蛋白富含N-豆蔻酰化位点,N-豆蔻酰化修饰发生在多肽链N端的甘氨酸残基上,赋予蛋白灵活可变的膜结合能力[18-19]。ANT介导ATP与ADP的跨线粒体膜交换,利用产电转运机制,在底物浓度梯度和电子传递链产生的线粒体膜电位的驱动下[11, 20],通过ANT载体2种状态的循环实现ADP/ATP的交换,ANT载体的中心结合位点在线粒体基质开放状态(matrix-open state)下结合ATP并转运至细胞器膜内腔,在细胞质开放状态(cytoplasmic-open state)下专一地与细胞器内等量的ADP分子结合并转移到膜外释放,完成ADP/ATP的转运[13, 21-22]。由于ANT在氧化磷酸化及能量代谢中发挥着重要作用,已经在线虫、哺乳动物、真菌等多种生物体中被广泛研究[10]。除了介导ADP/ATP的转运,在细胞凋亡调控网络中ANT也发挥着重要作用[23]。作为线粒体凋亡途径的关键步骤,线粒体外膜的通透化作用(mitochondrial outer membrane permeabilization, MOMP)触发凋亡因子(如细胞色素c等)的释放,使其从线粒体膜间隙进入细胞质,在细胞质中,这些因子确保了凋亡级联的传播和细胞死亡的执行,但该机制仍存在争议[24]。线粒体通透性转换孔(mitochondrial permeability transition pore compiex, mPTPC)的打开导致线粒体膨大和线粒体外膜破裂,被认为是哺乳动物MOMP发生的关键机制之一。虽然该孔的分子组成尚未完全确定,但有研究认为其主要成分是ANT、电压依赖性阴离子通道(voltage-dependent anion channel, VDAC)和亲环素D(cyclophilin D)[25-27]。ANT作为PTPC最主要的成分之一在介导细胞凋亡调控中具有重要贡献[28]。
目前,已经在多种病原微生物中对ANT蛋白进行了功能初步探究。在小麦白粉病菌()中,王俊美等[17]通过RCAE技术鉴定到1个保守的ANT蛋白BgtAACPx,该蛋白含有ANT蛋白的所有特征,并且该基因在侵染后48~ 72 h表达量显著提升,推测该蛋白可能在形成吸器及菌丝过程中提供能量。在小麦条锈病菌(),TANG等[29]通过同源比对发现1个保守的PstANT蛋白,通过免疫胶体金发现该蛋白定位于真菌线粒体,其3个结构域对其功能具有重要意义,qRT-PCR显示在侵染阶段显著上调表达,推测该蛋白可能与病原菌生长发育有关。综上作为MCF家族成员的基因在病原菌能量代谢以及转换途径中发挥重要作用。本研究在课题组前期获得的甘蔗镰孢菌全基因组数据(未公布)的基础上,通过生物信息学分析,鉴定得到一个腺苷酸转移酶基因。qRT-PCR验证发现基因的表达贯穿甘蔗镰孢菌细胞的生命活动周期,可能与细胞生命活动中的能量供应相关,为进一步解析该基因在致病过程中的作用和制定甘蔗梢腐病防控措施提供理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料及菌株 本研究以‘中蔗1号’为供试甘蔗品种,取蔗茎于温室大棚(广西大学)内桶栽,光周期为16∶8(光照∶黑暗),5叶展齐后用于接种实验,该品种对表现为感病。供试菌株为本实验室分离纯化的甘蔗镰孢菌()菌株,于28℃恒温下PDA/PDW培养基中生长。大肠杆菌Trans1-T1感受态细胞(购自北京全式金生物技术股份有限公司)于37℃恒温条件下LB培养基中生长。
1.1.2 试剂 高纯度DNA纯化回收试剂盒、质粒小提试剂盒购自天根生物技术(北京)有限公司;TB Green®Premix Ex Taq™ II、pMD™18-T Vector Cloning Kit购自宝日医生物技术(北京)有限公司。
1.2 方法
1.2.1 生物信息学分析 蛋白质的理化性质由在线工具ExPASy-Proparam(https://web.expasy.org/ protparam/)分析得到。蛋白质的跨膜区通过在线工具TMHMM Server 2.0(http://www.cbs.dtu.dk/ services/TMHMM/)以及TMPRED(http://www. ch.embnet.org/software/TMPRED form.html/)进行分析。蛋白质的保守结构域通过在线工具Conserved Domain Search(https://www.ncbi.nlm. nih.gov/)预测分析。蛋白的功能位点由在线工具Scanprosite(https://prosite.expasy.org/scanprosite/ scanprosite_doc.html)预测分析。亚细胞定位由在线工具Euk-mPLoc 2.0(http://www.csbio.sjtu.edu. cn/bioinf/euk-multi-2/)预测分析。利用BLAST比对分析软件对克隆目的片段进行同源性分析,利用DNAMAN软件进行多序列比对分析。
1.2.2 总RNA的提取及cDNA合成 甘蔗镰孢菌()于PDA平板上28℃恒温培养72、144、216 h后,提取菌丝RNA。接种甘蔗后,分别于0、12、24、72、120、168 h采集甘蔗叶片,参照TaKaRa MiniBEST Universal RNA Extraction Kit提取总RNA,紫外分光光度计检测样品RNA的浓度和纯度,琼脂糖凝胶电泳检测样品RNA的完整性。利用反转录试剂盒合成cDNA第一链,反应体系和反应程序参照试剂盒(TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix)说明书。
1.2.3 目的基因克隆 利用在线工具Primer- BLAST(https://www.ncbi.nlm.nih.gov/tools/primer- blast/)设计基因的特异性引物F/R(表1),以菌丝cDNA为模板,用高保真酶(2× Phanta®Max Master Mix)进行PCR扩增,反应体系(50 µL)为:

2×Phanta Max Master Mix25 μL Forward Primer (10 μmol/L)1 μL Reverse Primer (10 μmol/L)1 μL cDNA1–5 μL ddH2Oup to 50 μL
PCR反应程序参照2×Phanta®Max Master Mix说明书。反应结束后琼脂糖凝胶电泳进行检测,利用DNA纯化回收试剂盒纯化回收目的基因后,利用DNA A-Tailing Kit(TaKaRa)在DNA片段的3¢末端加“A”尾,连接至pMD18-T Vector克隆载体(TaKaRa),转化至大肠杆菌Trans1-T1,挑取阳性克隆送生工生物工程(上海)股份有限公司测序。
1.2.4 目的基因的表达模式分析 使用LightCycler 96定量PCR仪器进行反应,以反转录得到的cDNA为模板,在Primer-BLAST (https://www.ncbi.nlm.nih.gov/tools/primer-blast/)上进行qRT-PCR引物的设计(表1),选取核糖体18s基因作为内参基因。利用TB Gree(TaKaRa)染料法进行PCR扩增,每个反应设3个生物学重复。反应结束后,按照2–∆∆CT法[30]分析基因在菌丝生长时期以及侵染甘蔗时期的相对表达量。用GraphPad Prism软件进行绘图。
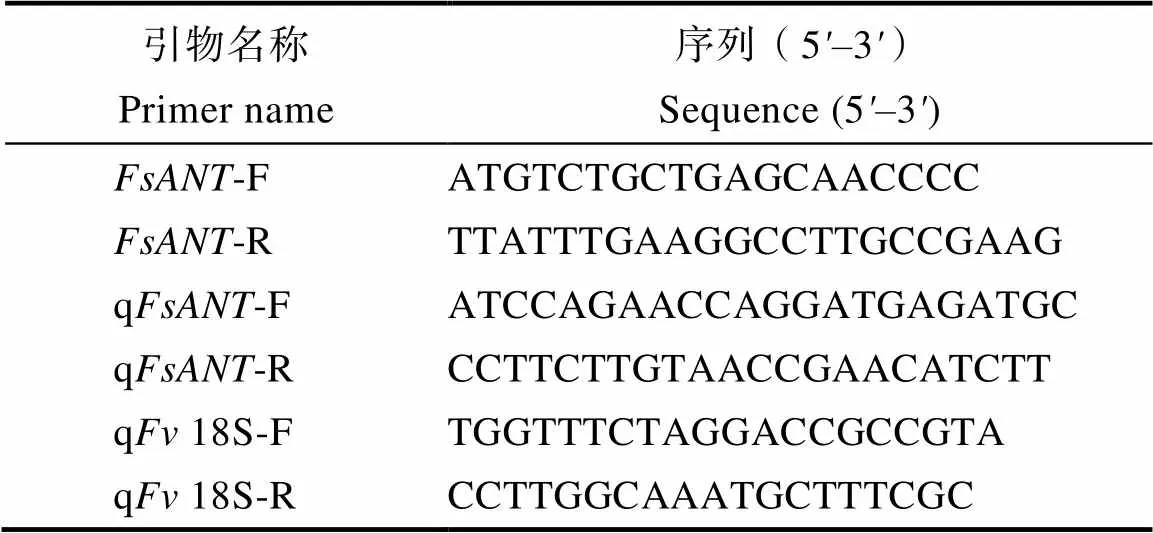
表1 本研究所用引物
2 结果与分析
2.1 FsANT序列分析及同源比对
根据前期测得的甘蔗镰孢菌()基因组,通过BlastP软件分析得到了一个腺苷酸转移酶蛋白序列,基因的ORF框长度为936 bp,编码311个氨基酸。利用NCBI Conserved domian search软件对其保守结构域进行分析,结果显示,FsANT基因编码的氨基酸序列含有1个保守的ADP/ATP transproter结构域(图1)。小麦白粉菌[17]和小麦条锈菌[29]中的ANT蛋白已经报道,下载其蛋白序列。通过软件的比对分析,发现FsANT与已经报道的BgtAACPx,PstANT同源性较高,并且含有相似的结构域(Repeat 1、Repeat 2和Repeat 3)。说明该基因编码的蛋白可能是一个ANT蛋白(图2)。

图1 FsANT保守结构域

图2 FsANT与已知ANT蛋白的多序列比对
2.2 目的基因的克隆
根据已经获得的甘蔗镰孢菌基因ORF设计基因特异性引物-F/R(表1),以菌丝cDNA为模板,进行目的基因克隆。通过琼脂糖凝胶电泳检测得到长度约936 bp大小的条带(图3),克隆测序获得序列与基因组测序结果一致(图4)。
2.3 FsANT生物信息学分析
通过ExPASy-Proparam软件分析其理化性质(表2),其编码蛋白分子量为33 761.390 Da,理论pI值为9.890,亲水性平均系数为0.031,被归类为疏水性蛋白。不稳定系数为24.800(小于40),为稳定蛋白。利用TMHMM和TMPRED软件分析表明(图5),FsANT蛋白含有5个跨膜结构,分别为9~34,116~141,180~204,216~241,280~307位氨基酸,属于跨膜蛋白。Scanprosite分析结果表明ANT蛋白含有3种功能位点,其中3个蛋白激酶C磷酸化位点、3个酪蛋白激酶II磷酸化位点和14个N-豆蔻酰化位点(表3)。其中富含N-豆蔻酰化位点作为ANT蛋白的一个重要特征,说明FsANT可能是一个保守的功能蛋白。利用Euk-mPLoc 2.0软件进行亚细胞定位分析,预测结果表明ANT蛋白亚细胞定位于线粒体。
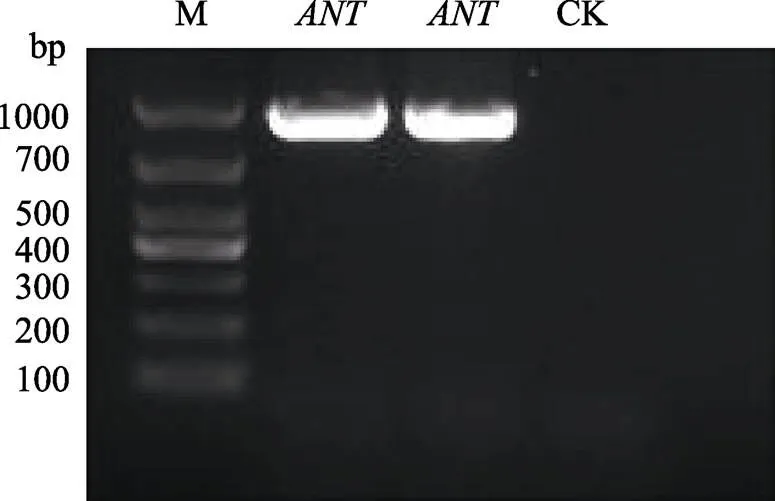
图3 FsANT基因ORF的PCR扩增产物

图4 FsANT基因测序结果

表 2 FsANT蛋白的基本理化性质

图5 FsANT跨膜结构分析
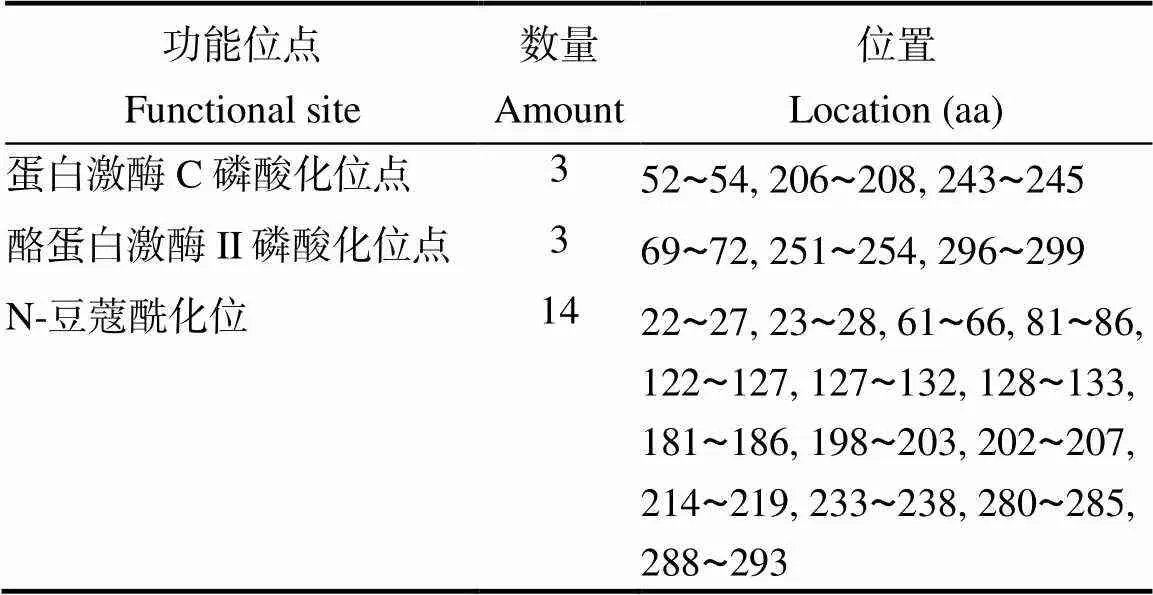
表3 FsANT蛋白的功能位点
ANT的一级结构显示该蛋白有3个重复的同源区域,在每个重复区域都可以找到1个共同的MCF基序(图6),即PxD/ExxK/RxK/R-(20~30个氨基酸残基)-D/EGxxxxaK/RG(其中字母a表示芳香族残基)。Repeat 1、Repeat 2和Repeat 3与已报道的基序基本相同,其中只有单个氨基酸的突变,可能与物种差异性有关。同时Repeat 3出现了RRRMMM序列,这是所有属于MCF的ANT载体蛋白都具有的特征。
2.4 FsANT表达模式分析
通过qRT-PCR分析基因的表达模式,菌丝时期以在PDA平板生长72 h的表达量作为对照(CK,设相对表达量为1);侵染时期以在菌丝时期的表达量作为对照(CK,设相对表达量为1),GraphPad Prism软件绘制表达模式图。基因在生长的各个时期均有表达且表达无显著差异(图7A)。基因的表达贯穿于侵染甘蔗的整个时期,接种后12 h该基因开始上调表达,24 h表达量显著升高,72 h达到表达高峰,与在菌丝体的表达量存在极显著差异,约为菌丝表达量的2.6倍,72 h后表达量开始下降(图7B)。根据先前的研究基础,甘蔗镰孢菌在侵染甘蔗24 h后,分生孢子长出芽管,伸入植物气孔或毛状体;侵染后72 h,菌丝加快生长,从气孔伸出,缠绕毛状体进一步向周边扩散[31]。这表明基因在甘蔗镰孢菌在甘蔗表面定殖及扩散过程中发挥了重要功能,推测可能主要参与能量代谢。

图6 FsANT的3个MCF基序
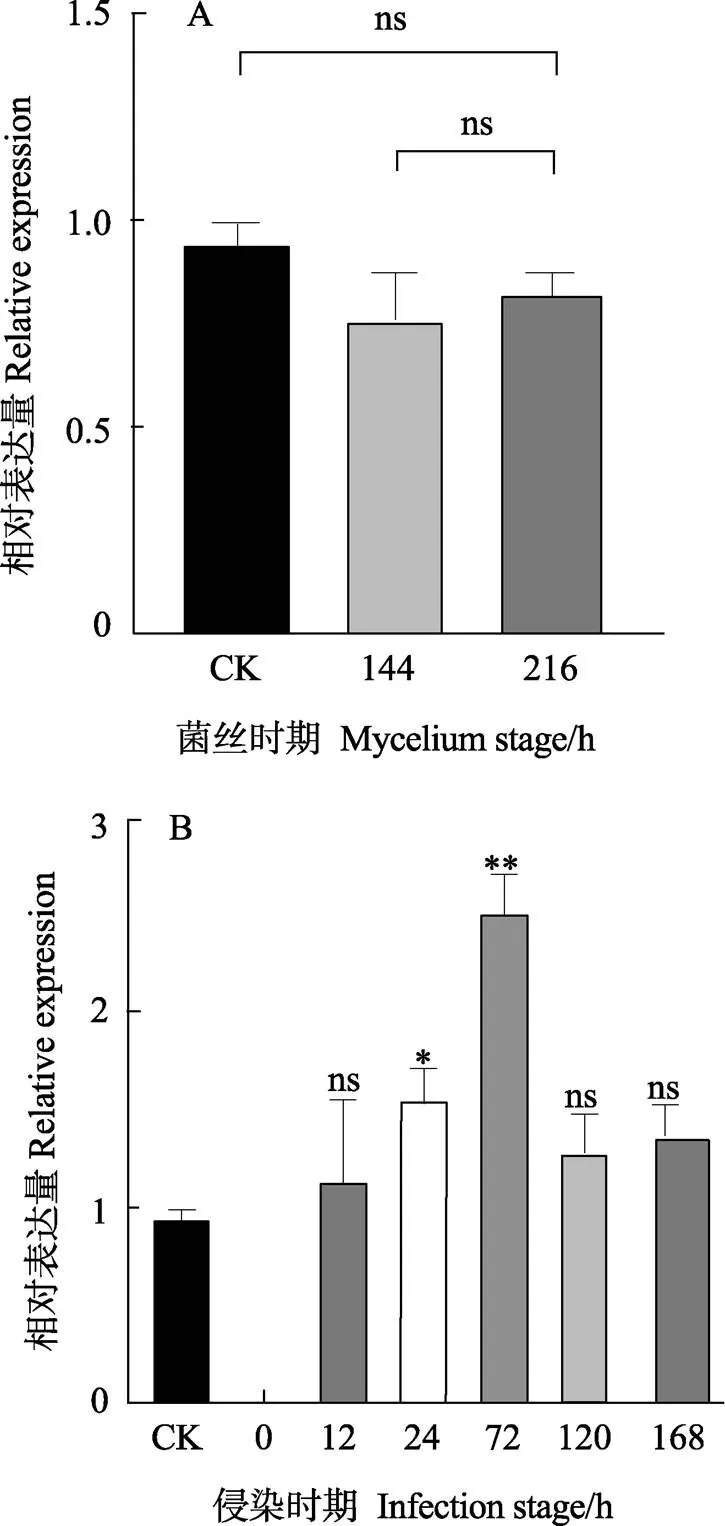
ns表示差异不显著(P>0.05),*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
3 讨论
近年来,随着我国蔗区甘蔗梢腐病的普遍发生,病原菌变异速度较快,所以控制病原菌的危害是一类重要难题。以病原菌生长保守基因为切入点,通过抑制病原菌的繁殖来提高品种抗性,也是一种经济有效的手段。ANT蛋白作为重要的能量转换蛋白,可以转运ADP/ATP,并且可以调控细胞凋亡。PEREIRA等[28]和ZHIVOTOVSKY等[32]发现ANT参与酵母、线虫及哺乳动物的细胞凋亡过程。王俊美等[17]发现基因的表达可能和白粉菌与小麦互作时所需的能量提供有关;TANG等[29]的研究表明基因可能参与小麦条锈菌细胞的能量供应以及细胞凋亡调控过程。本研究从甘蔗梢腐病病原菌中克隆得到了一个936 bp的基因,该基因编码311个氨基酸,含有ADP/ATP transporter结构域,通过DNAMAN多序列比对分析,发现该蛋白与已知的ANT蛋白(PsANT[29], BgtAACPx[17])结构域特征高度相似,推测FsANT蛋白可能与PsANT, BgtAACPx等已报道的ANT蛋白具有类似的功能。
本研究得到的ANT蛋白符合MCF成员的一般特征,通过与已报道的文献相比较[10],ANT蛋白重复表达了“PxD/ExxK/RxK/R-(20~30个残基)- D/EGxxxxa(芳香族氨基酸残基)K/RG”基序,Repeat 1和Repeat 2中出现个别氨基酸的突变,这可能与物种差异性有关;位于ANT转运重要位置的“RRRMMM”序列在Repeat 3中检测到,表明该ANT蛋白可能具有转运ADP/ATP的一般特性。FsANT蛋白定位在线粒体上,这与ANT蛋白在线粒体中发挥功能的特性相一致。在菌丝生长各个时期的表达无显著差异,表达相对稳定,推测该基因可能参与甘蔗镰孢菌细胞整个生长的能量供应;同时该基因在侵染时期上调表达,接种后24 h表达量显著升高,72 h达到表达高峰,与在菌丝体的表达量存在极显著差异。基因的表达模式在其他文献中也有报道,小麦白粉菌基因在侵染72 h表达量最高[17];小麦条锈菌基因在接种后24 h呈现上调表达,接种48 h以及120 h为2个表达高峰期[29]。由此可见,这类基因的表达模式基本相同,表达贯穿病原菌与寄主互作的整个时期,但是主要在侵染后期发挥功能。通过比较病原菌侵染过程的显微观察结果,说明该基因参与分生孢子到芽管的萌发,并且在菌丝定殖甘蔗和扩散中发挥重要功能,推测该基因为病原菌侵染过程提供能量。综上,基因在甘蔗镰孢菌生长的各个时期以及侵染甘蔗过程中均发挥了重要功能,可能与细胞生命活动中的能量供应相关。下一步将通过真菌基因敲除,显微观察,致病力鉴定等进一步探究该基因的功能,并通过HIGS技术讨论该基因对于抗病种质材料创制的意义。
综上,本研究克隆得到了甘蔗镰孢菌的一个腺苷酸转位酶基因,推测该基因可能参与甘蔗镰孢菌的能量代谢。但是,对基因参与能量代谢的机制,还需要进一步研究。
[1] MOORE P H, PATERSON A H, TEW T. Sugarcane: the crop, the plant, and domestication[M]. Oxford: Wiley Blackwell, 2013.
[2] 李 明, 田洪春, 黄智刚. 我国甘蔗产业发展现状研究[J]. 中国糖料, 2017, 39(1): 67-70.
LI M, TIAN H C, HUANG Z G. Research on the development status of sugarcane industry in China[J]. Sugar Crops of China, 2017, 39(1): 67-70. (in Chinese)
[3] SITI N, MOHAMED S. Pathogenicity and aethiology of fusarium species associated with pokkah boeng disease on sugarcane[D]. Pulau Pinang: University Sains Malaysia, 2007.
[4] 王泽平, 刘 璐, 高轶静, 罗 霆, 段维兴, 张保青, 杨翠芳, 周 珊, 张革民. 我国甘蔗梢腐病2种主要病原菌孢子萌发特性及品种(系)抗性评价[J]. 西南农业学报, 2017, 30(3): 595-601.
WANG Z P, LIU L, GAO Y J, LUO T, DUAN W X, ZHANG B Q, YANG C F, ZHOU S, ZHANG G M. Conidial germination of two principal pathogen of pokkah boeng disease in China, and resistance evaluation of sugarcane varieties[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2017, 30(3): 595-601. (in Chinese)
[5] 李伟伟, 赵四东, 黄 璐. 广西甘蔗糖业发展态势分析及其升级转型对策研究[J]. 热带农业科学, 2017(11): 122-128.
LI W W, ZHAO S D, HUANG L. Study on the development trend, upgrading and transformation strategy of sugarcane industry in Guangxi[J]. Chinese Journal of Tropical Agriculture, 2017(11): 122-128. (in Chinese)
[6] 张玉娟. 甘蔗梢腐病病原分子检测及甘蔗组合、品种的抗病性评价[D]. 福州: 福建农林大学, 2009.
ZHANG Y J. Molecular detection and resistance evaluation for pokkah boeng disease of sugarcane[D]. Fuzhou: Fujian Agriculture and Forestry University, 2009. (in Chinese)
[7] MENG J R, HUANG H J, LI Y X. First report ofcausing sugarcane pokkah boeng in China[J]. Plant Disease. 2020, 104: 1553-1554.
[8] 单红丽, 李文凤, 张荣跃, 王晓燕, 李 婕, 仓晓燕, 尹 炯, 罗志明, 黄应昆. 甘蔗梢腐病暴发流行原因及产量糖分损失测定[J]. 中国糖料, 2018, 40(3): 40-42, 45.
SHAN H L, LI W F, ZHANG R Y, WANG X Y, LI J, CANG X Y, YIN J, LUO Z M, HUANG Y K. Analysis on epidemic reason of sugarcane pokahh boeng and its losses on yield and sucrose content[J]. Sugar Crops of China, 2018, 40(3): 40-42, 45. (in Chinese)
[9] LIN Z Y, XU S Q, QUE Y X. Species-specific detection and identification of Fusarium species complex, the causal agent of sugarcane pokkah boeng in China[J]. PLoS One, 2014, 9 (8): e104195.
[10] NURY H, DAHOUT-GONZALEZ C, TREZEGUET V. Relations between structure and function of the mitochondrial ADP/ATP carrier[J]. Annu Rev Biochem, 2006, 75: 713-41.
[11] CHAN K W, SLOTBOOM D J, COX S. A novel ADP/ATP transporter in the mitosome of the microaerophilic human parasite[J]. Current Biology, 2005, 15(8): 737-742.
[12] KING M S, KERR M, CRICHTON P G. Formation of a cytoplasmic salt bridge network in the matrix state is a fundamental step in the transport mechanism of the mitochondrial ADP/ATP carrier[J]. Biochimica et Biophysica Acta, 2016, 1857(1): 14-22.
[13] KLINGENBERG M. The ADP and ATP transport in mitochondria and its carrier[J]. Biochimica et Biophysica Acta, 2008, 1778(10): 1978-2021.
[14] MHLMANN T, TJADEN J, SCHWPPE C. Occurrence of two plastidic ATP/ADP transporters inL. molecular characterisation and comparative structural analysis of similar ATP/ADP translocators from plastids and rickettsia prowazekii[J]. European Journal of Biochemistry, 1998, 252(3): 353-359.
[15] HASHIMOTO M, MAJIMA E, GOTO S. Fluctuation of the first loop facing the matrix of the mitochondrial ADP/ATP carrier deduced from intermolecular crosslinking of Cys56 residues by bifunctional dimaleimides[J]. Biochemistry, 1999, 38(3): 1050-1056.
[16] AQUILA H, MISRA D, EULITZ M. Complete amino acid sequence of the ADP/ATP carrier from beef heart mitochondria[J]. Physiology Chemistry, 1982, 363(3): 345-349.
[17] 王俊美, 徐 飞, 宋玉立, 李亚红, 韩自行, 李丽娟, 张姣姣. 小麦白粉菌ADP/ATP载体蛋白基因的克隆及表达特征分析[J]. 植物病理学报, 2018, 48(3): 339-345.
WANG J M, XU F, SONG Y L, LI Y H, HAN Z X, LI L J, ZHANG J J. Cloning of an ADP/ATP carrier protein-coding geneinf. sp.and analysis on its expression pattern during infection process[J]. Acta Phytopathologica Sinica, 2018, 48(3): 339-345. (in Chinese)
[18] KIMURA A, KURATA Y, NAKABAYASHI J. N -Myristoylation of the Rpt2 subunit of the yeast 26S proteasome is implicated in the subcellular compartment-specific protein quality control system[J]. Journal of Proteomics, 2016, 130: 33-41.
[19] YOHANNAN S, FAHAM S, YANG D. The evolution of transmembrane helix kinks and the structural diversity of G protein-coupled receptors[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(4): 959-963.
[20] KLINGENBERG M. The ADP/ATP Carrier in mitochondrial membranes[J]. The Enzymes of Biological Membranes, 1985(1): 511-553.
[21] KIM Y H, HAIDL G, SCHAEFER M. Compartmentalization of a unique ADP/ATP carrier protein SFEC (sperm flagellar energy carrier, AAC4) with glycolytic enzymes in the fibrous sheath of the human sperm flagellar principal piece[J]. Developmental Biology, 2007, 302(2): 463-476.
[22] RUPRECHT J J, KING M S, ZOGG T. The molecular mechanism of transport by the mitochondrial ADP/ATP carrier[J]. Cell, 2019, 176(3): 435-477.
[23] PFAFF E, KLINGENBERG M. Adenine nucleotide translocation of mitochondria[J]. European Journal of Biochemistry, 1968, 6(1): 66-79.
[24] KINNALLY K W, ANTONSSON B. A tale of two mitochondrial channels, MAC and PTP, in apoptosis[J]. Apoptosis, 2007, 12(5): 857-868.
[25] MARTINOU J C, DESAGHER S, ANTONSSON B. Cytochrome c release from mitochondria: all or nothing[J]. Nature Cell Biology, 2000, 2(3): 41-43.
[26] BRAS M, QUEENAN B, SUSIN S A. Programmed cell death via mitochondria: different modes of dying[J]. Biochemistry, 2005, 70(2): 231-239.
[27] CROMPTON M , The mitochondrial permeability transition pore and its role in cell death[J]. Biochem, 1999, 341(2): 233-249.
[28] PEREIRA C, CAMOUGRAND N, MANON S. ADP/ATP carrier is required for mitochondrial outer membrane permeabilization and cytochrome c release in yeast apoptosis[J]. Molecular Microbiology, 2007, 66(3): 571-582.
[29] TANG C L, WEI J P, HAM Q M, LIU R, DUAN X Y, FU Y P, HUANG X L.ANT, the adenine nucleotide translocase of, promotes cell death and fungal growth[J]. Scientific Reports, 2015, 5(1): 2045-2322.
[30] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR[J]. Methods, 2001, 25(4): 402-408.
[31] 刘丹丹, 姚姿婷, 赖小群, 姚 潇, 张木清, 邹承武, 陈保善. 甘蔗梢腐病轮枝镰刀菌侵染甘蔗叶片的显微观察[J]. 中国糖料, 2019, 41(4): 41-45.
LIU D D, YAO Z T, LAI X Q, YAO X, ZHANG M Q, ZHOU C W, CHEN B S. Microscopic observation on the infection of sugarcane leaves by pokkah boeng pathogen[J]. Sugar Crops of China, 2019, 41(4): 41-45. (in Chinese)
[32] ZHIVOTOVSKY B, GALLUZZI L, KEPP O. Adenine nucleotide translocase: a component of the phylogenetically conserved cell death machinery[J]. Cell Death and Differentiation, 2009, 16(11): 1419-1425.
Cloning of anGene inand Analysis on Its Expression Pattern During Infection Process
WANG Caixia1,2, HUANG Zhen1,3*, LI Huixue1,2, ZHOU Yuming1,2, DUAN Zhenzhen1,3, BAO Yixue1,3, ZHANG Muqing1,3**, YAO Wei1,2,3**
1. State Key Lab of Conservation and Utilization of Agric-Biological Resources, Nanning, Guangxi 530004, China; 2. Guangxi Key Lab of Sugarcane Biology, Nanning, Guangxi 530004, China; 3. College of Agriculture, Guangxi University, Nanning, Guangxi 530004, China
Sugarcane is the main sugar crop in China and the most important raw material for sugar production. The threat of diseases and insect pests in sugarcane production has caused serious losses to the sugar industry. Tip rot caused byis a fungal disease that seriously affects sugarcane crop production. It is of great significance to study the pathogenic genes of. Adenine nucleotide translocase (ANT) mediates the exchange of ADP/ATP between mitochondria and cytoplasmic matrix, which plays an important role in eukaryotic cell energy metabolism and is closely related to cell growth, development and apoptosis. In this study, a 936 bp ANT gene sequence ofwith a complete open reading frame (ORF) was cloned, tentatively named, encoding 311 amino acids.protein ofwas found to cluster with ANT protein of other pathogens, indicating thatmay had the similar function. Softwares analysis showed that the protein encoded by this gene was a stable hydrophobic protein, containing five transmembrane structures. In addition, ANT has three homologous and repeated MCF motifs in one ADP/ATP transporter domain, which conforms to the basic structural characteristics of Mitochondrial carrier family (MCF). The software predicted that the gene might target mitochondria. qRT-PCR results showed thatgene expression was relatively stable during mycelia growth period without significant difference. In the process of interaction with sugarcane, the expression pattern of this gene began to be up-regulated 12 h after inoculation, and increased significantly 24 h after inoculation, and reached its peak at 72 h. It is speculated that the expression ofgene was not only related to the growth ofcells, but also maight participate in the interaction betweenand sugarcane, and mainly played a role in the later stage of infection. The study of pathogenic growth conserved genes would provide a new idea for sugarcane breeding against pokkah boeng disease.
sugarcane pokkah boeng disease;; adenine nucleotide translocase (ANT); gene clone; expression analysis
S435.661
A
10.3969/j.issn.1000-2561.2022.11.007
2022-01-25;
2022-03-21
广西重点研发计划项目(桂科AB21238008);国家自然科学基金项目(No. 32001603);国家现代农业糖料产业技术体系项目(No. CARS-170726)。
王彩霞(1998—),女,硕士研究生,研究方向:甘蔗遗传育种;*同等贡献作者:黄 振(1994—),男,博士研究生,研究方向:甘蔗遗传育种。**通信作者(Corresponding author):姚 伟(YAO Wei),E-mail:yaoweimail@163.com;张木清(ZHANG Muqing),E-mail:zmuqng@163.com。
