橡胶树ICE转录因子对盐胁迫的响应及功能鉴定
2022-12-16杨署光史敏晶田维敏
李 言,杨署光,史敏晶,田维敏
橡胶树ICE转录因子对盐胁迫的响应及功能鉴定
李 言,杨署光,史敏晶,田维敏*
中国热带农业科学院橡胶研究所/农业农村部橡胶树生物学与遗传资源利用重点实验室/海南省热带作物栽培生理学重点实验室,海南海口 571101
ICE(inducer of CBF expression)是类似MYC(myelocytomatosis)的bHLH(basic helix-loop-helix)转录因子,在植物应对低温、干旱、高盐等非生物胁迫中起重要的调节作用。本研究通过qPCR分析橡胶树ICE家族成员的表达模式。结果表明:5个ICE家族成员均响应盐胁迫上调表达。在盐胁迫2 h时,、、和显著上调表达;在盐胁迫4 h时,和的表达量达到最大值,其中的上调幅度最大;在盐胁迫4 h内无显著变化,但在处理8 h时显著上调表达。过表达这5个ICE家族成员均可不同程度地提高拟南芥的耐盐性,其中过表达的植株对盐胁迫的抗性最强,在盐胁迫下,野生型拟南芥(WT)全部枯萎,而转化植株的存活率为96.29%,平均单株鲜重为0.03 g,平均单株干重为0.0035 g,在HbICE家族成员转化株系中均表现最高。在盐胁迫下,WT和转基因植株的电导率均显著增加,叶绿素含量和相对含水量均显著降低,其中转化植株的相对电导率的增加幅度最小,叶绿素含量和相对含水量的降低幅度最小。因此,转化植株的抗盐性可能与增强膜系统的稳定性和减缓叶绿素降解和保持相对含水量有关。该研究结果对橡胶树HbICE家族成员的生物学功能有了新的认识,有望为改良农作物耐盐性提供候选靶基因。
橡胶树;ICE;耐盐性;功能鉴定
植物在漫长的进化过程中形成了高效且复杂的生理生化机制,以适应低温、干旱、高盐等非生物胁迫。这些生理和生化过程的改变涉及到基因转录的变化,如盐胁迫下,ICEs的表达量发生变化[1]。ICE(inducer of CBF expression)是类似于MYC(myelocytomatosis)的bHLH(basic helix-loop-helix)转录因子,调节植物应对低温、干旱、高盐等非生物胁迫。ICE和MYC类转录因子均具有相似的结构域,如富含S(serine)区、NLS(nuclear localization signal)区、bHLH结构域、Zipper结构域和二聚体化功能域[2-5]。但是,ICE转录因子不同于MYC转录因子的结构特征在于其bHLH结构域中含有一段高度保守的氨基酸序列:KMDRASILGDAI(D/E)YLKELL[4, 6]。
ICEs在植物激素介导的植物应对环境胁迫反应中起着非常重要的转录调控作用[7-10]。在水稻[4]、西红柿[11]、小麦[12]、结缕草[13]和拟南芥[1]等植物中的基因响应低温、干旱和高盐胁迫,能够显著提高植物的逆境胁迫抗性。正常条件下,ICE转录因子与JAZ互作处于无活性状态;低温胁迫下,植物快速合成活性形式茉莉酸(jasmonyl isoleucine, JA-Ile),且被茉莉酸(jasmonicacid, JA)受体COI1(coronatine-insensitive 1)感知,含有F-box蛋白COI1的复合物招募茉莉酸信号途径抑制因子JAZ,然后泛素化被26S蛋白酶体降解,从而释放出ICE转录因子,该转录因子可特异性结合到CBF(C-repeat binding factor)启动子的顺式作用元件G-box(CANNTG)上,控制着CBF信号转导途径各组分的转录水平[14],显著提高植物的抗寒性。ICE不仅能够提高植物的抗寒性,还能够提高植物的耐旱、耐盐等功能。在拟南芥中,转录因子能够与基因的启动子结合从而启动基因转录,增强拟南芥的抗寒性[3],过表达还能够提高转基因水稻的耐旱性和耐盐性[1]。过表达结缕草同样可以增强转基因拟南芥的耐旱性和耐盐性[13]。高盐胁迫下,西红柿极显著上调表达,且能够提高转基因烟草的耐盐性[11]。
橡胶树(Muell. Arg.)是典型的热带经济作物,是世界天然橡胶的主要来源。我国植胶区处于热带北源,属于非传统植胶区。橡胶树种植业除了遭受低温和干旱胁迫外,还会受到高盐胁迫。有些植胶区高温干旱,降雨量少,土壤的风化淋溶程度较低,土壤盐度较大,pH高于橡胶树适宜生长的酸碱度(pH 4.5~5.5),如海南省昌江黎族自治县的红田植胶区,该地区的pH较高,土壤盐度较大,影响土壤有机质的分解和营养元素的释放,从而抑制橡胶树的生长发育[15]。另外,我国有1×108hm2盐碱地,其中有3.33×107hm2具有开发利用潜力,如果盐碱地作物发展起来,将对保障中国粮仓、端牢中国饭碗起到重大作用[16]。除了盐碱地土壤治理外,推进耐盐作物培育也是重要的治理措施。目前,通过转基因手段创制出许多耐盐植物种质,其中农作物就有26种[17],这为盐碱地的开发提供了良好的作物资源。研究表明,ICEs转录因子在植物的耐盐胁迫调控中具有重要的作用。本研究通过qPCR分析橡胶树ICE家族成员在盐胁迫下的表达模式,借助遗传转化技术鉴定橡胶树ICE家族成员的耐盐功能,为解析ICE在橡胶树应答盐胁迫中的调控机制提供理论依据。同时也为培育耐盐农作物新品种提供优质的基因资源。
1 材料与方法
1.1 材料
实验材料为橡胶树无性系‘93-114’处于一蓬叶稳定期的芽接苗,橡胶树HbICEs家族成员转基因株系种子和哥伦比亚野生型拟南芥种子为本实验室保存。RNAprep Pure多糖多酚植物总RNA提取试剂盒、快速质粒小提试剂盒和Fastking一步法出基因组cDNA第一链合成预混试剂购于天根生化科技有限公司,2×TB GreenTMPremix Ex TaqTMⅡ(TliRNaseH Plus)购于大连宝生物公司,其他生化试剂及耗材均为进口或国产分析纯试剂。引物合成由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 材料处理 盐胁迫处理需要的恒温培养箱(PGR15,COVVILN,加拿大)条件设置为:光照强度为125 μmol/(m2·s),16 h光照和8 h黑暗,相对湿度为80%,温度为28℃。将30株生长一致的橡胶树‘93-114’芽接苗置于培养箱中预培养2 d,平均分为处理组和对照组,用400 mmol/L NaCl溶液浇灌处理组幼苗1次,用同样体积的水浇灌对照组,然后继续培养,分别在时间点0、2、4、8、12、24 h收集叶片,每个时间点采集5株幼苗各1片树叶,等量制成1个混合样,处理组和对照组各15株幼苗制成3个生物学重复[18]。将采集的样品迅速置于液氮中,后续用于总RNA的提取。
1.2.2 总RNA提取和cDNA合成 通过RNAprep Pure多糖多酚植物总RNA提取试剂盒提取采集样品的总RNA。利用Fastking一步法出基因组cDNA第一链合成预混试剂合成cDNA。
1.2.3 qPCR分析 采用CFX384实时荧光定量PCR系统(Bio-Rad,加利福尼亚,美国)进行qPCR分析。稀释10倍的cDNA作为qPCR模板。反应总体系为10 µL,其中模板1 µL,2×TB GreenTMPremix Ex TaqTMⅡ5 µL,正向和反向引物各0.3 µL,最后用无菌去离子水补足10 µL。和内参基因、、的引物参照LI等[19]已发表的文献。qPCR反应程序为:95℃预变性30 s;95℃变性10 s,60℃退火20 s,72℃延伸20 s,40个循环后分析溶解曲线。相对表达量通过2–DDCT法进行计算。
1.2.4 耐盐性分析 为了鉴定HbICEs家族成员的耐盐性,待转基因株系种子萌发后,移栽至基质培养土中,置于光照培养箱中培养,培养箱条件设置为:光照强度为200 μmol/(m2·s),12 h光照和12 h黑暗,光照时温度为23℃,黑暗时温度为21℃,相对湿度为80%。用300 mmol/L氯化钠溶液浇灌生长2周的野生型拟南芥(WT)和转基因株系,5 d淋1次。统计盐处理前每个株系的株数以及盐处理后每个株系的存活株数、鲜重和干重等。
1.2.5 生理指标测定 相对叶绿素含量的测定:待培养土中的野生型拟南芥和转基因株系生长4周时,用300 mmol/L氯化钠溶液浇灌,5 d淋1次。盐胁迫7 d后,使用SPAD-502 PLUS叶绿素仪测定每个株系的平均叶绿素含量(SPAD值)。相对含水量的测定:取盐胁迫7 d的WT和各转基因株系相同部位的叶片,测定叶片鲜重(1);然后将叶片放入含有50 mL去离子水的离心管中,浸泡6 h,叶片吸水至饱和,取出叶片,用吸水纸吸干叶片表面残留的水,再测定叶片的重量(2);最后将叶片放入85℃的烘箱中,过夜烘干至恒重,称烘干叶片的重量(3)。相对含水量=(1–3)/(2–3)×100%[5]。相对电导率的测定:用梅特勒FiveEasy plus电导率仪测定各样品的相对电导率,取WT及各株系相同部位干净的叶片0.2 g,剪成5 mm×5 mm的碎片,放入含有30 mL超纯水的离心管中;置于真空干燥器中,抽真空10 min,叶片呈水渍状;从真空干燥器中取出,置于室温条件下30 min,每5 min震荡1次,用准备好的电导率仪测定电导率L1;将离心管置入沸水中,水浴20 min,期间震荡2次,取出冷却至室温后测定电导率L2;相对电导率= L1/L2×100%[5]。
1.3 数据处理
采用T-test方法对基因相对表达量、生理指标等进行差异显著性分析。
2 结果与分析
2.1 盐胁迫对橡胶树ICEs基因表达的影响
在橡胶树无性系‘93-114’叶片中,HbICEs家族成员均响应盐胁迫的诱导,但是其表达量和响应盐胁迫的时间有差异。在本底表达中,和的表达量较高,其次是,和的表达量最低(图1)。在盐处理8 h后,才响应胁迫显著上调表达,上调表达趋势持续至24 h。在盐处理2 h时,的表达量极显著上调表达,增至最高值,是本底表达量的2倍,然后表达量逐渐降低,在处理8 h和12 h恢复为本底表达水平,24 h时又上调表达。在盐处理2 h时,的表达量极显著上调表达,然后持续显著下调表达。在盐处理条件下,的表达量迅速极显著上调表达,在处理4 h时表达量增至最高值,是本底表达量的2倍以上,然后表达量逐渐降低,在处理12 h恢复为本底表达水平,24 h时又上调表达。在盐处理条件下,的表达量迅速极显著上调表达,在处理4 h时表达量增至最高值,然后表达量逐渐降低,在处理8 h和12 h时表达量显著低于本底表达水平,24 h时又上调表达(图1)。

**和*分别表示差异极显著(P<0.01)和差异显著(P<0.05)。
2.2 过表达HbICEs对拟南芥耐盐性的影响
将、、、和转化的拟南芥株系和WT植株培养2周,然后用300 mmol/L氯化钠溶液浇灌,盐胁迫培养1周。表型鉴定结果显示,WT植株全部枯死,转化株系生长受到抑制,部分植株已枯死,存活率为62.96%。转化株系部分植株已枯死,存活率与转化株系的无显著差异。转化株系的枯死株数最多,存活率最低为39.50%。转化株系的枯死株数最少,存活率最高为96.29%。转化株系的部分植株枯死,存活率为73.59%(图2A、图2B)。存活的和转化植株的平均单株鲜重最大,其次是和,转化植株的平均单株鲜重最小(图2C)。不同转基因平均单株间干重高低差异与鲜重的基本一致。和转化植株的平均单株干重最高,其次是,和转化植株的平均单株干重最低(图2D)。表明HbICEs家族能够增强转基因株系的耐盐性,但增强耐盐的程度不同。
2.3 过表达HbICEs对拟南芥生理指标的影响
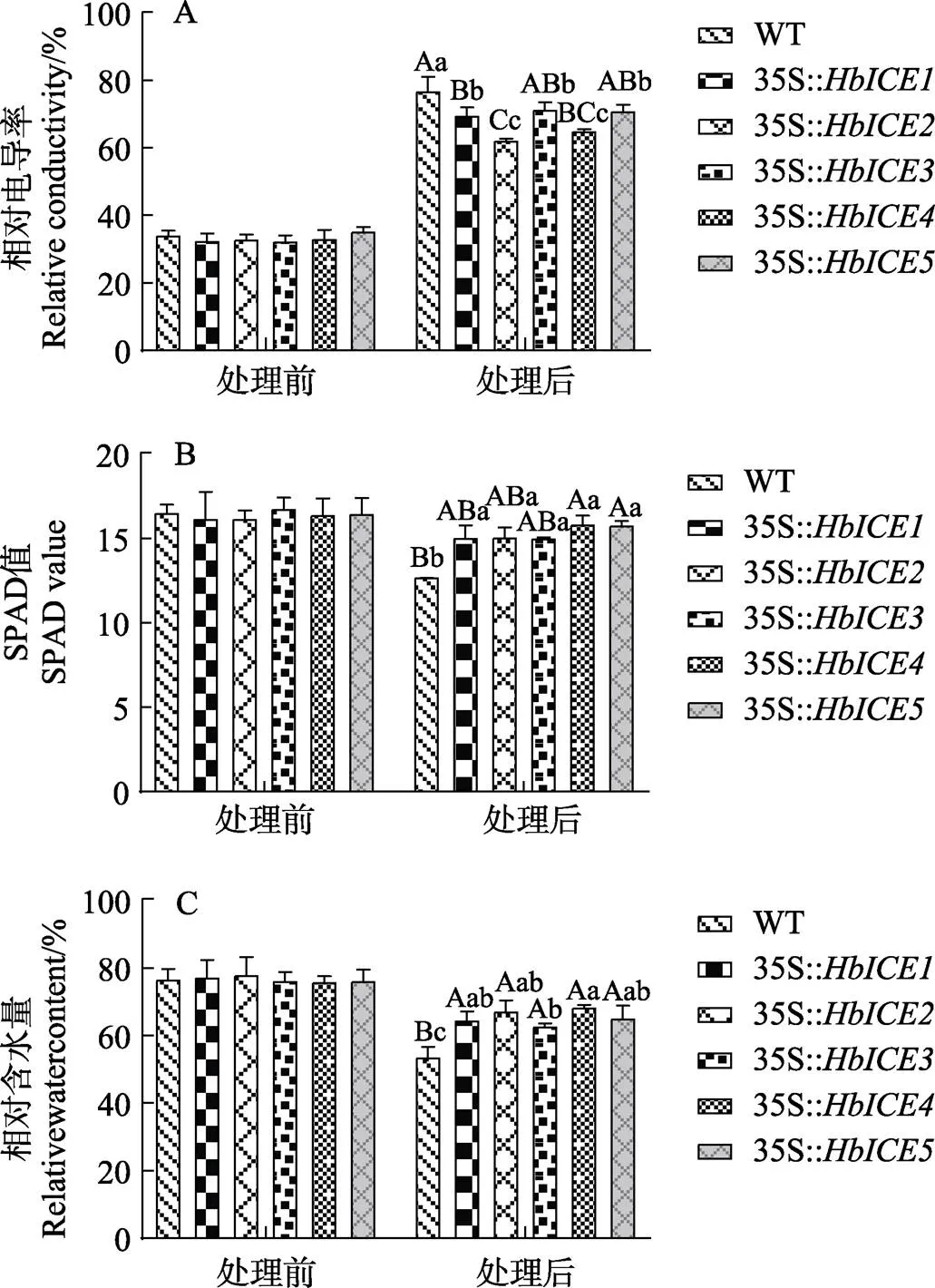
相对电导率测定结果显示,在高盐胁迫前,家族成员转基因植株的相对电导率与WT无显著差异。高盐胁迫后,家族成员转基因植株和WT植株的相对电导率大幅度上调,是处理前的2倍左右。但过表达、、、和的拟南芥转化植株的相对电导率显著低于WT植株(图3A)。在5种类型的转基因植株之间,、和的转化植株的相对电导率较高,而和的转化植株的相对电导率较低(图3A)。值测定结果显示,在高盐胁迫前,家族成员转基因植株的叶绿素含量与WT无显著差异(图3B)。高盐胁迫下,WT植株的叶绿素含量显著下调,家族成员转基因植株的叶绿素含量也小幅度下调,但叶绿素含量仍显著高于WT植株,其中以转化的拟南芥植株叶绿素含量最高(图3B)。相对含水量测定结果显示,在高盐胁迫前,家族成员转基因植株的叶绿素含量与WT无显著差异。高盐胁迫下,家族成员转基因植株和的WT植株相对含水量不同幅度降低,但过表达、、和基因的拟南芥植株的相对含水量仍显著高于WT植株,其中以转化植株相对含水量较低,和转化植株相对含水量较高(图3C)。

不同大小写字母分别表示差异极显著(P<0.01)和差异显著(P<0.05)。
3 讨论
在橡胶树基因组中有5个ICE家庭成员,它们不仅响应低温和干旱的诱导,还能够提高转基因植株的抗寒性和抗旱性[5]。本研究结果表明橡胶树5个ICE家庭成员也响应盐胁迫,参与橡胶树盐胁迫反应,但它们的表达模式和表达量各不相同。在盐胁迫下,、和的表达量迅速上调,在处理2 h或4 h时达到最大值,然后表达量降低,在处理12 h时,和恢复本底表达,呈下调表达,在处理24 h时,3个基因的表达量又显著上调。、和在盐胁迫下的表达模式基本一致,推测它们具有耐盐功能的冗余性。西红柿响应盐胁迫上调表达[11]。在高盐胁迫下,水稻(OrbHLH001)[20]和结缕草[13]同样上调表达,这就说明ICE对于植物调控盐胁迫逆境反应可能具有保守性。
过表达水稻(OrbHLH2)基因上调、、和等胁迫相关基因的表达,从而显著增强植株对盐和渗透胁迫的耐受性[21]。盐胁迫下,激活的OrICE1诱导基因的表达,并将信号向下转导。特异性地与启动子区域内的DRE/ CRT元件相结合,从而调节、以及等基因表达,最终应答多种逆境胁迫[22]。(OrbHLH001)能够特异性结合启动子的E-box元件上,通过调控的表达维持细胞内钠离子和钾离子的平衡[23]。本研究表明,过表达橡胶树也能够提高转基因拟南芥的耐盐性,5个橡胶树HbICE成员可能与水稻一样,通过调控下游基因、、、和的转录调节植物响应盐胁迫。在5个橡胶树HbICE成员中,转基因植株的耐盐性最高,可能与增强膜系统的稳定性和渗透调节有关,其机制可能与油菜相似,通过激活抗氧化系统提高膜系统的稳定性[24]。此外,还可能通过提高脯氨酸、可溶性糖等物质含量调节植物细胞渗透平衡[24-25],维持细胞膜膜系统的稳定性,降低电导率。叶绿素是植物光合色素,反映植物生长状况,是耐盐性指标之一。盐胁迫导致植物叶绿体受到破坏,膜系统受损,促使叶绿素降解[26-27]。过表达的植株在盐胁迫下的膜系统受损程度较轻,减缓了叶绿素的降解,所以它的叶绿素含量显著高于WT,生长情况较好。该结果与油菜的功能一致,盐胁迫下转基因植株的叶绿素含量显著高于盐胁迫的对照[24]。另外,相对含水量反映植物逆境抗性的重要指标。过表达的植株在盐胁迫下的膜系统受损程度较轻,膜的透性较低,水溶性物质外渗较少,植物失水也较少,所以的植株在盐胁迫下的相对含水量显著高于盐胁迫下的WT。转化植株在盐胁迫下含有更多的水,冲淡细胞内盐分的浓度,降低盐胁迫的损害,这一结果与李光道等[26]阐述的“稀盐”说法一致。
不同大小写字母分别表示差异极显著(P<0.01)和差异显著(P<0.05)。
我国盐碱地面积较大,可开发利用的盐碱地就有3.33×107hm2,我国大力开展盐碱地治理工作。培育耐盐作物也是重要的治理措施。通过分子标记、基因编辑、基因过表达等生物技术培育了耐盐水稻[28]、耐盐大豆[29-30]、耐盐油菜[31]等经济作物,为开发利用我国的盐碱地提供了良好的作物资源。ICEs是重要的植物转录因子,参与各种非生物胁迫应答调控,其下游靶基因DREB同样可以调控植物响应非生物胁迫反应。高表达DREBs可增强大豆、油菜等作物的耐盐性[29-31]。橡胶树ICEs不仅能够提高转基因植物的耐寒和耐旱性[5],还能够提高转基因植物的耐盐性,为培育抗逆农作物新品种提供优质基因资源。
[1] VERMA R K, KUMAR V V S, YADAV S K, KUMAR T S, RAO M V, CHINNUSAMY V. Overexpression ofenhances yield and multiple abiotic stress tolerance in indica rice[J]. Plant Signaling and Behavior, 2020, 15(11): 1814547.
[2] BADAWI M, REDDY Y V, AGHARBAOUI Z, TOMINAGAY, DANYLUK J, SARHAN F, HOUDE M. Structure and functional analysis of wheat(inducer of CBF expression) genes[J]. Plant Cell Physiology, 2008, 49: 1237-1249.
[3] CHINNUSAMY V. ICE1: a regulator of cold-induced transcriptome and freezing tolerance in[J]. Genes Development, 2003, 17: 1043-1054.
[4] NAKAMURA J, TAKASHI YUASA T, HUONG TT, HARANO K, IWAYA-INOUE M. Rice homologs of inducer of CBF expression (OsICE) are involved in cold acclimation[J]. Plant Biotechnology, 2011, 28: 303-309.
[5] LI Y, QUAN C, YANG S, WU S, SHI M, WANG J, TIAN W MFunctional identification of ICE transcription factors in rubber tree[J]. Forests, 2022, 13(1): 52.
[6] TOLEDO-ORTIZ G, HUQ E, QUAIL P H. Thebasic/helix-loop-helix transcription factor family[J]. Plant Cell, 2003, 15: 1749-1770.
[7] NIU Y, FIGUEROA P, BROWSE J. Characterization of JAZ interacting bHLH transcription factors that regulate jasmonate responses in[J]. Journal of Experimental Botany, 2011, 62(6): 2143-2154.
[8] MIURA K, NOZAWA R. Overexpression ofenhances tolerance to cold and salt stresses and attenuates response to abscisic acid in[J]. Plant Biotechnology, 2014, 31(2): 167-172.
[9] HU Y, JIANG Y, HAN X, WANG H, PAN J, YU D. Jasmonate regulates leaf senescence and tolerance to cold stress: crosstalk with other phytohormones[J]. Journal Experimental Botany, 2017, 68(6): 1361-1369.
[10] HU Y, JIANG L, WANG F, YU D. Jasmonate regulates the inducerof cbf expression-c-repeat binding factor/dre bindingfactor1 cascade and freezing tolerance in[J]. The Plant Cell, 2013, 25(8): 2907-2924.
[11] FENG H L, MA N N, MENG X, ZHANG S, WANG J R, CHAI S, MENG Q W. A novel tomato MYC-type ICE1-like transcription factor, SlICE1a, confers cold, osmotic and salt tolerance in transgenic tobacco[J]. Plant Physiology Biochemistry, 2013, 73: 309-320.
[12] GUO J, REN Y, TANG Z, SHI W, ZHOU M. Characterization and expression profiling of the ICE-CBF-COR genes in wheat[J]. Peer Journal, 2019, 7: e8190.
[13] ZUO Z F, KANG H G, PARK M Y, JEONG H, SUN H J, SONG P S, LEE H Y.MYC type transcription factorregulates cold tolerance in transgenic[J]. Plant Science, 2019, 289: 110254.
[14] DANIEL G Z, JONATHAN T V, DANIEL C, THOMASHOW M F. Cold induction ofCBF genes involves multiple ICE (inducer of CBF expression) promoter elements and a cold-regulatory circuit that is desensitized by low temperature[J]. Plant Physiology, 2003, 133(2): 910-918.
[15] 杜忠杰, 林 电, 许 杰, 林建明. 海南省橡胶园土壤养分状况研究[J]. 广东农业科学, 2011, 38(11): 73-77.
DU Z J, LIN D, XU J, LIN J M. The nutrient status of rubber plantation soil in Hainan province[J]. Guangdong Agricultural Sciences, 2011, 38(11): 73-77. (in Chinese)
[16] 王旺年, 葛均筑, 杨海昌, 阴法庭, 黄太利, 蒯 婕, 王 晶, 汪 波, 周广生, 傅廷栋. 大田作物在不同盐碱地的饲料价值评价[J]. 作物学报, 2022, 48(6): 1451-1462.
WANG W N, GE J Z, YANG H C, YIN F T, HUANG T L, KUAI J, WANG J, WANG B, ZHOU G S, FU T D. Adaptation of feed crops to saline-alkali soil stress and effect of improving saline-alkali soil[J]. Acta Agronomica Sinica, 2022, 48(6): 1451-1462. (in Chinese)
[17] KOTULA L, GARCIA C P, ZORB C, COLMER T D, FLOWERS T J. Improving crop salt tolerance using transgenic approaches: an update and physiological analysis[J]. Plant Cell Environment. 2020, 43(12): 2932-2956.
[18] 李 言, 余文才, 陆庆志, 杨署光, 田维敏. 非生物胁迫对橡胶树热激转录因子家族成员表达的影响[J]. 热带作物学报, 2021, 42(8): 2119-2125.
LI Y, YU W C, LU Q Z, YANG S G, TIAN W M. Effects of abiotic stresses on the expression of heat shock transcription factor (HSF) family members in rubber tree (Muell. Arg.)[J]. Chinese Journal of Tropical Crops, 2021, 42(8): 2119-2125. (in Chinese)
[19] LI Y, YU W, CHEN Y, YANG S G, WU S H, CHAO J Q, WANG X L, TIAN W M. Genome-wide identification and characterization of heat-shock transcription factors in rubber tree[J]. Forests, 2019, 10(12): 1157.
[20] LI F, GUO S, ZHAO Y,CHEN D, CHONG K, XU Y. Overexpression of a homopeptide repeat-containing bHLH protein gene () from Dongxiang wild rice confers freezing and salt tolerance in transgenic[J]. Plant Cell Reports, 2010, 29: 977-986.
[21] ZHOU J, LI F, WANG J L,MA Y, CHONG K, XU Y Y. Basic helix-loop-helix transcription factor from wild rice () improves tolerance tosalt-and osmotic stress in[J]. Journal of Plant Physiology, 2009, 166(12): 1296-1306.
[22] 王昕嘉, 李昆志. 植物bHLH转录因子参与非生物胁迫信号通路研究进展[J]. 生命科学, 2015, 27(2): 208-216.
WANG X J, LI K Z. Progress of plant bHLH transcription factors involved in abiotic stress signaling pathways[J]. Chinese Bulletin of Life Sciences, 2015, 27(2): 208-216. (in Chinese)
[23] CHEN Y, LI F, MA Y, CHONG K, XU Y. Overexpression of, a putative helix–loop–helix transcription factor, causes increased expression ofand maintains ionic balance under salt stress in rice[J]. Journal of Plant Physiology, 2013, 170: 93-100.
[24] ZHANG T, MO J, ZHOU K, CHANG Y, LIU Z. Overexpression ofgene increases abiotic stress tolerance in tobacco[J]. Plant Physiology and Biochemistry, 2018, 132: 515-523.
[25] 潘凌云, 马家冀, 李建民, 尹兵兵, 付 畅. 植物盐胁迫应答转录因子的研究进展[J]. 生物工程学报, 2022, 38(1): 50-65.
PAN L Y, MA J J, LI J M, YIN B B, FU C. Advances of salt stress-responsive transcription factors in plants[J]. Chinese Journal of Biotechnology, 2022, 38(1): 50-65. (in Chinese)
[26] 李光道, 白生才, 张秀志, 李 军, 唐学清, 王宗明, 陈国斌. 植物抗盐性研究综述[J]. 甘肃农业科技, 2011(2): 29-33.
LI G D, BAI S C, ZHANG X Z, LI J, TANG X Q, WANG Z M, CHEN G B. Review on salt resistance of plants[J]. Gansu Agricultural Science and Technology, 2011(2): 29-33. (in Chinese)
[27] PARDO J M. Biotechnology of water and salinity stress tolerance[J]. Current Opinion in Biotechnology, 2010, 21(2): 185-196.
[28] QIN H, LI Y, HUANG R. Advances and challenges in the breeding of salt-tolerant rice[J]. International Journal of Molecular Sciences, 2020, 21(21): 8385.
[29] HOU Z, LI Y, CHENG Y, LI W, LI T, DU H, KONG F, DONG L, ZHENG D, FENG N, LIU B, CHENG Q. Genome-wide analysis ofgenes identifies a novel salt tolerance gene in wild soybean ()[J]. Frontiers in Plant Science, 2022, 13: 821647.
[30] TU T Q, VACIAXA P, LO T T M, NGUYEN N H, PHAM N T T, NGUYEN Q H, DO P T, NGUYEN L T N, NGUYEN Y T H, CHU M H. GmDREB6, a soybean transcription factor, notably affects the transcription of theandgenes in transgenic tobacco under salt stress conditions[J]. Saudi Journal of Biological Sciences, 2021, 28(12): 7175-7181.
[31] SHAH N, ANWAR S, XU J, HOU Z, SALAH A, KHAM S, GONG J, SHANG Z, QIAN L, ZHANG C. The response of transgenicto salt stress: a review[J]. Biotechnol Lett, 2018, 40(8): 1159-1165.
Salt Stress Response and Functional Indentification offrom Rubber Tree
LI Yan, YANG Shuguang, SHI Minjing, TIAN Weimin*
Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Biology and Genetic Resources of Rubber Tree, Ministry of Agriculture and Rural Affairs / Hainan Key Laboratory for Cultivation & Physiology of Tropical Crops, Haikou, Hainan 571101, China
ICE (inducer of CBF expression), the MYC (myelocytomatosis)-like bHLH (basic helix-loop-helix) transcription factor, plays an important role in regulating the responses of plants to abiotic stresses such as low temperature, drought, and high salt. In this study, the expression patterns of rubber tree ICE genes were analyzed by qPCR. The expression of fivewere up-regulated in rubber tree seedlings upon salt stress,andwere significantly up-regulated under salt stress for 2 h. At 4 h of salt stress, the expression ofandreached the maximum with the most up-regulated level of. Under salt stress for 4–24 h,was significantly down regulated. The expression ofhad no obvious change before 4 h of salt stress, but increased significantly after 8 h. Therefore, all fivegenes may participate in the salt stress response of rubber tree. Overexpression of, especially, led to an enhanced salt-tolerance of transgenicbased onsurvival rate, average fresh and dry weight per plant. Under salt stress, all wild-typewilted. The survival rate ofoverexpressingwas 96.29%, the average fresh weight per plant was 0.03 g, and the average dry weight per plant was 0.0035 g, the three growth parameters ofoverexpressing plants were the highest among the transformed strains of rubber treegenes. Compared with the physiological indexes before salt stress, the relative conductivity of WT andtransgenic plants increased significantly under salt stress, and the chlorophyll content and relative water content decreased significantly. Among them, relative conductivity increase oftransformedwas the smallest, and the decrease of SPAD value (chlorophyll content) and relative water content was the smallest. Therefore, the enhanced salt-tolerance was associated with lower relative conductivity, a physiological parameter for evaluating membrane system stability, as well as higher chlorophyll content and relative water content in comparison to those of WT. Salt stress leads to the damage of plant cell membrane system, resulting in the decrease of water content, the destruction of chloroplasts and the degradation of chlorophyll. The membrane system of plants overexpressingwas slightly damaged under salt stress, delaying the decrease of water content and the degradation of chlorophyll. Rubber tree HbICEs can not only improve the cold and drought tolerance of transgenic plants, but also improve the salt-tolerance of transgenic plants. This study would deepen the understanding of the biological function of rubber tree, and provide candidate target genes for improving salt-tolerance of crops.
Muell. Arg.; inducer of CBF expression; salt tolerance; functional identification
S794.1
A
10.3969/j.issn.1000-2561.2022.11.003
2022-05-17;
2022-07-12
广东省重点领域研发项计划项目(No. 2020b020217002);国家天然橡胶产业技术体系(No. CARS-33-YZ1)。
李 言(1982—),男,博士,助理研究员,研究方向:植物分子生物学。*通信作者(Correponding author):田维敏(TIAN Weimin),E-mail:wmtian@163.com。
