松油烯-4-醇对结直肠癌细胞恶性行为的影响及其机制
2022-12-16吴映敏曾智锐陈腾祥
杨 艳 ,吴映敏, 曾智锐,李 连,张 毅,陈腾祥
(1.贵州医科大学基础医学院生理学教研室,贵州 贵阳 550004; 2. 贵州医科大学第三附属医院输血科,贵州 都匀 558000;3. 贵州医科大学附属肿瘤医院,贵州 贵阳 550004)

在我国,结直肠癌(colorectal cancer,CRC)是一种发病率及恶性程度极高的恶性肿瘤。根据世界卫生组织发布的最新全球癌症数据,2020年结直肠癌的发病率约为24.8/10万、死亡率约为12.0/ 10万[1]。在中国,结直肠癌的发病率呈明显上升趋势,死亡率亦明显增加[2]。临床治疗结直肠癌的方法以手术治疗为主,而化疗为中晚期结直肠癌术后的最常用辅助治疗方法,常用的一线化疗药物有5-氟尿嘧啶(5-FU)和铂类[3]。然而,多数患者不良反应较重,且化疗后易复发[4]。因此,需要不断地筛选功能化合物分子作为新药前体供开发利用。
精油主要来源于植物且具有抗癌作用[5]。精油的主要有效成分之一为松油烯-4-醇 ( terpinen-4-ol,化学式: C10H18O,T4O),其安全性高,已被FDA批准作为上市的治疗皮肤真菌病的药物[6]。近年来,有研究发现T4O具有诱导神经胶质瘤细胞凋亡及周期阻滞的作用[7]。因此,其在肿瘤中的应用被广泛关注。本研究拟探讨T4O对RKO与HCT116细胞恶性生物学行为的影响及作用机制,以期为T4O在结直肠癌的治疗中提供有力依据。
1 材料和方法
1.1 材料
1.1.1细胞 结直肠癌细胞RKO和HCT116购于美国The Global Bioresource Center细胞库,保存于本室。
1.1.2试剂 RPMI 1640培养基(货号:31800-022)、DMEM高糖培养基(货号:SH30022.01)和胎牛血清(fetal bovine serum,FBS,货号:AB20180213E)均购于上海诺娃医药科技有限公司;CCK-8试剂盒(货号:C0037)购自上海瑶韵生物公司;凋亡检测试剂盒(货号:KGF004)购自杭州昊鑫生物科技有限公司;周期检测试剂盒(货号:22845)购自西安百萤生物科技有限公司;Transwell小室(货号:3413)和基底凝胶(货号:356231)购于上海凌仪生物科技有限公司;RIPA 裂解液(货号:abs9116)和PMSF(货号:0754-5G)购于索莱宝生物公司;SDS-PAGE制胶试剂盒(货号:KGP113-8%)购于江苏慧智生物科技有限公司;兔源性α-tublin单克隆抗体(ER130905)和兔源性Caspase 7多克隆抗体(3010-100)购于上海齐源生物科技有限公司;兔源性NR3C1单克隆抗体(A-AO1504a)、兔源性P21多克隆抗体(LS-C54485)、兔源性E-cadherin多克隆抗体(ABP51220)和山羊抗兔(111-005-003)二抗购于武汉艾美捷科技生物公司;兔源性N-cadherin多克隆抗体(GTX50758)购于上海长岛生物技术公司;兔源性Cyclin B1多克隆抗体(M1508-1)购于华安生物;兔源性cleaved-Caspase7多克隆抗体(WL02360)购于沈阳万类生物科技有限公司;T4O(纯度>99.5%;3001)购于合肥天健化工公司;阳性药物5-Fu(纯度> 99.67%;HY-90006)和放线菌酮(CHX; 纯度>99.86%,HY-12320)购于武汉MCE生物公司。药物均以二甲基亚砜配制成10 mmol·L-1的母液放于-20 ℃冰箱中。转染脂质体3000(L3000150)购自美国赛默飞生物公司;靶向NR3C1的小干扰RNA (si-NR3C1)和阴性对照小干扰RNA(NC)均购自于北京易锦生物,si-NR3C1和NC序列分别为5′-ACTGGCTGTCGCTTCCTCAAT-3和5′-AACACCGAACGAGUCACGATT-3′。
1.1.3仪器 酶标仪(型号:RT-6000)购于上海天呈科技有限公司重庆办事处;培养箱(型号:BPH-962)购于江苏迅迪仪器科技有限公司;流式细胞仪(型号:ACEA NovoCyte)购于福州科远贸易有限公司;超净台(型号:BBS-SDC)购于济南泰医生物技术有限公司;凝胶成像系统(型号:1025025 Rev A)购于美国Bio-rad公司;倒置显微镜(型号:XD-202)购于巴玖实业。
1.2 方法
1.2.1细胞培养 RKO用含10% FBS的DMEM培养,HCT116用含10% FBS的RPMI 1640培养。两种细胞均放置于恒温培养箱中培养(37 ℃、5% CO2),隔日换液。根据细胞生长状态,待密度汇达80%以上,消化后传代并冻存。
1.2.2运用CCK-8实验检测T4O对细胞增殖的影响 结直肠癌细胞株RKO和HCT116 (均3 × 103个/孔)均匀铺于96孔板上。用不同浓度梯度(0、1、2、4 μmol·L-1)的T4O和4 μmol·L-1的5-Fu处理上述细胞,每种细胞的复孔数为6个;24 h后,配制CCK-8检测液(CCK-8 液与含 10%胎牛血清的DMEM培养基以1 ∶9比例混匀),弃原培养基,每孔加上述检测液100 μL,再次放入养箱中培养2.5 h。开启酶标仪,波长调为450 nm,读取OD值。每种细胞的相对增殖百分比为实验组OD值与空白组OD值的差值除对照组OD值与空白组OD值的差值的百分比。
1.2.3克隆平板实验检测T4O对各细胞克隆形成能力的影响 RKO和HCT116(1 × 103个/孔)均匀接种于6孔板中。培养箱中恒温培养,贴壁后用不同浓度的(0、1、2、4 μmol·L-1)的T4O和4 μmol·L-1的5-Fu处理上述细胞。培养14 d后,换液后用含4 %的多聚甲醛溶液固定20 min,再用0.5%结晶紫常温染色25 min。干燥处风干并拍照,计算上述细胞的克隆形成数并记录。
1.2.4运用流式细胞术检测T4O对上述细胞凋亡的影响 结直肠癌细胞RKO和HCT116(均3×105个/孔)接种于6孔板中。待细胞生长贴壁后,分别用不同浓度(0、1、2、4 μmol·L-1)的T4O和4 μmol·L-1的5-Fu处理上述细胞。24 h后,用无EDTA的胰酶消化细胞后,以含10%浓度的FBS中和后,收集于1.5 mL的离心管中。1 000 r·min-1离心5 min,PBS洗涤2次后,转移至流式专用管(黑色)中。加入含2.5 μL Annexin V和5 μL PI的binding buff液,在室温孵育30 min后,流式细胞仪中检测细胞的凋亡情况。凋亡率为细胞位于右上和右下象限的比例。
1.2.5利用流式细胞实验检测T4O对各细胞周期的影响 RKO和HCT116均匀铺于6孔板中(3×105个/孔)。待细胞生长贴壁后,分别用不同浓度的T4O(0、1、2、4 μmol·L-1)和4 μmol·L-1的5-Fu处理上述细胞。24 h后,用无EDTA的胰酶消化细胞后,以含10%浓度的FBS中和后,收集于1.5 mL的离心管中。1 000 r·min-1离心5 min,PBS洗涤2次后,加入75%的乙醇并在-20 ℃的环境中放置24 h。离心后弃乙醇,PBS洗涤2次,转移细胞至流式专用管(黑色)中,加入PI检测液。常温培养30 min,流式细胞仪测不同细胞在生长周期(G1、S和G2/M期)中的比率。
1.2.6划痕愈合实验检测T4O对结直肠癌细胞的迁移能力的影响 结直肠癌细胞RKO和HCT116(均2×105个/孔)均匀铺于6孔板内。细胞状态佳且密度达95%~100%时,饥饿处理(无血清培养)24 h。10 μL枪头轻划一直线,PBS清洗3次,需拍下0 h各细胞的划痕图片,分别用不同浓度的T4O(0、1、2、4 μmol·L-1)和4 μmol·L-1的5-Fu处理上述细胞,继续恒温培养24 h,换液后再次拍下图片。精确测量划痕0 h和划痕24 h两个时间点的面积(ImageJ软件测量),计算同一处理组 0 h与24 h的划痕面积之差即为24 h 内划痕的愈合面积。各药物浓度处理组24 h内划痕愈合面积与对照组24 h内划痕愈合面积的百分比即为相对迁移率。
1.2.7Transwell检测经T4O处理后细胞的侵袭能力 在Transwell上室中铺Matrigel胶,分别铺300 μL的RKO和HCT116的细胞悬液(含4×105个细胞),上室中细胞用T4O(0、1、2、4 μmol·L-1)和4 μmol·L-1的5-Fu处理。下室加入700 μL含10% FBS的完全培养基。37 ℃培养24 h,弃旧液,4 %多聚甲醛常温固定25 min,0.5%结晶紫常温染色30 min,PBS洗3次,风干。计数细胞侵袭数(显微镜放大100倍随机拍取4个视野)。
1.2.8免疫印迹实验检测细胞中E-cadherin、N-cadherin、p21、Cyclin B1、Cleave-Caspase7和NR3C1蛋白的表达 RKO和 HCT116分别用RIPA(含1% PMSF)裂解细胞,定量后用Loading buff进行样本制备。每孔加入25 μg蛋白样本,行SDS-PAGE分离,湿转发法转移至PVDF膜后,用含5%脱脂奶粉的TBST封闭2 h。分别加入E-Cadherin抗体、N-Cadherin抗体、CyclinB1抗体、p21抗体、Caspase7抗体(稀释度1 ∶1 000)、cleaved-Caspase7抗体(稀释度1 ∶500)、α-tublin单克隆抗体(稀释度1 ∶2 000)和NR3C1单克隆抗体(稀释度1 ∶1 000)等抗体,4 ℃下孵育18 h。PBST清洗。用相应二抗室温孵育2 h,PBST洗涤,化学发光法曝光,检测各蛋白条带的灰度值,实验重复3次。
1.2.9T4O靶点分析 根据T4O的药效团,利用在线工具Swissprediction(http://www.swisstargetprediction.ch/)和TargetNet(http://targetnet.scbdd.com/)分析预测T4O的蛋白靶点。此外,T4O作用靶点在Cytoscape软件(version)中生成。进一步对靶点进行计算机分子对接分析,计算靶点与T4O的结合得分。计算机分子操作步骤如下:(1)从Protein Data Bank(https://www.rcsb.org/)和PubMed compound(https://pubchem.ncbi.nlm.nih.gov/compound/11230)中下载NR3C1蛋白(检索代号:5NFP)和T4O的3D结构图。在Autodock软件中,清除原配体后,进行柔性对接。结合得分负值越大则结合时释放能量越多,结合越稳定。
1.2.10免疫印迹检测NR3C1蛋白的降解率 用100 μg·L-1放线菌酮(CHX)抑制RKO和 HCT116细胞的蛋白翻译,同时分别给予等体积DMSO和2 μmol·L-1T4O处理0、1、2和4 h后,RIPA裂解细胞,提取蛋白样本,行免疫印迹实验检测Rko和 Hct116细胞经DMSO和T4O处理后每个时间段NR3C1的蛋白水平变化。
1.2.11细胞转染 结肠癌RKO和HCT116细胞铺于6孔板中,待汇合度达到60%~70%时,弃掉原来培养基,更换成新鲜的培养基。用2.5 μL的脂质体3000分别与2.5 μL的NC和si-NR3C1配成转染混合液。各孔分别加入NC和si-NR3C1转染混合液后,在37 ℃培养24 h后,更换培养基。
1.2.12划痕实验检测沉默NR3C1对T4O介导的迁移抑制的影响 NC和si-NR3C1组结直肠癌细胞RKO和HCT116(均2×105个/孔)均匀铺于6孔板内。细胞状态佳且密度达95%~100%时,饥饿处理(无血清培养)24 h。10 μL枪头轻划一直线,PBS清洗3次,需拍下0 h各细胞的划痕图片,分别以4 μmol·L-1的T4O和等体积DMSO处理上述细胞24 h。余步骤同“1.2.6”项。
1.2.13CCK-8实验检测沉默NR3C1对T4O介导的增殖抑制的影响 NC和si-NR3C1组RKO和HCT116 (均3×103个/孔)细胞均匀铺于96孔板上。以4 μmol·L-1的T4O和等体积DMSO处理上述细胞24 h,每种细胞的复孔数为6个。余步骤同“1.2.2”项。
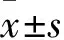
2 结果
2.1 T4O抑制结直肠癌细胞RKO和HCT116的增殖Fig 1 CCK-8 检测结果显示,用浓度为0(DMSO)、1、2和4 μmol·L-1的T4O以及4 μmol·L-15-Fu处理细胞,24 h后,各组RKO细胞的相对增殖率分别为(100±7.0) %、(73.8±8.6) %、(59.2±7.1) %、(47.6±3.5) %和(59.5±2.0)%;各组HCT116细胞的相对增殖率分别为(100±12.5) %、(85.9±13.4) %、(73.4±9.6) %、(45.5±1.4) %和(59.7±2.7)%。与对照组相比,T4O处理后的RKO和HCT116细胞,增殖率明显减少,差异具有统计学意义(P均<0.05);与4 μmol·L-15-Fu的阳性药物处理组相比,4 μmol·L-1的T4O处理组细胞的增殖率明显减少,差异具有统计学意义(P均<0.01)。结果提示,T4O明显抑制结直肠癌细胞RKO和HCT116的增殖,且较阳性药5-Fu明显。
2.2 T4O抑制结直肠癌细胞RKO和HCT116的克隆形成能力如Fig 2显示,用0、1、2和4 μmol·L-1的T4O以及4 μmol·L-15-Fu分别处理RKO和HCT116细胞14 d后,各组RKO细胞克隆形成数依次为(491±38)个、(408±34)个、(312±39)个、(220±27)个和(350±36)个;各组HCT116细胞克隆形成数依次为(520±43)个、(440±36)个、(325±40)个、(85±13)个和(370 ±35)个。相比较于对照组,T4O处理过的细胞,克隆形成数明显减少,差异具有统计学意义(P均<0.05);与4 μmol·L-1的5-Fu阳性药处理组相比,4 μmol·L-1的T4O处理组细胞的克隆形成能力明显减少,差异具备统计学意义(P均<0.01)。结果提示,T4O明显抑制结直肠癌细胞RKO和HCT116的克隆形成能力,且较阳性药5-Fu明显。
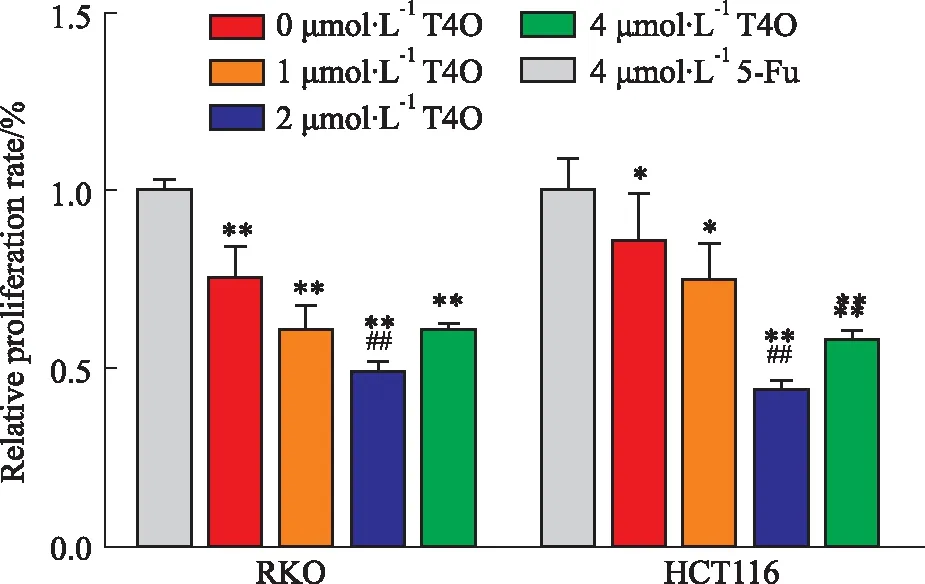
Fig 1 Effects of different concentrations of T4O on proliferation of human colorectal cancer cells RKO and HCT116 detected by CCK-8 assay n=3)
2.3 T4O促进RKO和HCT16的凋亡凋亡检测结果(Fig 3)显示,用浓度分别为0、1、2和4 μmol·L-1的T4O以及4 μmol·L-1的5-Fu处理细胞24 h后,各组RKO细胞凋亡率分别为(3.06±0.51) %、(6.70±0.92) %、(9.20±1.32) %、(20.00±2.41) %和(15.59±1.6) % ; 各组HCT16细胞凋亡率分别为( 1.98±0.20) %、(3.97±0.41) %、(7.55±0.76) %、(19.42±1.9) % 和(8.17±0.8)%。T4O处理组与对照组相比,其凋亡率增加,差异有统计学意义,P<0. 05;与4 μmol·L-15-Fu 的处理组相比,4 μmol·L-1的T4O处理组细胞凋亡明显增加,差异有统计学意义,P<0. 05。结果提示,T4O 明显促进结直肠癌细胞RKO和HCT116的凋亡,且较阳性药5-Fu显著。

Fig 2 Effects of T4O on colony formation of human colorectal cancer cells RKO and HCT116 detected by colony formation assay n=3)

Fig 3 Effects of T4O on apoptosis of RKO and HCT116 detected by flow cytometry n=3)*P<0.05,**P<0. 01 vs control, ##P<0. 01 vs 5-Fu.
2.4 T4O诱导RKO和HCT116阻滞在G1期流式细胞周期实验结果(Fig 4)显示,用0、1、2和4 μmol·L-1的T4O以及4 μmol·L-1的5-Fu处理细胞24 h后,各组RKO细胞在G1期的百分比分别为(41.98±2.3) %、(44.63±2.6) %、(47.22±2.7) %、(57.54±3.1) %和(47.26±2.1) %,在S期的百分比分别为(40.93±1.9) %、( 36.23±1.6) %、(36.04±1.5) %、(25.33±1.3) %和(40.52±2) %,在G2/M期的百分比分别为(15.54±0.7) % 、(16.68±0.8) %、(15.12±0.7) %、(16.58±0.8) %和(8.91±3.3) %;各组HCT16细胞在G1期的百分比分别为(43.80±2.3) %、(53.51±2.8) %、(54.28±2.9) %、(62.18±3.3)%和(47.5±3.2)%,在S期的百分比分别为(30.32±2.0) %、(23.86±1.9) %、(18.18±1.6) %、(14.05±1.4) %和(38.9 ±3.1) %,在G2/M期的百分比分别为(18.42±1.7) %、(18.46±1.7) %、(19.72±1.8) %、(18.41±1.7) %和(13.4±2.1) %。与各细胞系的对照组相比,不同浓度的T40处理后,RKO和HCT116在G1期的细胞比例明显增加,在S期的比例明显减少。差异均具有统计学意义,P均<0.05;与4 μmol·L-15-Fu的处理组相比,4 μmol·L-1的T4O处理组细胞的G1期细胞比例明显增加,差异具备统计学意义,P<0. 01。提示,T4O诱导直肠癌细胞RKO和HCT116阻滞在G1期,且其作用较同浓度5-Fu明显。
2.5 T4O明显抑制结直肠癌细胞RKO和HCT116的迁移Fig 5划痕愈合实验结果显示,将0、1、2和4 μmol·L-1的T4O以及4 μmol·L-1的5-Fu 处理细胞24 h后,各组RKO细胞的相对迁移率分别为(100±14.2) %、(75.5±9.6) %、(69.8±3.9) %、(28.7±3.9) % 和(64.1±6.3) %;各组HCT116细胞的相对迁移率分别为(100±4.3) % 、(72.3±1.9) %、(43.8±3.2) %、(6.1±1.9) %和(67.0±7.0) %。与对照组相比,T4O处理组细胞迁移率减少,差异有统计学意义(P均<0.05);与4 μmol·L-1的5-Fu的处理组相比,4 μmol·L-1的T4O处理组细胞的迁移能力明显降低,差异具有统计学意义(P均<0.01)。结果提示,T4O明显减少结直肠癌细胞RKO和HCT116的迁移能力,且较阳性药5-Fu显著。

Fig 4 Effects of T4O on cell cycle of RKO and HCT116 cells detected by flow cytometry n=3)*P<0. 05, **P<0. 01 vs control, ##P<0. 01 vs 5-Fu.
2.6 T4O明显抑制结直肠癌细胞RKO和HCT116的侵袭能力Fig 6 Transwell小室实验结果显示,用浓度为0、1、2和4 μmol·L-1的T4O以及4 μmol·L-15-Fu处理RKO和HCT116细胞,24 h后,各组RKO细胞每视野下侵袭过膜的细胞数为(720±42)个、(460±28)个、(300±19)个、(40±4)个和(200±25)个;各组HCT116细胞侵袭过膜的细胞数为(540±34)个、(392±23)个、(322±21)个、(76±9)个和(350±31)个。与对照组相比,T4O处理组侵袭细胞数量均明显减少,差异有统计学意义(P均<0.01);与4 μmol·L-1的5-Fu的处理组相比,4 μmol·L-1的T4O处理组细胞的侵袭能力明显减少,差异具有统计学意义(P均<0.01)。结果提示,T4O 明显减少结直肠癌细胞RKO和HCT116的侵袭能力,且较阳性药5-Fu明显。
2.7 T4O对E-Cadherin、N-Cadherin、CyclinB1、P21、cleaved-Caspase7表达的影响用不同浓度(0、1、2、4 μmol·L-1) 的T4O以及4 μmol·L-15-Fu处理结直肠癌细胞RKO和HCT16后,Fig 7免疫印迹实验检测结果显示,与对照组相比,各浓度T4O处理组N-Cadherin和CyclinB1的相对表达量均见明显减少, E-Cadherin、p21和cleaved-Caspase7蛋白的相对表达水平均明显增加,差异具有统计学意义(P<0. 05);此外,与4 μmol·L-1的5-Fu处理组相比,4 μmol·L-1的T4O处理组N-Cadherin和CyclinB1的相对表达量均见明显减少,E-Cadherin和cleaved-Caspase7蛋白的相对表达水平均明显增加,差异具有统计学意义(P<0. 05)。
2.8 NR3C1可能为T4O的关键作用靶点根据T4O的药效团,我们利用在线软件 Swissprediction与TargetNet,预测T4O可能的作用靶点。结果发现,T4O有10个可能的作用靶点(Fig 8A-B)。其中,T4O与NR3C1的对接结合分数最高,为(Fig 8C,Tab 1)。提示,NR3C1可能是T4O的重要作用靶点。

Fig 5 Effects of T4O on migration of human colorectal cancer cells RKO and HCT116 determined by wound healing assay ( × 40) n=3)
Black lines indicated 50 μm.*P<0. 05;**P<0. 01vscontrol;##P<0. 01vs5-Fu.

Fig 6 Effects of T4O on invasion of T4O on RKO and HCT116 cells determined by Transwell invasion assay ( × 40) n=3)

Fig 7 Effects of T4O on protein level of E-Cadherin, N-Cadherin, CyclinB1, p21, cleaved-Caspase7 and Caspase7 in RKO and HCT116 cells detected by Western blot n=3)
2.9 T4O增加NR3C1的表达及蛋白稳定性基于NR3C1可能是T4O的重要靶点,我们探究T4O对结直肠癌RKO和HCT116细胞中NR3C1蛋白的表达影响。结果提示(Fig 9A),T4O处理后NR3C1蛋白的表达量明显增加。此外,通过CHX抑制蛋白的合成,我们发现,与对照组相比,T4O处理后NR3C1蛋白的降解率明显降低(Fig 9B)。提示,T4O具有增加NR3C1蛋白稳定性的作用。
2.10 沉默NR3C1能够缓解T4O介导的迁移和侵袭抑制通过构建NR3C1沉默细胞株,我们发现si-NR3C1能够明显抑制T4O介导的NR3C1表达量的增多(Fig 10A)。通过划痕实验(Fig 10B-C),我们发现NC+DMSO、NC+T4O和si-NR3C1+T4O组RKO细胞的迁移率分别为(100±15.2) %、(48.7±9.3) %和(73.7±9) %;NC+DMSO、NC+T4O和si-NR3C1+T4O组HCT116细胞的迁移率分别为(100±9.4) %、(50±4.6) %和(90±2.6) %;与NC+T4O组相比,si-NR3C1+T4O组细胞的迁移率均明显增强,差异均有统计学意义(P<0.01)。此外,通过CCK-8实验(Fig 10D),我们发现,NC+DMSO、NC+T4O和si-NR3C1+T4O组RKO细胞的增殖率分别为(100±6.4) %、(58.6±4.3) %和(92.5±7.4) %;NC+DMSO、NC+T4O和si-NR3C1+T4O组HCT116细胞的增殖率分别为(99.6±3.1) %、(56.1±3) %和(84.7±3) %;与NC+T4O组相比,si-NR3C1+T4O组细胞的增殖率均明显增强,差异均有统计学意义(P<0.01)。提示,沉默NR3C1的表达能够明显缓解T4O介导的结肠癌细胞的迁移和增殖抑制。

Tab 1 Docking score between T4O and each target
3 讨论
结直肠癌患者的5年生存率低,中晚期患者多低于30%。当前,放化疗行手术切除是结直肠癌临床治疗的主要措施。放化疗杀灭或抑制肿瘤,提高治愈机会,但同时会导致患者机体免疫力的下降,肿瘤易复发[8]。此外,放化疗导致的肝肾心等副作用较多。相对而言,有些中医药可发挥抗肿瘤作用,同时提高患者的免疫力[9]。因此,从中药或其他天然产物中挖掘有效抗结直肠癌成分,开发结直肠癌治疗药物,是值得探索的治疗方法。
T4O是中药姜黄的有效成分之一[10],已经通过FDA批准,成为抗寄生虫感染及治疗皮肤真菌病的药物,在临床上广泛应用;此外,T4O有较高的安全性,可内服和外用[11]。近年来研究发现,T4O亦具有良好的抗肿瘤作用。T4O可通过抑制P-膜蛋白的表达,减少黑色素瘤对化疗药物的耐受性[12]。T4O可诱导人白血病HL-60细胞出现过度自噬,进而导致凋亡[13]。本研究在结直肠癌细胞RKO及HCT116中进行的细胞功能学实验,发现T4O 可抑制RKO及HCT116的恶性生物学能力,诱导细胞凋亡和细胞阻滞在G1期,且在同浓度下较阳性药物5-Fu明显。研究表明,T4O具有良好的体外抗结直肠癌活性。
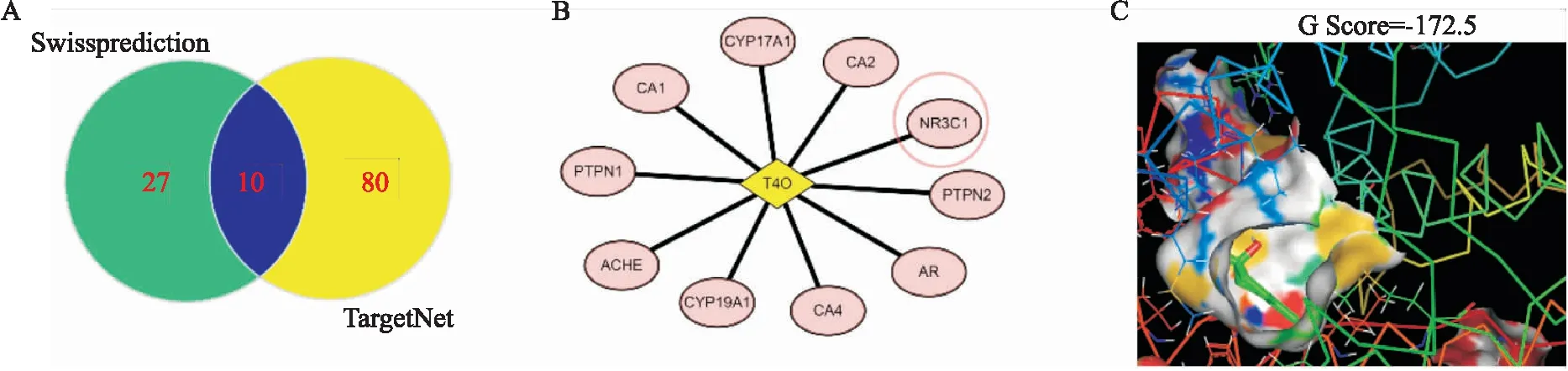
Fig 8 Prediction of target proteins of T4O action(A-B) and molecular docking between T4O and NR3C1( C).

Fig 9 Effects of T4O on protein level and degradation rate of NR3C1 in RKO and HCT116 cells detected by Western blot n=3)
网络药理学和计算机分子对接技术是通过生物信息学手段,预测和模拟药物分子与靶蛋白之间的相互作用,为分子的作用提供间接证据[14]。基于T4O的药效团分析,本研究发现了T4O可能有10个潜在作用靶点。对靶点与T4O进行分子对接验证,发现T4O与NR3C1的对接得分最高,提示T4O与NR3C1的结合很稳定[15]。NR3C1基因是位于人体 5号染色体上,由9个外显子构成,其编码的蛋白属于糖皮质激素受体,也是核激素受体超家族的一员[16]。NR3C1蛋白在多种肿瘤扮演着抑癌基因的角色,如胃癌、乳腺癌以及结直肠癌等[17]。此外,多项研究表明,多种肿瘤细胞内的调控机制导致NR3C1蛋白在肿瘤组织的表达量明显减少,如异常的DNA甲基化、基因突变及蛋白酶体降解等[17]。因此,诱导抑癌蛋白NR3C1表达增加或活性增加是治疗肿瘤的一种治疗策略。进一步,我们用T4O处理结直肠癌细胞,发现T4O能够明显促进NR3C1的表达。此外,T4O处理后,NR3C1的降解速率明显降低。因此,我们推测:T4O可能与NR3C1结合,封闭了NR3C1上一些蛋白酶体的降解位点,进而减少蛋白酶体对NR3C1的降解,进而增加NR3C1的表达量。为进一步探究NR3C1是否参与T4O介导的功能学过程,我们构建NR3C1沉默的RKO和HCT116细胞株,通过功能学实验发现,沉默NR3C1的表达能够明显缓解T4O对结肠癌RKO和HCT116细胞迁移和侵袭的抑制。

Fig 10 Knockdown of NR3C1 relieved inhibitory effects of T4O on migration and proliferation of RKO and HCT116 cells n=3)
综上所述,T4O可能通过延缓NR3C1蛋白的降解,进而抑制结直肠癌细胞的恶性行为,诱导其凋亡和G1期阻滞。T4O具有明显的抗结直肠癌作用,有望成为临床治疗结直肠癌的辅佐用药之一。
