减电荷聚甲基丙烯酸钠接枝介质的制备及蛋白质吸附性能
2022-12-15李宪秀何涛毛建卫沙如意
李宪秀,何涛,毛建卫,2,沙如意
(1 浙江科技学院生物与化学工程学院,浙江 省农产品化学与生物加工技术重点实验室,浙江 省农业生物资源生化制造协同创新中心,浙江 杭州 310023;2 浙江工业职业技术学院,浙江 绍兴 312000)
离子交换色谱是蛋白质分离纯化中被广泛使用的一种关键技术,通过离子交换配基与蛋白质之间的静电相互作用不同来实现对蛋白质的分离[1-2]。为了进一步提高介质对蛋白质的吸附容量和传质速率,以聚合物为配基的接枝型色谱介质被成功研发并报道[3-6]。
表面引发原子转移自由基聚合反应(SI-ATRP)是一种通过调节引发剂和单体用量以及反应时间长短,可实现对聚合物的接枝密度、分子量、分子结构精准控制的技术[7-9],用于制备聚合物接枝型介质并展现出了优良的蛋白质吸附性能[10-12]。聚二甲胺基丙基丙烯酰胺(pDMAPAA)接枝型阴离子交换介质(FF-pDMAPAA)对牛血清白蛋白(BSA)的吸附容量和传质速率随着接枝链长度的增加呈现先上升后下降的现象,在离子交换容量(IC)为458mmol/L 时达到最高水平,此时动态结合容量可在流速为150~1350cm/h 条件下保持在180mg/mL 以上[13]。研究表明,通过SI-ATRP法可开发高性能的离子交换色谱介质,聚合物接枝链提供的三维立体吸附空间和“链传递”现象促进了蛋白质吸附容量和传质速率的提升。然而,高电荷密度的聚合物配基会造成蛋白质结合强度增大、空间位阻效应以及链间的静电排斥效应增强,进而对蛋白质吸附造成不利影响[14-15]。例如,采用甲基丙烯酸钠(MA)阴离子单体通过SI-ATRP 法制备得到的一系列不同IC 值(接枝链长度)的聚甲基丙烯酸钠(pMA)接枝型阳离子交换介质在IC 值(接枝链长度)较高时,对γ-球蛋白的吸附容量较低,并且对溶菌酶和γ-球蛋白的传质速率也较低[16]。
为了进一步提高聚合物接枝型离子交换介质对蛋白质的传质速率,研究者们基于电荷中和原理对带电聚合物进行了修饰和改造[17-19]。利用乙酸钠对聚乙烯亚胺(PEI)接枝型介质的聚合物配基电荷进行部分中和,介质的蛋白质吸附容量基本保持不变,但其传质速率提升了3 倍[17]。在对PEI 衍生型阳离子交换介质进行乙醇胺电荷中和修饰后,也发现介质的蛋白质传质速率有了明显提升[20]。因此,通过部分电荷中和反应降低聚合物配基的电荷密度,进而减弱蛋白质与配基之间的结合强度以及配基之间的静电排斥效应,可促进蛋白质传质速率的提升。
在对pMA接枝型阳离子交换介质的研究中发现,IC 值为320mmol/L 的pMA 接枝型介质(FF-pMA-320)对γ-球蛋白的吸附容量最高,对溶菌酶的吸附容量也处于较高水平,但其对两种蛋白质的传质速率较低。因此,为了提高pMA 接枝型阳离子交换介质的蛋白质传质速率,并探究电荷密度变化对pMA 接枝型介质的蛋白质吸附行为的影响,选取FF-pMA-320 为初始介质,对其含有的带电配基(羧基)进行乙醇胺中和修饰,并以尺寸大小不同的溶菌酶和γ-球蛋白为模型蛋白,考察不同种类的蛋白质在介质上的吸附行为随配基电荷密度的变化规律,丰富接枝型阳离子交换介质的种类和应用。
1 材料和方法
1.1 材料
MA,梯希爱(上海)化成工业发展有限公司;溶菌酶(来自于鸡卵清,纯度约96%,Mw约14300,pI约11.4),Sigma-Aldrich(St.Louis,MO,USA);γ-球蛋白(来源于牛血清,纯度约99%,Mw约150000,pI 约6.9),北京中生瑞泰科技有限公司;三(羟甲基)氨基甲烷(Tris),上海生工生物工程技术有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC),Alfa Sesar (Ward Hill, MA, USA);N,N-二甲基甲酰胺(DMF,优级纯)、三乙胺(TEA,优级纯)以及其他分析纯试剂,天津江天化工技术股份有限公司。
FF-pMA-320源自前期研究工作[16]。通过将γ-球蛋白和溶菌酶分别溶解在20mmol/L 乙酸盐缓冲液(pH 5.0)和20mmol/L Tris-HCl(pH 8.0)中得到实验所需的蛋白质溶液。
1.2 乙醇胺中和修饰FF-pMA-320
乙醇胺中和修饰FF-pMA-320的方法如图1 所示。称取5g FF-pMA-320 溶于15mL 去离子水中,加入乙醇胺1mL,然后向混合液中加入一定质量的EDC,于25℃用盐酸调节混合悬浮液pH至4.75~5,置于25℃、170r/min 的恒温水浴摇床中振荡反应24h。反应结束后用大量去离子水清洗介质,制备得到不同IC值的介质。
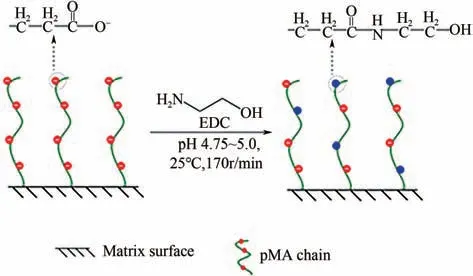
图1 乙醇胺中和修饰FF-pMA-320示意图
1.3 阳离子交换容量的测定
取1g 抽干的介质,加入10mL 0.1mol/L 的盐酸(HCl),将混合物置于25℃、170r/min 水浴摇床中平衡30min以质子化接枝聚合物中的羧基。然后将悬浊液转移到离心管中,于3000r/min离心5min,弃上清,再次加入上述体积和浓度的盐酸,重复两次。将含有介质的悬浮液倒入G3 砂芯漏斗后加入去离子水进行清洗,直到检测出抽滤得到的液体变为中性。将介质抽干后进行称量,然后将其加入到盛有25mL NaOH 和NaCl 混合液的锥形瓶中,其中NaCl浓度为0.5mol/L,NaOH浓度为0.05mol/L。置于25℃、170r/min 水浴摇床平衡3h。将悬浊液于3000r/min离心5min,取5mL 上清,以甲基橙作指示剂,用0.05mol/L的盐酸滴定上清液中NaOH含量,当溶液由黄色转变为橙色即达到滴定终点。然后对初始NaOH 和NaCl 混合溶液进行滴定,确定初始液中NaOH 的含量,计算NaOH 的消耗量,就可得到介质的IC值。
1.4 蛋白质静态和动态吸附实验
蛋白质静态吸附实验采用间歇摇瓶法[21]进行,可获得介质对蛋白质的相关吸附性能参数。首先用平衡缓冲液将经过去离子水洗净抽干的介质平衡12h。然后向25mL 锥形瓶中加入约0.05g 抽干的介质,之后加入已知浓度的蛋白质溶液。其中,蛋白质溶液体积为5mL,浓度范围是0.5~5mg/mL。将锥形瓶密封后,置于25℃的恒温水浴摇床中,溶菌酶170r/min 振荡24h,γ-球蛋白100r/min 振荡24h,使介质能够充分吸附上蛋白。最后将蛋白质与介质的悬浮液取出放于离心管中,静置30min。将平衡缓冲液作为参比,在280nm 下测定上清液的吸光值。根据物料衡算得到介质对蛋白质的吸附量,再通过Langmuir 方程[22-23]拟合吸附曲线,从而得到蛋白质的qm值和Kd值,如式(1)。

式中,qm为蛋白质的饱和吸附容量,mg/mL;Kd为解离常数,mg/mL;c和q分别为达到吸附平衡时蛋白质在液相和固相上的浓度,mg/mL。
采用间歇搅拌法[24]可测定阳离子交换介质对蛋白质的吸附动力学,进而获得动力学参数。首先使用平衡缓冲液配置100mL 浓度为1mg/mL 的蛋白质溶液并对其进行脱气处理,然后将其放入150mL三口圆底烧瓶中。将搅拌桨放入三口圆底烧瓶中的蛋白质液面以下进行搅拌,使蛋白质溶液混合均匀,采用恒温水浴将温度稳定在25℃。蛋白质溶液通过蠕动泵循环流经ÄKTA ExplorerTM 100(Uppsala,Sweden)上的UV-900紫外检测器,流速为20mL/min。当蛋白质溶液的紫外吸光值稳定后,称取一定量用平衡缓冲液预平衡12h并抽干的介质加入烧瓶里的蛋白溶液中,在线检测液相不同时间下蛋白质吸光值的变化,从而确定蛋白质在液相中的浓度与时间的关系曲线。实验所得数据用有效孔扩散模型[25-26]进行拟合,并利用MathWorks Corporation 开发的Matlab 软件(Natick,MA,USA)求解得到蛋白质在介质中的有效扩散系数(De)。
实验所用蛋白质为γ-球蛋白和溶菌酶,所对应的平衡缓冲液分别为20mmol/L 乙酸盐缓冲液(pH 5.0)和20mmol/L Tris-HCl(pH 8.0)。在动力学实验中,温度为25℃时γ-球蛋白在自由溶液中的扩散系数(D0)为4.4×10-11m2/s[27],溶菌酶的D0值为11×10-11m2/s[16],蛋白质在介质中的有效扩散系数与在自由溶液中的扩散系数的比值(De/D0)代表介质对蛋白质的传质速率。
1.5 动态结合容量的测定
本实验在ÄKTA Start 层析系统(GE Healthcare,Uppsala, Sweden) 中进行。首先将介质填装进TricornTM5/50(50mm×5mm)层析柱(GE Healthcare,Uppsala,Sweden)中,并将层析柱连接到层析系统中。然后经1.5mL/min 的流速形成体积为(1.05±0.05)mL 的固定床层。将层析柱用平衡缓冲液平衡15~20个柱体积,待紫外检测器信号稳定后将紫外吸光值归零。然后将用平衡缓冲液配制的1mg/mLγ-球蛋白溶液以上述流速上样至50%穿透。停止进样后将吸附的蛋白质用0.5mol/L NaCl洗脱下来,再对层析柱进行再生,再生液为0.5mol/L的NaOH。
蛋白质的动态结合容量(DBC)以10%穿透进行计算[24],如式(2)。
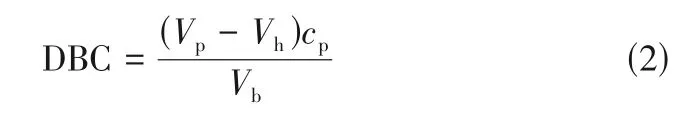
式中,Vp为达到10%穿透时蛋白质的进样量,mL;Vh为系统死体积,mL;cp为上样蛋白质浓度,mg/mL;Vb为填充层析柱体积,mL。
此实验中,平衡缓冲液为20mmol/L 乙酸盐缓冲液(pH 5.0),操作流速为0.5~2.5mL/min (150~750cm/h)。
2 结果与讨论
FF-pMA-320对γ-球蛋白的吸附容量较高,然而,由于可利用孔空间的减小以及接枝链间排斥作用增加,导致其对γ-球蛋白的传质速率与IC 值较低的MA接枝型介质相比较小。为了提高此介质对γ-球蛋白的传质速率,采用乙醇胺中和修饰FFBr-pMA-320以降低接枝链电荷密度,制备得到IC值分别为(170±6)mmol/L 和(234±5)mmol/L 的介质,命名为pMA-320-R170和pMA-320-R230,研究电荷密度对蛋白质吸附行为的影响机制。
2.1 静态吸附
盐浓度为0 时,测定了γ-球蛋白和溶菌酶在pMA-320-R170和pMA-320-R230上的静态吸附情况,并与初始介质FF-pMA-320 作对比。通过Langmuir 方程拟合得到的吸附等温线如图2 所示,吸附平衡参数见表1。
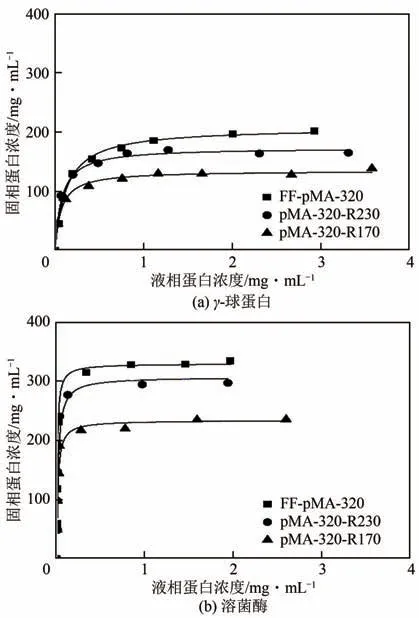
图2 两种蛋白质在阳离子交换介质中的吸附等温线
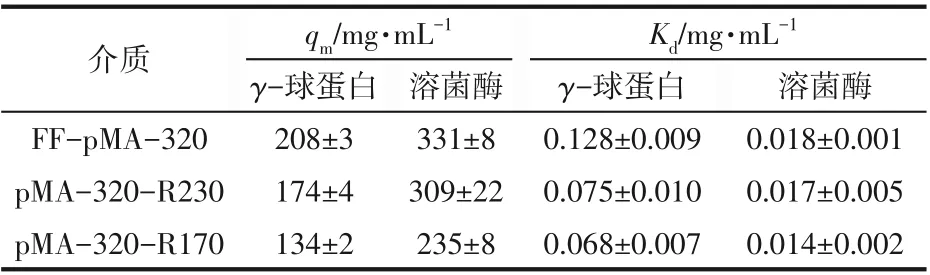
表1 γ-球蛋白和溶菌酶在阳离子交换介质上的吸附平衡参数
对于两种蛋白来说,随着IC值的降低,qm均呈现逐渐下降趋势(表1),当IC值下降至170mmol/L时,介质对γ-球蛋白和溶菌酶的qm值与初始介质相比分别下降了36%和29%。这与文献中报道的研究结果不同,例如溶菌酶在乙醇胺中和修饰的聚乙烯亚胺接枝型阳离子交换介质(FF-PEI-CR)中的吸附容量随IC 值下降呈现出先轻微上升后逐渐下降趋势[20],BSA 在乙酸钠中和修饰的PEI 接枝型阴离子交换介质中的吸附容量随IC 值下降基本保持不变[17]。本研究中所用的初始介质的IC 值(320mmol/L)与PEI接枝型介质的IC值(970mmol/L 或740mmol/L)相比较低,并且聚合物pMA 的电荷密度(9.25mmol/g polymer)小于PEI的电荷密度(23.25mmol/g polymer),造成了初始介质FF-pMA-320 的蛋白质吸附位点较少。FF-pMA-320 经过乙醇胺中和修饰后,接枝链的电荷密度降低,使得与蛋白质结合的可及性结合位点数减少,导致介质对蛋白质的qm值呈现降低趋势。经过中和修饰后,介质对两种蛋白尤其是γ-球蛋白的Kd值降低(表1),表明蛋白质与带电配基之间结合强度随介质电荷密度的降低而增大。这是因为电荷密度降低会减弱聚合物接枝链间的静电排斥作用,使得三维立体接枝层对蛋白质入孔产生的空间位阻作用减弱,从而使蛋白质更易与吸附位点结合,导致蛋白质与带电配基之间结合强度增大。同一种减电荷介质对γ-球蛋白的吸附容量明显小于其对溶菌酶的吸附容量,这与未经中和修饰的FF-pMA-320对两种蛋白质吸附容量的差异表现一致。蛋白质尺寸不同造成其在入孔以及进入孔内与配基发生吸附作用的过程中所受到的空间阻力大小不同[28];此外,带电配基在不同蛋白质吸附条件下解离程度不同,造成配基与蛋白质之间的静电相互作用力大小有所差异,二者共同影响了不同蛋白质在同一介质上的吸附量。
与其他聚合物接枝型阳离子交换介质相比,乙醇胺中和修饰的pMA 接枝型介质对蛋白质的吸附容量处于较高水平。当IC 值相近时,pMA-320-R230 对溶菌酶的吸附容量是海藻酸钠接枝型介质Alg-FF-240吸附容量(225mg/mL)的1.4倍,是商品化介质CM Sepharose FF 吸附容量(194mg/mL)的1.6 倍[24]。相同吸附条件下,pMA-320-R170 对γ-球蛋白的吸附容量高于Alg-FF-160[27]。
2.2 吸附动力学
以γ-球蛋白和溶菌酶为模型蛋白,对pMA-320-R170和pMA-320-R230两种介质在0mmol/L NaCl时进行吸附动力学实验,所得吸附动力学曲线如图3所示,拟合得到的吸附动力学参数De/D0如图4所示。
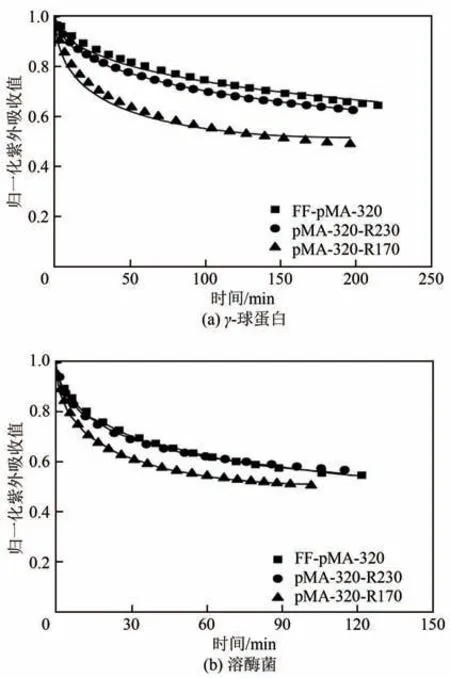
图3 两种蛋白质在阳离子交换介质上的吸附动力学曲线
图4表明,随着IC值的降低,两种蛋白的De/D0值均呈现上升趋势,当IC值下降至170mmol/L时,γ-球蛋白的De/D0值是其在初始介质FF-pMA-320 上的5.5倍,溶菌酶的传质速率是其在初始介质上的1.6倍。相同吸附条件下,pMA-320-R170对γ-球蛋白的传质速率是Alg-FF-160(De/D0=0.045)的4.9倍,是CM Sepharose FF(De/D0=0.074)的3 倍[27]。这种De/D0值上升的趋势类似于文献报道的乙醇胺中和修饰PEI接枝型阳离子交换介质FF-PEI-CR,当FFPEI-CR 的IC 值下降至430mmol/L 时,溶菌酶在介质中的De/D0值是初始介质FF-PEI-C970的15 倍[20]。此外,电荷密度降低导致De/D0值上升的现象也发生在阴离子交换介质中,FF-PEI-R440 对BSA 的传质速率是FF-PEI-L740 的3 倍[17]。pMA 接枝链因乙醇胺中和修饰降低了电荷密度,使得接枝链之间的静电排斥作用减弱,增加了接枝链在蛋白质传质过程中的灵活性;另外,蛋白质的吸附容量降低减弱了介质孔道入口存在的“蛋白质排阻”作用[29],导致其传质速率经乙醇胺中和修饰后明显增加。
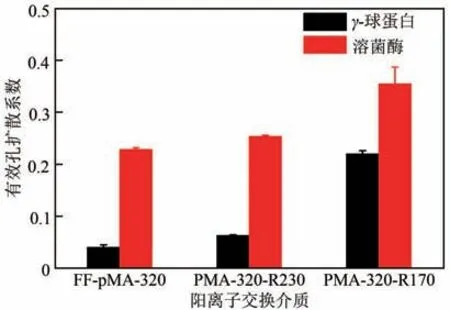
图4 两种蛋白在阳离子交换介质中的De/D0值
2.3 动态结合容量
经过乙醇胺中和修饰后,pMA 接枝型介质的γ-球蛋白传质速率提升较为明显,为了探究电荷密度变化对DBC 值的影响,测定了不同流速下γ-球蛋白在FF-pMA-320、pMA-320-R170 和pMA-320-R230 中的DBC 值,穿透曲线如图5 所示,计算得到的DBC值如图6所示。
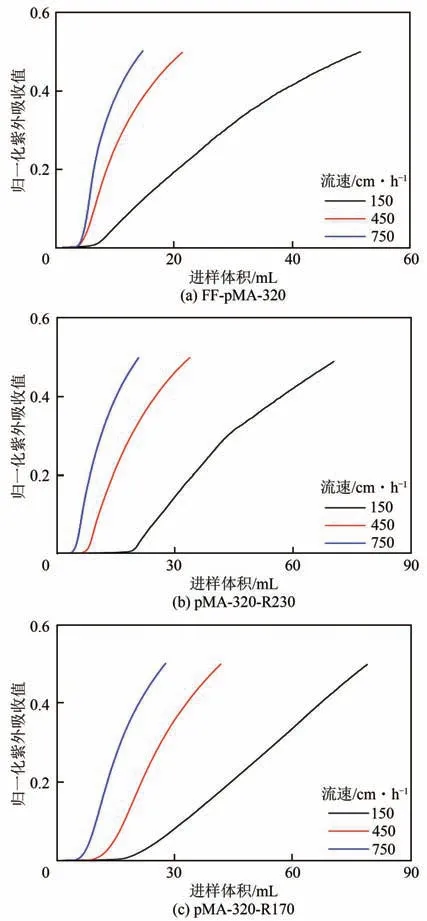
图5 不同流速下γ-球蛋白在三种阳离子交换介质中的归一化穿透曲线
由图6可以看出,随着流速的提高,三种介质对γ-球蛋白的DBC 值均呈现下降趋势。在流速为150~750cm/h时,pMA-320-R170对γ-球蛋白的DBC值明显大于其他两种介质,在最低流速下是FF-pMA-320 的2.8 倍。这种DBC 值随介质电荷密度降低而升高的现象与其他减电荷介质类似,例如流速为150cm/h 时,FF-PEI-R440对BSA 的DBC 值是初始介质的两倍[17],流速高于150cm/h时,FF-pAEM513-R339对BSA的DBC值高于初始介质FF-pAEM513[19]。由介质对γ-球蛋白传质行为研究结果可知,乙醇胺中和修饰可显著提高介质对蛋白质的传质速率,弥补了吸附容量降低对蛋白质DBC 值带来的不利影响,从而使介质的DBC 值受传质速率的大小影响更大,这与文献[30]结果相似。因此,pMA-320-R170对γ-球蛋白的DBC值在所研究的流速范围内高于另外两种介质。
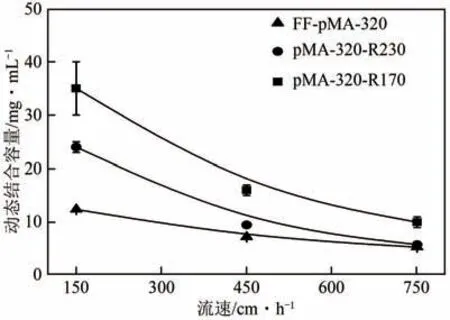
图6 不同流速下γ-球蛋白在阳离子交换介质上的DBC值
3 结论
通过乙醇胺中和修饰pMA 接枝型介质FFpMA-320,降低介质的电荷密度,得到两种IC 值较低的介质pMA-320-R170 和pMA-320-R230,研究电荷密度对pMA 接枝型介质的蛋白质吸附性能的影响,结果表明:由于电荷密度的降低导致蛋白质吸附位点较少,介质对溶菌酶和γ-球蛋白的吸附容量均随电荷密度(IC 值)的降低而减少。接枝链之间的静电排斥效应随电荷密度的降低而减弱,使得链的灵活性增加,蛋白质吸附容量的降低减弱了被吸附的蛋白质对后续蛋白质入孔产生的空间位阻效应,造成介质对蛋白质的传质速率随电荷密度的减小而提高。因此,在流速为150~750cm/h时,具有最低电荷密度的介质(pMA-320-R170)对γ-球蛋白的DBC 值最高。上述研究结果证明乙醇胺中和修饰法有助于提高pMA 接枝型介质的蛋白质的吸附性能(传质速率和动态结合容量),为将经过电荷中和修饰的pMA 接枝型介质应用于蛋白质的实际分离纯化过程提供理论依据。
