戊唑醇-三唑酮双模板分子印迹聚合物在烟叶农残检测中的应用
2022-12-15景联鹏顾丽莉师君丽李增良杨发容李国栋
景联鹏,顾丽莉,师君丽,李增良,杨发容,李国栋
(1 昆明理工大学化学工程学院,云南 昆明 650500;2 云南省烟草农业科学研究院,云南 玉溪 653100)
戊唑醇和三唑酮属于三唑类杀菌剂,因其低毒、杀菌广谱和活性高等特点被广泛应用于小麦、蔬菜和烟草等农作物的病虫防治[1]。由于戊唑醇和三唑酮用量大,化学性质稳定,不易降解,半衰期长,因此在使用过程中可能对动植物及环境造成危害,从而严重威胁人类健康和生态安全[2-3],故而对农产品和环境中戊唑醇和三唑酮的残留分析具有十分重要的意义。
目前,检测三唑类杀菌剂的方法主要包括液相色谱法(LC)[4]、气相色谱法(GC)[5]、高效液相色谱法(HPLC)[6]、气质联用法(GC-MS)[7]、分光光度法[8]、液质联用法(LC-MS)[9]、超高效液相色谱-串联质谱(UHPLC-MS/MS)[10]等。农产品成分越复杂,对低含量三唑类杀菌剂的检测要求越高,故需探索出一种干扰小、富集能力强的前处理技术,以排除样品中基质的影响,确保检测的准确性。
分子印迹聚合物(molecularly imprinted polymer,MIPs)是一种具有与目标分子完全匹配印迹空腔的功能材料[11]。因MIPs 对模板分子具有“记忆”功能,能对其进行特异性识别,并且制备简单,物理化学性质稳定,目前已被广泛应用于固相萃取[12-14]、色谱固定相[15]、药物释放[16]、传感器[17-18]和催化剂[19]等领域。
分子印迹固相萃取(molecularly imprinted solid phase extraction,MISPE)作为一种高选择性前处理技术,在针对其研究与应用上,当前大多局限于单模板印迹体系的研究,不能实现多种物质的同时高效分离与富集。赵春娟等[20]将以三唑醇、烯唑醇和腈菌唑为模板制备的MIPs 按质量比为1∶1∶1混合作为固相萃取柱的填充物用于样品的前处理,虽取得了较好的效果,但该方式也仅仅是物理复合,并未实现真正的化学复合,而且聚合物颗粒不均匀也会导致吸附不均匀。
本文在本文作者课题组前期研究工作的基础上,以戊唑醇和三唑酮为双模板分子,MAA 为功能单体,通过沉淀聚合法制备双模板分子印迹聚合物,并将其应用于烟叶中三唑类农药的残留分析,建立烟叶中戊唑醇、三唑酮及其结构类似物农药残留的MISPE-UHPLC-MS/MS检测方法。
1 实验部分
1.1 材料与试剂
戊唑醇(tebuconazole, TBZ, 98%)、三唑酮(triadimefon,TDF,98%)、三唑醇(triadimenol,TDM,98%)、莠去津(atrazine, ARZ, 98%) 和西草净(simetryn, SMT, 98%),德国Dr.Ehrenstorfer 公司;腈菌唑(myclobutanol, MYC, 98.5%),上海阿拉丁公司;乙二醇二甲基丙烯酸酯(ethylene glycol dimethacrylate,EGDMA,分析纯),北京百灵威科技有限公司;偶氮二异丁腈[2,2'-azobis(2-methylpropionitrile),AIBN,分析纯],天津光复精细化工研究所;其他试剂如甲基丙烯酸(methacrylic acid,MAA)、乙腈和冰乙酸等皆为分析纯,天津致远化学试剂有限公司。
1.2 仪器与设备
场发射扫描电子显微镜(SEM),Tecnai G2 TF30 STwin 型,荷兰FEI 公司;傅里叶红外光谱仪(FTIR),Equinox55 型,德国BRUKER公司;台式高速离心机,TG16-WS 型,湖南湘仪实验室仪器开发有限公司;旋转蒸发仪,RE-2000A型,上海亚荣生化仪器厂;气浴恒温振荡器,ZD-85型,金坛市城东新瑞仪器厂;超高效液相色谱仪,Agilent 1290 InfinityUHPLC 型,美国Agilent Technologies;质谱仪,AB Sciex Qtrap(TM)3200 MS/MS 型,美国ABSciex,CA。
1.3 分子印迹聚合物的制备
1.3.1 功能单体的筛选
筛选步骤:①采用Gaussian view 5.0分别构建了模板分子和4种功能单体(AA、AM、MAA、TFMAA)的分子模型,运用Gaussian 09 软件中B3LYP 基组的6-31G+(d,p)水平对模板分子和4 种功能单体的结构进行优化与计算,得出各分子优化构象;②研究模板分子与各功能单体可能形成的复合物情况,并从氢键键长、氢键数目及氢键作用的活性位点分析比较模板分子与各功能单体的作用原理及作用力;③按式(1)计算模板-单体复合物的结合能。
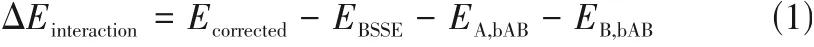
式中,ΔEinteraction为模板分子与功能单体的结合能,kJ/mol;Ecorrected为消除了因单体基组重叠造成的能量降低后的A-B 复合物能量,kJ/mol;EBSSE为矫正能,kJ/mol;EA,bAB为A、B基组下A的能量,kJ/mol;EB,bAB为A、B基组下B的能量,kJ/mol。
1.3.2 沉淀聚合法制备双模板MIPs
于100mL 玻璃瓶中依次加入0.1mmol TBZ、0.1mmol TDF、0.8mmol MAA和50mL乙腈,超声溶解后通N2除氧,随后置于气浴恒温振荡器中预聚合12h;在预聚合结束后的溶液中依次加入4mmol EGDMA 和30mg AIBN,混合均匀后通N2除氧15min,然后置于60℃的气浴恒温振荡器中热聚合24h;热聚合结束后,将样品冷却至室温,再以10000r/min分离聚合物,倒掉上清液,将所得聚合物干燥至恒重后放入索氏提取器中,用甲醇-乙酸(体积比9∶1)循环洗脱聚合物,直至洗脱液中无TBZ 和TDF 为止,再用甲醇将聚合物洗涤至中性;最后将聚合物干燥至恒重,即得到TBZ-TDFMIPs。作为对照,非分子印迹聚合物(NIPs)的制备除了不加TBZ 和TDF 以外,其他步骤均与TBZTDF-MIPs的制备一致[21-22]。
1.4 MIPs吸附性能探究
1.4.1 动态吸附实验
称取若干份MIPs 和NIPs 各10mg 于10mL 离心管中,分别加入20mg/L的TBZ或TDF乙腈标准溶液5mL,混匀后置于室温下分别吸附10min、30min、50min、70min、90min、110min、130min、150min和170min后过滤膜,收集滤液并用UHPLC-MS/MS检测滤液中TBZ 或TDF 的浓度,按式(2)计算不同时间下聚合物对TBZ或TDF的吸附量(Q)。

式中,Q为MIPs 或NIPs 对TBZ 或TDF 分子的吸附容量,mg/g;C0和C分别为TBZ 或TDF-乙腈溶液的初始浓度和吸附结束后的浓度,mg/L;V为溶液的体积,L;M为MIPs或NIPs的质量,mg。
1.4.2 静态吸附实验
称取若干份MIPs 和NIPs 各10mg 于10mL 离心管中,分别加入5mL 不同浓度的TBZ 或TDF 乙腈标准溶液(1~80mg/L),室温下吸附24h后过滤膜,收集滤液并用UHPLC-MS/MS 检测滤液中TBZ 或TDF的浓度,通过式(2)计算聚合物对TBZ或TDF的吸附容量。
1.4.3 选择性吸附实验
称取若干份MIPs 和NIPs 各10mg 于10mL 离心管中,分别加入20mg/L 的不同农药(TBZ、MYC、TDM、TDF、SMT 和ARZ)的乙腈标准溶液5mL,混匀后置于室温下吸附24h后过滤膜,收集滤液并用UHPLC-MS/MS 检测滤液中TBZ、MYC、TDM、TDF、SMT和ARZ的浓度,通过式(2)计算聚合物对上述6种农药的吸附容量,探究聚合物的选择性吸附性能。
1.5 分子印迹固相萃取柱的装填及应用
1.5.1 加标烟叶样品的制备
准确称取3g 干燥后的烟叶样品分别置于20mL离心管中,添加3mL 3种浓度(0.2mg/L、0.5mg/L、1mg/L)的农残混标溶液,再加入10mL 乙腈溶液,振荡混匀后超声提取1h,经离心、过滤和旋蒸后用3mL乙腈复溶,即得加标烟叶提取液。
1.5.2 分子印迹固相萃取吸附实验
分别取100mg TBZ-MIPs 和TBZ-TDF-MIPs 制备分子印迹固相萃取(MISPE)小柱,依次加入5mL水和5mL甲醇对萃取柱进行活化后,取2mL的加标烟叶提取液进行上样,待小柱充分吸附农药后用5mL 水对萃取柱进行淋洗,再用10mL 甲醇-乙酸溶液(体积比9∶1)对农残进行洗脱,收集洗脱液并旋蒸除去洗脱剂,再用1mL 乙腈复溶后过滤膜,供UHPLC-MS/MS分析。
1.6 UHPLC-MS/MS分析条件
色谱条件:ACQUITY UHPLC BEH-C18色谱柱(10㎝×2.1mm,1.8µm),流速0.4mL/min,检测波长228nm,流动相A(0.1%甲酸-水溶液),流动相B(0.1%甲酸-乙腈溶液)。
质谱条件:离子喷射电压5500V,雾化温度550℃,扫描方式为正离子扫描,检测方法为多反应检测模式。
2 结果与讨论
2.1 功能单体的种类及其与模板结合比例选择
2.1.1 模板分子与功能单体结合位点分析
优化后的模板分子与功能单体的几何构型及其静电势分布如图1所示,根据颜色标尺可知,颜色越蓝的部位表示该位点电正性越强,易失去电子;颜色越红的部位表示该位点电负性越强,易得到电子。理论上电正和电负性越强的位点即为形成氢键的潜在位点[23],模板与单体的潜在位点情况如表1所示。
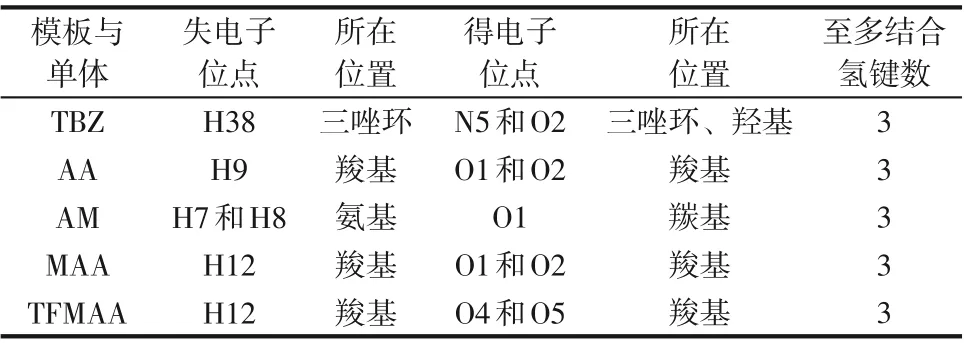
表1 TBZ与4种功能单体的潜在结合位点与可能结合氢键数
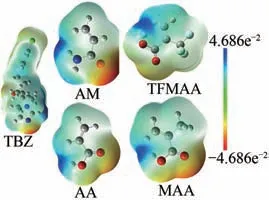
图1 模板TBZ与单体AA、AM、MAA和TFMAA的静电势分布
2.1.2 模板-单体复合物构型及其配比优化
根据静电势分布图将TBZ与各功能单体之间以氢键形式相连,并在B3LYP 基组的6-31G+(d,p)下对模板-单体复合物的空间构型进行优化,筛除不符合条件的连接方式并再次优化,最终复合物构型及氢键键长如图2所示。
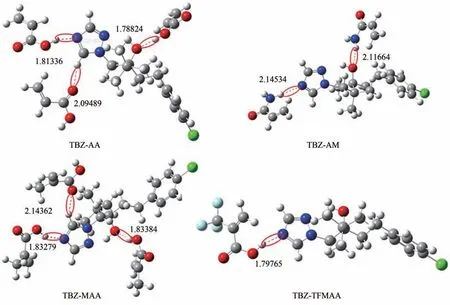
图2 TBZ与4种功能单体形成复合物的几何结构
基于上述复合物构型及模板-单体配比优化,对复合物构型进行能量计算,并进行平衡校正,结果如表2所示。由表2可知,TBZ与MAA结合能最大,其次分别是AA、AM 和TFMAA,结合能ΔE越大,表明功能单体与模板分子之间的相互作用力就越强,所得聚合物印迹空腔的活性位点能量就越高,亲和性和选择性也就越强。因此MAA是制备TBZMIPs 的最佳功能单体,且TBZ 与MAA 结合比例为1∶3。针对三唑酮(TDF),其功能单体的筛选过程与TBZ一致,根据本文作者课题组之前的研究结果,MAA 与TDF 之间的结合能最大,且TDF 与MAA 结合比例也为1∶3[21]。为使模板分子与功能单体之间的预组装更加充分,实际制备时常适当增加功能单体的比例,因此,制备复合模板分子印迹聚合物的摩尔比选为TBZ∶TDF∶MAA=1∶1∶8。
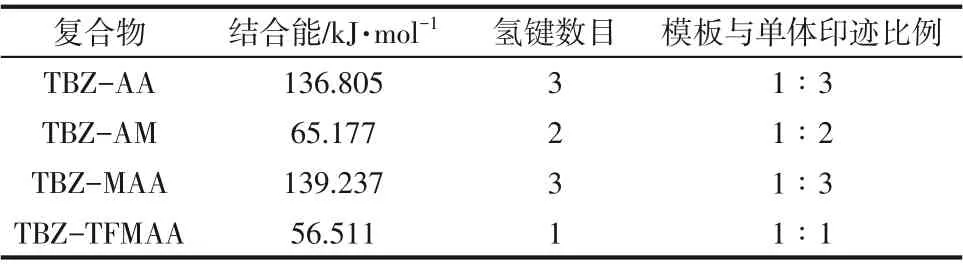
表2 TBZ与4种功能单体相互作用的作用能(ΔE)和氢键数
2.2 聚合物的物理表征
2.2.1 微观形貌表征
采用扫描电子显微镜(SEM)对MIPs 和NIPs的微观形貌进行表征。如图3 所示,MIPs 和NIPs均为纳米级的球形聚合物,并且微球粒径均一,球形度高,彼此之间无粘连现象。另外MIPs 微球表面粗糙,存在很多孔穴,这些微孔结构有利于MIPs对TBZ和TDF的吸附,而NIPs微球表面则比较光滑。

图3 聚合物的场发射扫描电镜图
2.2.2 红外光谱表征
为考察双模板分子印迹聚合物是否制备成功,对两种模板分子、MIPs 洗脱前后和NIPs 的红外光谱进行分析,如图4所示。由图可以看出,在MIPs洗脱前后以及NIPs 洗脱后的红外谱图中,在1732cm-1附近的吸收峰为交联剂EGDMA中C==O振动峰,1635cm-1附近的吸收峰为EGDMA中C==C振动峰,MIPs 洗脱前后以及NIPs 洗脱后均在1157cm-1处出现尖锐的峰,该峰为EGDMA中O—C—O振动峰,1257cm-1处出现尖锐的峰,该峰为功能单体MAA中C—O振动峰,这些特征吸收峰表明聚合物制备成功。另外TBZ、TDF 和MIPs 洗脱前均在672cm-1处出现吸收峰,这是TBZ和TDF中的C—Cl吸收峰,而该峰未在MIPs和NIPs洗脱后的谱图中出现,并且MIPs洗脱后和NIPs的谱图中主要峰形基本一致,表明模板分子TBZ和TDF已经被完全洗脱。
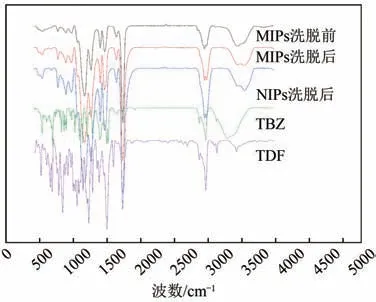
图4 聚合物洗脱前后和TBZ、TDF的红外光谱图
2.3 聚合物吸附性能
2.3.1 动态吸附性能
测试了MIPs和NIPs对TBZ及TDF的吸附量(Q)随时间的变化关系,如图5所示。由图5可知,MIPs对TBZ和TDF的吸附量均随时间的延长而增加,在150min 时接近吸附平衡,表明MIPs 对TBZ 和TDF具有较快的吸附动力学。尽管NIPs 对TBZ 和TDF的吸附量随时间的增加而缓慢增加,但是吸附量始终低于MIPs,这是因为MIPs 表面及内部具有与模板分子大小及结构互补的三维印迹空腔,故MIPs对模板分子的吸附是化学吸附和物理吸附并存的,而NIPs对模板分子的吸附仅为物理吸附。
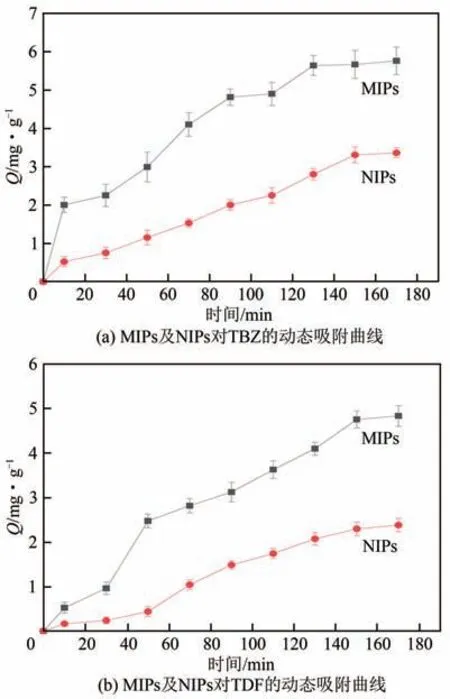
图5 MIPs与NIPs的动态吸附曲线
2.3.2 静态吸附性能及Scatchard模型分析
通过静态吸附实验考察聚合物对模板分子的吸附性能,绘制MIPs 和NIPs 对TBZ 及TDF 的静态吸附曲线,如图6所示。由图中曲线走势可知,MIPs对TBZ 或TDF 的吸附量始终高于NIPs,这是因为MIPs 微球中含有与TBZ 或TDF 分子互补的三维印迹空腔,对TBZ或TDF具有记忆功能,能对其进行特异性吸附,而NIPs 无与之互补的印迹空腔,仅通过物理作用吸附TBZ及TDF分子。
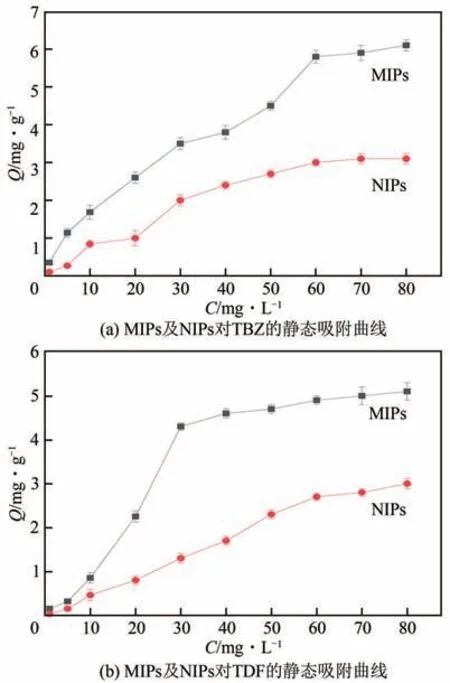
图6 MIPs与NIPs的静态吸附曲线
采用Scatchard 模型分析MIPs 对模板分子的吸附位点种类、解离常数以及最大吸附量[24]。Scatchard模型如式(3)所示。

式中,Qmax为结合位点的最大表观结合量,mg/g;Q为MIPs对模板分子的吸附量,mg/g;C为吸附液中模板分子的平衡浓度,mg/L;K为结合位点的平衡解离常数,mg/L。
由图7 可知,Q/C对Q是非线性关系,MIPs 对TBZ 及TDF 的Scatchard 曲线分成了两部分,表明MIPs对TBZ或TDF分子的吸附是不均匀的,存在两类吸附位点。原因可能是在热聚合过程中,TBZ或TDF分子与功能单体MAA产生了不同的作用方式,同时自由基聚合过程的不稳定性也导致MIPs 表面及内部的印迹空腔大小和数量有所差异,而且除了模板分子的印迹作用,还存在其他共存物的非印迹作用。为研究两类吸附位点的结合效能,对两个线性部分进行拟合,分别计算出戊唑醇与三唑酮的平衡解离常数K和饱和吸附量Qmax,结果如表3所示。
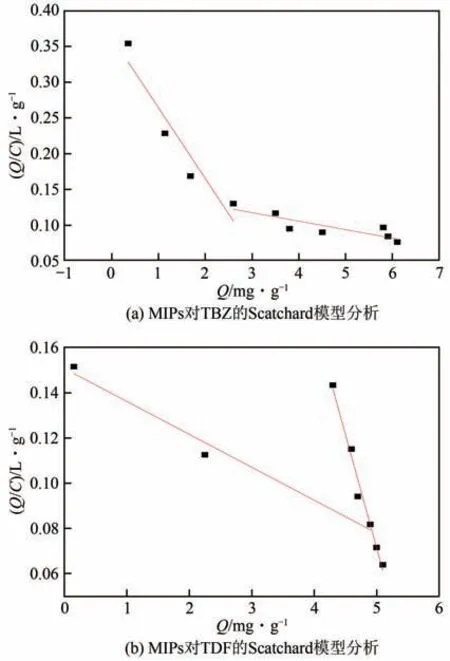
图7 MIPs的Scatchard模型分析
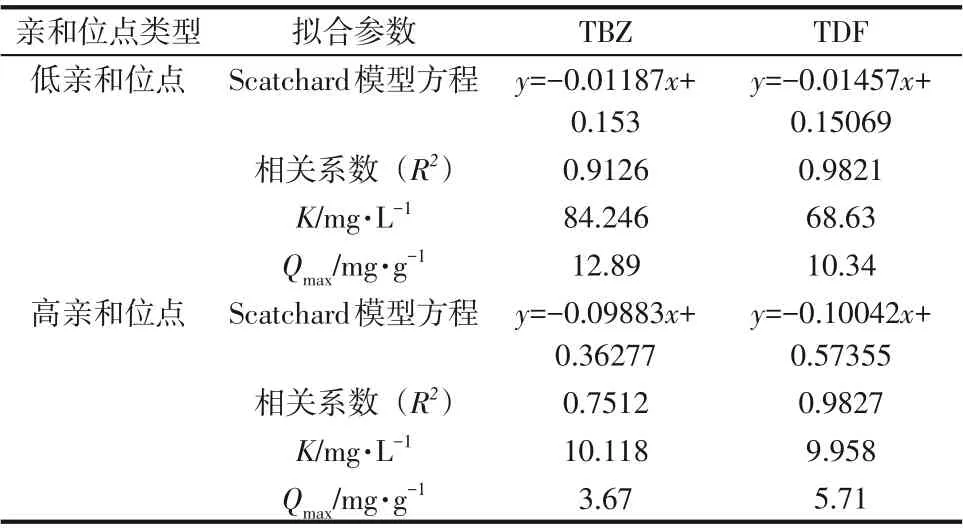
表3 MIPs静态吸附曲线的Scatchard分析及亲和位点分布
2.3.3 选择性吸附性能
为考察MIPs 的特异性吸附能力,选择含TBZ、MYC、TDM 和TDF 4 种三唑类杀菌剂,以及SMT和ARZ 两种三嗪类除草剂的标准液作为吸附液,通过平衡吸附实验测定MIPs对6种农药的吸附量,结果如图8所示。
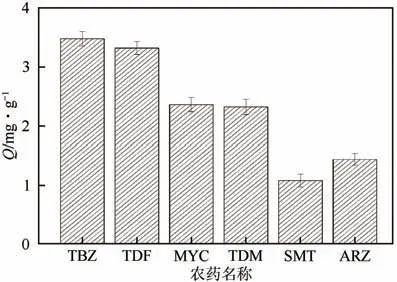
图8 MIPs对6种农药的选择性吸附性能
由图8可知,MIPs对6种农药均有一定的吸附能力,且吸附能力由大到小依次为:TBZ、TDF、MYC、TDM、ARZ和SMT。其中MIPs对TBZ和TDF的吸附效果最好,吸附量分别达到了3.48mg/g 和3.32mg/g,对MYC和TDM的吸附容量也较高,吸附量分别为2.36mg/g和2.32mg/g,而对ARZ和SMT的吸附效果最差,吸附容量仅为1.44mg/g和1.08mg/g。这是因为MIPs 内部存在与TBZ 和TDF 相匹配的印迹空腔,表现出对TBZ 和TDF 特异性吸附,而MYC 和TDM 分子结构与模板分子结构类似,但SMT 和ART 的分子结构与模板分子结构差异大,故MIPs表现出良好的组选择性以及特异选择性。
2.4 戊唑醇-三唑酮-MISPE-UHPLC-MS/MS 检测烟叶中农药残留
2.4.1 标准曲线的绘制
分别以6 种农药(TBZ、TDF、TDM、MYC、ARZ和SMT)的浓度为横坐标,峰面积为纵坐标,拟合标准曲线,结果如表4所示。由表可知,在0.0005~0.1mg/L 浓度范围内具有良好的线性关系,相关系数R2为0.9991~1.0000。
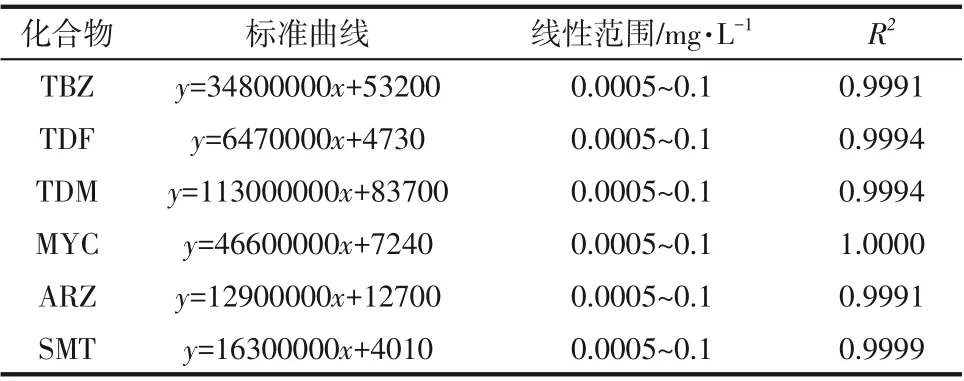
表4 6种农药的标准曲线及相关系数
2.4.2 戊唑醇-三唑酮-MISPE对样品的净化能力
为评价戊唑醇-三唑酮-MISPE柱对烟叶样品中农药的净化能力,以C18-SPE柱和HLB-SPE柱作为对比,将加标烟叶用3种固相萃取柱进行前处理,然后用UHPLC-MS/MS检测,对应色谱图如图9所示。
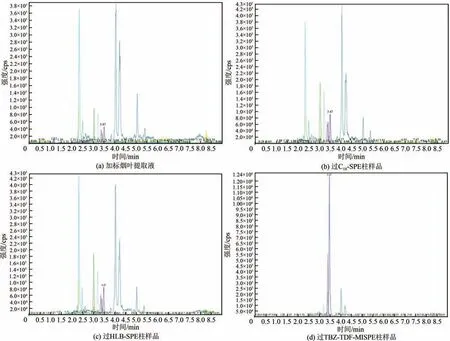
图9 戊唑醇-三唑酮-MISPE对样品的净化能力
由图9 可知,TBZ-TDF-MISPE 柱、C18-SPE 柱和HLB-SPE柱对烟叶样品均有一定的净化能力,6种农药的峰都能很好地分离开来,但3种固相萃取柱的净化能力差异较大。其中TBZ-TDF-MISPE 柱净化效果最好,C18-SPE柱和HLB-SPE柱净化效果次之,因为TBZ-TDF-MISPE 柱能特异性吸附目标分子,而C18-SPE柱和HLB-SPE柱因其无选择性,通过物理作用同时吸附目标分子和其他杂质。
2.4.3 回收率与精密度
为考察TBZ-TDF-MISPE-UHPLC-MS/MS方法的准确性和重复性,分别在0.2µg/g、0.5µg/g和1µg/g加标水平下进行回收率实验,结果如表5所示。
由表5可知,样品中TBZ、TDF、TDM和MYC的回收率在72%~110.3%,相对标准偏差(RSD)为2.38%~7.92%(n=3),而ARZ和SMT的回收率仅为4.35%~15.8%,说明该法选择性强,回收率高,精密度好,能满足烟叶中TBZ、TDF、MYC 和TDM的检测要求。
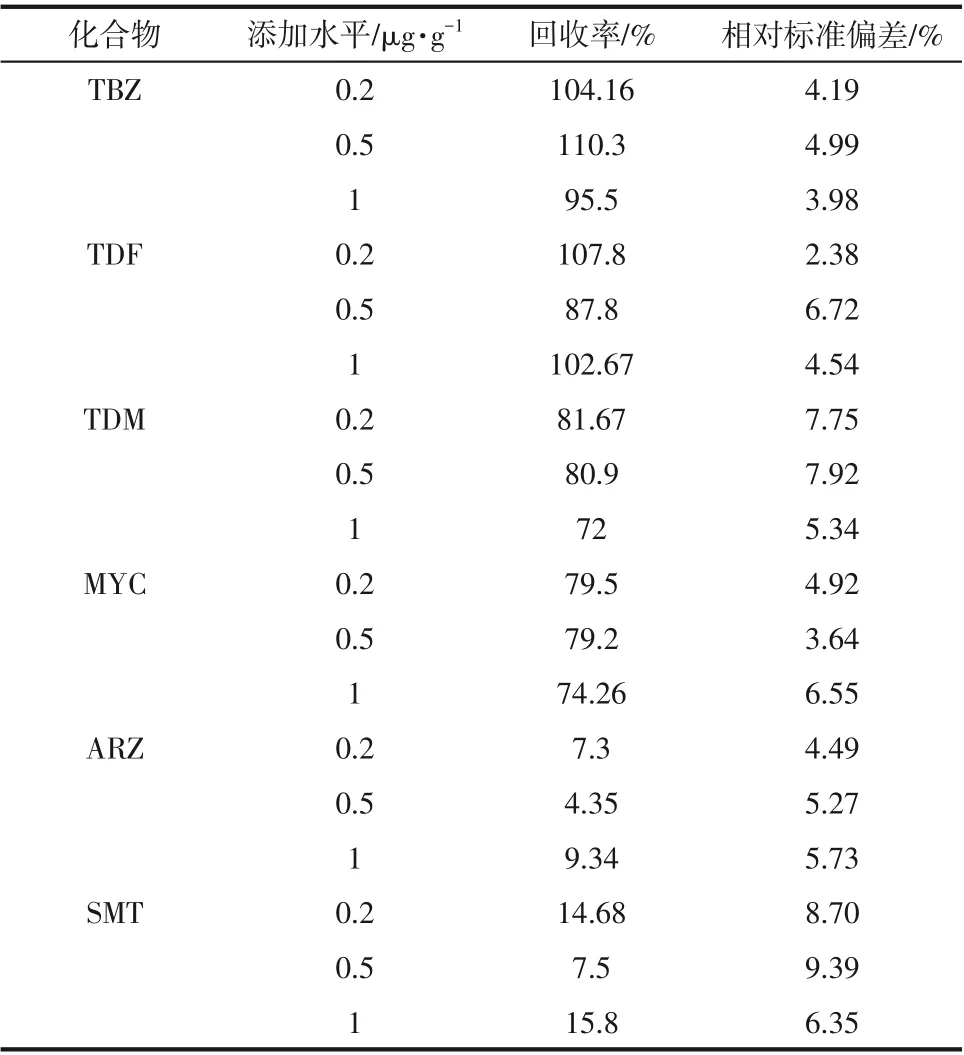
表5 固相萃取的加标回收率和精密度(n=3)
2.4.4 单模板和双模板MISPE柱分离效果对比
TBZ-MISPE柱、TDF-MISPE柱[21]和TBZ-TDFMISPE 柱对戊唑醇和三唑酮的回收率如表6 所示。由表6 可知,TBZ-MISPE 柱在加标水平(0.2µg/g、0.5µg/g 和1µg/g)下对TBZ 和TDF 两者的平均回收率差异明显,对TBZ达到了110.16%,而对TDF仅为45.3%;TDF-MISPE 柱在加标水平(0.01µg/g、0.05µg/g、0.1µg/g和0.5µg/g)下对TBZ和TDF的平均回收率分别为90.02%和98.27%,二者差异较小;TBZ-TDF-MISPE 柱对TBZ 和TDF 的平均回收率分别为103.32%、99.42%,二者接近。通过对比3种MISPE柱对戊唑醇和三唑酮的分离效果,可以得出双模板MISPE柱的分离效果优于单模板MISPE柱,双模板MISPE 柱更有利于实现同时且高效地对样品中农残(TBZ和TDF)的分离与富集。
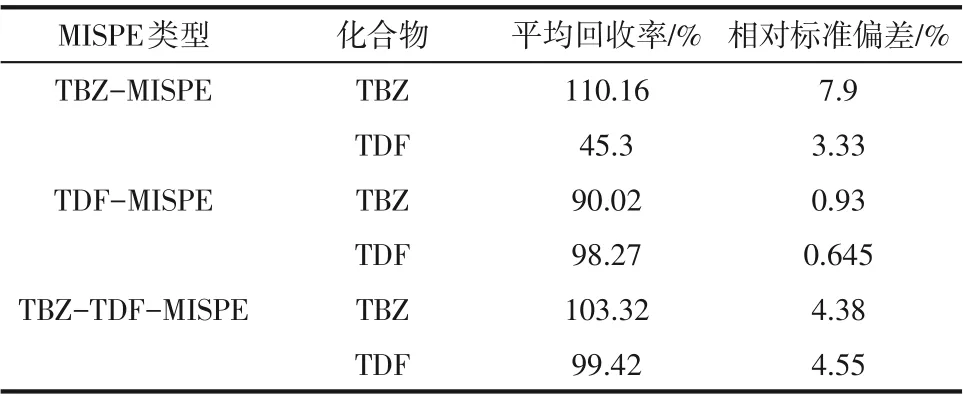
表6 单模板和双模板MISPE柱分离效果对比
3 结论
以戊唑醇和三唑酮作为双模板,通过沉淀聚合法制备了具有良好吸附性能的双模板MIPs。动态吸附结果显示MIPs 的吸附容量在2.5h 时即可接近饱和;静态吸附及Scatchard 分析结果表明,MIPs对模板分子具有较强的吸附能力,并且MIPs 的吸附位点不均一,存在高低两类亲和位点;选择性吸附结果表明MIPs 不仅对戊唑醇和三唑酮具有很好的吸附能力,也对其结构类似物腈菌唑和三唑醇具有一定的吸附能力,而对莠去津和西草净吸附能力很弱,表现出良好的特异选择性和组选择性。以双模板MIPs 作为固相萃取柱填料制备MISPE 柱,建立了戊唑醇-三唑酮-MISPE-UHPLC-MS/MS 检测烟叶中4种杀菌剂的方法,并与单模板MISPE柱进行对比。结果表明,戊唑醇-三唑酮-MISPE 柱对三唑类杀菌剂的富集能力优于单模板MISPE 柱,在加标水平(0.2µg/g、0.5µg/g、1µg/g)下的平均回收率为72%~110.3%,RSD 为2.38%~7.92%,满足烟叶中三唑类杀菌剂残留分析的要求。另外,基于该MIPs良好的吸附性能,所建立的MISPE-UHPLCMS/MS方法也可以应用于食品、环境中相应三唑类杀菌剂残留的检测。
