1 型糖尿病并发牙周炎患者牙周基础治疗效果1 例报告及文献复习
2022-12-15闫嘉晴
闫嘉晴, 朱 莹, 胡 敏
(1. 吉林大学口腔医院牙周科, 吉林 长春 130021;2. 吉林大学口腔医院正畸科, 吉林 长春 130021)
糖尿病是牙周炎的危险因素之一已成为共识, 然而相关报道[1-3]主要集中于2 型糖尿病(type 2 diabetes mellitus, T2DM), 1 型 糖 尿 病(type 1 diabetes mellitus, T1DM) 并 发 牙 周 炎(periodontitis, PD)的报道相对较少。部分研究[4]讨论了T1DM 与PD 之间的关系, 但相关病例报道并不多见。PD 是一种由菌斑微生物引起的慢性感染性口腔疾病, 可引起牙龈上皮组织炎症, 造成牙周支持组织破坏, 最终导致牙齿脱落和咀嚼功能丧失。PD 是危害人类牙齿和全身健康的主要口腔疾病之一, 其发病率高、危害大、病因复杂、病理过程反复、治愈困难, 是我国成年人牙齿缺失的首要原因[5]。近年来, 随着我国人民生活水平的提高和生活方式的改变, 糖尿病的发病率也呈逐年升高趋势, 并且发病年龄越来越年轻化, T1DM 患病率也呈现明显升高趋势。T1DM 是由免疫介导的胰腺细胞破坏引起的自身免疫性疾病, 约占儿童和青少年糖尿病总数的90%[6]。流行病学调查[7-8]显示:PD 与糖尿病之间存在密切的双向关系, 糖尿病是PD 的特定危险因素, 其在导致牙周微生物菌群过度炎症反应的同时, 阻碍炎症的消退和修复, 进而破坏牙周组织。PD 会导致机体促炎介质水平升高, 使胰岛素抵抗加剧进而加重糖尿病病情[9]。有研究[10]显示:受遗传等因素的影响, 即使血糖稳定在正常水平, T1DM 患者PD 发病率仍高于非糖尿病患者。目前T1DM 并发PD 的病因尚未完全明确, 其发病机制、预防和治疗方式亦需要进行更深入的研究, 以实现早期诊断疾病和延缓疾病进展[11]。本文作者收集并分析1 例T1DM 并发PD 患者的临床资料并进行文献回顾, 旨在为患者和临床医生预防及治疗T1DM 并发PD 提供依据。
1 临床资料
1.1 一般资料患者, 女性, 22 岁, 因“牙龈萎缩1 年”, 于2020 年11 月来本院牙周科就诊。1 年前, 患者自觉牙龈萎缩明显, 无牙周治疗史。8 年前患者确诊为T1DM, 除控制饮食外, 采用胰岛素泵控制血糖。近3 年空腹血糖水平稳定在6.0~7.0 mmol·L-1, 糖化血红蛋白水平控制在6.5%~7.0%, 无其他全身系统性疾病。
1.2 专科检查患者口腔卫生情况差, 简化口腔卫生指数(Simplified Oral Hygiene Index, OHI-S)为2。牙龈暗红, 边缘退缩, 牙龈乳头充血水肿, 质地松软, 探诊深度(probing depth, PD)为2~8 mm, 附着丧失(attachment loss, AL)为2~5 mm, 出 血 指 数(bleeding index, BI) 为4, 探 诊 出 血(bleeding on probing, BOP)阳性位点约占总位点的90%。31、41、42 和47 Ⅰ度 松 动, 14、24、34、38、44 和48 缺 失, 18 和28向伸长, 拍摄口腔内照片(图1)并建立牙周检查记录表。行影像学检查, 曲面断层影像(图2)显示:全口牙槽骨呈水平型骨吸收, 牙槽骨高度降至根长的1/3~1/2 处, 磨牙根分叉区可见骨低密度影, 临床诊断为慢性牙周炎。
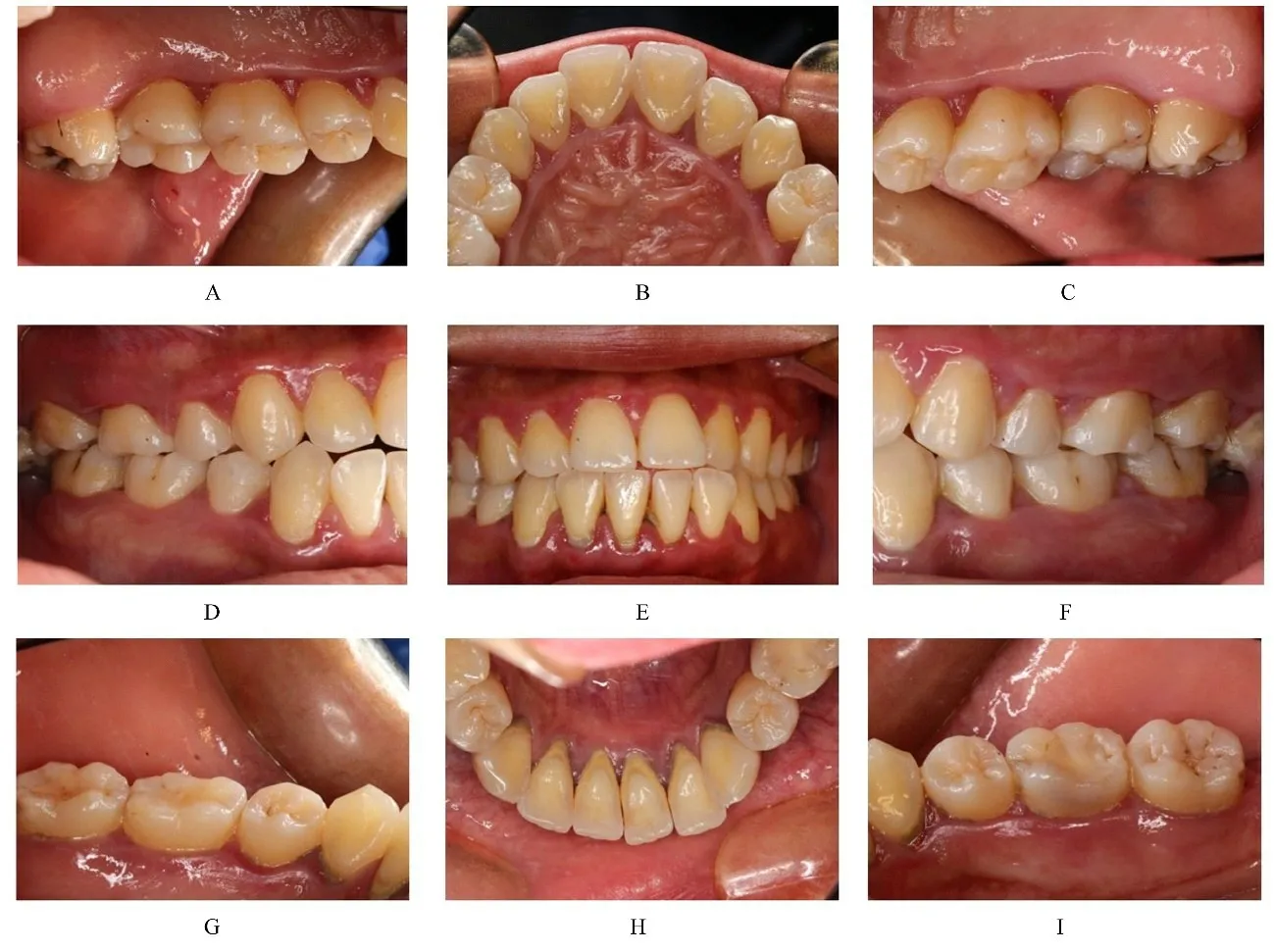
图1 T1DM 并发PD 患者治疗前口腔内照片Fig.1 Intraoral photographs of patient with T1DM complicated with PD before treatment
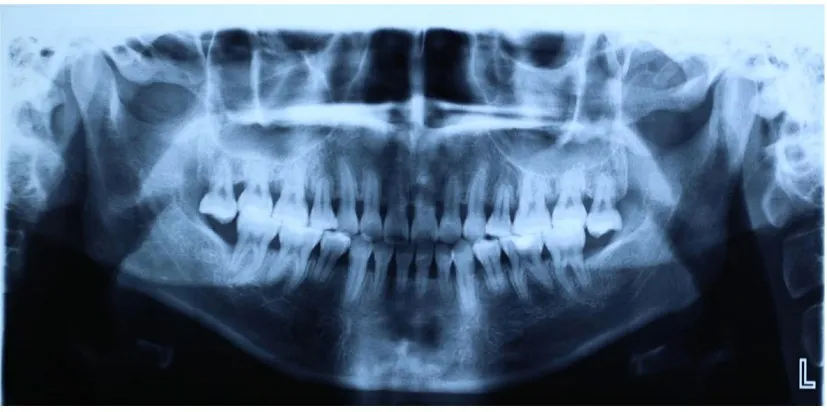
图2 T1DM 并发PD 患者曲面断层图像Fig. 2 Panoramic radiograph of patient with T1DM complicated with PD
1.3 治疗方法告知患者及其家属病情和治疗计划, 使患者知情同意;嘱患者长期监控并稳定血糖;口腔卫生宣教, 牙周基础治疗;建议患者牙周情况稳定后, 转诊口腔颌面外科, 拔除18 和28;牙周定期维护, 控制菌斑, 定期复查。
1.4 治疗过程2020 年11 月患者初次就诊, 首先监控血糖, 患者空腹血糖水平为6.8 mmol·L-1, 糖化血红蛋白百分率为6.9%, 完成全口龈上洁治术和牙面光洁术, 嘱患者于术前采用聚维酮碘漱口液含漱, 每次10 mL, 每次30 s, 洁治术后继续使用漱口液3 d, 每日3 次。龈下刮治术和根面平整术前嘱患者预防性使用抗生素5 d。2020 年11—12 月患者分4 次完成全口龈下刮治术和根面平整术, 牙周袋内置派力奥缓释剂。牙周基础治疗后6 周后复诊, 患者血糖控制稳定, 空腹血糖水平为6.7 mmol·L-1, 糖化血红蛋白水平为6.9%。患者口腔卫生保持良好, 牙龈颜色变浅, 肿胀程度减轻, 质地坚韧, 仅上颌后牙和下前牙舌侧可见少量软垢, 牙石未见, 拍摄口腔内照片(图3), 并再次进行牙周专业探诊, 行牙周检查记录, 31、41、42 和47 松动度得到改善, 未见明显松动, PD 为0~4 mm, BOP 百分率降至13%。该患者牙周基础治疗6 周后, 牙周组织炎症减轻, 病情得到控制。为避免病情反复, 再次强化口腔卫生宣教, 进入维护期, 每隔3 个月复诊1 次。2022 年2 月, 患者牙周基础治疗后1 年复诊, 患者血糖控制稳定, 空腹血糖水平为6.8 mmol·L-1, 糖化血红蛋白水平为6.8%。口腔卫生状况保持尚可, 仅下颌双侧后牙舌侧龈缘稍红并可见少量牙石和软垢, 其余牙的牙龈呈淡粉色, 龈缘菲薄, 质韧。PD 为0~4 mm, BOP 百分率约为14%, 全口牙齿无松动(图4), 行牙周检查记录。行影像学检查, 患者曲面断层影像显示:牙槽骨高度无明显变化, 部分硬骨板重新形成, 呈致密连续影(图5)。嘱患者进行全口龈上洁治术和牙面光洁术, 约半年后复诊, 不适随诊。
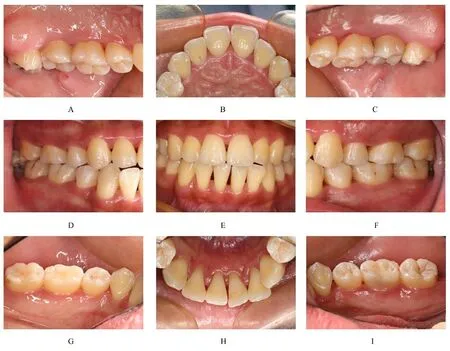
图3 T1DM 并发PD 患者牙周基础治疗后6 周口腔内照片Fig.3 Intraoral photographs of patient with T1DM complicated with PD 6 weeks after initial periodontal therapy
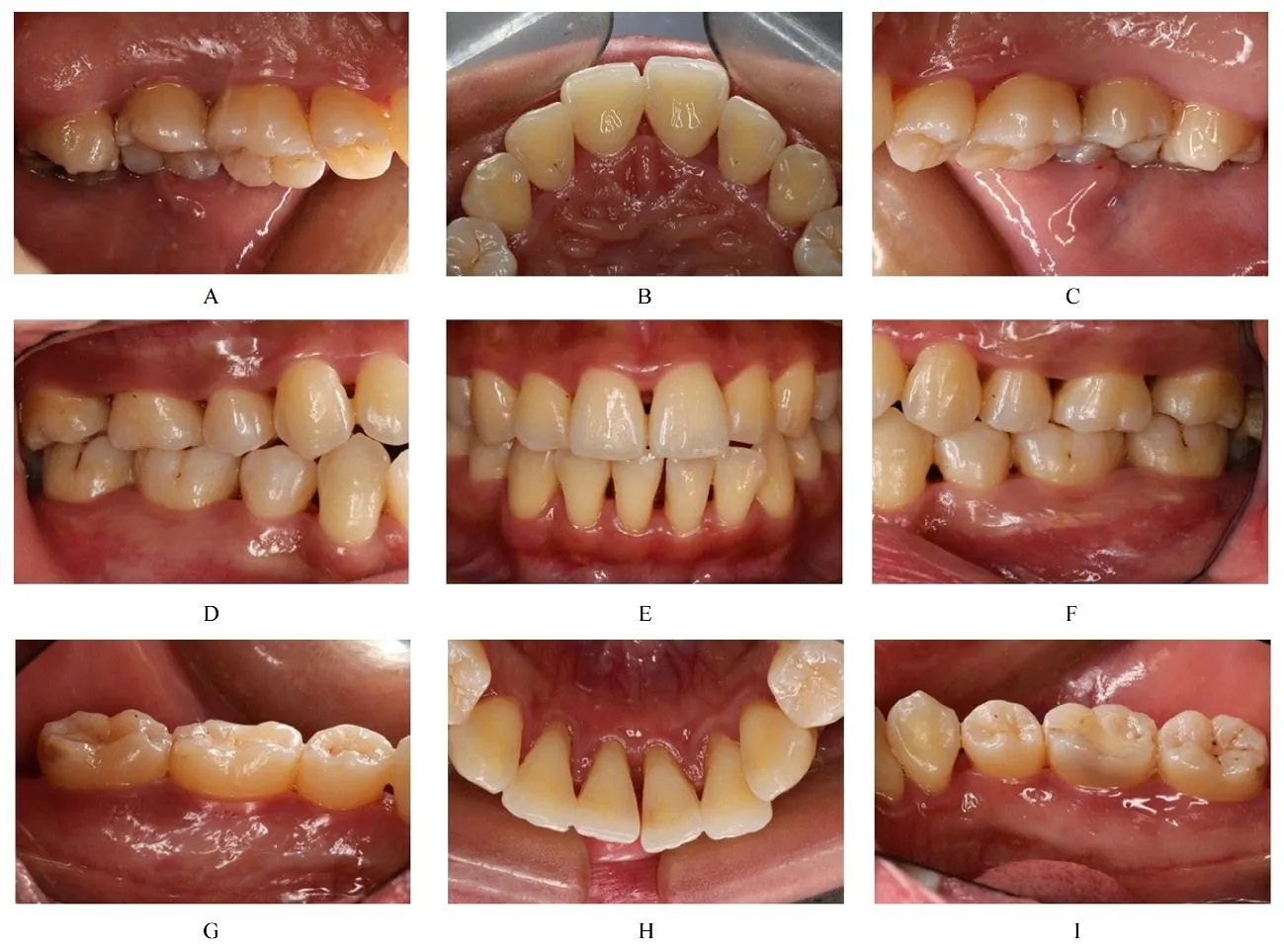
图4 T1DM 并发PD 患者牙周基础治疗后1 年口腔内照片Fig.4 Intraoral photographs of patient with T1MD complicated with PD 1 year after initial periodontal therapy
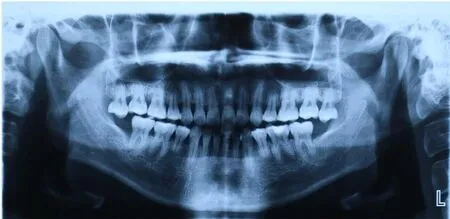
图5 T1DM 并发PD 患者牙周基础治疗后1 年曲面断层图像Fig. 5 Panoramic radiograph of patient with T1DM complicated with PD 1 year after initial periodontal therapy
2 讨 论
随着社会的发展, 人民生活水平得到提高, 但生活节奏加快、压力增大和作息不规律等原因促使糖尿病的发病率逐年升高。糖尿病视网膜病变、糖尿病肾病、PD、骨质疏松、心血管疾病和糖尿病足等均是其常见并发症[12], 流行病学数据及动物模型研究[13]显示:PD 是糖尿病的第六大并发症, 关于T1DM 与PD 相关性的报道相对较少。最近的一项系统评价研究[14]显示:T1DM 患者发生PD的百分率较非糖尿病患者增加了1 倍以上, 重症发生率也更高。
T1DM 患者较易发生PD 的具体机制尚未有明确定论, 可能与微生物菌群失调、炎性细胞因子增多和氧化应激加重等有关[15-16]。本研究主要从疾病的相关性、预防和临床治疗的角度分析:对T1DM患者而言, 血糖是否长期控制在正常范围内, 对PD 的患病率及其严重程度有明显影响。高血糖症和晚期糖基化终产物(advanced glycation end products, AGEs) 会影响胶原蛋白稳定性、血管完整性和细胞功能, ACEs 聚集巨噬细胞和单核细胞受体并刺激促炎细胞因子的释放, 增加PD 易感性[17]。同时, 牙周病原菌和毒力因子会刺激胰岛素抵抗, 引起全身炎症, 影响血糖控制[18]。流行病学研究[19]显示:高血糖是骨破坏的危险因素, 血糖控制不良的T1DM 患者骨密度降低, 牙槽骨吸收增加。NASCIMENTO 等[20]回顾分析了平均随访4.8 年患者的报告显示:高血糖与PD 的发病率和严重程度呈正相关关系。也有研究[21]显示:T1DM 患者的血糖水平越高, PD 严重程度越高;上述证据表明:预防与治疗PD 的第一步是控制血糖。血糖控制不佳的T1DM 患者应视为患PD 的高风险人群, 并且应告知糖尿病患者该风险[22]。有研究[23]显示:T1DM 并发PD 患者的口腔内微生物多样性明显高于无糖尿病的PD 患者, 主要为金黄色葡萄球菌和链球菌, 其次为粪肠球菌、罗氏菌和铜绿假单胞菌等。有学者[24]认为:口服益生菌可激活T1DM 患儿的免疫系统, 调节肠道菌群, 减少炎症反应, 延缓及抑制T1DM 的发展, 为T1DM 和T1DM 并发PD 患者的临床治疗提供了新的思路。但目前其临床相关性尚不清楚, 在严格控制血糖的前提下, 适当应用抗菌药物, 可以降低T1DM 患者的牙周炎症和氧化应激指标, 对患者的牙 周 健 康 是 有 益 的[25]。研 究[26]显 示:T1DM 和T2DM 均会增加骨折风险, 但T1DM 患者骨折风险高于T2DM 患者。T1DM 患者成长过程中成骨细胞的功能被破坏, 骨钙素降低, 成骨细胞和类骨质的数量减少, 患者骨脆性增加[27]。骨质疏松症的预防首先是保证骨矿物质含量和密度, 青春期是骨矿物质含量及密度增加的高峰, 而T1DM 发病高峰多介于9~14 岁, 因此T1DM 患者较易发生骨损伤[28]。PD 发生时破骨细胞活性增强, 成骨细胞数量减少, 使新骨形成受到损害, T1DM 的存在会导致骨重塑过程的失衡, 导致骨吸收超过骨形成[29]。孙尚敏等[4]发现:T1DM 大鼠有明显的牙槽骨吸收现象, 并表现为缓慢的水平型骨吸收。临床上, 由于大多数T1DM 并发PD 患者在早期对牙周健康的关注度不足, 因此通常就诊时牙槽骨就已出现了水平型骨吸收。T1DM 患者对牙周组织炎症性疾病高度敏感, 该炎症性疾病会迅速累及牙周支持组织, 牙槽骨的骨质疏松又加快了这一进程。为避免T1DM 患者牙槽骨的吸收, 临床医生除了要预防并控制牙周组织炎症性疾病, 也要努力寻找避免异常骨代谢的方法。
与健康者比较, T1DM 患者更易并发PD, 且年龄相对较低, 因此以疾病的早期预防与治疗就显得尤为重要。口腔临床医生应为患有T1DM 的患者提供早期的口腔检查及相关治疗, 口腔医生的早期诊断和干预可以预防并阻断牙周组织的不可逆性损伤。未来可进一步研究及追踪T1DM 患者牙周疾病的进展, 以确保该类高危人群保持最佳口腔健康状态[30]。T1DM 并发PD 患者的治疗中, 菌斑的控制非常重要。牙周基础治疗不仅能去除菌斑和牙石, 控制PD 的发生发展, 还可以有效控制牙周感染, 避免影响全身健康。为提高牙周治疗的安全性, 医师需要根据患者的血糖控制情况及健康状况制订牙周治疗计划, 当患者空腹血糖水平≤7 mmol·L-1, 糖化血红蛋白水平≤7.5%时治疗方法与健康者相似, 但治疗前1 周需考虑预防性使用抗生素, 治疗过程中操作轻柔, 避免患者情绪焦虑;当空腹血糖水平>11.4 mmol·L-1时, 建议仅给予急症处理, 常规牙周基础治疗需待血糖水平稳定后再进行[31]。徐欣然等[32]通过评估60 例伴或不伴有糖尿病的PD 患者牙周基础治疗的临床疗效发现2 组患者临床反应基本相似。
本文作者首先监测患者的空腹血糖水平为6.8 mmol·L-1, 糖化血红蛋白水平为6.9%, 并预防性使用抗生素。将每次牙周基础治疗时间都尽量安排在上午9:00, 即早饭后1~2 h, 每次治疗时间控制在1 h 内。初诊完成全口龈上洁治术和牙面光洁术, 而后分4 次行龈下刮治术和根面平整术, 并在治疗过程中严格控制麻药用量, 同时配合使用抗菌药物, 并进行口腔卫生宣教。牙周基础治疗后6 周进行牙周再评估, 口内检查显示患者口腔卫生状况良好, 牙龈颜色变浅, 肿胀程度减轻。再次强调菌斑控制的重要性, 详细讲解刷牙方法和牙线及冲牙器的使用方法。嘱患者每隔3 个月复诊1 次, 严格控制菌斑, 长期监控血糖, 避免复发。随访1 年内无复发, 治疗效果良好, 可适当延长复诊时间。
本文作者首先监控患者的血糖, 通过牙周基础治疗和口腔卫生宣教控制菌斑, 患者疗效良好, 随访1 年内无复发, 但该患者还需长期随访, 定期维护。T1DM 患者发生重症PD 的概率较高, 临床上应早期关注T1DM 患者的牙周状况, 与患者做好沟通, 尽量早期预防和阻断T1DM 患者牙周疾病的发生发展。
