miR-431-3p 对胃癌细胞增殖和凋亡的影响及其靶向调控CTDP1 基因表达机制
2022-12-15谢先顺蒋海兵
谢先顺, 王 伟, 蒋海兵
(1. 南华大学衡阳医学院附属第二医院血液肿瘤内科, 湖南 衡阳 421001;2. 南华大学衡阳医学院附属第二医院消化内科, 湖南 衡阳 421001)
胃癌是胃黏膜上皮恶性肿瘤, 在我国居恶性肿瘤发病率首位且呈年轻化趋势[1], 但目前我国胃癌早期诊断率较低, 预后较差。 微小 RNA(microRNA, miRNA) 作为非编码小RNA, 调控多种基因表达, 并参与细胞分化、增殖、凋亡、迁移和侵袭等生理过程[2-3]。研究[4-6]显示:miRNAs的表达与胃癌的发生发展密切相关。微小RNA-431(microRNA-431, miR-431) 在胃癌组织中异常低表达, 并且参与胃癌细胞的迁移和侵袭[7], miR-431-5p 可以通过调控Wnt/β-catenin 信号通路参与胃癌细胞的增殖和凋亡[8], 但其相关分子机制尚不清楚。人羧基末端结构域磷酸酶1(carboxyterminal domain phosphatase 1, CTDP1)是一种蛋白磷酸酶, 在胃癌组织中高表达, 沉默CTDP1 基因表达可抑制胃癌细胞增殖, 诱导细胞在G0/G1期阻滞, 促进细胞凋亡[9]。上述研究结果显示:miR-431与CTDP1 同时参与胃癌细胞的增殖凋亡过程, 且采用生物信息学软件分析miR-431 与CTDP1 基因存在靶向结合位点, 可提出假设:miR-431 通过靶向调控CTDP1 基因表达, 从而参与胃癌的发生发展。因此, 本研究构建miR-431-3p 过表达或CTDP1 过表达胃癌细胞株, 探讨miR-431-3p 是否靶向调控CTDP1 表达对胃癌细胞增殖和凋亡产生影响, 为寻找胃癌的有效诊断靶点和分子靶点提供新思路。
1 资料与方法
1.1 临床资料本研究共纳入2018年2月—2019年6 月在本院经病理诊断确诊为胃癌的68 例患者的胃癌组织及其癌旁组织(距离肿瘤边缘至少2 cm)。患者中男性41 例, 女性27 例, 年龄39~71 岁, 平均年龄为(52.4±6.3)岁。所有患者术前均未接受过放疗、化疗和生物治疗等, 均签署知情同意书。所有标本取出后迅速置于液氮中, 之后将标本移至-80 ℃冰箱冻存, 用于后续实验。
1.2 细胞、主要试剂和仪器人正常胃黏膜上皮GES-1 细胞、人胃癌MKN-28 细胞、MGC-803 细胞、HGC-27 细胞和人肾293T 细胞均购自湖南丰晖生物科技有限公司, 人胃癌MKN-45 和SGC-7901 细胞购自通派(上海) 生物科技有限公司。miR-431-3p 拟态片段(miR-431-3p mimics 和mimics NC)、CTDP1 过表达慢病毒表达载体和空载慢病毒表达载体均由上海吉玛制药技术有限公司合成, miScript ⅡRT Kit 购自上海凯杰生物技术有限公司, Lipofectamine 3000 购自美国Invitrogen公司, BCA 蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司, 胞浆蛋白提取试剂盒购自北京索莱宝公司, TB Green®Premix Ex Taq™Ⅱ试剂盒购自大连宝生物公司, MTT 试剂、TaqMan™advanced miRNA cDNA 合成试剂盒和TaqMan ™advanced miRNA 分析试剂盒均购自美国Thermo Fisher 公 司, Annexin Ⅴ-FITC/PI 荧光双染细胞凋亡检测试剂盒购自武汉Procell 公司, 兔抗人CTDP1 多克隆抗体购自美国Novus 公司, 细胞色素C(cytochrome C, Cyt C)、B细胞淋巴瘤2(B cell lymphoma-2, Bcl-2)、Bcl-2 相 关X 蛋白(Bcl-2 associated X protein, Bax)和GAPDH 单克隆抗体均购自英国ABCAM 公司。双荧光素酶报告基因分析系统购自美国Promega 公司。
1.3 细胞转染和分组取对数生长期人胃癌SGC-7901 细胞, 按照每孔1×105个的密度接种至24 孔细胞培养板培养24 h。更换为含凝聚胺的新鲜培养基, 按病毒感染复数(multiplicity of infection, MOI) 为40∶1 分别加入滴度为1×108TU·mL-1CTDP1 慢病毒及其阴性对照慢病毒感染细胞, 培养48 h, 置于荧光显微镜下观察转染效率。加入胰酶消化细胞1 d 后转染, 并按照每孔1×105个的密度接种至24 孔细胞培养板, 培养至细胞密度为90%。 加入无血清培养基稀释的miR-431-3p mimics和mimics NC, 与稀释的Lipofectamine 3000室温孵育20 min。将复合物加入细胞培养板中与细胞共培养, 在37 ℃、5% CO2培养箱中培养48 h, 采用实时荧光定量 PCR (real-time fluorescent quantitative PCR, RT-qPCR) 法检测转染效率。将细胞分为空白组、空载过表达(mimic NC)组、miR-431-3p 过表达(miR-431-3p mimic) 组、空载慢病毒(Vector) 组、 CTDP1 过表达慢病毒(CTDP1 过表达)组和miR-431-3p mimic+CTDP1过表达(共转染)组。
1.4 RT-qPCR 法检测胃癌组织和细胞中miR-431-3p 及CTDP1 mRNA 表达水平取对数生长期人正常胃黏膜上皮GES-1 细胞和5 种人胃癌细胞系或慢病毒感染后的SGC-7901 细胞, 弃上清液, 加入磷酸盐缓冲液(phosphate buffered solution, PBS)洗涤2 次后, 每孔加入1 mL TRIzol 试剂, 提取细胞总RNA。取胃癌组织和癌旁组织, 常规制备石蜡切片, 脱蜡处理, 采用核酸提取试剂盒提取组织中的RNA。根据miScript ⅡRT Kit 逆转录试剂盒操作步骤, 将总RNA 逆转录合成为cDNA。采用TB Green®Premix Ex Taq™Ⅱ试剂盒和ABI 7500荧光定量检测仪检测胃癌组织和细胞中CTDP1 mRNA 表达水平。采 用TaqMan ™ advanced miRNA cDNA 合成试剂盒配合TaqMan™advanced miRNA 分析试剂盒检测胃癌组织和细胞中miR-431-3p 表达水平。引物序列:miR-431-3p 上游引物5'-CCAGGTCGTCTTGCAGG-3', miR-431-3p 下游引物 5'-GTTGTTGGTTGGTTGGTTGT-3';U6 上游引物5'-CTCGCTTCGGCAGCACA-3', U6 下游引物5'-AACGCTTCACGAATTTGCGT-3';CTDP1 上游引物5'-GTGCCGGAGTTGATGGTGAG-3', CTDP1 下游引物5'-GCTGCTCGGTTGTGTGAATC-3'; GAPDH 上游引物5'-ACAACTTTGGTATCGTGGAAGG-3', GAPDH下游引物5'-GCCATCACGCCACAGTTTC-3'。反应程序:42 ℃、5 min, 95 ℃、10 s;95 ℃、5 s, 60 ℃、32 s, 共40 次循环。采用2-△△Ct法计算组织和细胞中miR-431-3p 和CTDP1 mRNA 表达水平。
1.5 Western blotting 法检测各组细胞中目的蛋白表达水平取对数生长期细胞, 1 000 g 离心5 min, 弃去培养基, 采用预冷的PBS 缓冲液洗涤2 次, 将细胞刮至EP 管中, 加入适量RIPA 细胞裂解液, 颠倒裂解30 min。4 ℃、 12 000 g 离心10 min, 取上清至新EP 管中。BCA 蛋白浓度测定试剂盒检测蛋白浓度。采用胞浆蛋白提取试剂盒提取细胞的胞浆蛋白, 用于Cyt C 蛋白表达水平检测。配制12%SDS-PAGE 胶, 将蛋白样品置于沸水浴中5 min, 每孔30 μg 蛋白上样进行电泳, 再采用湿转法将蛋白转移至聚偏二氟乙烯膜上, 将该膜转至含封闭液的平皿中, 室温摇床上室温封闭2 h, TBST洗涤3 次, 加入对应一抗CTDP1 抗体(1∶1 000)、Bcl-2 抗体(1∶2 000)、Bax 抗体(1∶1 000)、CytC 抗体(1∶5 000)和GAPDH 抗体(1∶2 500), 4 ℃过夜孵育。TBST 洗涤3 次后, 加入辣根过氧化物酶标记的二抗, 室温孵育2 h 后, TBST 室温摇床洗涤3 次, 然后显影, 拍照, 采用Image J 软件分析蛋白条带灰度值, 计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GADPH 蛋白条带灰度值。
1.6 双荧光素酶报告系统检测293T 细胞中荧光素酶活性采用生物信息学软件TargetScan 预测miR-431-3p 与CTDP1 3'-UTR 区域结合位点, 并在293T 细胞中验证miR-431-3p 与CTDP1 基因的靶向调控关系。将包含预测靶点的野生型(WT)CTDP1 序列构建入pmiRGlo 载体(WT CTDP1 3'-UTR), 对应地将含预测靶点的突变型(MUT)CTDP1 序列构建入pmiRGlo 载体(MUT CTDP1 3'-UTR)。将293T 细胞接种至24 孔细胞培养板中, 采 用Lipofectamine 3000 将100 ng WT 型 或MUT 型报告质粒与miR-431-3p mimic 或mimic NC 共转染。转染48 h 后, 获取细胞裂解物, 并按照双荧光素酶报告基因分析系统说明书进行检测, 若存在靶向结合, 则CTDP1 mRNA 被miR-431-3p 靶向结合并降解, 导致荧光素酶活性降低, 若不存在靶向结合, 则荧光素酶活性无变化。荧光素酶活性(F/R)=萤火虫萤光素酶活性/海肾萤光素酶活性。
1.7 MTT 法检测各组细胞增殖活性转染后12、24、48 和72 h, 取对数生长期的细胞, 弃去培养基, 加入100 μL 新鲜培养基(以只含培养基的孔为空白组)。每孔加入10 μL、 12 mmol·L-1MTT溶液, 37 ℃孵育4 h 后, 每孔加入100 μL SDS-HCl溶液, 充分混匀后, 置于37 ℃培养箱孵育6 h。采用酶标仪于570 nm 处检测吸光度(A)值, 计算细胞增殖活性, 细胞增殖活性=(实验组A 值-空白组A值)/(阴性对照组A值-空白组A值)×100%。
1.8 克隆形成实验检测各组细胞克隆形成数取对数生长期细胞, 加入0.25%胰蛋白酶消化成单个细胞, 采用含10%胎牛血清的培养液重悬, 按每培养皿100 个细胞的密度接种至10 mL 培养液中, 均匀分散细胞, 将培养皿置于37 ℃、5 % CO2的饱和湿度恒温培养箱中培养。密切观察细胞生长情况, 待观察到肉眼可见的克隆细胞时, 终止培养。弃去细胞上清, 加入PBS 缓冲液洗涤2 次, 加入5 mL 甲醇固定细胞15 min。弃去固定液, 加适量Giemsa 染色液染色15 min, 流水冲洗, 室温干燥。在显微镜下观察大于10 个细胞的克隆数。
1.9 流式细胞术检测各组细胞凋亡率取对数生长期细胞, 低速离心5 min, 弃上清, PBS 缓冲液洗涤后重悬细胞。取5×105个重悬细胞, 1 000 g 离心5 min, PBS 缓冲液洗涤后加入500 μL Binding Buffer 溶液重悬细胞。每孔加入5 μL Annexin Ⅴ-FITC 和5 μL PI 染色液, 混匀后, 室温避光孵育15 min。流式细胞术检测各组细胞凋亡率, 细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.10 统计学分析采用SPSS 21.0 统计软件对数据进行统计学分析。胃癌组织中miR-431-3p 和CTDP1 mRNA 表达水平不符合正态分布, 以中位数(四分位数间距) 表示;多组间比较采用Kruskal-Wallis 检验, 组间两两比较采用Wilcoxon检验;胃癌细胞中miR-431-3p 和CTDP1 mRNA 及蛋白表达水平、荧光素酶活性、细胞增殖活性、克隆细胞数和细胞凋亡率均符合正态分布, 以x±s表示。多组间样本均数比较采用单因素方差分析, 组间两两比较采用LSD-t检验;采用Pearson 相关性检验分析临床胃癌患者癌组织中miR-431-3p 与CTDP1 mRNA 表达水平的相关性。以P<0.05 为差异有统计学意义。
2 结 果
2.1 胃癌组织中miR-431-3p 和CTDP1 mRNA 表达水平及其相关性分析与癌旁组织比较, 胃癌组织中miR-431-3p 表达水平明显降低(Z=6.65,P<0.01), CTDP1 mRNA 表 达 水 平 明 显 升 高(Z=10.04,P<0.01)。Pearson 相关性分析结果显 示: 在 胃 癌 组 织 中, miR-431-3p 与CTDP1 mRNA 表达水平呈负相关关系(r=-0.316,P=0.009)。见图1。
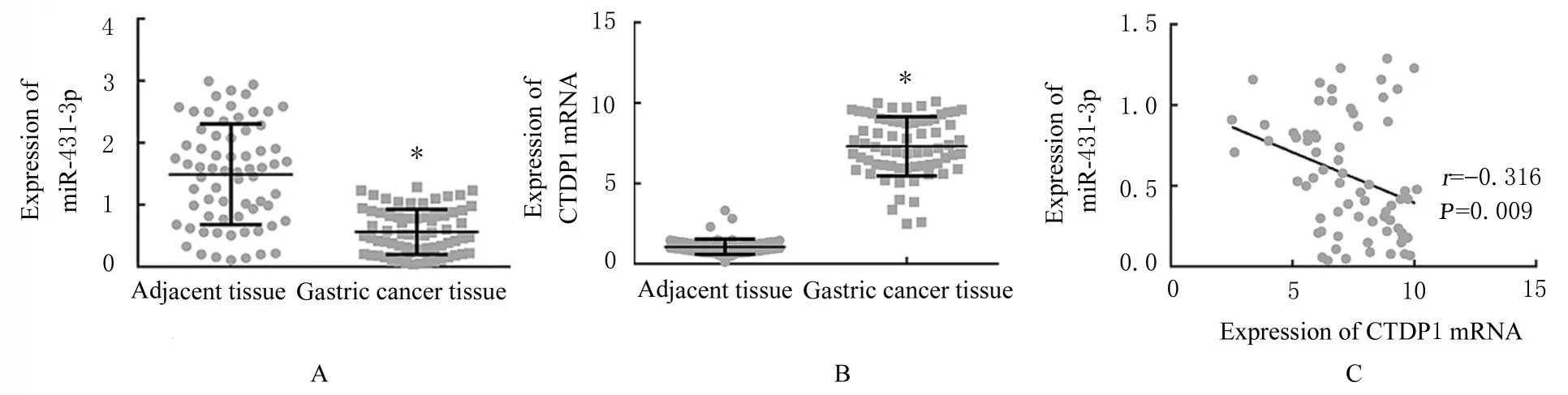
图1 胃癌组织和癌旁组织中miR-431-3p 及CTDP1 mRNA 表达水平的相关性Fig.1 Correlation between expressions of miR-431-3p and CTDP1 mRNA in adjacent tissue and gastric cancer tissue
2.2 胃癌细胞中miR-431-3p 表达水平和CTDP1 mRNA 及蛋白表达水平与人正常胃黏膜上皮GES-1 细胞比较, 其他5 种人胃癌细胞中miR-431-3p 表达水平均降低(P<0.01), CTDP1 mRNA 和蛋白表达水平均升高(P<0.05);且在SGC-7901细胞中, miR-431-3p表达水平最低, CTDP1 mRNA和蛋白表达水平较高。因此, 选择SGC-7901 细胞为后续实验对象。见图2 和3。
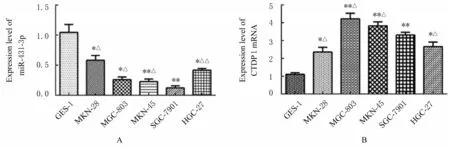
图2 人正常胃黏膜上皮GES-1 细胞和5 种人胃癌细胞中miR-431-3p 及CTDP1 mRNA 表达水平Fig. 2 Expression levels of miR-431-3p and CTDP1 mRNA in human normal gastric epithelial GES-1 cells and five kinds of human gastric cancer cells
2.3 共转染后各组胃癌细胞中目的蛋白表达水平与空白组和mimic NC 组比较, miR-431-3p 组SGC-7901 细胞中CTDP1 和Bcl-2 蛋白表达水平明显降低(P<0.05), Cyt C 和Bax 蛋白表达水平升高(P<0.05); 与 空 白 组 和Vector 组 比 较, CTDP1 过表达组SGC-7901 细胞中CTDP1 和Bcl-2蛋白表达水平明显升高(P<0.05), Cyt C 和Bax蛋白表达水平降低(P<0.05);与空白组和miR-431-3p 组比较, 共转染组SGC-7901 细胞中CTDP1和Bcl-2蛋白表达水平明显升高(P<0.05), Cyt C和Bax 蛋白表达水平降低(P<0.05)。见图4 和5。

图4 Western blotting 法检测各组细胞中CTDP1 蛋白表达水平电泳图(A)和直条图(B)Fig. 4 Electrophoregram (A) and histogram(B) of expressions of CTDP1 protein in cells various groups detected by Western blotting method
2.4 293T 细胞中miR-431-3p 表达水平和miR-431-3p 与CTDP1 mRNA 靶向作用的验证与空白组和mimic NC 组比较, miR-431-3p mimic 组293T细胞中miR-431-3p 表达水平明显升高(P<0.01), CTDP1 mRNA 和蛋白表达水平降低(P<0.01)。与mimic NC 组比较, miR-431-3p mimic 组293T 细胞中WT CTDP1 3'-UTR 荧光素酶活性明显降低(P<0.05), MUT CTDP1 3'-UTR 荧光素酶活性无明显改变。见图6~9。
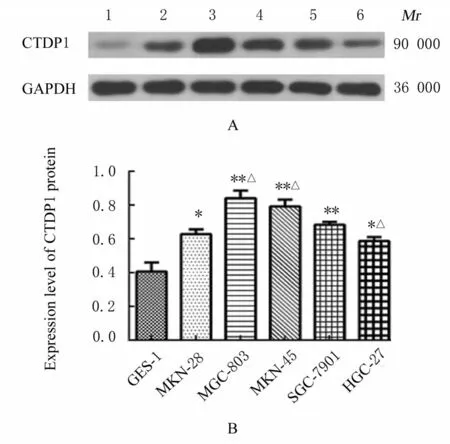
图3 人正常胃黏膜上皮GES-1 细胞和5 种人胃癌细胞中CTDP1 蛋白表达电泳图(A)及直条图(B)Fig. 3 Electrophoregram(A)and histogram(B)of expressions of CTDP1 protein in human normal gastric epithelial GES-1 cells and five kinds of human gastric cancer cells
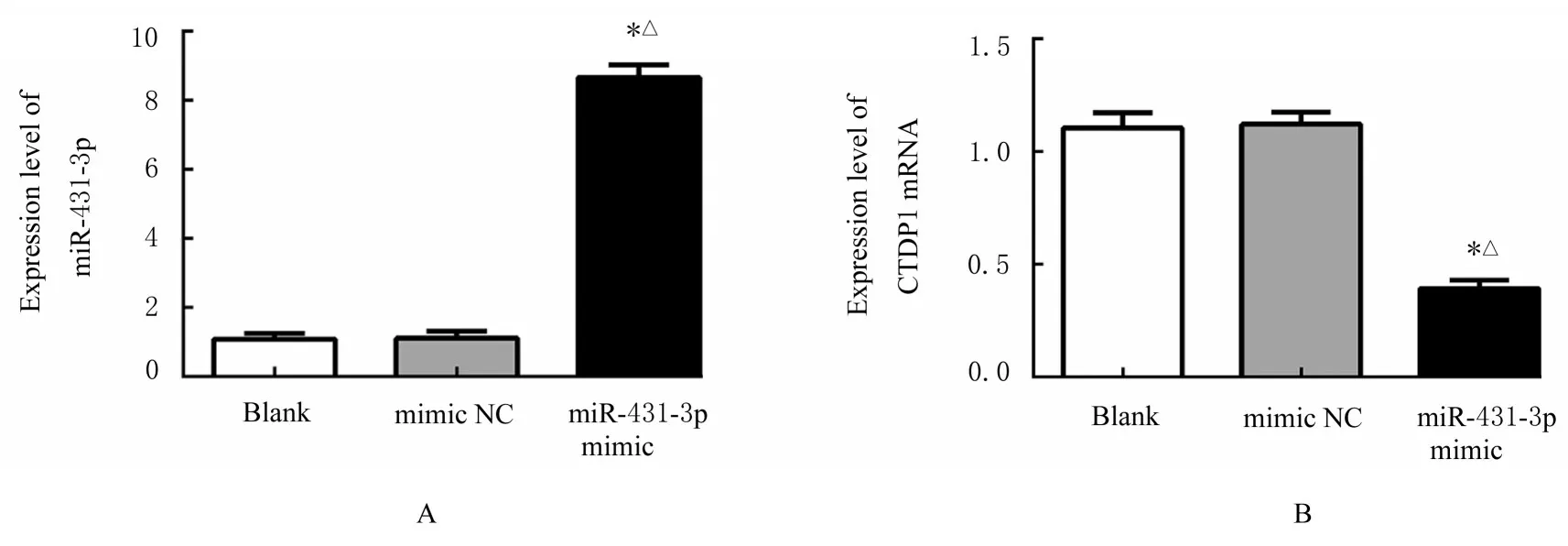
图6 各组SGC-7901 细胞中miR-431-3p 和CTDP1 mRNA 表达水平Fig.6 Expression levels of miR-431-3p and CTDP1 mRNA in SGC-7901 cells in various groups
2.5 各组胃癌细胞增殖活性和细胞克隆形成数
与空白组和mimic NC 组比较, miR-431-3p 组SGC-7901 细胞中增殖活性和克隆形成数明显降低(P<0.05);与空白组和Vector 组比较, CTDP1过表达组SGC-7901 细胞中增殖活性和克隆形成数明显升高(P<0.05)。与miR-431-3p 组比较, 共转染组SGC-7901 细胞中增殖活性和克隆形成数明显升高(P<0.05)。见图10~12。
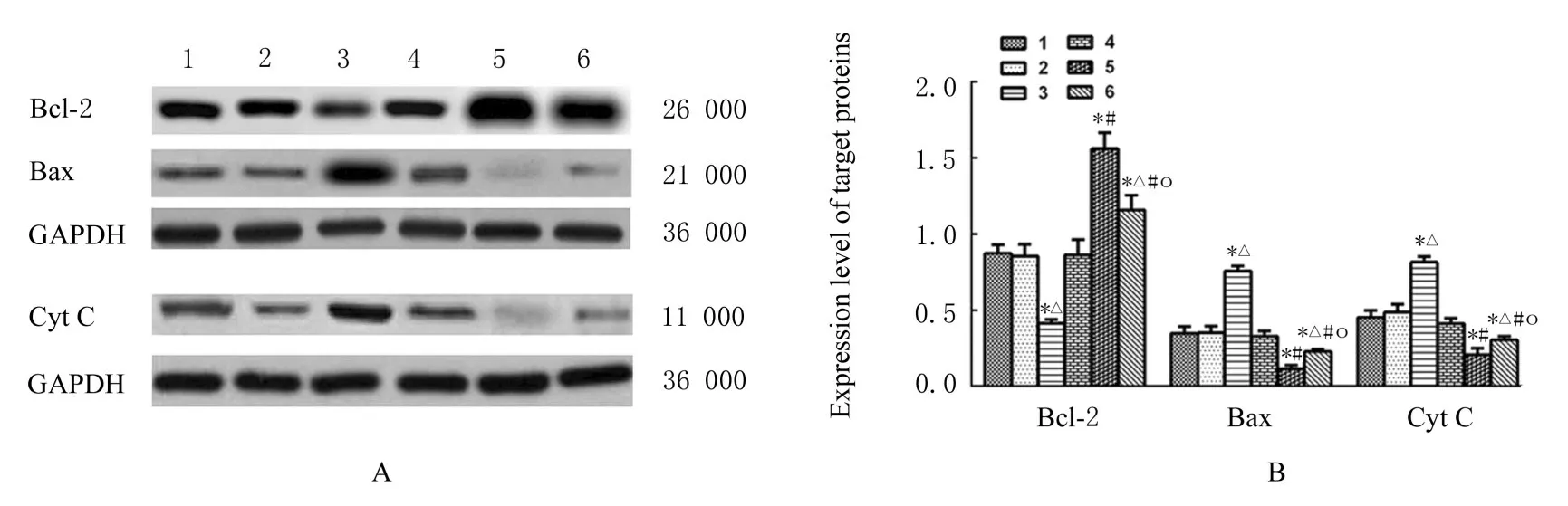
图5 Western blotting 法检测各组SGC-7901 细胞中目的蛋白表达电泳图(A)和直条图(B)Fig. 5 Electrophoregram(A)and histogram(B)of expressions of target proteins in SGC-7901 cells in various groups detected by Western blotting method
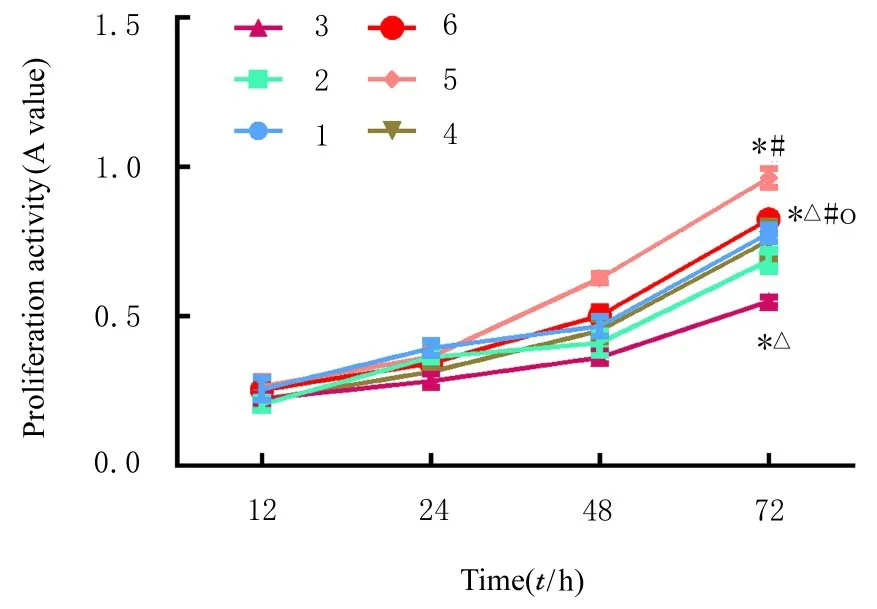
图10 MTT 法检测各组SGC-7901 细胞增殖活性Fig. 10 Proliferation activities of SGC-7901 cells in various groups detected by MTT method
2.6 各组胃癌细胞凋亡率与空白组和mimic NC组比较, miR-431-3p 组胃癌细胞凋亡率明显升高(P<0.05);与空白组和Vector 组比较, CTDP1过表达组细胞凋亡率明显降低(P<0.05);与空白组和miR-431-3p 组比较, 共转染组细胞凋亡率明显降低(P<0.05)。见图13 和14。
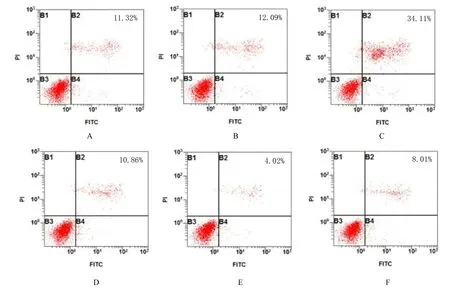
图13 流式细胞术检测各组SGC-7901 细胞凋亡率Fig.13 Apoptotic rates of SGC-7901 cells in various groups detected by flow cytometry
3 讨 论
RNA 聚合酶Ⅱ是真核生物中调控转录结构基因的多亚基复合体, 其最大的亚基含有一个独特的羧基末端结构域(C-terminal domain, CTD)。CTD 可通过逆磷酸化修饰调节基因的转录、延伸以 及mRNA 处 理 等[10-11]。FCP1、SCP1 和PP1 均为CTD 磷 酸 酶, 能 影 响CTD 作 用 的 发 挥[12]。CTDP1 可编码磷酸酶FCP1, 参与各种关键的生物学活动, 如作为阻遏物元件1(repressor 1, RE-1)-沉 默 转 录 因 子 (repressor element silencing transcription factor, REST) 复合体的驱动因子, 沉默非神经元的神经元基因, 使G1/S 期发生转换[13]。近年来研究[9]显示:CTDP1 在癌症中发挥促进作用。LI 等[14]发现:CTDP1 在鼻咽癌组织中表达上调, circCTDP1 基因敲除可抑制鼻咽癌细胞增殖、迁移和侵袭, 并促进细胞的凋亡。此外, 沉默CTDP1 基因能抑制胃癌细胞的增殖[9]。因此, CTDP1 可能成为胃癌分子靶向治疗的重要靶点。本研究结果显示:与癌旁组织比较, 胃癌组织中CTDP1 高表达, 因此推测CTDP1 异常高表达可能促进胃癌的进展, 明确其作用机制有利于为胃癌的早期诊断和治疗提供新的方向。
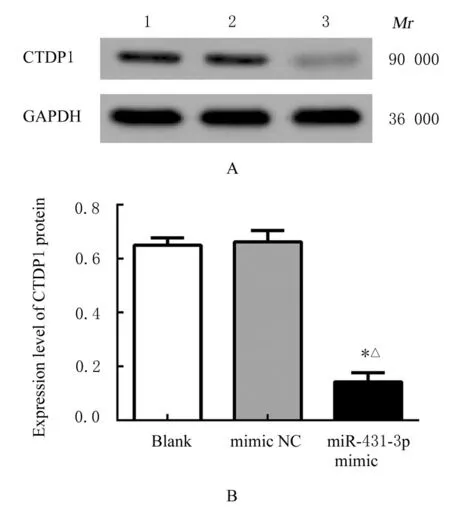
图7 各组SGC-7901 细胞中CTDP1 蛋白表达电泳图(A)和直条图(B)Fig. 7 Electrophoregram(A)and histogram(B)of expressions of CTDP1 protien in SGC-7901 cells in various groups
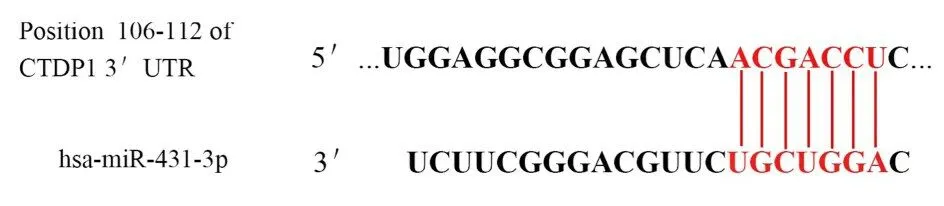
图8 miR-431-3p 和CTDP1 3'-UTR 靶向位点预测Fig. 8 Prediction of miR-431-3p and CTDP1 3'-UTR target sites
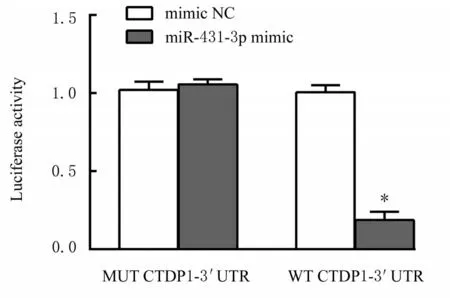
图9 各组293T 细胞中荧光素酶活性Fig. 9 Luciferase activities in 293T cells in various group s
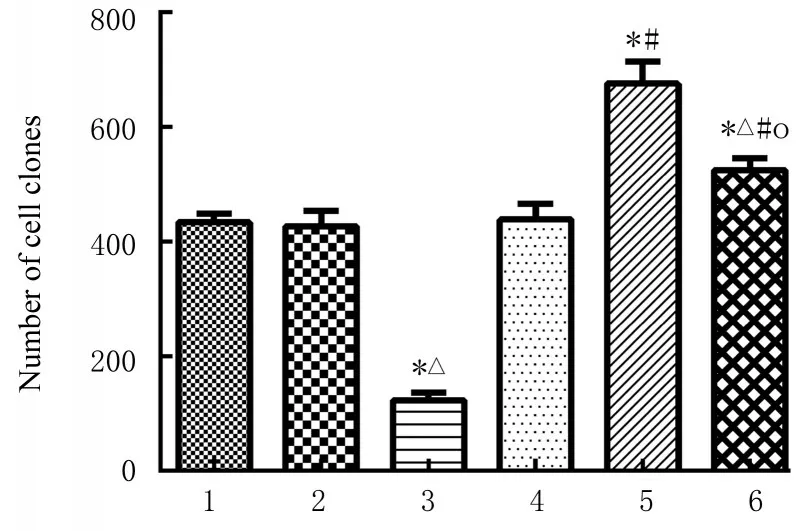
图11 各组SGC-7901 细胞克隆形成数Fig. 11 Number of clone formation of SGC-7901 cells in various groups
近年来miR-431 在癌症中的作用机制研究得到广泛关注。miR-431 参与多种癌症的致癌过程, 如胰 腺 和 神 经 内 分 泌 肿 瘤[15]、乳 腺 癌[16]和 结 肠癌[17]。研究[18]显示:miR-431 能靶向调控A 激酶锚 蛋 白1 (A kinase anchoring protein, AKAP1), 抑制肝癌细胞活力和糖酵解加速, 促进细胞凋亡。在乳腺癌组织中, miR-431 通过靶向FGF9 抑制细胞增殖和迁移, 具有肿瘤抑制剂作用[16]。与健康人群比较, 甲状腺乳头状癌患者组织和血浆中miR-431 的表达水平均明显降低, miR-431 能够作为甲状腺乳头状癌淋巴结转移阳性的预测因子以及潜在的治疗靶点[19]。circ-CSPP1 通过靶向miR-431/LASP1 轴调控结直肠癌细胞增殖、凋亡、迁移和侵袭水平[20]。miR-431 在胃癌组织中低表达且参与癌细胞的增殖和凋亡过程[7-8]。本研究结果显示:与癌旁组织比较, 人胃癌组织中miR-431-3p表达水平下调。体外细胞实验结果显示:miR-431-3p过表达能抑制人胃癌细胞增殖活性和克隆形成, 促进细胞凋亡, 但miR-431 与CTDP1 的关系是否参与胃癌发生发展尚未得到证实。本研究通过构建miR-431-3p mimic 胃癌细胞, 发现miR-431-3p 过表达能下调CTDP1 表达水平, 双荧光素酶报告系统也验证了miR-431-3p 靶向调控CTDP1。结合之前的研究, 可以推测miR-431-3p 可能通过靶向调控CTDP1 抑制人胃癌细胞的增殖, 促进细胞凋亡, 进而起到肿瘤抑制作用。为了进一步验证结论, 本研究构建了CTDP1过表达人胃癌细胞和miR-431-3p mimic 及CTDP1 过表达共转染人胃癌细胞, CTDP1 过表达能促进人胃癌细胞增殖, 抑制细胞凋亡。 共转染miR-431-3p mimic 能明显逆转CTDP1 过表达的促癌作用。本研究可能存在一些局限性, 如仅从细胞层面探讨miR-431-3p 和CTDP1 调控胃癌细胞增殖凋亡过程, 动物层面尚未涉及;仅从胃癌细胞增殖和凋亡行为及细胞中关键蛋白表达水平说明miR-431-3p 与CTDP1 的调控作用, 未涉及到中游具体分子通路机制。本课题组后续将从上述2 个层面入手, 深入剖析miR-431-3p/CTDP1 轴对胃癌增殖和凋亡的调控作用。
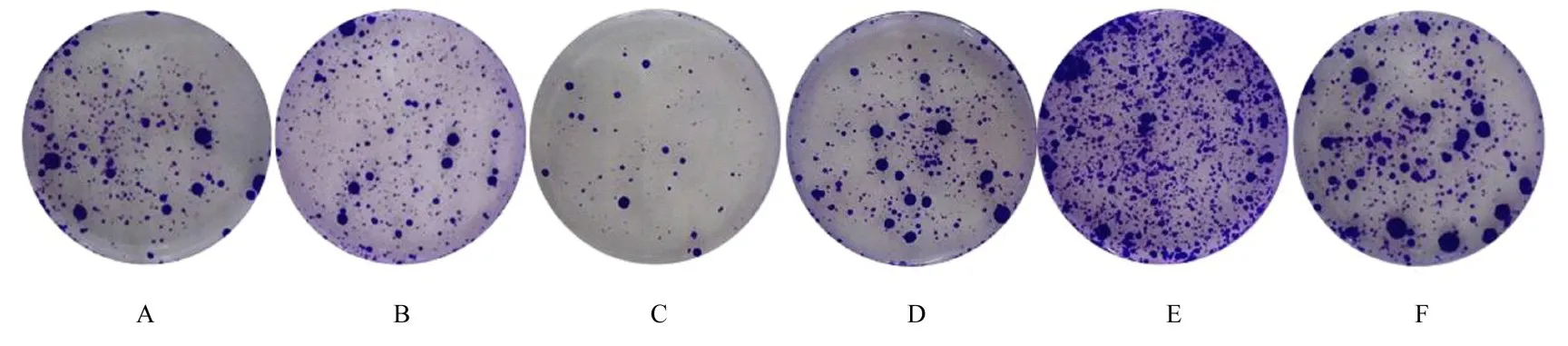
图12 克隆形成实验检测各组SGC-7901 细胞克隆形成情况(Giemsa 染色)Fig.12 Clone formation of SGC-7901 cells in various groups detected by clone formation experiment(Giemsa staining)
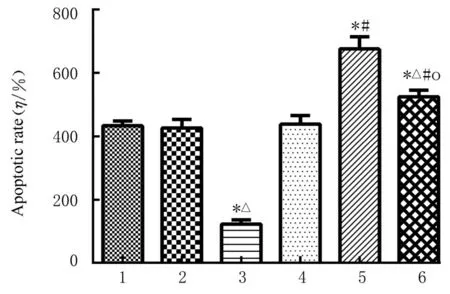
图14 各组SGC-7901 细胞凋亡率Fig. 14 Apoptotic rates of SGC-7901 cells in various groups
综上所述, miR-431-3p 在人胃癌组织中呈异常低表达, 并且miR-431-3p 通过靶向调控CTDP1 抑制人胃癌细胞增殖, 促进细胞凋亡, 是有效的抑癌因子, 本研究结果为胃癌的防治提供了一种新的有效靶点。
