宫颈上皮内瘤变Ⅰ级患者病变进展危险因素分析
2022-12-15贾荣霞石贽堃包美静王冠群褚雨晴
贾荣霞, 周 旭, 石贽堃, 包美静, 王冠群, 褚雨晴, 林 杨
(吉林大学第二医院妇产科, 吉林 长春 130041)
宫颈上皮内瘤变 (cervical intraepithelial neoplasia, CIN) 是与宫颈癌密切相关的病变[1]。在宫颈上皮内瘤变Ⅰ级(cervical intraepithelial neoplasia grade Ⅰ, CINⅠ)患者中有22%~32%的病变持续存在, 1%~11%的病变恶性进展[2]。影响CINⅠ病变进展的因素目前尚不清楚, 国内外尚无明确预测CINⅠ进展的生物学标志物的相关报道, 因此识别CINⅠ患者中真正具有进展风险的高危人群尤为重要。阴道镜下病理活检作为宫颈病变的确诊手段, 在发现宫颈病变和指导治疗方面有不可替代的作用[3]。临床实践发现阴道镜下某些图像特征有望成为临床上预测病变进展的有效指标。目前关于阴道镜图像特征与CINⅠ进展关系的报道较少, 本研究以本科210 例CINⅠ级患者作为研究对象, 分析其临床资料和阴道镜下病变图像特征与病变进展的关系, 旨在为CINⅠ患者提供更合适的个体化治疗方案。
1 资料与方法
1.1 研究对象随机选取2019年7月1日—2019年12 月1 日就诊于本科、经阴道镜下活检病理学诊断为CINⅠ且选择保守治疗的210 例患者作为研究对象。纳入标准:经病理学诊断为CINⅠ, 高危型人乳头瘤病毒(high risk human papillomavirus, HRHPV) 阳性。排除标准:妊娠期和哺乳期妇女, 有子宫切除术、宫颈和阴道病变治疗史者, 并发其他恶性肿瘤者, 免疫缺陷疾病或长期服用免疫抑制剂者。
1.2 随访资料记录研究对象初次确诊为CINⅠ时的年龄、 液基薄层细胞学检查(thin layer cytologic test, TCT)、人 乳 头 瘤 病 毒(human papilloma virus, HPV)、 绝 经 状 态、 转 化 区(transformation zone, TZ) 及阴道镜下图像特征(异型血管、增生、病变面积和病变边界)。
采取复诊方法对研究对象进行随访。每隔12 个月复诊1 次, 随访24 个月, 随访时进行HPV、TCT 和病理学检查。HPV 检测结果记录为16/18感染或非16/18 感染, TCT 和活检病理按照宫颈细胞学及组织病理学诊断结果记录。如果随访时病理学检查结果为正常或CINⅠ则判定为病变未进展, 如 果 为 宫 颈 上 皮 内 瘤 变 Ⅱ 级 (cervical intraepithelial neoplasia grade Ⅱ, CINⅡ)、宫颈上皮内瘤变Ⅲ级(cervical intraepithelial neoplasia grade Ⅲ, CINⅢ) 或宫颈癌判定为病变进展。按照随访病理结果将研究对象纳入病变进展组(40 例)和病变未进展组(170 例), 分析2 组初次确诊为CINⅠ的临床数据。210 例CINⅠ患者中, 12 个月随访时失访0 例, 24 个月随访时失访0 例。
1.3 TCT 检测采用细胞刷在宫颈外口鳞柱上皮交界处位置沿同一方向旋转2~5 圈, 然后将刷头保存在细胞保存液中备用。采用沉降式制片术和巴氏染色技术染色。对于TCT 检测结果的判定, 严格按照第3 版阴道细胞TBS 报告系统的分类标准。
宫颈细胞学诊断结果记录为未见上皮内瘤样病变和恶性细胞(no intraepithelial neoplasia and malig nant cells, NILM)、无明确诊断意义的鳞状上 皮 细 胞 病 变 (atypical squamous cells of undetermined significance, ASCUS)、不能排除高级别鳞状上皮内病变不典型细胞(atypical squamous cells-cannot exclude high-grade squamous intraepithelial lesion, ASC-H)、低级别鳞状上皮内病 变 (low-grade squamous intraepithelial lesion, LSIL)、 高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion, HSIL) 和 鳞 状 细胞癌。
1.4 HPV 检测采用专用HPV 宫颈细胞采集刷, 置于宫颈外口鳞柱上皮交界处位置沿同一方向旋转2~5 圈, 采集宫颈脱落细胞, 然后将刷头保存于细胞保存液中备用, 检测采用杂交捕获2 代技术对标本进行细胞学测试。
将HPV 检测结果分为16/18 高危型或其他12 种 非16/18 高 危 型。
1.5 阴道镜检查专业的阴道镜医师对宫颈原始图像和醋酸染色后不同时间段图像进行采集, 适时换用不同光源观察血管特征性图像。①镜下观察:采用生理盐水清洁宫颈, 将分泌物擦拭干净, 首先采用低倍镜搭配白光, 以全面观察子宫颈, 重点检查鳞柱交界(squamocolumnar junction, SCJ) 和TZ, 观察子宫颈表面是否存在异型血管及增生等;②醋酸染色:5%醋酸敷于宫颈及阴道壁50~60 s, 观察完整的SCJ, 发现并评价任何异常区域或非典型的转化区;从低倍镜到高倍镜, 借白光和绿光滤镜全面检查子宫颈和阴道上皮的变化, 仔细观察醋白及血管等异常图像。如有需要, 可重复采用醋酸染色;③碘实验:采用蘸取复方碘溶液的小棉球轻轻地、触压式地、依次涂抹在宫颈和阴道的观察区域;在阴道镜引导下取材最严重的子宫颈的异常区域, 进行2~4 点活检, 必要时行子宫颈管搔刮术(endocervical curettage, ECC)。
1.6 阴道镜诊断标准CINⅠ:醋白上皮病变表面光滑、边缘模糊不规则。动态观察薄醋白上皮出现慢, 消失快, 偶伴有细小点状血管呈小而有规则的镶嵌。CINⅡ-Ⅲ级:病变边缘轮廓分明, 表面光滑, 致密厚实醋白上皮, 呈牡蛎白。动态观察出现快、消失慢, 常伴有隆起感, 可见粗镶嵌或粗点状血管。若致密厚实的醋酸白环覆盖柱状上皮开口, 提示病变累及腺体。浸润癌:宫颈表面呈溃疡或溃烂, 常伴有增生及出血, 致密厚实醋白上皮, 不典型血管, 广泛的不规则点状血管和镶嵌[4]。
1.7 宫颈组织病理学检测标本的采集和诊断标准阴道镜下对宫颈可疑病灶行多点活检送病理室制备石蜡切片显微镜下诊断。宫颈组织病理学诊断标准:宫颈病变分为慢性宫颈炎、CINⅠ、CINⅡ和CINⅢ。
1.8 统计学分析采用SPSS 22.0 统计软件对数据进行统计学分析。以随访结果(病变有无进展)作为结局事件值(因变量), 以年龄、TCT、HPV、绝经状态、转化区和阴道镜下图像特征(异型血管、增生、病变象限和病变边界)作为拟入选的自变量。自变量中年龄、TCT、HPV、绝经状态、转化区及阴道镜下图像特征(异型血管、增生、病变象限和病变边界)均为计数资料, 以百分率表示, 组间比较采用χ2检验。将单因素分析中统计结果阳性的影响因素纳入多因素Logistic 回归模型, 采用逐步回归法筛选独立影响CINⅠ病变进展的相关因素。以P<0.05 为差异有统计学意义。
2 结 果
2.1 CIN 患者随访情况210 例患者中病变进展有40 例, 占19.05%, 病变未进展有170 例, 占80.95%。
2.2 CINⅠ患者病变进展相关危险因素单因素分析CINⅠ病变进展单因素分析结果显示:2 组患者年龄(χ2=25.94,P<0.01)、TCT 情况(χ2=10.97,P<0.01)、是否感染HPV(16/18)(χ2=4.10,P=0.043)、是否伴有增生(χ2=8.18,P=0.004) 和绝经状态(χ2=25.56,P<0.01) 组间比较差异有统计学意义。见表1。
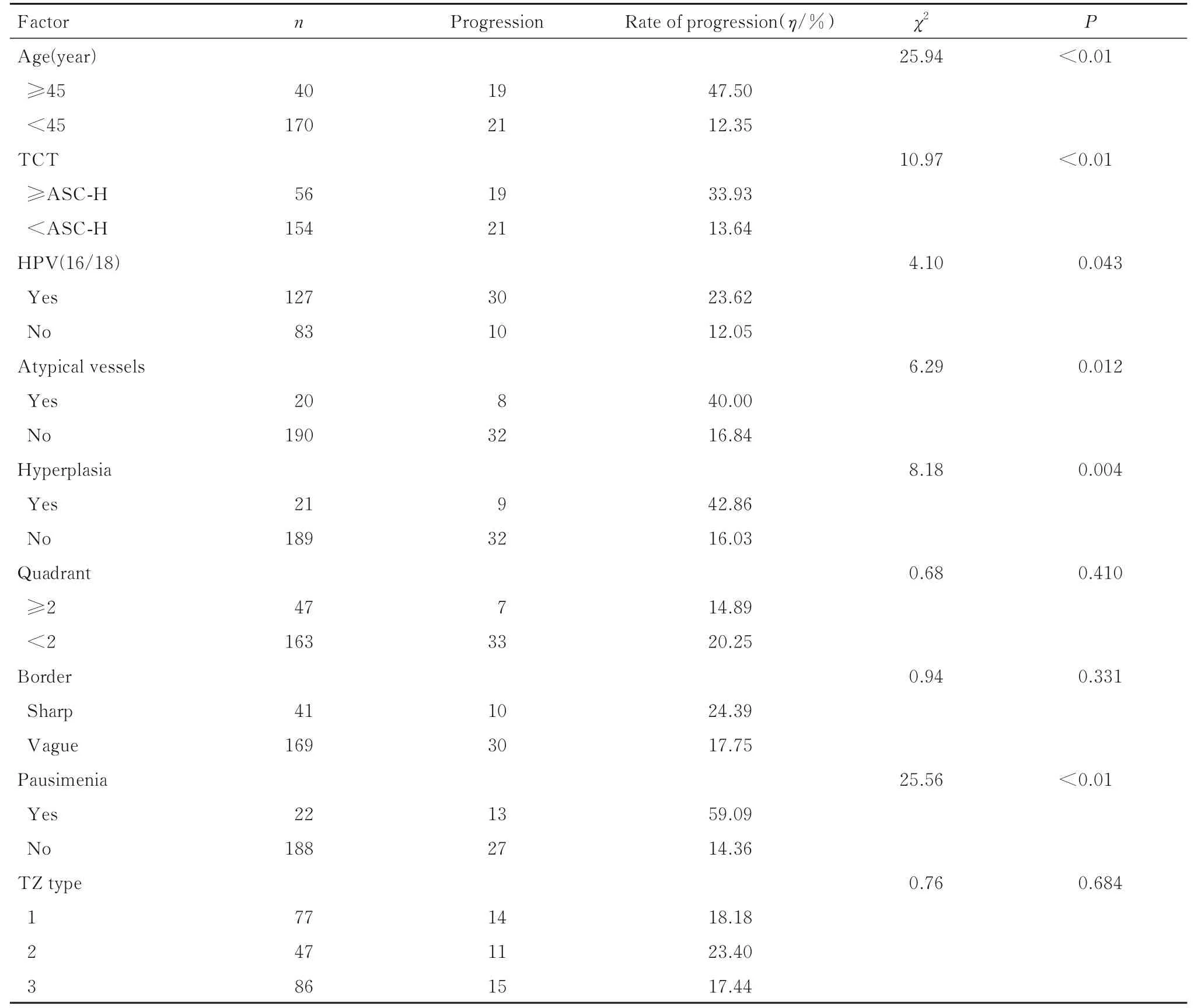
表1 CINⅠ患者病变进展相关危险因素的单因素分析Tab.1 Univariate analysis on risk factors related to disease progression of CINⅠpatients
2.3 多因素Logistic 逐步回归分析以病变是否进展为因变量, 以单因素分析结果中阳性结果为自变量, 进行变量赋值。见表2。多因素Logistic 逐步回归分析纳入P<0.05 的单因素, 包括年龄、TCT、阴道镜下图像特征(异型血管和增生)。本研究结果显示:年龄≥45 岁(OR=5.95,P=0.005, 95%CI: 1.70~20.84 )、 TCT≥ASC-H(OR=3.319,P=0.007, 95%CI:1.38~7.97)、出 现 异 型 血 管(OR=9.91,P<0.01, 95%CI:2.95~33.34)、伴有增生(OR=8.51,P<0.01, 95%CI:2.60~27.84) 是CINⅠ患者病变进展的独立危险因素。见表3。
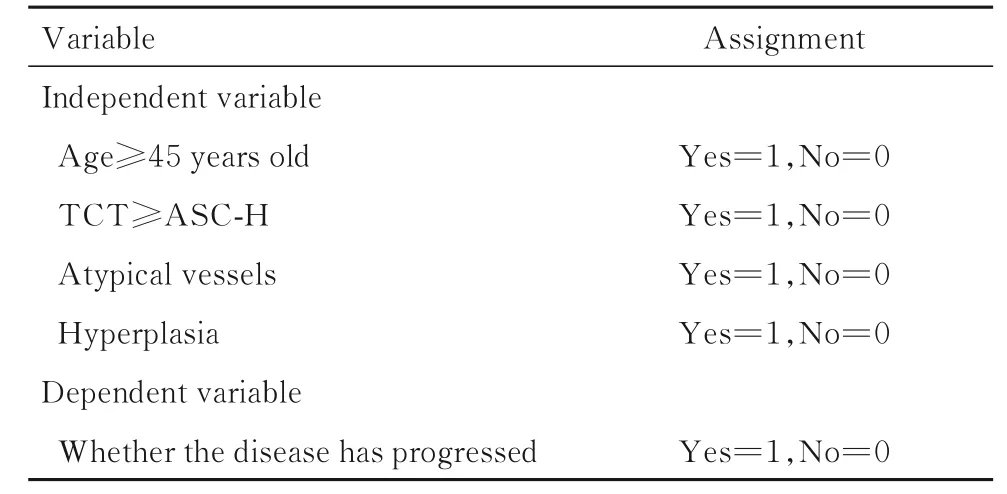
表2 变量赋值Tab.2 Assignment of variables
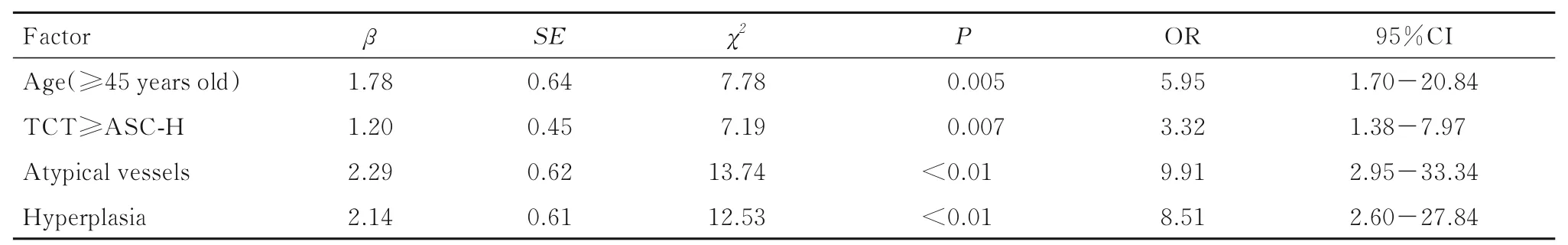
表3 CINⅠ患者病变进展相关危险因素的多因素Logistic 逐步回归分析Tab. 3 Multivariate Logistic stepwise regression analysis on risk factors related to disease progression of CINⅠpatients
3 讨 论
宫颈癌为威胁全世界女性健康的一大恶性疾病, 是多个国家癌症死亡的主要原因, 患病人数占女性恶性肿瘤的15%[5]。据统计, 2020 年在全球范围内约有60 万例宫颈癌新发病例, 34 万例的宫颈癌死亡病例[6]。其中绝大部分病例出现在发展中国家, 严重危害女性的身心健康。
研究者[7]最早在宫颈癌的标本中发现HPV DNA, 于1976 年提出宫颈癌的发生与HPV 感染有关的假想。此后证实宫颈癌是与HPV 密切相关的一种恶性肿瘤。高危型人乳头瘤病毒(high-risk human papillomavirus, HR-HPV)持续感染是诱发CIN 和宫颈癌的主要危险因素和必要条件之一[8]。尽管随着HPV 疫苗的普及, 宫颈癌相关筛查方法以及阴道镜检查的技术发展, 宫颈癌的病死率有效降低, 但宫颈癌仍然是20~39 岁女性癌症死亡的第二大原因[9]。按照CIN 非典型增生病变程度以及侵袭范围, 临床上可将CIN 分成CINⅠ、CINⅡ和CINⅢ3 个级别[10]。CINⅠ作为病变最轻的等级, 其转归结局包括自然消退、持续存在、进展为CINⅡ-Ⅲ甚至宫颈癌。目前持续性CINⅠ尚无明确定义, 大多数学者秉持的观点为CINⅠ持续超过24 个 月 为 病 变 持 续 存 在[11]。研 究[12]显 示:约 有60%的CINⅠ患者在12 个月左右可以自然消退, 22%~32%的CINⅠ患者病变持续存在, 约10%的CINⅠ患者病变24 个月内进展为CINⅡ-Ⅲ, 约1%病变最终进展为宫颈癌, 多数癌前病变进展为宫颈癌需要8~12 年。临床工作中若能筛选进展风险高的CINⅠ患者, 及时进行个体化干预, 就能真正实现降低宫颈癌的发病率和病死率, 从而使患者的存活率达到100%[13]。定期随访是管理CIN 1 的首选方法, 但由于病变的复杂性和可消退性, CINⅠ的临床诊治既容易出现干预不足, 又容易过度治疗, 因此, 分析患者的年龄、TCT、HPV、绝经状态、转化区和阴道镜下图像特征(异型血管、增生、病变象限和病变边界), 发现阴道镜下进展风险高的“警示征”及其危险因素, 对临床治疗具有重大意义。本研究结果显示:患者年龄、异型血管、病变区是否有增生和TCT 结果为CINⅠ病变进展的危险因素。
3.1 年 龄BEKOS 等[14]对783 例CINⅠ级患者进行回顾性分析, 结果显示:30 岁以下的患者病变自然消退率明显升高。MA 等[15]研究显示:患者年龄越大, 宫颈病变级别越高, CINⅠ患者年龄主要为≤24 岁和25~34 岁, CINⅡ-Ⅲ患者年龄分布主要为25~34 岁和35~44 岁, 宫颈癌患者年龄分布主要为35~44 岁和45~54 岁。本研究结果显示:年龄为病变进展的独立危险因素, 2 组患者年龄比较差异有统计学意义(OR=5.95,P=0.005, 95%CI:1.70~20.84), 提示患者年龄越大, 宫颈病变进展的可能性越大。宫颈阴道上皮的完整性高度依赖于雌激素, 雌激素可使鳞状上皮增厚, 增加糖原含量, 糖原在乳杆菌作用下转化为乳酸, 维持阴道正常的酸性环境。酸性环境可抑制其他病原体生长, 有利于阴道乳杆菌的生长。乳杆菌是阴道的优势菌, 可分泌H2O2、细菌素及其他抗微生物因子, 抑制或杀灭致病微生物, 竞争排斥机制阻止致病微生物黏附于阴道上皮细胞[16]。对于更年期和绝经后女性而言, 雌激素和孕激素减少, 乳酸杆菌含量低,某些厌氧菌, 如链球菌、普雷沃氏菌和厌氧球菌有所增加, 以乳酸杆菌耗竭和厌氧菌过度生长为其菌群特征[17]。当乳酸杆菌群并非优势菌群时, HPV 持续感染风险增加, 机制可能是菌群产生的乳酸、H2O2和细菌素等保护性物质减少, 破坏了阴道黏膜屏障的完整性, 宫颈上皮的屏障功能受损, 减弱了宫颈阴道上皮局部抗感染和抗肿瘤的作用;且年龄偏大的患者机体免疫功能下降, 对HR-HPV 的防御力减弱, 对HR-HPV 的自然清除能力降低, 更容易导致宫颈病变进展。
3.2 细胞学结果 MASSAD 等[18]研究显示:细胞学结果为ASCUS、NILM或LSIL者5年内CINⅠ及病变进展率较低, 对于细胞学轻度异常的患者推荐随访复查。另有研究[19]显示:细胞学为LSIL 或HPV 阳性、细胞学为ASCUS的CINⅠ女性, 5 年内病变进展为CINⅢ甚至宫颈癌的风险为3.8%, 而细胞学HSIL 的CIN Ⅰ女性, 5 年内病变进展为CINⅢ甚至宫颈癌的风险高达15.0%。本研究结果显示:TCT是CINⅠ患者病变进展的危险因素(OR=3.319,P=0.007, 95%CI:1.38~7.97)。
3.3 异型血管醋酸实验引起的醋酸白色变化是阴道镜检查最重要的部分[20]。CIN 诊断的主要依据是阴道镜下醋白上皮和异常血管。异常血管包括点状血管、异型血管和镶嵌等。醋酸实验通常将5%乙酸溶液涂于宫颈管和宫颈表面, 异常细胞蛋白会发生构象改变, 引起透光性改变, 形成醋白上皮, 呈白色, 边界不规则, 多数伴有隆起感。醋白上皮的特异性有限, 正常子宫颈上皮(炎症反应和鳞状细胞不成熟化生)至子宫颈癌组织整个阶段都可出现醋白上皮。血管异常增生的早期变化是异型血管的出现。点状血管呈斜型或垂直向上达白色上皮表面, 从上皮下方冲出, 阴道镜下呈点状或逗点状。新生血管构成的图像在镜下可呈现为细镶嵌及粗镶嵌, 龟背样改变, 有时出现内部边界。由于异常上皮增生的速度比血管快, 血管间距被上皮不规则地分隔, 血管管径增粗, 镜下以粗点状血管、不规则的粗镶嵌及异型血管多见。有研究[21]显示:CINⅡ-Ⅲ和宫颈癌患者中点状血管、异型血管及镶嵌这3 种常见的血管异常发生率明显高于CINⅠ患者, 与既往研究[21]结果一致。本研究结果显示阴道镜图像出现异型血管为CINⅠ病变进展的危险因素。
3.4 增 生调控局部组织中细胞生长的基因失控, 异常增生而形成的新生物, 表现为增生样或团块样。机体在生理状态下以及在炎症、损伤修复时的病理状态下也常有组织和细胞的增生, 但良性增生是有一定限度的, 一旦增生的原因消除后就不再继续增生, 而肿瘤性增生则是持续性难以控制的因此可以预测病变区域伴有增生的患者病变进展可能性大, 本研究结果显示:阴道镜下出现增生为CINⅠ病变进展的危险因素。。
3.5 其他因素①阴道菌群:研究[22]显示在HPV 导致CIN 及宫颈癌的发生机制中阴道菌群起了不可忽视的作用。CINⅠ、CINⅡ、CINⅢ和宫颈癌患者阴道菌群与正常健康女性阴道菌群对比发现:随着病变等级升高, 阴道乳杆菌占比逐渐降低, 阿托波菌和加德纳菌等厌氧菌群占比逐渐升高[23-26]。细菌性阴道炎患者唾液酸苷酶活性升高, 降解覆盖在宫颈上皮的黏液、凝胶层和局部免疫球蛋白, 破坏宫颈黏膜导致上皮细胞的创伤, 增加HPV 的易感性, 导致潜伏的 HPV 重新激活, HPV 持续感染的概率增加, 从而影响宫颈对HPV的清除, 加快宫颈病变的进展。阴道炎反复发作(2 次以上) 的人群更易感染HPV, 病变更易进展[27-29]。②性生活:过频的性生活使阴道pH 值升高, 避孕套的频繁使用使宫颈上皮造成物理损伤, 且一般避孕套孔径大于HPV 病毒颗粒直径, 不能阻止HPV 的通过。③吸烟:吸烟会使摄入的尼古丁和亚硝胺高浓度存在于宫颈黏液中, 其诱导DNA 损伤, 使宫颈局部的免疫防御能力遭到破坏, 影响机体对HPV 的清除, 导致宫颈病变的发生和进展[30-32]。④免疫缺陷与抑制:免疫缺陷可降低HPV 的清除率, 造成HPV 的持续感染, 使宫颈病变短期内发生进展。
综上所述, CIN Ⅰ患者年龄≥45 岁、TCT≥ASC-H、阴道镜下出现异型血管和病变区伴有增生为CINⅠ病变进展的独立危险因素。因此, 对于不同个体CINⅠ级患者可参考其就诊时临床资料制订最合适的治疗方案, 一定程度上避免过度治疗且同时有效降低宫颈高级别病变的发生率。
