藏红花素对自发性高血压大鼠血管内皮功能障碍及动脉粥样硬化的作用及其ROCK/JNK 信号通路机制
2022-12-15余淑华吴倩倩杨东伟
余淑华, 刘 朏, 吴倩倩, 杨东伟
(1. 郑州大学附属郑州中心医院高血压科, 河南 郑州 450000;2.郑州大学附属郑州中心医院心血管内科, 河南 郑州 450000)
内皮功能障碍(endothelial dysfunction, ED)表现为内皮依赖性血管舒张功能受损、氧化应激升高、慢性炎症、白细胞黏附、高渗透性和内皮细胞衰老, 被认为是多种人类全血管疾病的标志[1]。高血压作为一种慢性疾病, 可引起患者心力衰竭、血管性痴呆和中风等心血管疾病的发生发展[2]。研究[3]显示:血管功能向血管收缩、促炎和氧化应激状态转变可能导致ED 损伤, 这是高血压的关键事 件, 而 ED 被 认 为 是 动 脉 粥 样 硬 化(atherosclerosis, As)发展的早期过程[4], 高血压或血脂异常可独立触发As 的不同发展阶段[5]。藏红花是鸢尾科多年生无茎草本植物, 藏红花素(crocin, CR)为从藏红花中分离而来的类胡萝卜素, 具有抗炎、抗氧化和清除自由基等药理活性, 可预防心血管疾病[6], 研究[7]显示:在长期给药过程中, CR 具有降压和维持正常血压的作用。RhoA/Rho 相 关 激 酶 (RhoA/Rho-associated kinase, ROCK)/C-Jun 氨基酸末端激酶(C-Jun N-terminal kinase, JNK) 信号通路与多种心血管疾病的发生相关, 抑制该通路可降低自发性高血压(spontaneous hypertension, SH) 大鼠的血压和血脂水平, 减轻血管平滑肌细胞过度迁移引起的内膜增厚, 减少As、心肌梗死和中风等严重心血管疾病的发生[8]。但关于CR 是否可通过ROCK/JNK信号通路改善SH 大鼠ED 及As 的相关报道较少, 本研究观察CR 对SH 大鼠的作用并探讨其可能的作用机制, 为SH 治疗提供依据。
1 材料与方法
1.1 实验动物、药品、主要试剂和仪器10 只6 周龄SPF 级雄性Wistar Kyoto 大鼠购自常州卡文斯实验动物有限公司, 动物生产许可证号:SCXK(苏)2016-0010, 50 只SH 大鼠购自中科院上海实验动物中心, 动物生产许可证号:SCXK (沪)2020-0005, 体 质 量(180±20) g, 恒 温(22±2)℃、恒湿(55±5)%条件下普通饲养, 12 h 光-暗循环适应1 周, 充分给予水和饲料。CR(纯度≥95%)购自上海纯优生物科技有限公司, 大鼠丙二醛(malondialdehyde, MDA) 和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px) ELISA试剂盒购自上海酶联生物研究所, 大鼠8-异构前列腺 素F2α (8-isoprostaglandin F2α, 8-iso-PGF2α)、一 氧 化 氮 (nitric oxide, NO)、 内 皮 素 1(endothelin-1, ET-1) 和血栓素B2 (thromboxane B2, TXB2)ELISA 试剂盒购自南京森贝伽生物科技有限公司, 兔抗ROCK1、兔抗ROCK2、兔抗JNK 和 兔 抗 磷 酸 化JNK (phophorylated JNK, p-JNK)单克隆抗体购自美国Abcam 公司。实时荧光 定 量PCR (real-time fluorescence quantitative PCR, RT-qPCR) 仪和多功能酶标仪购自美国赛默飞世尔科技有限公司, 化学发光凝胶成像系统购自美国ProteinSimple 公司。
1.2 实验动物分组及给药选取10 只6 周龄SPF级雄性Wistar Kyoto 大鼠作为正常组, SH 大鼠随机分为模型组、低剂量CR 组、中剂量CR 组和高剂量CR 组, 每组10 只, 其中低、中和高剂量CR组大鼠腹腔注射25、50 及100 mg·kg-1·d-1CR, 正常组和模型组大鼠每日腹腔注射等量生理盐水, 连续4 周。
1.3 各组大鼠24 h 尿8-iso-PGF2α 肾脏排泄量检测末次给药后, 将大鼠置于单独代谢笼中收集24 h 尿液, 收集尿液时提前加入抗菌剂和抗生素以防样品降解。4 ℃、3 000 r·min-1离心15 min, 收集上清, 严格按照ELISA 试剂盒说明书操作步骤检测大鼠24 h 尿8-iso-PGF2α 肾脏排泄量, 单位为ng·L-1。
1.4 各组大鼠血压和血脂水平检测及动脉粥样硬化指数(atherosclerosis index, AI)计算收集24 h尿液后, 腹腔注射1%戊巴比妥钠(30 mg·kg-1)麻醉各组大鼠, 采用无创尾动脉血压测量系统测量大鼠收缩压和舒张压。腹腔静脉采血, 37 ℃水浴培养30 min 后3 000 r·min-1离心15 min 分离血清, 全自动生化分析仪检测各组大鼠血清总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、 低 密 度 脂 蛋 白 胆 固 醇 (low density lipoprotein cholesterol, LDL-c)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-c)水平, 并计算AI, AI=(TC-HDL-c)/HDL-c。
1.5 各组大鼠血清GSH-Px 活性和MDA、NO、ET-1 及TXB2 水平检测各组大鼠尾动脉收集血液, 4 ℃、3 500 r·min-1离心15 min 分离血清, 严格按照ELASA 试剂盒说明书操作并计算大鼠血清GSH-Px 活性和MDA、NO、ET-1 及TXB2 水平。
1.6 各组大鼠As 情况观察颈椎脱臼法处死大鼠, 取胸主动脉组织, 4%多聚甲醛固定过夜, 常规石蜡包埋并制备厚度为4 μm 石蜡切片, 二甲苯脱蜡、乙醇水洗, 苏木精染色5 min, 1%盐酸酒精分化10 s, 0.6% 氨水返蓝, 伊红染液染色30 s, 脱水透明后, 中性树脂封片, 200 倍镜下观察并拍照记录。
1.7 RT-qPCR 法检测各组大鼠主动脉组织中ROCK1、ROCK2 和JNK mRNA 表 达 水 平采 用TRIzol 试剂提取各组大鼠主动脉组织总RNA, 测定其浓度和完整性合格后, 将RNA 逆转录为cDNA。引物序列采用Primer Premier 软件设计, 由生工生物工程(上海)有限公司合成。制备RTqPCR 反 应 体 系, 2 000 r·min-1离 心5 min, 避 光, RT-qPCR 法检测大鼠主动脉组织中ROCK1、ROCK2 和JNK mRNA 表达水平。扩增条件:5 ℃、10 min, 95 ℃、15 s 和60 °C、1 min, 共40 个循环。以正常组作为对照, 以GAPDH 作为内参基因, 采用2-ΔΔCt法计算目的基因mRNA 表达水平。引物序列:ROCK1 上游引物5'-TGGAGTACATGCCTGGTGGAGAC-3', ROCK1 下 游 引 物5'-AGCAGCATGTTGTCAGGCTTCAC-3';ROCK2 上 游引物5'-TGGAGTACATGCCAGGTGGAGAC-3', ROCK2 下游引物5'-ATCCAGTGCAAGCACGACTCAG-3';JNK 上 游 引 物5'-ATCTCCGTAGACGAAGCTCTCCAG-3', JNK 下 游 引 物5'-GACGCCATTCTTAGTTCGCTCCTC-3'; GAPDH上游引物 5'-CAACGTGTCATGTGGTGGACCTG-3', GAPDH 下游引物5'-CAACGTGTCATGTGGTGGACCTG-3'。
1.8 Western blotting 法检测大鼠主动脉组织中ROCK1、ROCK2、JNK 和p-JNK 蛋白表达水平取暂时保存于液氮中的主动脉组织, 于预冷裂解液中裂解, 1 2000 r·min-1、4 ℃离心10 min 后取上清, BCA 法检测蛋白浓度, 加热变性。SDS-PAGE 凝胶电泳分离蛋白, 湿转蛋白至PVDF 膜, 5%脱脂乳封闭2 h, 后直接于4 ℃一抗(1∶1 000 稀释)内孵 育 过 夜; 洗 膜6 次, 每 次10 min, 于 二 抗(1∶10 000 稀释)内室温孵育1.5 h, 洗膜6 次, 每次10 min, 将PVDF 膜与ECL 发光液反应2 min, 化学发光凝胶成像系统曝光并拍照记录。采用Image J 软件分析条带灰度值, 以目的蛋白与内参GAPDH 条带灰度值比值表示目的蛋白表达水平。
1.9 统计学分析采用SPSS 25.0 统计软件进行统计学分析。各组大鼠收缩压, 舒张压, 血脂水平, AI, 24 h 尿8-iso-PGF2α 肾 脏 排 泄 量, 血 清GSH-Px 活性和MDA、NO、ET-1 及TXB2 水平, 主动脉组织中ROCK1、ROCK2 和JNK mRNA 表达水平及ROCK1、ROCK2、JNK 及p-JNK 蛋白表达水平均符合正态分布, 以±s表示, 多组间样本均数比较采用单因素方差分析, 组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠收缩压和舒张压与正常组比较, 其他各组大鼠收缩压和舒张压升高(P<0.05);与模型组比较, 低、中和高剂量CR 组大鼠收缩压及舒张压降低(P<0.05);与低剂量CR 组比较, 中和高剂量CR 组大鼠收缩压及舒张压降低(P<0.05);与中剂量CR 组比较, 高剂量CR 组大鼠收缩压和舒张压降低(P<0.05)。见表1。
表1 各组大鼠收缩压和舒张压Tab. 1 Systolic blood pressure and diastolic blood pressure of rats in various groups (n=10, ±s, P/mmHg)

表1 各组大鼠收缩压和舒张压Tab. 1 Systolic blood pressure and diastolic blood pressure of rats in various groups (n=10, ±s, P/mmHg)
*P<0.05 vs normal group;△P<0.05 vs model group;#P<0.05 vs low dose of CR group;○P<0.05 vs medium dose of CR group.
Group Normal Model CR Low dose Medium dose High dose Systolic blood pressure 113.35±4.26 187.68±12.03*Diastolic blood pressure 72.27±4.25 116.91±5.27*108.17±4.63△97.25±5.91△#82.78±4.02△#○168.76±10.03△137.93±8.11△#124.22±6.74△#○
2.2 各组大鼠血脂水平和AI与正常组比较, 其他各组大鼠血清TC、TG 和LDL-c 水平及AI 升高(P<0.05), HDL-c 水平降低(P<0.05);与模型组比较, 低、中和高剂量CR 组大鼠血清TC、TG和LDL-c 水平及AI 降低(P<0.05), HDL-c 水平升高(P<0.05);与低剂量CR 组比较, 中和高剂量CR 组大鼠血清TC、TG 和LDL-c 水平及AI 降低(P<0.05), HDL-c 水平升高(P<0.05);与中剂量CR 组比较, 高剂量CR 组大鼠血清TC、TG 和LDL-c 水平及AI 降低(P<0.05), HDL-c水平升高(P<0.05)。见表2。

表2 各组大鼠血脂水平和AITab.2 Blood lipid levels and AI of rats in various groups (n=10, x±s)
2.3 各组大鼠24 h 尿8-iso-PGF2α 肾脏排泄量
与正常组(1.75 ng·L-1±0.10 ng·L-1)比较, 其他各组大鼠24 h 尿8-iso-PGF2α 肾脏排泄量升高(P<0.05);与 模 型 组(5.87 ng·L-1±0.34 ng·L-1)比 较, 低 (5.07 ng·L-1±0.23 ng·L-1)、 中(4.14 ng·L-1±0.13 ng·L-1) 和 高 剂 量CR 组(2.92 ng·L-1±0.20 ng·L-1) 大 鼠24 h 尿8-iso-PGF2α 肾脏排泄量降低(P<0.05);与低剂量CR 组比较, 中和高剂量CR 组大鼠24 h 尿8-iso-PGF2α 肾脏排泄量降低(P<0.05);与中剂量CR 组比较, 高剂量CR 组大鼠24 h 尿8-iso-PGF2α肾脏排泄量降低(P<0.05)。
2.4 各组大鼠血清GSH-Px 活性和MDA、NO、ET-1 及TXB2 水平与正常组比较, 其他各组大鼠 血 清MDA、 ET-1 和TXB2 水 平 升 高(P<0.05), GSH-Px 活性和NO 水平降低(P<0.05);与模型组比较, 低、中和高剂量CR 组大鼠血清MDA、 ET-1 及TXB2 水 平 降 低 (P<0.05), GSH-Px 活性和NO 水平升高(P<0.05);与低剂量CR 组比较, 中和高剂量CR 组大鼠血清MDA、ET-1 及TXB2 水 平 降 低(P<0.05), GSH-Px 活性和NO 水平升高(P<0.05);与中剂量CR 组比较, 高剂量CR 组大鼠血清MDA、ET-1 和TXB2水平降低(P<0.05), GSH-Px 活性和NO 水平升高(P<0.05)。见表3。
表3 各组大鼠血清GSH-Px 活性和MDA、NO、ET-1 及TXB2 水平Tab.3 Serum activities of GSH-Px and levels of MDA, NO, ET-1,and TXB2 of rats in various groups (n=10, ±s)

表3 各组大鼠血清GSH-Px 活性和MDA、NO、ET-1 及TXB2 水平Tab.3 Serum activities of GSH-Px and levels of MDA, NO, ET-1,and TXB2 of rats in various groups (n=10, ±s)
*P<0.05 vs normal group;△P<0.05 vs model group;#P<0.05 vs low dose of CR group;○P<0.05 vs medium dose of CR group.
Group Normal Model CR Low dose Medium dose High dose MDA[cB/(nmol·L-1)]8.12±0.21 15.27±1.08*GSH-Px[cB/(μmol·L-1)]109.52±9.68 58.24±3.68*NO[cB/(μmol·L-1)]22.10±2.18 13.58±0.72*ET-1[ρB/(ng·L-1)]65.85±4.31 114.78±5.95*TXB2[ρB/(ng·L-1)]32.61±3.10 58.99±4.60*53.33±3.77△46.06±3.69△#35.86±3.24△#○14.12±0.62△11.86±0.84△#9.52±0.81△#○65.09±4.03△78.39±6.20△#98.67±7.51△#○14.54±1.10△16.66±1.14△#19.96±0.94△#○103.70±5.64△87.86±6.96△#72.46±4.69△#○
2.5 各组大鼠主动脉组织AS 情况HE 染色结果显示:正常组大鼠主动脉血管壁薄而光滑, 厚度均匀, 内外弹板清晰完整;模型组大鼠血管壁表面粗糙不完整, 内膜可见有增生且明显增厚, 于纤维帽和胆固醇晶体下观察到大量泡沫细胞及AS 坏死物质, 炎性细胞浸润;与模型组比较, 低、中和高剂量CR组大鼠主动脉AS相关病理形态逐渐改善。见图1。
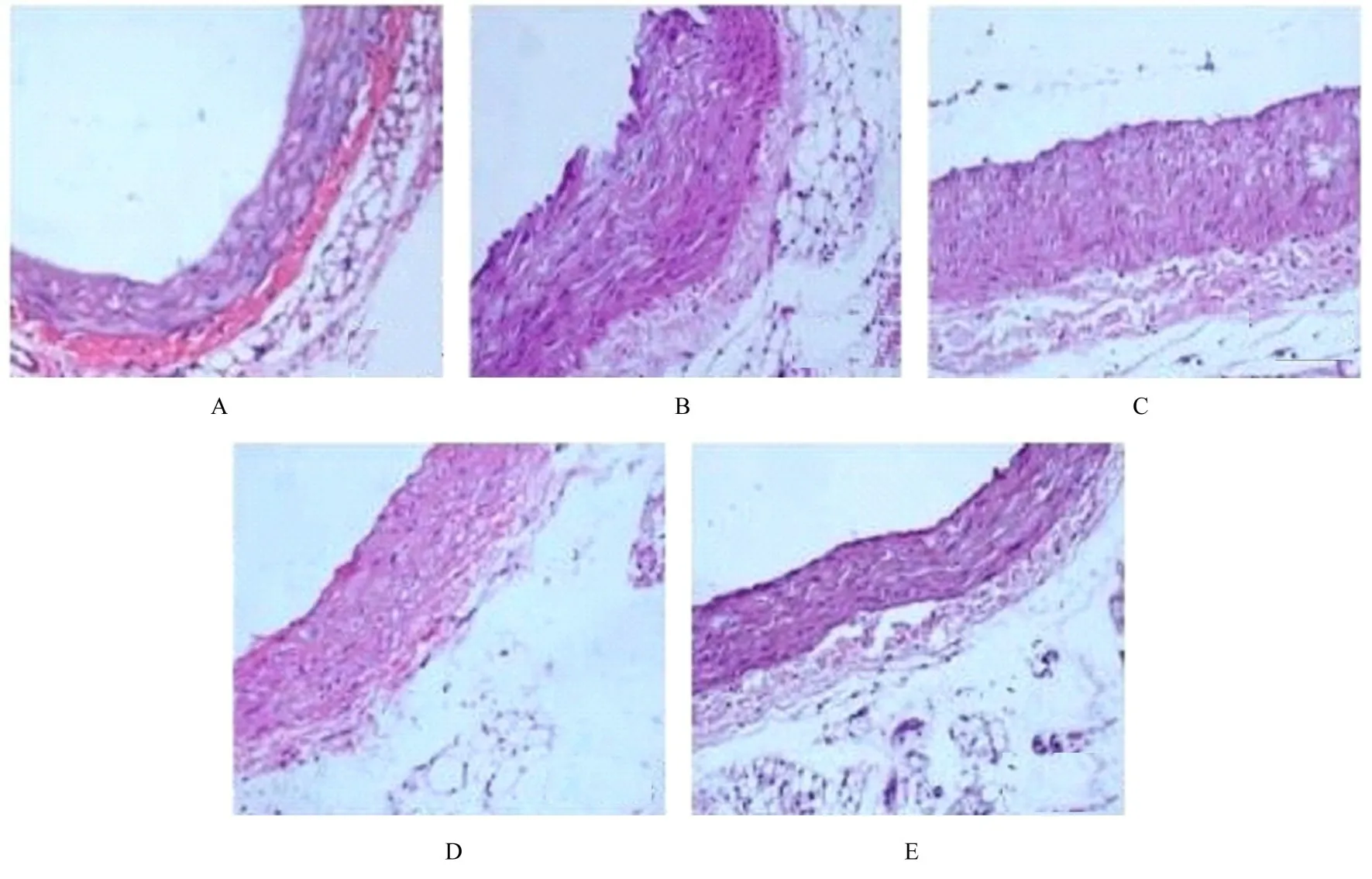
图1 各组大鼠主动脉组织形态表现(HE, ×200)Fig.1 Morphology of aorta tissue of rats in various groups(HE, ×200)
2.6 各组大鼠主动脉组织中ROCK1、ROCK2 和JNK mRNA 表达水平与正常组比较, 其他各组大鼠主动脉组织中ROCK1、 ROCK2 和JNK mRNA 表达水平升高(P<0.05);与模型组比较, 低、中和高剂量CR 组大鼠主动脉组织中ROCK1、ROCK2 及JNK mRNA 表达水平降低(P<0.05);与低剂量CR 组比较, 中和高剂量CR 组大鼠主动脉组织中ROCK1、ROCK2 及JNK mRNA 表达水平降低(P<0.05);与中剂量CR 组比较, 高剂量CR 组大鼠主动脉组织中ROCK1、ROCK2 和JNK mRNA 表达水平降低(P<0.05)。见表4。
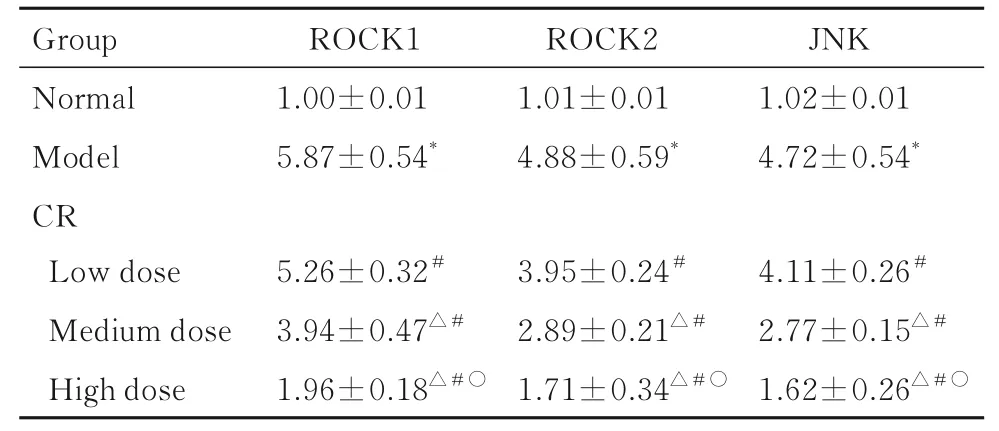
表4 各组大鼠主动脉组织中ROCK1、ROCK2 和JNK mRNA 表达水平Tab. 4 Expression levels of ROCK1, ROCK2, and JNK mRNA in aorta tissue of rats in various groups (n=10, x±s)
2.7 各组大鼠主动脉组织中ROCK1、ROCK2、JNK 和p-JNK 蛋白表达水平与正常组比较, 其他各组大鼠主动脉组织中ROCK1、ROCK2、JNK 和p-JNK 蛋白表达水平升高(P<0.05);与模型组比较, 低、中和高剂量CR 组大鼠主动脉组织中ROCK1、ROCK2、JNK 及p-JNK 蛋白表达水平降低(P<0.05);与低剂量CR 组比较, 中和高剂量CR 组大鼠主动脉组织中ROCK1、ROCK2、JNK及p-JNK 蛋白表达水平降低(P<0.05);与中剂量CR 组比较, 高剂量CR 组大鼠主动脉组织中ROCK1、ROCK2、JNK 和p-JNK 蛋白表达水平降低(P<0.05)。见图2 和表5。
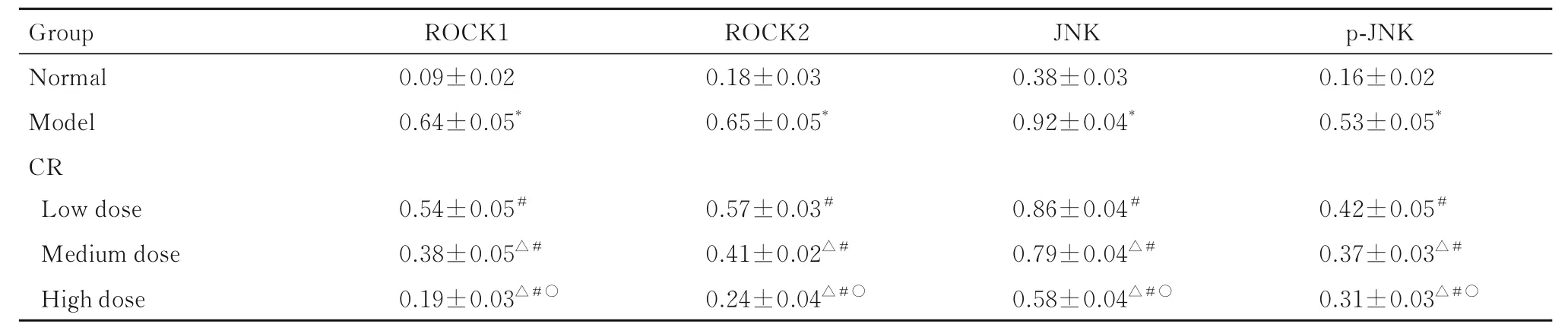
表5 各组大鼠主动脉组织中ROCK1、ROCK2、JNK 和p-JNK 蛋白表达水平Tab.5 Expressions levels of ROCK1, ROCK2, JNK,and p-JNK proteins in aorta tissue of rats in various groups (n=10, x±s)
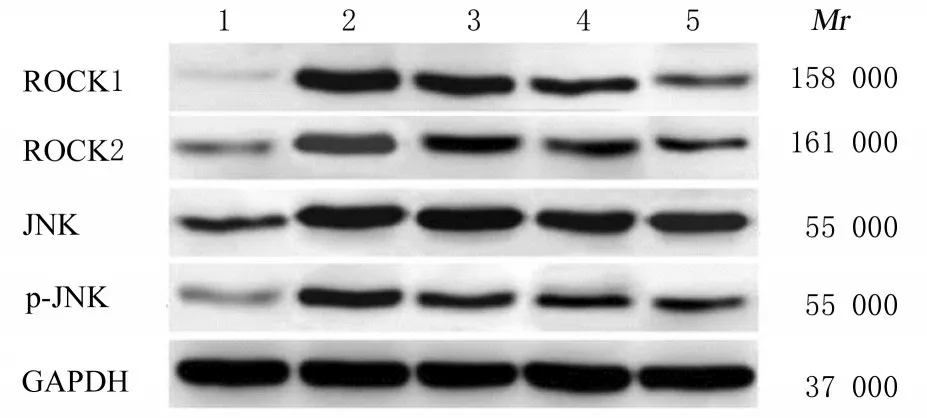
图2 Western blotting 法检测各组大鼠主动脉组织中ROCK1、ROCK2、JNK 和p-JNK 蛋白表达电泳图Fig. 2 Electrophoregram of expressions of ROCK1,ROCK2, JNK, and p-JNK proteins in aorta tissue of rats in various groups detected by Western blotting method
3 讨 论
氧化应激和ED 是导致高血压患者血管舒张受损 的 关 键 因 素[9]。 研 究[10]显 示: 活 性 氧(reactiveoxygenspecies, ROS) 代谢产物及衍生物显著增加可引起肾脏和主动脉组织中氧化损伤加重, 促进血管平滑肌细胞增殖、迁移和凋亡, 引起的血管重塑将利于高血压和As 发展, 提示抗氧化反应可能是SH 治疗的一种有效策略。
动脉高血压是导致以ED、心脏组织和肝肾功能变化为特征的严重组织损伤的主要危险因素, 高血压的理想治疗必须通过控制血压来实现[11], 抗氧化剂及促氧化剂之间的失衡是血管损伤的主要因素, 可以导致血压升高[12]。CR 是一种天然化合物, 可作为抗氧化剂改善多种组织的氧化损伤[13]。研究[14-15]显示:CR 可改善肺动脉重构、预防肺动脉高压、降低妊娠期高血压大鼠血压、减轻N-硝基-L-精氨酸甲酯诱导的高血压大鼠血清和胎盘组织中的炎症及氧化应激信号。8-iso-PGF2α 是F2 异前列腺素家族的成员, 已被公认为是用于评估氧化应 激 的 有 价 值 的 生 物 标 志 物[16], MDA 为ROS 自由基氧化终产物, GSH-Px 可清除ROS 所诱发的脂质过氧化物, 两者分别用于提示氧化和抗氧化状态。研究[12,17]显示:在抗高血压治疗过程中, 24 h 尿 液 中8-iso-PGF2α 肾 排 泄 量 和MDA 水 平 降低, GSH-Px 活性升高。本研究结果显示:SH 大鼠血压水平、24 h 尿8-iso-PGF2α 肾排泄量和血清MDA 水平明显升高, 血清GSH-Px 活性明显降低, 提示SH 大鼠机体氧化应激反应严重;与模型组比较, 不同剂量CR 组大鼠血压水平、24 h 尿8-iso-PGF2α 肾排泄量和血清MDA 水平明显降低, 血清GSH-Px 活性明显升高, 提示CR 可能通过抑制SH大鼠机体氧化应激损伤而发挥降血压作用。
高血压可导致血管功能发生病理变化, 其中ED 主要特征为NO 生物利用度受损、内皮诱导的血管舒张作用减弱和氧化应激过度产生[18], 其中NO 产生和生物利用度受损可能与内皮源性血管收缩及血管舒张物质的失衡有关[19]。血清ET-1、TXB2 和NO 为内皮功能常用指标, 其中ET-1 和TXB2 均具有血管收缩作用, 研究[20]显示:抗高血压治疗可降低ET-1、TXB2 水平并提高血清NO水平, 藏红花提取物参与平滑肌细胞的抑制作用、钙通道的阻断和内皮功能障碍等, 可通过NO 合酶途径诱导离体大鼠主动脉环的血管舒张, 对SH 大鼠的降血压效果显著[21]。本研究结果显示:不同剂量CR 作用SH 大鼠后, SH 大鼠血清ET-1 和TXB2 降低, NO 水平升高, 提示CR 可能通过改善内皮细胞功能, 调节血管内皮细胞产生的舒张和收缩因子平衡, 促进SH 大鼠血管平滑肌松弛, 扩张动脉血管, 进而降低血压水平。动脉高血压通常与血脂异常有关[22], ED、内膜大量脂质沉积、先天和适应性免疫反应加剧、血管平滑肌细胞增殖和细胞外基质重塑的血管病理演变可导致As 斑块形成[23]。研 究[24]显 示:高 血 压 患 者 中TC、TG 和LDL-c 水平升高, HDL-c 水平降低, 且HDL-c 水平与As 呈负相关关系。本研究结果显示:胸主动脉组织HE 染色可观察到SH 大鼠动脉血管中有大量泡沫细胞及动脉粥样坏死物质, 且血清TC、TG 和LDL-c 水 平 及AI 升 高, HDL-c 水 平 降 低, 提示SH 大鼠存在As;经CR 治疗后上述情况可逆转, 提示CR 可能通过降低SH 大鼠血脂水平及机体氧化反应, 减轻内皮细胞功能障碍, 进而降低As 进展。
ROCK 属于丝氨酸/苏氨酸蛋白激酶家族成员, 是RhoA/ROCK 信号通路的主要效应分子, 为JNK 信号通路激活的重要上游信号。ROS 可激活RhoA/ROCK 信 号[25], 通 过JNK 通 路 调 节 平 滑 肌表 型 调 节 和 血 管 重 塑[26], 并 促 进As 发 生[27], 另ROCK/JNK 信号可与血管紧张素Ⅱ和ET-1 等血管活性物质相互作用, 促进炎症、氧化应激和血栓形成等。本研究结果显示:经CR 治疗后, SH 大鼠主动脉组织中ROCK1、ROCK2 和JNK mRNA 及蛋白表达水平以及JNK 磷酸化水平明显降低, 提示CR 可能通过抑制ROCK/JNK 信号通路激活, 降低SH 大鼠机体氧化应激损伤, 减轻ED 并减缓As 发展, 从而发挥改善SH 作用。
综上所述, CR 可降低血压及血脂水平, 减轻SH 大鼠ED 和As, 其作用机制可能与抑制ROCK/JNK 信号通路激活有关。
