肿瘤归巢肽-近红外荧光蛋白融合蛋白的制备及其荧光特性
2022-12-15杨馥旭胡楠楠穆业腾范宇鑫郭峰霖关新刚
杨馥旭, 胡楠楠, 郭 冲, 穆业腾, 薛 晗, 范宇鑫, 郭峰霖, 关新刚,2
(1. 北华大学医学技术学院医药生物工程重点实验室, 吉林 吉林132013;2. 台州学院医学院基础医学系, 浙江 台州 318000)
近红外光谱(near-infrared spectrum, NIR)的光学窗口为650~900 nm, 具有背景荧光低、光散射少和组织光透性较高等优点, 是用于活体和深部组织成像的理想示踪光谱[1-3]。近红外荧光蛋白(near-infrared fluorescent protein, NIRFP) 是一种能发出近红外荧光的新型蛋白质。与传统绿色荧光蛋白[4](green fluorescent protein, GFP)和红色荧光蛋白[5](red fluorescence protein, RFP) 比较, NIRFP 由于其良好的生物相容性和可用于活体成像功能得到了越来越多的关注。已有研究者[6-8]制备出近红外荧光蛋白720(near-infrared fluorescent protein 720, iRFP720)、单体近红外荧光蛋白670(monomeric near-infrared fluorescent protein 670, miRFP670) 和具有光激活特性的多种NIRFP。AN 等[9]采用小型超红荧光蛋白和牛血清白蛋白制备了用于肿瘤活体成像的荧光探针;HERBERT等[10]制备了载NIRFP 的病毒颗粒, 能够实时追踪颗粒通过高通透性和滞留效应 (enhanced permeability and retention effect, EPR)靶向至肿瘤组织。然而, 目前关于具有肿瘤主动靶向功能NIRFP 的报道较少。
miRFP670 是一种激发波长为642 nm 和发射波长为670 nm 的单体近红外荧光蛋白, 源自沼泽红假单胞菌的细菌光敏色素感受器, 在哺乳动物细胞中具有较强光稳定性和光强度[8]。肿瘤归巢肽(tumor homing peptides, THPs) 是一类对肿瘤组织和血管具有归巢效应的短肽, 能够与肿瘤细胞表面的特异性受体结合[11]。 LyP-1 ( 序 列CGNKRTRGC)就是采用噬菌体展示技术筛选得到 的THPs。LyP-1 能够与乳腺癌[12]、胰 腺 癌[13]和卵巢癌[14]等肿瘤细胞表面高表达的p32 蛋白特异性结合, 从而靶向至肿瘤部位[15], 因此LyP-1近年来被广泛应用于肿瘤的精准诊断和靶向治疗领域[16-18]。本研究基于miRFP670 的近红外荧光特性和LyP-1 的肿瘤靶向性, 构建miRFP670-LyP1 的原核表达载体, 表达纯化的融合蛋白miRFP670-LyP1, 探讨融合蛋白miRFP670-LyP1 的细胞内吞和胞内发光特性, 旨在构建一种可主动靶向肿瘤组织, 具有近红外荧光特性的外源性荧光纳米探针, 为开发靶向肿瘤的新型示踪剂提供依据。
1 材料与方法
1.1 质粒、细胞、主要试剂和仪器pmiRFP670-N1 质粒(美国Addgene 公司), pET-28a 质粒、大肠杆菌BL21、大肠杆菌DH5α 和乳腺癌4T1 细胞均由本实验室保存。EcoR Ⅰ和NotⅠ限制性核酸内切酶(日本TaKaRa 公司), T4 DNA 连接酶(美国New England Biolabs 公司)。质粒小提试剂盒和凝胶回收试剂盒(北京天根生物有限公司), Ni-NTA 树脂、异丙基- β -D- 硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside, IPTG) 和卡那霉素[生工生物工程(上海) 股份有限公司]。核酸电泳系统和SDS-PAGE 电泳系统(美国Bio-Rad 公司), 多功能酶标仪Tecan Spark (瑞士帝肯公司), 荧光倒置显微镜(美国Lifte-Technologies公司)。
1.2 miRFP670-LyP1 融合蛋白原核表达载体的构建和鉴定采用EcoR Ⅰ和NotⅠ限制性核酸内切酶对pmiRFP670-N1 质粒及pET-28a 质粒进行双酶切5 h, 将酶切产物经0.8%琼脂糖凝胶电泳分离。凝胶回收目的片段, 并采用T4 DNA 连接酶4 ℃水浴连接过夜, 获得连接产物pET-miRFP670。将连接产物热激转化至DH5α 大肠杆菌感受态细胞, 37 ℃振摇1 h, 离心后涂布于含有卡那霉素的LB 平板上, 37 ℃过夜培养。挑取单克隆菌落, 接种于含卡那霉素的LB 培养基, 37 ℃、170~180 r·min-1摇菌过夜, 提取质粒后进行双酶切及琼脂糖凝胶电泳验证, 并将重组质粒送至生工生物工程(上海)股份有限公司行测序分析。根据miRFP670 基因序列设计引物, 引入LyP-1 的DNA 序列, 采用引物行PCR 反应, 取5 μL PCR 产物行琼脂糖凝胶电泳, 剩余产物纯化后加入DpnⅠ酶去除质粒模板。采用酶切产物转化DH5α 大肠杆菌感受态细胞, 次日摇菌提取质粒(pET-miRFP670-LyP1), 送至生工生物工程(上海)股份有限公司行测序分析。
1.3 miRFP670-LyP1 融合蛋白原核表达的检测
将测序正确的pET-miRFP670-LyP1 质粒转化至BL21 大肠杆菌感受态细胞, 37 ℃过夜培养, 挑取单克隆菌落接种至含卡那霉素的LB 培养基中, 37 ℃、170~180 r·min-1摇菌过夜。次日, 按1∶50的比例将菌液扩大至100 mL 含卡那霉素的LB 培养基中。在3 种条件下进行原核表达:①37 ℃、170~180 r·min-1摇菌至波长600 nm 处吸光度(A)值达到0.8, 加入终浓度为1.0 mmol·L-1IPTG, 37 ℃、 170~180 r·min-1诱 导 蛋 白 表 达5 h;②37 ℃、170~180 r·min-1摇菌至A(600)值达到0.5, 菌液置于冰水中冷却, 加入终浓度为0.1 mmol·L-1IPTG, 16 ℃、120~140 r·min-1诱导蛋白表达18 h;③37 ℃、170~180 r·min-1摇菌至A(600)值达到0.5, 菌液置于冰水中冷却, 加入终浓度为0.5 mmol·L-1IPTG, 16 ℃、120~140 r·min-1诱导蛋白表达18 h。离心收集菌体, 重悬并超声破碎菌体, 离心分离上清和沉淀, 再将沉淀重悬, 采用SDS-PAGE 电泳分析miRFP670-LyP1 融合蛋白表达情况。
1.4 纯化后miRFP670-LyP1 融合蛋白表达检测
按2 倍柱体积的量将超声后离心分离的上清液加入至Ni-NTA 树脂中, 置于杂交炉, 4 ℃结合100 min。加入2 倍柱体积的洗涤缓冲液洗涤5 次, 去除非特异性结合蛋白, 加入1 倍柱体积的洗脱缓冲液, 置于4 ℃杂交炉20 min, 洗脱3 次, 收集洗脱液。对洗脱产物进行SDS-PAGE 电泳分析。
1.5 miRFP670-LyP1 融合蛋白细胞内吞形态表现将无菌洁净的细胞爬片置于24 孔细胞培养板底部, 将处于对数生长期的4T1 细胞接种于24 孔细胞培养板中, 37 ℃、5% CO2培养箱中培养中, 过夜培养至贴壁。次日, 加入终浓度为3 μmol·L-1无菌miRFP670-LyP1 融合蛋白溶液, 共孵育4 h, PBS 缓冲液清洗2 次, 4% 多聚甲醛固定, DAPI染色8 min, PBS 缓冲液清洗3 次, 抗荧光淬灭封片剂封片。在荧光显微镜(激发波长为640 nm)下观察融合蛋白的细胞内吞形态表现。
2 结 果
2.1 miRFP670-LyP1 融合蛋白原核表达载体的构建采用限制性核酸内切酶EcoR Ⅰ和NotⅠ双酶切质粒pmiRFP670-N1 和pET-28a, 0.8% 琼脂糖凝胶电泳分离酶切产物, 分离载体片段和miRFP670 基因片段, 见图1A。将条带凝胶回收, 4 ℃水浴连接过夜, 将连接产物转化至DH5α 大肠杆菌感受态细胞, 提取重组质粒, 酶切电泳验证。重组质粒经双酶切后得到5 343 和964 bp 这2 条片段(图1B), 提示重组质粒pET-miRFP670 初步构建成功。DNA 序列测定结果显示:miRFP670 基因成功插入至pET-28a 载体中的EcoR Ⅰ位点(GAATTC), 证明重组质粒pET-miRFP670 构建成功(图2A)。在重组质粒pET-miRFP670 基础上, 通过点突变将LyP-1 的DNA 序列插入至miRFP670 基因序列的C 端, 构建pET-miRFP670-LyP1 原核表达载体。LyP-1 的基因序列成功插入至miRFP670 基因序列的C 端, 且未发现其他位点的突变, 证明pET-miRFP670-LyP1 原核表达载体构建成功, 测序结果见图2B。

图1 pET-28a 原核表达载体和miRFP670-M 质粒双酶切(A)及重组质粒pET-miRFP670 和pET-miRFP670-LyP1的双酶切鉴定(B)电泳图Fig. 1 Double digestion electrophoregram of pET-28a prokaryotic expression vector and miRFP670 plasmid(A)and identification electrophoregram of double digestion of recombinant plasmid pET-miRFP670 and pET-miRFP670-LyP1(B)

图2 重组质粒pET-miRFP670 (A) 和pET-miRFP670-LyP1 (B)的测序结果Fig. 2 Sequencing results of recombinant plasmids pETmiRFP670 (A)and pET-miRFP670-LyP1 (B)
2.2 miRFP670-LyP1 融合蛋白的原核表达情况
将测序正确的pET-miRFP670-LyP1 质粒转化至BL21 大肠杆菌感受态细胞。探索37 ℃(5 h)和16 ℃(18 h)2 种温度条件下miRFP670-LyP1 融合蛋白的原核表达情况, SDS-PAGE 电泳结果显示:2 种条件下, 在相对分子质量为35 000 附近均出现了明显的蛋白条带, 且16 ℃(图3A)条件下菌体细胞裂解液上清中的目的蛋白表达量明显多于37 ℃(图3B), 证明低温诱导可增加miRFP670-LyP1 融合蛋白的可溶性表达。
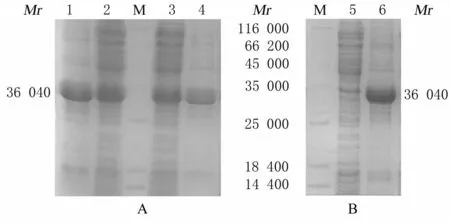
图3 16 ℃(A)和37 ℃(B)时miRFP670-LyP1 蛋白原核表达SDS-PAGE 电泳图Fig. 3 SDS-PAGE electrophoregram of prokaryotic expressions of miRFP670-LyP1 protein at 16℃ (A) and 37 ℃(B)
由于不同浓度IPTG 对蛋白表达情况影响较大, 本研究比较了16 ℃、IPTG 终浓度为0.5 和0.1 mmol·L-1时, miRFP670-LyP1 融 合 蛋 白 在 菌体细胞裂解液上清中的表达量, 结果表明融合蛋白表达量无明显差异。表达在菌体细胞裂解液上清中的目的蛋白更易被纯化, 因此本研究后续采用16 ℃、IPTG 终浓度为0.1 mmol·L-1诱导过夜的条件行菌液的扩大培养。
2.3 纯化后miRFP670-LyP1 融合蛋白表达
miRFP670-LyP1 融合蛋白的C 端带有组氨酸标签, 因此采用Ni-NTA 树脂利用亲和层析的方式进行蛋白纯化。菌体细胞裂解液上清与Ni-NTA 树脂结合后, 经多次洗涤, 3 次洗脱, 获得含有目的蛋白的洗脱液。经纯化后在相对分子质量约为35 000 位置存在2 条单一较粗的蛋白条带, 蛋白条带的相对分子质量与预期miRFP670-LyP1 融合蛋白的相对分子质量相符, 初步确定为miRFP670-LyP1 融合蛋白。见图4。
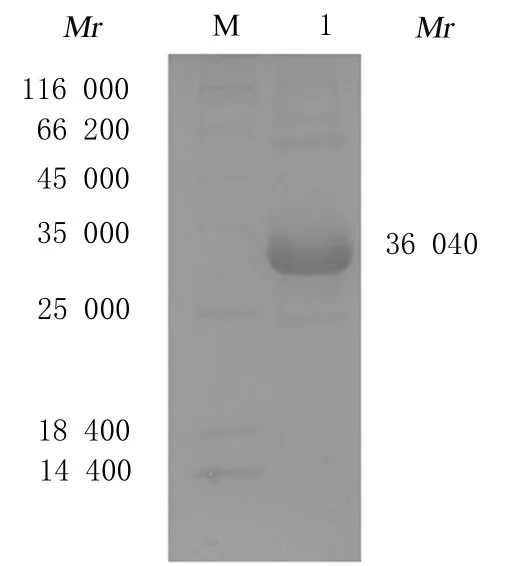
图4 纯化后miRFP670-LyP1 融合蛋白表达SDSPAGE 电泳图Fig. 4 SDS-PAGE electrophoregram of expression of miRFP670-LyP1 protein after purification
2.4 miRFP670-LyP1 融合蛋白的细胞内吞形态表现将miRFP670-LyP1 融合蛋白和乳腺癌4T1 细胞共孵育4 h, 荧光显微镜下观察miRFP670-LyP1融合蛋白的细胞内分布情况, 结果显示:在乳腺癌4T1 细胞的细胞核周围检测到NIRFP, 提示miRFP670-LyP1 融合蛋白可被乳腺癌4T1 细胞高效内吞。见图5。

图5 荧光显微镜下乳腺癌4T1 细胞中miRFP670-LyP1 蛋白的细胞内吞形态表现(Bar=20 μm)Fig. 5 Morphology of endocytosis of miRFP670-LyP1 protein in breast cancer 4T1 cells under fluorescence microscope(Bar=20 μm)
3 讨 论
与核磁共振成像、X 射线计算机断层扫描和正电子发射断层扫描比较, 荧光成像不需要高能电离辐射, 且操作简单, 被广泛应用于生命科学和生物医学领域。目前, 用于NIR 荧光成像的材料主要包括 量 子 点[19]、 上 转 换 纳 米 粒 子(upconversion nanoparticles, UCNP)[20]和 有 机 小 分 子 染 料[21]等。吲哚菁绿(indocyanine green, ICG) 是美国食品和药物管理局唯一批准用于医学诊断的近红外荧光染料, 但其光稳定性较低[22]。用于近红外荧光成像的量子点中含有金属离子[23], 可能具有长期毒性[24]。此外, 这些荧光成像材料的体内降解也是不容忽视的问题。开发用于癌症治疗与诊断的新材料具有重要的应用前景。
具有近红外荧光特性的荧光蛋白的发射窗口为700~1 700 nm, 具有较近红外荧光染料低的荧光强度。因NIRFP 具有较好生物相容性、可降解性和深层组织穿透能力, 近年来在活体成像领域得到越来越多的关注。目前已报道的大部分NIRFP 源自于沼泽红假单胞菌和蓝藻捕光藻胆蛋白[6, 25]。哺乳动物细胞中血红素降解为胆红素过程的中间产物— 胆 绿 素(biliverdin, BV) 是NIRFP 的 发 色团[26]。单体近红外荧光蛋白体内亮度略低于二聚体近红外荧光蛋白, 但单体近红外荧光蛋白的相对分子质量较小, 因此可作为标签蛋白对近红外荧光标记的蛋白质进行示踪研究。已报道的NIRFP 大多用于细胞水平成像研究[27-28], 由大肠杆菌和酵母等宿主表达的NIRFP 用于体内生物成像的报道较少, NIRFP 作为外源性荧光探针的应用仍然是个挑战。
THPs LyP-1 靶向蛋白P32 在乳腺癌、子宫内膜腺癌和黑色素瘤等肿瘤组织中高表达[12], 因此本研究采用LyP1 的肿瘤靶向特性构建miRFP670-LyP1 融合蛋白的表达载体, 制备具有肿瘤靶向及荧光成像特性的miRFP670-LyP1 融合蛋白。本研究中荧光成像检测结果显示:在640 nm 的激发光源的照射下, 融合蛋白miRFP670-LyP1 发出明亮的近红外红光, 说明THPs LyP-1 的引入未影响近红外荧光蛋白miRFP670 的近红外发光特性。本研究中荧光显微镜成像结果显示:融合蛋白可被小鼠乳腺癌4T1 细胞高效内吞, 显示出作为肿瘤靶向荧光探针的潜力。
本研究成功构建了miRFP670-LyP1 融合蛋白的原核表达载体, 在大肠杆菌中成功表达后, 通过亲和层析的方式得到高纯度的miRFP670-LyP1 融合蛋白。具有近红外荧光特性的miRFP670-LyP1融合蛋白可被乳腺癌细胞高效内吞。本研究为开发靶向肿瘤的新型示踪试剂提供了重要参考。
