富血小板纤维蛋白和羟基磷灰石复合物的制备方法及其性能评价
2022-12-15张庆宇徐庭瑞矫君君夏德庚张天翼
张庆宇, 徐庭瑞, 矫君君, 夏德庚, 张天翼, 张 莉, 马 宁
(1. 吉林大学口腔医院急诊科, 吉林 长春 130021;2. 吉林大学口腔医院牙周科, 吉林 长春 130021)
口腔颌面部的牙槽骨等骨组织可因炎症、肿瘤和外伤等引起不同程度的吸收或缺失, 自体骨移植是颌骨缺损修复的“金标准”, 但骨量来源有限、供区损伤和受区再吸收等缺点限制了其应用[1]。异种骨替代材料(xenogenic bone substitute material, XBSM) 已有超过30 年的发展历史, 优异的生物相容性、骨传导性和较为低廉的成本共同促进了XBSM 在口腔临床中的应用[2]。尤其是动物骨骼来源的羟基磷灰石(hydroxyapatite, HA)是临床上最常用的XBSM, 为天然骨经过清洗、切割、研磨和脱脂等系列处理后制成[3-4], 与人类骨骼的无机成分构成相似, 具有天然的多孔支架结构且吸收速率缓慢[5], 但由于缺乏骨诱导性且颗粒之间无黏着力, 植入体内时常与其他材料复合应用。富血小板纤维蛋白(platelet-rich fibrin, PRF) 是经过离心工艺制成的含有超生理浓度血小板的血液浓缩制品, 属于第2 代血小板浓缩物, 可在数周内持续释放多种生长因子, 且将其压制为薄膜后可对成骨支架材料起到一定的包裹作用[6]。PRF 在使用时多被直接覆盖在HA 表面, 这使生长因子主要集中在靠近PRF 的区域内被释放, 包裹不严密时还易出现HA 颗粒的撒漏。近年来, 随着相关研究的深入, 出现了改良型PRF(advanced-PRF, A-PRF)和可注射型PRF(injectable-PRF, I-PRF)等新型血小板浓缩物[7]。与传统PRF 制备工艺比较, A-PRF 降低了离心速度并增加了离心时间, 凝块中含有更多细胞因子和自体细胞, 且细胞的分布更加均匀[8];而I-PRF 不仅进一步降低了离心速度, 还减少了离心时间, 这使其同时具有更高的生长因子释放量和短时流动性, 可在凝固前与其他材料充分混合并在凝固后起到黏附作用[9]。目前国内外对A-PRF 和I-PRF 的研究较少, 且主要为关于其本身性能的单纯性研究, 尚未见将二者与成骨支架材料制备成复合物的相关报道。本研究首次采用模拟“三明治”制作工艺将A-PRF、I-PRF 和HA 进行复合, 可同时获得2 种新型PRF 的高生长因子释放能力和I-PRF 的流动性, 构建出兼具一定外形可塑性和稳定性的复合物, 并对其结构和性能进行观察及检测, 为颌骨缺损修复的进一步研究提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器普通级日本大耳白兔(长春市亿斯实验动物技术有限责任公司), 动物生产许可证号:SCXK(吉)2016-0004。模拟体液(simulated body fluid, SBF)(青岛捷世康生物科技有限公司)、DMEM 培养基(美国赛默飞世尔科技公司)、 胎牛血清(fetal bovine serum, FBS)(美国Clark Bioscience 公司)和CCK-8 试剂盒(苏州新赛美生物科技有限公司)。低速离心机(上海尚普仪器设备有限公司)、无添加型塑料采血管(山东天爱医疗器械有限公司)、冷冻干燥机(日本东京理化器械株式会社)、扫描电子显微镜(scanning electron microscope, SEM)(德国蔡司集团)、牙片机(延吉迪智特医疗器械有限公司)和锥形束CT(cone beam CT, CBCT) 机(德国卡瓦集团)。
1.2 PRF-HA 复合物的制备制作PRF 的血液取自本研究课题组成员, 供者均体健, 年龄23~25 周岁, 无吸烟或酗酒等不良嗜好。每单位材料制作时, 抽取15 mL 血液分别加入3 支无添加型塑料采血管中, 其中1 支配平后以700 r·min-1的转速离心3 min 制备I-PRF, 同时将另外2 支在另一离心机中1 300 r·min-1离心14 min 制备A-PRF。I-PRF制备完成后采用1 mL 注射器抽出, 滴在HA 上与之充分混合, A-PRF 倒入手术盘并采用眼科剪取材。待I-PRF 和HA 混合物凝固后, 将其置于2 片A-PRF 凝块之间, 即采用A-PRF 作为“面包片”, I-PRF 和HA 作为“馅料”, 复合形成类似“三明治”的结构, 即PRF/HA 复合物。采用无菌纱布挤压材料使血清析出, 修整外形备用。
1.3 SEM 观察PRF/HA 复合物横断面的微观结构将采用“三明治”法制备的PRF/HA 复合物置于-80 ℃超低温冰箱预冻, 然后移入冷冻干燥机抽干48 h, 去除水分。溅射喷金后采用SEM 在50 和300 倍视野下分别观察材料横断面的微观结构。
1.4 SBF 浸泡测定样品的矿化能力将每单位PRF/HA 复合物浸入10 mL SBF 之中, 并置于37 ℃恒温环境下, 在浸泡的第2、4、8 和16 天, 分别将材料中HA 取出, 采用“1.3”步骤中方法冷冻干燥。采用SEM 观察样品表面形态表现, 评估矿化结节和类骨层生长状况以检测复合物中HA的矿化能力。
1.5 CCK-8 法检测各组细胞增殖活性将1 单位PRF/HA 复 合 物 浸 入50 mL 含90% DMEM 和10% FBS 的完全培养基中, 于37 ℃恒温浸泡72 h, 离心后取上清液抽滤, 获得浸提液。在96 孔细胞培养板中, 分别以复合物浸提液和完全培养基与小鼠前成骨MC3T3-E1 细胞共同培养, 作为实验组和对照组, 每孔设5 复孔。培养至第1、3 和5 天时, 向每孔加入10 μL CCK-8 试剂, 于培养箱内恒温孵育后, 采用酶标仪测定各孔在波长450 nm 处的吸光度(A)值。以A 值代表细胞增殖活性并绘制柱状图, 比较各时间点实验组和对照组的A 值。
1.6 建立兔颅骨缺损模型检测成骨效果取6 只4 月龄的健康日本大耳白兔, 体质量为2.5~3.0 kg。适应性饲养1 周后, 采用盐酸塞拉嗪(商品名速眠新Ⅱ)臀大肌注射进行全身麻醉, 并在头部术区注射盐酸利多卡因进行局部麻醉。采用手术刀在兔颅顶正中切开1 个长约4 cm 且深达骨面的全层切口, 向外侧分离软组织后采用直径为6 mm 的环形孔钻在矢状缝两侧对称制造2 处颅骨缺损, 暴露出硬脑膜。将“三明治”法制备的PRF/HA 复合物置于左侧缺损区作为实验组, 右侧缺损区不植入任何材料作为对照组。术后3 d 内, 每日2 次肌肉注射庆大霉素4×104U。于术后4 和8 周各处死3 只日本大耳白兔, 取其颅骨, 采用牙片机和CBCT 机扫描术区, 根据平片和三维重建的成像结果, 观察骨缺损的愈合状况, 评价各组骨缺损模型的成骨效果。
1.7 统计学分析采用R 软件进行统计学分析和绘图。各组细胞增殖活性服从正态分布, 以±s表示, 样本均数组间两两比较采用两独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 “三明治”结构的PRF/HA 复合物的制备成功制备I-PRF 和A-PRF, I-PRF 离心完成后初期为具有一定流动性的淡黄色液体, 与HA 混合5~10 min 后凝固为胶冻状, HA 颗粒被包裹其中, A-PRF 离心完成即为淡黄色凝块(图1A~1C)。纱布挤压后, 3 层材料相互粘结成“三明治”结构(图1 D)。

图1 PRF/HA 复合物的制备Fig.1 Preparation of PRF/HA complex
2.2 PRF/HA 复合物横断面的微观结构SEM 观察材料横断面, 可见明显的三层结构。外侧两层A-PRF 较为致密, 为相互交织的纤维蛋白丝所构成的网状结构;中间一层主要成分为多孔且形状不规则的HA 颗粒, I-PRF 的纤维蛋白丝黏附和充填于颗粒之间、表面和孔隙中。见图2。

图2 SEM 观察PRF/HA 复合物横断面的微观结构Fig. 2 Microstructures of cross-section of PRF/HA complex observed by SEM
2.3 PRF/HA 复合物的矿化能力在SBF 中浸泡第2 天时, HA 表面即可见散在的矿化结节形成;第4 天时, 随着浸泡时间的延长, 矿化结节增大, 颗粒状类骨层继续生长;第8 天时, 类骨层形成花瓣状外形, 结构更为致密;第16 天时, HA 表面沉积的矿化成分已出现相互融合, 呈现出片层状结构。见图3。

图3 SBF 中浸泡不同时间后SEM 观察PRF/HA 复合物的微观结构(Bar=5 μm)Fig. 3 Microstructures of PRF/HA complex after immersed in SBF for different time points observed by SEM(Bar=5 μm)
2.4 作用不同时间各组MC3T3-E1 细胞的增殖活性与对照组比较, 第1 天(t=2.492,P<0.05)、第3 天(t=2.553,P<0.05) 和 第5 天(t=3.713,P<0.01) 实验组细胞增殖活性均明显升高, 提示PRF/HA 复合物浸提液对MC3T3-E1 细胞的增殖具有促进作用。见图4。
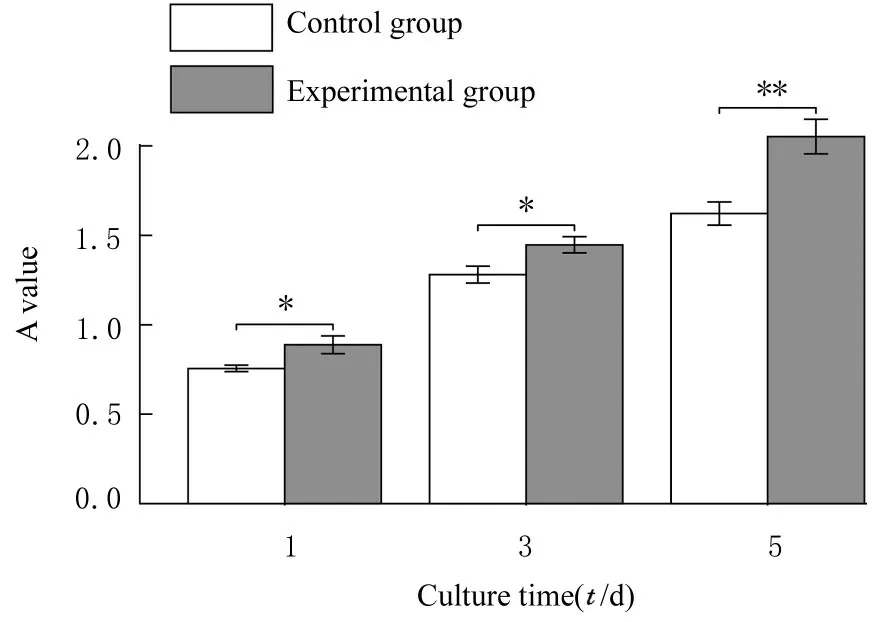
图4 各组MC3T3-E1 细胞的增殖活性Fig. 4 Proliferation activities of MC3T3-E1 in various groups
2.5 PRF/HA 复合物在各组日本大耳白兔体内的成骨效果成功构建日本大耳白兔的颅骨缺损模型, 并在实验组植入PRF/HA 复合物(图5)。术后7 d 拆除缝线, 6 只白兔伤口愈合状况均良好, 此后体质量逐渐增加并存活至预定处死时间。大体观察:各组白兔所取样本均有不同程度新骨形成, 实验组白兔骨颅骨按压时较对照组饱满。X 射线平片检查:术后4 周, 实验组白兔骨缺损区域边缘不规则, 内部有明显的颗粒状高密度阻射区域, 对照组则仅有模糊的云雾状影像(图6A);术后8 周, 实验组白兔骨缺损区域与周围正常骨组织界限较模糊, 对照组则仍存在明显的低密度区(图6B)。CBCT 检查:术后4 周, 实验组白兔颅骨缺损部位边缘可见新骨形成, 中央为散在分布的HA 颗粒, 对照组则仅有少量边缘成骨(图7A);术后8 周, 实验组白兔新生骨显著增多, 并与HA 颗粒相融合, 几乎完全充填骨缺损区, 对照组白兔新骨形成范围较实验组小(图7B)。
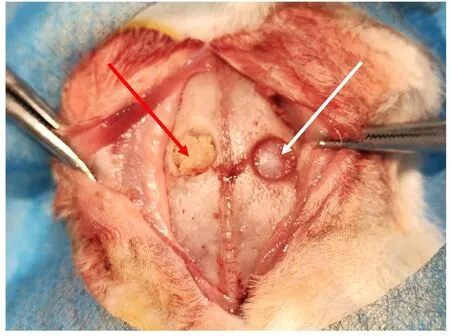
图5 白兔颅骨缺损模型的建立和材料植入Fig. 5 Establishment of cranial defect model and implantation of material of white rabbits
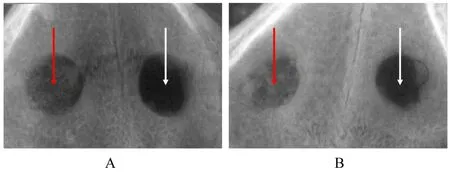
图6 术后4 和8 周时2 组白兔颅骨缺损的X 射线图像Fig. 6 X-ray images of cranial defect of white rabbits 4 and 8 weeks after operation in two groups
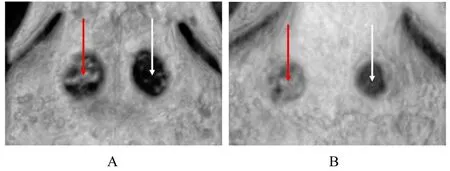
图7 术后4 周和8 周时白兔颅骨缺损的CBCT 图像Fig. 7 CBCT images of cranial defect of white rabbits 4 and 8 weeks after operation
3 讨 论
口腔颌面部的硬组织增量至今仍无完美的实现方案, 较为理想的骨修复材料不仅应具备良好生物相容性、生物活性、可降解性、骨传导性和骨诱导性等生物学性能以及适当的强度等机械性能, 还应来源广泛、易于获取[10]。HA 具有类似于人类骨骼的微观结构, 为成骨相关细胞的迁移和增殖提供了较为适宜的微环境, 在引导性骨再生(guided bone regeneration, GBR)技术中应用广泛[11], 但骨诱导性的缺乏减缓了受植区域的骨愈合过程, HA 与能够释放生长因子的成分联合或复合成为一个潜在研究方向[12]。PRF 作为一种制备简便的自体生长因子载体, 已被广泛应用于多个医学领域, 在骨缺损修复中的传统使用方法为将其压制成薄膜后直接覆盖于植骨区的支架材料表面, 但由于HA颗粒相互之间缺乏黏着力, 当覆盖不严密、缺损形状不规则或范围过大时稳定性较差, 可能会出现颗粒的移位甚至丢失。与传统PFR 的制备工艺比较, A-PRF[13]和I-PRF[14]通过降低离心速度减小了相对离心力(relative centrifugal force, RCF), 产物中各种生长因子的释放量增加, 且I-PRF 在离心完成后的数分钟内仍具有流动性, 因而可以与其他材料充分混合并在凝固后将其包裹[15]。本研究中, 通过模拟“三明治”的制作方法, 利用I-PRF 的凝固过程将HA 黏着成团, 并采用2 片A-PRF 从两侧进行包裹, 所制成的PRF/HA 复合物具有一定外形可塑性和稳定性, 材料整体可根据缺损区域的外形进行压实, 还可避免植入后的颗粒撒漏, SEM观察结果也证实HA 颗粒表面和间隙中均有I-PRF存在。
SBF 中钙离子(Ca2+)、镁离子(Mg2+)、钠离子(Na+)、 钾离子(K+)、 磷酸氢根离子(HPO42-)和硫酸根离子(SO42-)等离子浓度与人类血浆中相应离子浓度基本一致[16], 经其浸泡后能在表面形成磷灰石的材料通常也可在动物模型中产生类似的效果[17], 故可在体内实验前对支架材料的骨生物活性进行初步筛选和评价, 以减少不必要的动物消耗[18]。本研究结果显示:随着浸泡时间的延长, 复合物中HA 表面的磷灰石样的矿化结节和类骨层不断生长, 证实了其具有良好的矿化潜能。
骨再生的过程受转化生长因子β(transforming growth factor-β, TGF-β)、胰岛素样生长因子(insulin-like growth factor, IGF) 和血管内皮生长因 子(vascular endothelial growth factor, VEGF)等多种生物活性物质的调控[19], PRF 在纤维蛋白交织成的三维支架中保留了大量细胞因子, 并可随时间推移而逐渐释放[20]。本研究采用MC3T3-E1细胞进行体外实验结果显示:实验组细胞增殖活性较对照组高, 提示PRF/HA 复合物具有良好的生物相容性, 所释放的生长因子可加速骨愈合相关细胞生长, 促进骨组织的修复再生。
兔颅骨缺损模型的制备方法成熟且效果易于观察, 是体内评估骨修复材料性能最常用的动物模型之一[21]。本研究采用日本大耳白兔建立了2 处直径为6 mm[22]的圆孔形全层颅骨缺损, 并将实验总时长设置为8 周, 材料植入后术区未出现明显不良反应, 影像学观察的结果证实材料中的HA 成分未出现快速降解, 且不同时间点实验组白兔成骨效果均优于对照组;上述结果提示: 材料中的HA 为成骨过程提供支架, 同时伴随着PRF 中生长因子的持续释放, 使PRF/HA 复合物同时具备良好的骨传导性和骨诱导性。
本研究采用“三明治”法成功制备PRF/HA复合物, 其不仅具有良好的生物相容性, 在植入实验动物体内后也表现出加速骨骼再生的作用。但该材料尚未搭载种子细胞, 与理想的骨组织工程支架尚有差距, 本课题组将在后续研究中对其进行进一步的探讨和完善。
