基于网络药理学探讨杜仲-菟丝子治疗骨质疏松的作用机制*1
2022-12-15单文婷通讯作者
王 潇 单文婷 魏 鑫 刘 霞(通讯作者)
(贵州中医药大学,贵州 贵阳 550025)
骨质疏松是一种骨量减少、骨微结构退化、导致骨脆性增加的全身性骨骼疾病,属于中医“骨痹”范畴,其临床症状表现为乏力、疼痛、乃至全身骨痛,严重影响患者生活质量,成为一个常见的危害公共健康的问题[1]。目前,西医治疗以激素及钙剂为主[2],但长期使用可耐药,且并不能显著改善患者的预后,寻求骨质疏松症的中医治疗显得尤为重要[3]。杜仲和菟丝子是传统医学中常用的补肾类药物,均有促进骨形成、抑制骨吸收的功效,用于治疗骨质疏松疗效肯定,但具体作用机制尚不清楚[4],网络药理学是一种以系统药理学为基础,研究药物与疾病相互作用的新兴学科[5]。在网络药理学中,药物-靶点网络使研究人员探究药物治疗疾病的作用机制更加简洁。疾病靶点可应用于药物设计、药物发现和生物标志物检测领域[6]。基于此,本研究运用网络药理学手段,尝试构建“成分-靶点-通路-疾病”多维网络,从而探索杜仲和菟丝子治疗骨质疏松的潜在分子机制,为杜仲和菟丝子的临床应用以及骨质疏松相关疾病基础与临床研究提供一定的理论依据。现报告如下。
资料与方法
1方 法
1.1 杜仲-菟丝子药物活性成分及靶点的收集:采用TCMSP数据库及查阅相关文献,以口服生物利用度(Oral bioavailability,OB)≥30%,类药性(Drug likeness,DL)≥0.18作为活性成分筛选标准,筛选杜仲和菟丝子的有效成分及药物靶点。
1.2 杜仲-菟丝子靶点的获取:基于TCMSP 2.3,将杜仲和菟丝子的多个活性成分与潜在作用靶点逐个配对,筛选结束后,把杜仲和菟丝子活性成分作用的蛋白质通过UniProt蛋白数据库(https://www.uniprot.org)进行标准化,随后得到靶点蛋白的官方名称,以此杜仲和菟丝子活性的作用靶点可以进行预测。
1.3 骨质疏松靶点的获取:用“osteoporosis”作为关键词,在人类孟德尔遗传数据库OMIM、Drugbank、GeneCards、PharmGkb、TTD数据库中检索,得到骨质疏松疾病的相关靶点。与上述杜仲和菟丝子活性成分预测作用靶点取交集,得到杜仲和菟丝子治疗骨质疏松的作用靶点。
1.4 “中药-有效成分-靶点-疾病”网络的构建:利用Cytoscape3.9.0软件构建“中药-活性成分-交集靶点-疾病”调控网络图,并进行拓扑分析,药效成分与靶点的重要性将通过Cytoscape 3.9.0软件中计算连接度(Degree)参数来评判。
1.5 蛋白互作网络的构建与分析:将杜仲和菟丝子治疗骨质疏松的潜在作用靶点输入STRING数据库(https://string-db.org/),物种设定为“Homo sapiens”,获得蛋白与蛋白之间的相互作用关系,将数据保存为TSV格式,获得PPI网络信息,把node1、node2和Combine score信息导入Cytoscape3.9.0,绘制PPI网络并进行拓扑分析。
1.6 富集分析:为了研究与潜在目标相关的生物学功能,我们通过“clusterProfiler”R包进行了基因本体论(GO)和京都基因和基因组百科全书(KEGG)通路富集分析。“clusterProfiler”R包作为一种富集工具,具有基于多种资源的集成基因聚类分析。GO富集分析从3个维度对基因进行解释和注释,包括细胞成分(CC)、分子功能(MF)和生物过程(BP)分析。KEGG数据库主要用于通路分析。P<0.05被认为具有统计学意义。
2结 果
2.1 中药化合成分及靶点的获取:杜仲有28个化学成分,菟丝子有11个化学成分,2个药物共有31个化合成分,211个药物靶标。见图1。

图1 化合成分-靶点网络图
2.2 疾病靶点的获取:1322个疾病靶点与211个药物靶标取交集后,共获得83个差异基因,见图2。
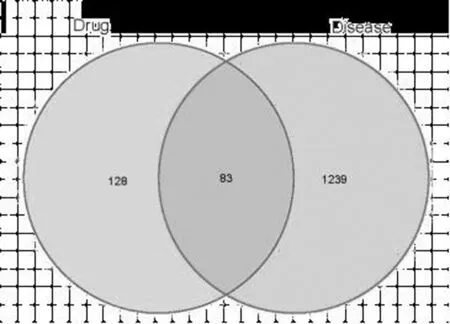
图2 药物靶点与疾病靶点的韦恩图
2.3 “中药-有效成分-靶点-疾病”网络的构建及主要有效成分筛选:使用Cytoscape3.9.0绘制杜仲和菟丝子有效成分治疗骨质疏松的基因网络图。基于杜仲和菟丝子活性成分与骨质疏松疾病靶点的相互作用,采用Cytoscape软件构建“药物-活性成分-交集靶点-疾病”网络,图中113个节点分别代表药物、疾病、交集靶点、活性成分等,220个线代表2节点之间的互作关系。结果显示,其中度值前5的药物分别是槲皮素(quercetin),山奈酚(kaempferol),β-胡萝卜素(beta-carotene),异鼠李素(isorhamnetin),丁香花素(Syringetin),度值前5的靶点是前列腺素内过氧化物合成酶2(PTGS2),核受体辅激活蛋白2(NCOA2),心脏钠通道(SCN5A),前列腺素内过氧化物合成酶1(PTGS1),二肽酶4(DPP4)。见图3。
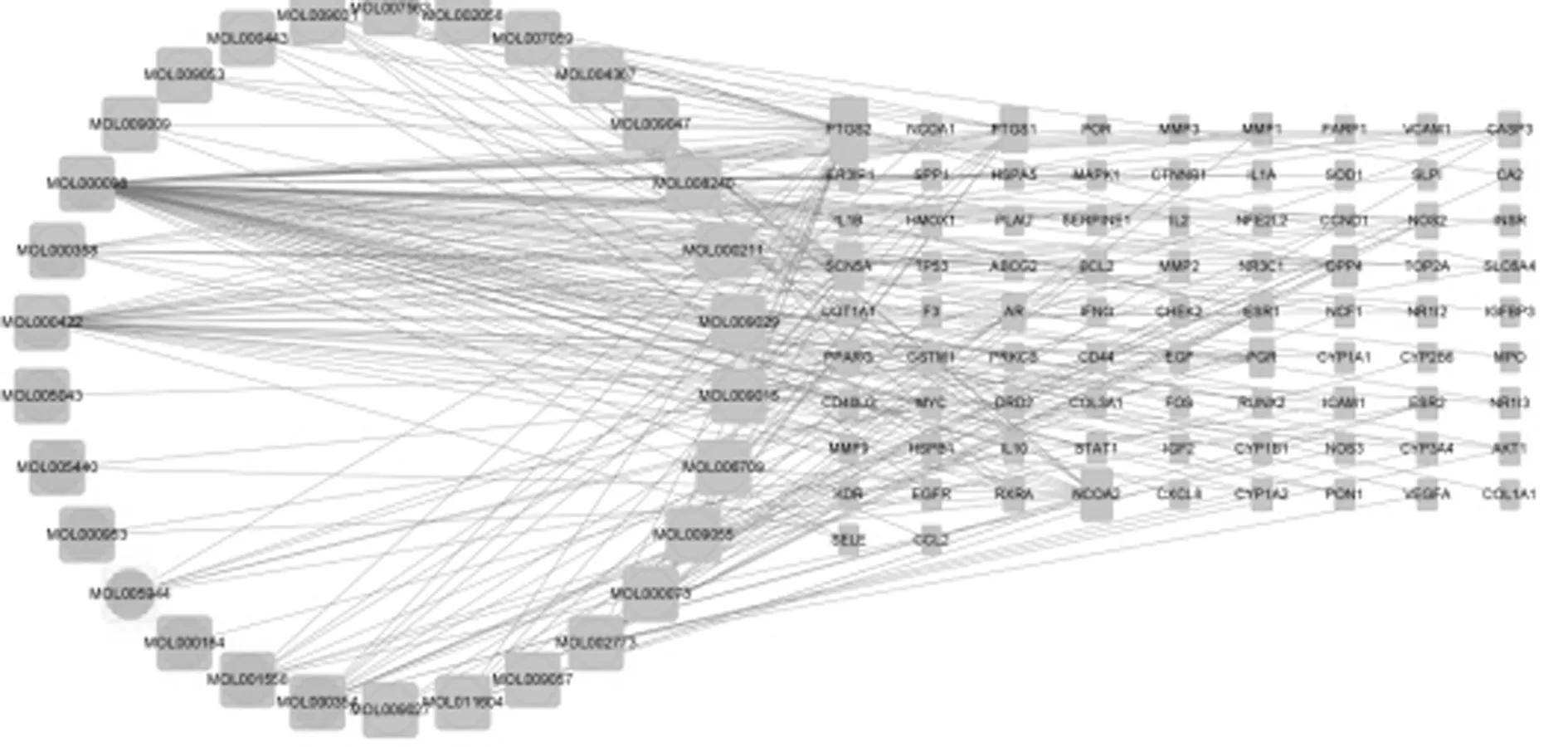
图3 中药-有效成分-靶点-疾病网络图
2.4 蛋白互作网络的构建与分析:图中节点为交集靶点蛋白,边为蛋白之间的互作关系,共有76个节点、456条边构成,根据度值排序,蛋白激酶(Akt1)、原癌基因c-FOS(FOS)、雌激素受体α基因(ESR1)、钙黏蛋白相关蛋白(CTNNB1)、肿瘤抑制蛋白(TP53)、促分裂原活化蛋白激酶1(mapk1)、类视黄醇X受体(RXRA)、表皮生长因子受体(EGFR)、核受体辅激活蛋白1基因(NCOA1)、白介素10(IL10)度值较高,可能是在杜仲和菟丝子治疗骨质疏松中发挥重要作用的核心靶点。见图4。

图4 PPI蛋白互作网络的构建与分析
2.5 富集分析:基因本体(GO)分析结果显示,生物过程(BP)涉及对药物的反应,对氧化应激的反应,细胞对化学压力的反应、活性氧代谢过程、对金属离子的反应、对活性氧的反应、生殖结构发育、生殖系统发育、对类固醇荷尔蒙的反应、细胞对氧化压力的反应。细胞成分(CC)涉及膜筏、膜微域、膜区、洞室、质膜筏子、焦点粘附、细胞-基质交界处、囊泡腔、血小板α颗粒腔体、转录调节器复合体。分子功能(MF)涉及核受体活性、配体激活的转录因子活性、DNA结合的转录因子结合、血红素结合、四吡咯结合、氧化还原酶活性、RNA聚合酶II特异性DNA结合转录因子结合、核受体结合、核荷尔蒙受体结合、激素受体结合、整合素结合。见图5。
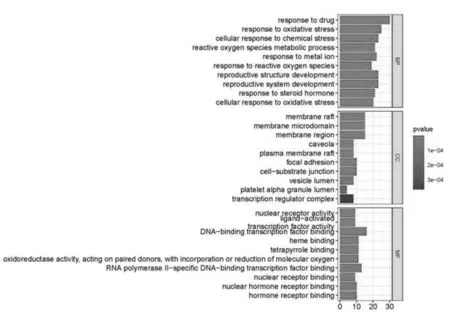
图5 GO分析条形图
2.6 京都基因与基因组百科全书(KEGG)分析结果表明:杜仲和菟丝子治疗骨质疏松的信号通路包括对药物的反应、对氧化应激的反应、细胞对化学压力的反应、活性氧代谢过程、对金属离子的反应、对活性氧的反应、生殖系统发育、对类固醇、荷尔蒙的反应、细胞对氧化压力的反应、对营养水平的反应、对脂多糖的反应、对源自细菌的分子的反应、多多细胞生物体过程、腺体发育、活性氧的生物合成过程、细胞对无机物的反应、细胞对金属离子的反应、上皮细胞增殖、对氧含量的反应、对有毒物质的反应、血管生成的正向调节、细胞对活性氧的反应、对雌性激素的反应、细胞对镉离子的反应、一氧化氮代谢过程、凋亡信号通路的负向调节、血管发育的正向调节、血管生成的调节。见图6。
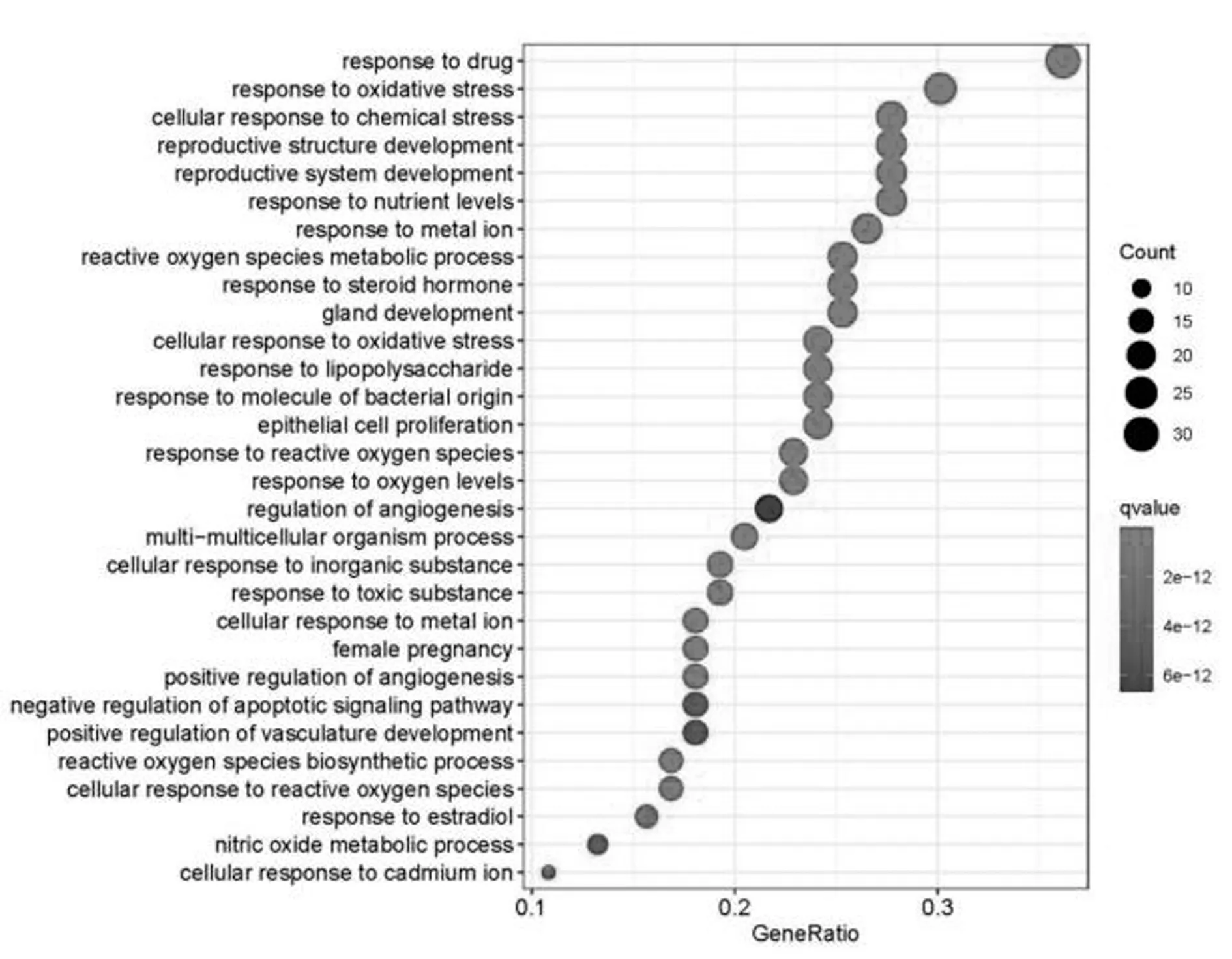
图6 KEGG分析气泡图
讨 论
骨质疏松是一种骨骼强度降低的常见骨骼疾病,随着年龄的增长,骨质疏松患者骨折的风险会逐步提高,后期有较高的伤残率和死亡率。骨质疏松的发生既有遗传性因素,也有非遗传性因素。非遗传因素包括一般环境的特征,如吸烟、营养、其他疾病,以及跌倒等直接相关的因素。与骨质疏松相关的遗传因素是那些决定骨量、骨大小、结构、微结构和内在特性的基因。已被确定为可能调节骨量的候选基因,包括AKT1[7],FOS[8],ESR1[9],CTNNB1[10],TP53[11]等。从各种基因的相互作用对骨骼强度和骨质量产生影响,骨质疏松的研究越来越复杂。这种复杂性使得骨质疏松症的治疗更加困难,但同时扩大了新药物靶点的可能性。
本研究表明,槲皮素(quercetin),山奈酚(kaempferol),β-胡萝卜素(beta-carotene),异鼠李素(isorhamnetin),丁香花素(Syringetin)等物质是杜仲和菟丝子中含有骨质疏松靶点较多的成分。其中,槲皮素是一种黄酮类化合物,已证明对衰老引起的骨质疏松有较好治疗作用[12]。槲皮素的各项研究均表明槲皮素具有改善骨小梁结构、增强骨密度、预防骨质疏松的作用[13-14]。山奈酚是从姜科植物山奈根茎提取的一种黄酮类化合物,具有抗癌防癌、抗菌、抗炎等多种药理作用[15-16]。山萘酚能明显改善骨质疏松大鼠骨小梁形态结构,减少骨量丢失以达到治疗骨质疏松的目的[17]。Kim[18]等研究发现山奈酚能够补钙、改善骨微结构、提升骨密度。β-胡萝卜素是属于类胡萝卜素之一,是一种橘黄色的脂溶性化合物,具有抗氧化、提升免疫功能的特性[19]。相关实验已经证明了β-胡萝卜素可保护细胞不受氧化剂的伤害,显著提高人体内抗氧化水平[20]。在基础研究方面,胡萝卜素可以抑制破骨细胞生成,刺激成骨细胞的增殖[21-22]。异鼠李素是一种植物类黄酮,具有抑制血小板聚集、降低胆固醇和抗氧化的作用[23]。有研究发现,异鼠李素可以通过抑制JNK、AKT/IKKα/β的活化来抑制NF-κB信号通路的激活[24-25]。晁杲[26]等通过去卵巢大鼠的实验发现,异鼠李素可以调节RANKL/RANK/OPG信号通路,促进骨保护素OPG的表达,抑制RANKL/RANK(NFκB)信号通路活。丁香花素为一种黄酮类衍生物,已有研究确定其对破骨细胞分化和骨吸收活性的抑制作用,此外,还发现丁香花素可以恢复成骨细胞-破骨细胞相互作用的平衡[27]。上述研究均说明槲皮素、山奈酚、胡萝卜素、异鼠李素、丁香花素有治疗骨质疏松的潜力。PPI结果显示,蛋白激酶(Akt1),原癌基因c-FOS(FOS),雌激素受体α基因(ESR1),钙黏蛋白相关蛋白(CTNNB1)等关键靶点参与了骨质疏松的发展,且能被杜仲和菟丝子所干预。激活蛋白激酶可以发挥多种生物效应[28],如调控细胞的生长,参与细胞凋亡等细胞过程[29]。蛋白激酶是可以控制成骨细胞和破骨细胞分化的独特信号,在缺少蛋白激酶的情况下,成骨细胞增长明显减少[30]。原癌基因是成骨细胞分化增殖的中的关键调控基因[31]。近年来,通过对动物的体内体外实验证实,FOS基因蛋白的表达对骨转化有非常重要的作用[32-33]。雌激素受体α基因不仅可以调节脂质代谢[34],而且可以抑制破骨细胞活性,对生殖功能和骨组织中也起着重要作用,参与了包括乳腺癌、子宫内膜癌和骨质疏松症在内的多种病理过程[35]。钙黏蛋白相关蛋白是典型Wnt信号通路的主要介质,在之前研究中发现,前期时成骨细胞前体中钙黏蛋白相关蛋白促进了软骨细胞的形成[26]。在后期,成熟成骨细胞或骨细胞中钙黏蛋白相关蛋白的缺失间接增加了破骨细胞分化和骨吸收,导致骨量减少[37]。动物实验也表明,CTNNB1的激活会促进小鼠骨质疏松模型的骨形成[38]。因此,研究蛋白激酶,原癌基因,雌激素受体α基因,钙黏蛋白相关蛋白等靶点的表达和调控对骨质疏松症的发病机制和治疗具有重要意义。KEGG结果表明,杜仲、菟丝子对骨质疏松患者氧化应激的反应、荷尔蒙的反应、类固醇、凋亡信号通路、雌性激素的反应等信号传导途径有较好的调控作用。氧化应激是指体内氧化与抗氧化作用失衡的一种状态[39]。目前许多研究已经证实,氧化应激在代谢过程不断产生的活性氧(ROS)就是导致骨质疏松发生的根本原因之一[40-41]。研究表明,氧化应激可以抑制骨髓中成骨细胞的分化,刺激破骨细胞的分化,致使骨质疏松的发生和发展[42]。寻找抗氧化剂具有抑制骨质疏松的潜力。通过荷尔蒙反应的治疗方法,不仅可以增加精力、改善记忆力、降低脂肪脂肪含量,增加肌肉强度,而且荷尔蒙雌激素加黄体素补充治疗方法,对骨质疏松症治疗与预防也有很好的效果[43]。类固醇又称类甾体,是细胞膜、信号分子的组成部分,能够维持细胞的物理形态和生化功能,具有很高的生物学意义。目前,类固醇诱导的骨质疏松症(glucocorticoids induced osteoporosis,GIO)是临床上常见的继发性骨质疏松症之一[44]。类固醇主要是通过上调过氧化物激活受体γ受体2[45]和对Wnt/β-catenin[46]信号通路对骨形成产生影响,之后会导致成骨细胞数量减少和骨细胞凋亡增加。细胞凋亡是一种受调节的细胞自杀机制,成人骨骼质量的维持不仅由破骨细胞和成骨细胞产生的变化控制,而且还受到细胞调控凋亡的影响。在正常的骨重塑过程中,破骨细胞、成骨细胞和骨细胞凋亡死亡的时间成为关键因素。改变成骨细胞和破骨细胞凋亡发生率的治疗药物可以纠正细胞数量的失衡,这已然成为骨质疏松症患者骨量减少和降低骨折风险的基础[47]。在骨骼生长过程中,女性和男性的骨骺生长板的闭合都需要雌激素。当雌激素缺乏时,会导致破骨细胞数量增多和骨吸收增强,骨的吸收量会大于骨的沉积量。在雌激素受体敲除小鼠[48]实验中,发现小鼠的骨密度明显下降[49]。目前,在所有主要类型的骨细胞(包括成骨细胞、破骨细胞和骨细胞)中均发现了雌激素受体[50-51],雌激素在骨骼的生长和成熟以及骨转换的调节中都起着非常重要的作用。
综上所述,本研究发现,杜仲和菟丝子改善骨质疏松的作用机制可能是通过影响蛋白激酶、原癌基因、雌激素受体α基因、钙黏蛋白相关蛋白、肿瘤抑制蛋白、促分裂原活化蛋白激酶1、类视黄醇X受体、表皮生长因子受体、核受体辅激活蛋白1基因、白介素10等基因的表达进而调控了氧化应激的反应、荷尔蒙的反应、类固醇、凋亡信号通路、雌性激素的反应等信号传导途径实现的。
