发热伴血小板减少综合征合并脑部症状患者临床资料分析
2022-12-14孙袁芳卢思琦吴家兵
郭 倩,龚 磊,朱 梦,孙袁芳,何 军,卢思琦,张 磊,吕 勇,吴家兵,
发热伴血小板减少综合征(Severe fever with thrombocytopenia syndrome,SFTS)是由发热伴血小板减少综合征病毒(Severe fever with thrombocytopenia syndrome vires,SFTSV)感染的一种新发蜱传疾病[1]。中国首次发现并分离出该病毒,根据国际病毒分类委员会(ICTV)的最新报告,已正式更名为大别班达病毒(Dabiebandavirus),属于白纤病毒科(Phenuiviridae)班达病毒属(Bandavirus)[2]。临床表现包括发热、白细胞减少、血小板减少、牙龈出血、血尿、胃肠道出血等症状,可伴有肝、肾、心脏等功能损伤,病情严重者可因休克、呼吸衰竭、多器官功能障碍、中枢神经系统受累等死亡[3-5]。据估计,病死率可能在9.5%~15.2%[6]。
SFTSV感染累及中枢神经系统引发的头痛、精神错乱、癫痫发作等症状,我们统称为SFTS合并脑部症状,其病死率为44.7%[7]。目前,SFTS合并脑部症状的研究较少,相关定义及发病机制尚不明确。多项研究报道,细胞因子水平升高可能在SFTS合并脑部症状发病机制中发挥重要作用[8]。然而,关于SFTS合并脑部症状患者的临床特征及疾病进展情况的资料仍然有限。本文通过对安徽省的4家医院收治的SFTS患者进行了回顾性调查,分析其临床特征及变化规律,为提高SFTS救治能力提供参考。
1 资料与方法
1.1 资料来源 选取安徽省3个城市4家收治SFTS患者的医院作为研究现场,回顾性收集2013年1月至2018年6月收治的SFTS患者的住院信息,包括人口统计学特征(就诊医院、性别、职业、年龄、住院时长、从发病到入院时间间隔)、临床表现(发热、恶心、呕吐、腹痛、腹泻、肌肉酸痛、头痛、畏寒、乏力、结膜充血、牙龈出血)及动态实验室参数(包括血常规、生化和凝血功能)。
所有患者入院时及住院期间定期采集血清标本,进行血液学和生化检查,密切监测临床进展,共48个实验室参数。血常规指标包括:白细胞(WBC)、中性粒细胞(GRA)、淋巴细胞百分比(LYNP)、淋巴细胞计数(LYM)、红细胞(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、血小板(PLT)、网织红细胞计数(RET)、网织红细胞百分比(RETP)。血液生化指标包括:总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TB)、前白蛋白(PA)、总胆汁酸(TBA)、尿素氮(BUN)、肌酐(CREA)、尿酸(UA)、空腹血糖(GLU)、总胆固醇(TC)、甘油三酯(TG)、C-反应蛋白(CRP)、线粒体天冬氨酸转氨酶(ASTM)、淀粉酶(AMY)、钾(K)、钠(Na)、氯(Cl)、钙(Ca)、镁(Mg)、磷(P)、二氧化碳结合力(CO2CP)、肌酸激酶(CK)、肌酸激酶同工酶(CKMB)、乳酸脱氢酶(LDH)、羟基丁酸脱氢酶(HBDH)、降钙素原(PCT)、肌红蛋白(MB)。凝血功能指标包括:凝血酶原时间(PT)、国际归一化比(INR)、凝血酶原活动度(PTA)、活性部分凝血酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB)、D-二聚体(DD)、血清纤维蛋白降解产物(FDP)。
1.2 研究方法 收集SFTS患者住院资料,根据其是否合并脑部症状,分为合并脑部症状组和未合并脑部症状组。比较分析两组患者人口统计学特征、临床表现、实验室参数之间的差异。
1.3 诊断标准
1.3.1 SFTS确诊病例 诊断符合2010年10月卫生部印发的《发热伴血小板减少综合征防治指南(2010版)》标准[9]。满足以下条件之一:1)病例标本新型布尼亚病毒核酸检测阳性;2)检测新型布尼亚病毒IgG抗体阳转或恢复期滴度较急性期4倍以上增高;3)分离到新型布尼亚病毒。
1.3.2 SFTS合并脑部症状病例 患者在符合上述SFTS确诊病例诊断标准的基础上,出现意识障碍(包括嗜睡、头昏、昏迷等)或脑膜刺激征阳性等相关脑部症状者。确认无脑部症状证据的SFTS患者定义为未合并脑部症状SFTS患者[7,10]。
1.3.3 纳入排除标准 SFTS患者诊断均符合2010年10月卫生部印发的《发热伴血小板减少综合征防治指南(2010版)》标准[9]。排除SFTS发病之前具有意识障碍或脑膜刺激阳性等脑部症状相关临床表现的患者。
1.3.4 临床分期 参照Gai ZT等[11]首次提出的将SFTS临床病程分为发热期 (病程1~7 d)、多器官功能障碍期 (病程8~13 d)、恢复期 (病程13 d以后) 3个阶段。

2 结 果
2.1 SFTS患者的人口统计学和临床特征 共收集来自4家医院的208例SFTS患者,其中合肥市某医院A 34例(16.35%), 合肥市某医院B57例(27.40%),巢湖市某医院39例(18.75%),六安市某医院78例(37.50%)。所有的患者平均年龄为(63.50±11.23)岁;男女性别比为1∶1;中位住院时间为10.00(6.00)d;从发病到入院时间间隔中位数为5.00(4.00)d;90.38%(188例)患者为农民;9.13%(19例)患者最终死亡。入院时临床表现以发热、乏力、头痛和胃肠道症状等流感样症状为主。
在SFTS患者中,62例(29.81%)患者在住院期间出现中枢神经系统症状,并发展为临床诊断SFTS合并脑部症状。4家医院SFTS患者脑部症状的发生率具有统计学差异(χ2=11.330,P=0.010)。与未合并脑部症状组相比,合并脑部症状死亡所占比例较高 (17.74%vs5.48%),且差异具有统计学意义(χ2=7.884,P<0.001)。详见表1。
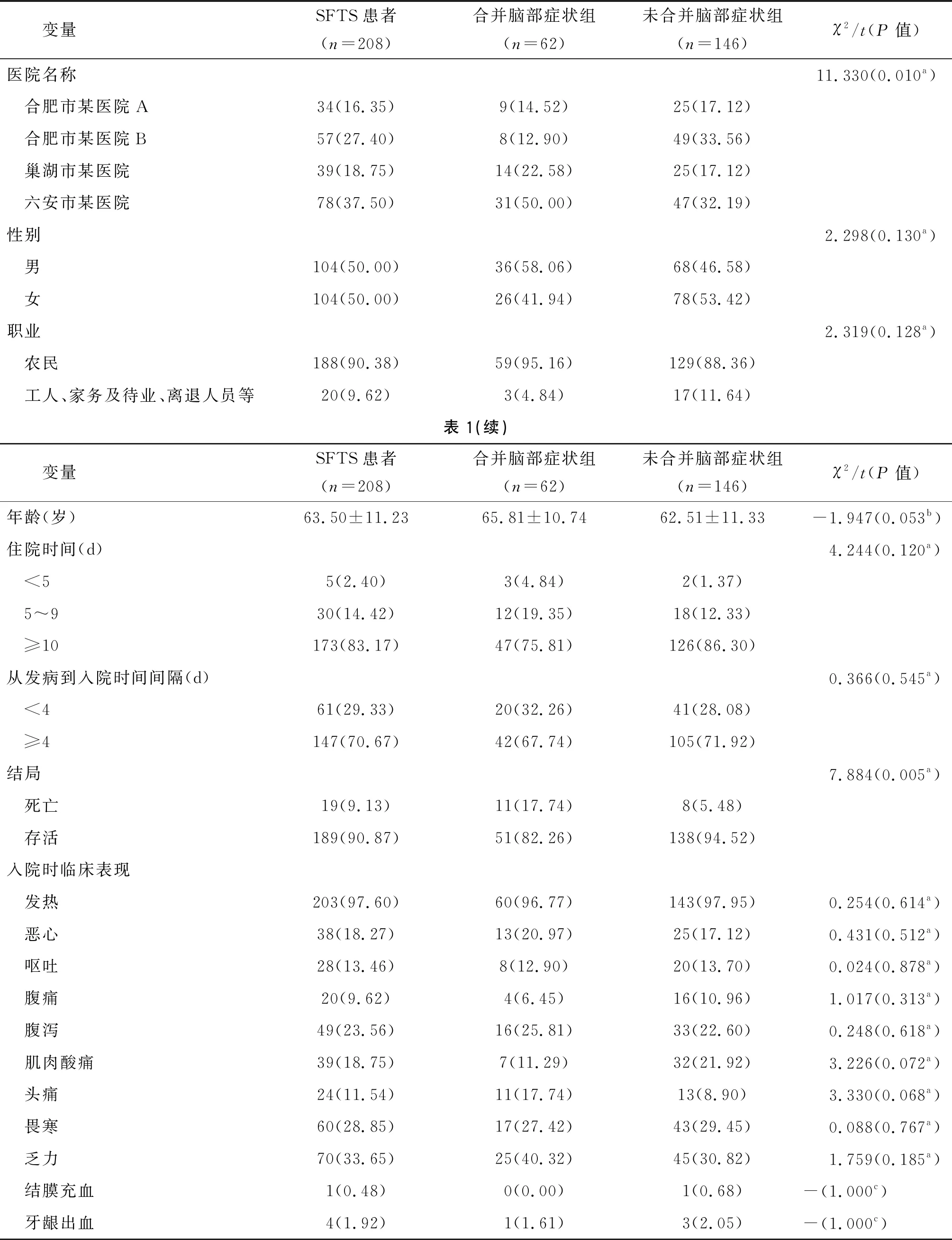
表1 SFTS患者的人口统计学和临床特征分析结果Tab.1 Analysis of demographic and clinical features of SFTS patients
2.2 SFTS合并脑部症状和未合并脑部症状患者的实验室参数比较 比较2组患者整个住院期间的实验室参数变化发现,SFTS合并脑部症状患者GRA、BUN、CREA、CRP和PCT高于未合并脑部症状组,而LYNP、LYM、PLT、TP、ALB、AMY和CO2CP低于未合并脑部症状组,并且差异均具有统计学意义(均P<0.05)。
在发热期(病程1~7 d),相较于未合并脑部症状患者,合并脑部症状的SFTS患者在疾病早期其BUN(Z=2.084,P=0.037)、CREA(Z=-2.698,P=0.007)、CRP(Z=-3.209,P=0.001)等更高,而PLT(Z=-2.469,P=0.014)、ALB(t=2.172,P=0.032)、CO2CP (Z=-2.245,P=0.025)等相对较低。
多器官功能障碍期,即发病后的8~13 d。在这一阶段,合并脑部症状组的GRA(Z=-2.346,P=0.019)、CRP(Z=-2.605,P=0.009)、Ca(Z=-2.807,P=0.005)等高于未合并脑部症状组。相比之下,RET(Z=-2.329,P=0.020), AMY(Z=-2.144,P=0.032)等低于未合并脑部症状组。
恢复期(病程13 d以后),合并脑部症状组的PLT(Z=-2.856,P=0.004)、AMY(Z=-2.586,P=0.010)低于未合并脑部症状组,CK(Z=-2.007,P=0.045)高于未合并脑部症状组。详见表2。

2.3 SFTS合并脑部症状和未合并脑部症状患者的实验室参数动态变化 对整个临床进展过程中差异有统计学意义的实验室参数进一步分析发现,所有SFTS患者LYNP、AMY、PCT水平始终偏高,而ALB水平始终偏低。SFTS合并脑部症状患者在发病初期BUN和CREA远高于正常水平,CO2CP低于正常水平,而在未合并脑部症状的SFTS患者中,这3项指标均在正常范围内(图1)。

注:各项指标以M(P25,P75)表示,X轴为发病日程;GRA,中性粒细胞百分比;LYNP,淋巴细胞百分比; LYM, 淋巴细胞计数;PLT,血小板;TP, 总蛋白;ALB, 白蛋白;BUN ,尿素氮;CREA, 肌酐;CRP,C-反应蛋白;AMY, 淀粉酶;CO2CP, 二氧化碳结合力;PCT, 降钙素原。图1 合并脑部症状组与未合并脑部症状组SFTS患者12个实验室参数的动态变化Fig.1 Dynamic profiles of 12 laboratory parameters in patients with SFTS with or without brain symptoms
3 讨 论
SFTS缺乏特效治疗药物及针对性疫苗,早期诊断、对症治疗、积极预防并发症发生是降低病死率的关键。与其他研究结果相似[12],我们报道了SFTS合并脑部症状的病死率为17.74%,显著高于未合并脑部症状SFTS患者。提示SFTS合并脑部症状患者更有可能发生严重后果,病死率较高。对比分析2组人群的人口学特征和临床表现资料,合并脑部症状患者的年龄略高于未合并脑部症状患者。2组患者入院时均出现发热、畏寒、乏力等临床表现,因此,在疾病初期仅根据临床表现很难将可能发展为合并脑部症状的SFTS患者识别。临床上需要密切关注患者疾病进展状态,结合相关实验室指标,尽早发现可能合并脑部症状SFTA患者。另外,我们发现不同医院SFTS合并脑部症状的检出率存在差异,这可能与病人入院时病情严重程度、病毒载量以及个体自身免疫水平有关[13]。
SFTSV可累及多系统和器官,随疾病进展,相应的实验室参数变化存在差异。通过对比2组患者不同临床分期实验室指标发现,整个病程中,合并脑部症状患者GRA、BUN、CREA、CRP和PCT较高,而LYNP、LYM、PLT、TP、ALB、AMY和CO2CP较低(均P<0.05)。普遍认为,SFTS患者合并脑部症状常发生在疾病早期,以发病的第5~6 d多见[7,11]。对比早期各实验室参数,合并脑部症状的SFTS患者BUN、CREA、UA、CRP、PCT更高,而LYNP、PLT、TP、ALB、CO2CP、FDP较低。实验室参数动态监测数据显示,SFTS合并脑部症状患者的早期BUN和CREA远高于正常水平,CO2CP低于正常水平,而在未合并脑部症状的SFTS患者中,这3项指标均在正常范围内。综合以上结果,提示发病早期应重点监测上述3个实验室参数,以期尽早识别可能发展为合并脑部症状的SFTS患者。此外,BUN、CREA和CO2CP水平异常也反映了个体存在一定程度肾损伤。
与以往的研究相似[14-17],我们发现病毒在早期首先入侵血液系统,LYNP升高,PLT降低。随后SFTS患者表现为肝、肾等多器官功能障碍,ALB低于正常水平并且降至整个病程的最低值,而AMY、PCT水平升高。在此阶段,虽然SFTS合并脑部症状组与未合并脑部状组的GRA、LYNP、RET、AMY、Ca、TB和CRP水平存在差异,但与正常参考范围相比,前5个实验室参数在两组间均表现为正常或异常,TB和CRP水平则在合并脑部症状组更高,且超出正常范围上限,提示合并脑部症状的患者器官损伤、感染情况更严重。进入恢复期后,存活患者逐渐康复,大部分临床参数恢复正常,但AMY水平依然高于正常参考范围,并且合并脑部症状组含量更高。有研究推断,AMY水平升高可能与SFTS发病机制“细胞因子风暴”有关,细胞因子对急性胰腺炎起作用,导致AMY升高[18]。综上,SFTS合并脑部症状的患者其肝、肾、胰腺等器官功能损伤更加严重。临床上应尽早发现SFTS合并脑部症状患者,积极治疗,有效防止其他并发症的发生。
Cui N等[7]和Kim UJ等[19]通过RT-PCR从SFTS合并脑部症状患者脑脊液中成功分离出SFTSV,但目前尚不能确认该病的发病机制就是由SFTSV引起。既往研究报道[20],在动物实验中,汉坦病毒入侵大脑可引起BALB /c乳鼠大脑神经(主要是皮质层和海马部位)细胞凋零,提示SFTS的神经损伤可能也是由病毒的入侵所致。此外,还发现克里米亚-刚果出血热(Crimean-Congo haemorrhagic fever,CCHF)病毒可以感染大脑,该病毒同属布尼亚病毒科的蜱传病毒[21-22]。未来仍需要对SFTS合并脑部症状患者的发病机制进一步研究。
合并脑部症状是SFTS严重并发症之一,病死率较高。本研究比较分析不同临床分期SFTS合并脑部症状患者的人口学特征、临床表现和实验室参数间的差异,辅助临床医生诊断并及早发现可能发展为合并脑部症状的SFTS患者,从而采取更有效的预防措施,最终降低病死率。我们的研究结果表明:在SFTS患者住院期间应密切监测实验室参数变化,尤其是早期BUN、CREA和CO2CP,一旦发现异常,应考虑是否合并脑部症状,提前预防并发症的发生,减少重症和死亡病例。另外,住院期间治疗药物可能会对实验室参数及病理变化时间节点产生影响,但我们的结论对临床治疗仍具有重要指导意义。
利益冲突:无
引用本文格式:郭倩,龚磊,朱梦,等. 发热伴血小板减少综合征合并脑部症状患者临床资料分析[J]. 中国人兽共患病学报,2022,38(11):1023-1030. DOI:10.3969/j.issn.1002-2694.2022.00.151
